Ранний белок 35 кДа
| Ранний белок 35 кДа (AcMNPV) | |||
|---|---|---|---|
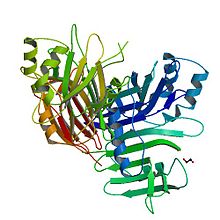 Структура P35 по Fisher et al. 1999 год [ 1 ] | |||
| Идентификаторы | |||
| Организм | |||
| Символ | P35 | ||
| Входить | 1403968 | ||
| ПДБ | 1П35 | ||
| RefSeq (мРНК) | NC_001623.1 | ||
| RefSeq (защита) | НП_054165.1 | ||
| ЮниПрот | P08160 | ||
| Другие данные | |||
| хромосома | 0: 0,12 - 0,12 Мб | ||
| |||
| Ранний белок 35 кДа (BmNPV) | |||
|---|---|---|---|
| Идентификаторы | |||
| Организм | |||
| Символ | P35 | ||
| Входить | 1488744 | ||
| RefSeq (мРНК) | NC_001962.1 | ||
| RefSeq (защита) | НП_047533.1 | ||
| ЮниПрот | P31354 | ||
| Другие данные | |||
| хромосома | 0: 0,11 - 0,11 Мб | ||
| |||
Белок Early 35 кДа , или P35 сокращенно , представляет собой бакуловирусный белок, который ингибирует апоптоз в клетках, инфицированных вирусом. Хотя бакуловирусы инфицируют только беспозвоночных в природе , эктопическая экспрессия Р35 у позвоночных животных и клеток также приводит к ингибированию апоптоза, что указывает на универсальный механизм. Было показано, что P35 является ингибитором каспаз с очень широким спектром активности как в отношении типов ингибируемых каспаз, так и в отношении видов, у которых этот механизм консервативен.
Распространение видов
[ редактировать ]P35 был обнаружен в различных штаммах вируса ядерного полиэдроза , разновидности бакуловируса, поражающего насекомых. Два ортолога P35, которые были подробно изучены, - это ортологи вируса мультикапсидного ядерного полиэдроза Autographa Californica (AcMNPV) и вируса ядерного полиэдроза Bombyx mori (BmNPV). Было обнаружено, что ортолог P35 из AcMNPV блокирует апоптоз в клетках млекопитающих гораздо эффективнее, чем ортолог из BmNPV. [ 2 ]
Функция
[ редактировать ]Белок P35 ингибирует апоптоз, действуя конкурентный необратимый ингибитор каспаз как . [ 3 ] P35 сначала служит субстратом каспазы и расщепляется между аминокислотами D87 и G88, т.е. после последовательности DQMD в P35 из AcMNPV и после последовательности DKID в P35 из BmNPV, в результате чего образуются два полипептидных продукта массой около 10 кДа и 25 кДа в размер. [ 3 ] Сайт расщепления расположен в открытой для растворителя петле, которая простирается от ядра бета-листа белка , что обеспечивает хороший доступ к каспазе. [ 1 ] [ 4 ] Однако, в отличие от других белков-субстратов каспазы, фрагменты P35 не диссоциируют от каспазы после расщепления. Вместо этого N-концевой фрагмент расщепления массой 10 кДа остается связанным с каспазой ковалентной стабильной тиоэфирной связью между остатком расщепления D87 Р35 и остатком цистеина в активном сайте каспазы. [ 5 ]
Хотя образование тиоэфирного промежуточного продукта между аспартатом сайта узнавания субстрата и цистеином активного сайта каспазы является нормальным явлением при опосредованном каспазой расщеплении белка, образующаяся связь обычно быстро гидролизуется, так что расщепляемые продукты могут отсоединяться. Однако в случае P35 комплекс каспаза-субстрат остается стабильным. Расщепление P35 вызывает быстрые конформационные изменения, которые перемещают его N-конец, который обычно скрыт в ядре бета-листа белка, в активный сайт каспазы. В результате этой перегруппировки N-концевые остатки C2 и V3 P35 взаимодействуют с активным центром каспазы, вытесняя воду и предотвращая реакцию гидролиза. Остаток C2 P35 конкурирует с остатком цистеина в активном центре каспазы за связывание с остатком D87 P35, удерживая реакцию в равновесном состоянии. [ 5 ] [ 6 ] [ 7 ] [ 8 ]
Взаимодействия
[ редактировать ]В клетках насекомых P35 ингибирует фермент Sf каспаза-1 , который был идентифицирован как структурный и функциональный ортолог человеческого CASP3 (CPP32) и CASP7 (MCH3). [ 9 ] Исследования с использованием очищенных человеческих каспаз in vitro показали, что белок способен также ингибировать некоторые из них, включая CASP1 , CASP3, CASP6 , CASP7, CASP8 и CASP10 . [ 10 ]
Клиническое значение
[ редактировать ]Поскольку бакуловирусы заражают только насекомых, а не человека, функция P35 в иммунном уклонении от инфицированных клеток не имеет клинического значения. Однако P35 рассматривается как потенциальный инструмент в генной терапии для подавления апоптоза там, где это нежелательно, например, для защиты трансплантированной ткани от иммунного отторжения или для уничтожения клеток-свидетелей при терапии рака; однако такие методы еще далеки от клинического применения. [ 11 ]
История и открытия
[ редактировать ]Роль P35 в ингибировании апоптоза была впервые описана Ролли Дж. Клемом в исследовательской группе Лоис К. Миллер на кафедре генетики Университета Джорджии в 1991 году. [ 12 ] определили причину ингибирования апоптоза с помощью P35 как его способность связывать и ингибировать каспазы (тогда еще называемые гомологами ICE ). Четыре года спустя, в 1995 году, Нэнси Дж. Бамп и ее коллеги из BASF Bioresearch Corporation в Вустере, штат Массачусетс , [ 13 ] Механизм ингибирования каспаз был открыт Гочжоу Сюй в команде Хао Ву на кафедре биохимии Медицинского колледжа Вейл Корнелл в 2001 году. [ 5 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б Фишер А.Дж., Круз В., Зуг С.Дж., Шнайдер К.Л., Фризен П.Д. (апрель 1999 г.). «Кристаллическая структура бакуловируса P35: роль новой петли реактивного сайта в ингибировании апоптотической каспазы» . Журнал ЭМБО . 18 (8): 2031–9. дои : 10.1093/emboj/18.8.2031 . ПМЦ 1171287 . ПМИД 10205157 .
- ^ Моришима Н., Окано К., Сибата Т., Маэда С. (май 1998 г.). «Гомологичные белки p35 бакуловирусов проявляют отличительную антиапоптотическую активность, которая коррелирует с индуцирующей апоптоз активностью каждого вируса». Письма ФЭБС . 427 (1): 144–8. дои : 10.1016/S0014-5793(98)00389-5 . ПМИД 9613616 . S2CID 29840073 .
- ^ Jump up to: а б Бертин Дж., Мендриса С.М., ЛаКаунт DJ, Гаур С., Кребс Дж.Ф., Армстронг Р.К., Томаселли К.Дж., Фризен П.Д. (сентябрь 1996 г.). «Подавление апоптоза бакуловирусом P35 включает расщепление и ингибирование вирус-индуцированной CED-3/ICE-подобной протеазы» . Журнал вирусологии . 70 (9): 6251–9. doi : 10.1128/jvi.70.9.6251-6259.1996 . ПМК 190650 . ПМИД 8709252 .
- ^ Зуг С.Дж., Бертин Дж., Фризен П.Д. (сентябрь 1999 г.). «Ингибирование каспазы бакуловирусом P35 требует взаимодействия между петлей реактивного сайта и ядром бета-листа» . Журнал биологической химии . 274 (37): 25995–6002. дои : 10.1074/jbc.274.37.25995 . ПМИД 10473544 .
- ^ Jump up to: а б с Сюй Г, Чирилли М, Хуан Ю, Рич Р.Л., Мышка Д.Г., Ву Х (март 2001 г.). «Ковалентное ингибирование, выявленное кристаллической структурой комплекса каспаза-8/p35». Природа . 410 (6827): 494–7. дои : 10.1038/35068604 . ПМИД 11260720 . S2CID 279649 .
- ^ Ридл С.Дж., Ренатус М., Снипас С.Дж., Салвесен Г.С. (ноябрь 2001 г.). «Механизм инактивации каспаз апоптотическим супрессором p35». Биохимия . 40 (44): 13274–80. дои : 10.1021/bi010574w . ПМИД 11683637 .
- ^ Сюй Дж., Рич Р.Л., Стигборн С., Мин Т., Хуан Ю., Мышка Д.Г., Ву Х (февраль 2003 г.). «Мутационный анализ взаимодействия р35-каспазы. Кинетическая модель ингибирования каспазы с помощью р35» . Журнал биологической химии . 278 (7): 5455–61. дои : 10.1074/jbc.M211607200 . ПМИД 12458208 .
- ^ Лу М, Мин Т, Элиезер Д, Ву Х (февраль 2006 г.). «Нативное химическое лигирование при ингибировании ковалентной каспазы с помощью p35». Химия и биология . 13 (2): 117–22. doi : 10.1016/j.chembiol.2005.12.007 . ПМИД 16492559 .
- ^ Ахмад М., Сринивасула С.М., Ван Л., Литвак Г., Фернандес-Алнемри Т., Алнемри Э.С. (январь 1997 г.). «Каспаза-1 Spodoptera frugiperda, новая протеаза гибели насекомых, которая расщепляет ядерный иммунофилин FKBP46, является мишенью антиапоптотического белка бакуловируса p35» . Журнал биологической химии . 272 (3): 1421–4. дои : 10.1074/jbc.272.3.1421 . ПМИД 8999805 .
- ^ Чжоу К., Кребс Дж. Ф., Снипас С. Дж., Прайс А, Алнемри Э. С., Томаселли К. Дж., Салвесен Г. С. (июль 1998 г.). «Взаимодействие бакуловирусного антиапоптотического белка p35 с каспазами. Специфичность, кинетика и характеристика комплекса каспаза/p35». Биохимия . 37 (30): 10757–65. дои : 10.1021/bi980893w . ПМИД 9692966 .
- ^ Долофф Дж.К., Су Т., Ваксман DJ (сентябрь 2010 г.). «Аденовирусная доставка ингибитора панкаспазы p35 усиливает уничтожение свидетелей с помощью терапии пролекарственными ферментами, направленными на ген P450, с использованием циклофосфамида +» . БМК Рак . 10 : 487. дои : 10.1186/1471-2407-10-487 . ПМК 2946310 . ПМИД 20836875 .
- ^ Клем Р.Дж., Феххаймер М., Миллер Л.К. (ноябрь 1991 г.). «Предотвращение апоптоза геном бакуловируса при заражении клеток насекомых». Наука . 254 (5036): 1388–90. Бибкод : 1991Sci...254.1388C . дои : 10.1126/science.1962198 . ПМИД 1962198 .
- ^ Бамп Нью-Джерси, Хакетт М., Хугунин М., Сешагири С., Брэди К., Чен П., Ференц С., Франклин С., Гаюр Т., Ли П. (сентябрь 1995 г.). «Ингибирование протеаз семейства ICE антиапоптотическим белком p35 бакуловируса». Наука . 269 (5232): 1885–8. Бибкод : 1995Sci...269.1885B . дои : 10.1126/science.7569933 . ПМИД 7569933 .