Катехин
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Бензол-1,2-диол [1] | |||
| Другие имена
Пирокатехин [1]
1,2-бензолдиол 2-гидроксифенол 1,2-Дигидроксибензол о -бензолдиол о -Дигидроксибензол | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| 471401 | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Лекарственный Банк | |||
| Информационная карта ECHA | 100.004.025 | ||
| Номер ЕС |
| ||
| 2936 | |||
| КЕГГ | |||
ПабХим CID
|
|||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| C6H6OC6H6O2 | |||
| Молярная масса | 110.112 g·mol −1 | ||
| Появление | перистые кристаллы от белого до коричневого цвета | ||
| Запах | слабый фенольный запах | ||
| Плотность | 1,344 г/см 3 , твердый | ||
| Температура плавления | 105 ° С (221 ° F; 378 К) | ||
| Точка кипения | 245,5 ° C (473,9 ° F; 518,6 К) (возвышенное вещество) | ||
| 312 г/л при 20 °C [2] | |||
| Растворимость | очень растворим в пиридине растворим в хлороформе , бензоле , CCl 4 , эфире , этилацетате | ||
| войти P | 0.88 | ||
| Давление пара | 20 Па (20 °С) | ||
| Кислотность ( pKa ) | 9.45, 12.8 | ||
| −6.876 × 10 −5 см 3 /моль | |||
Показатель преломления ( n D )
|
1.604 | ||
| 2,62 ± 0,03 Д [3] | |||
| Структура | |||
| моноклинический | |||
| Термохимия | |||
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
−354,1 кДж·моль −1 | ||
Энтальпия плавления (Δ f H ⦵ фу )
|
22,8 кДж·моль −1 (при температуре плавления) | ||
| Опасности | |||
| СГС Маркировка : | |||
  
| |||
| Опасность | |||
| Х301 , Х311 , Х315 , Х317 , Х318 , Х332 , Х341 | |||
| P261 , P301 , P302 , P305 , P310 , P312 , P330 , P331 , P338 , P351 , P352 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 127 ° С (261 ° F; 400 К) | ||
| 510 ° C (950 ° F; 783 К) | |||
| Взрывоопасные пределы | 1.4%–? [4] | ||
| Летальная доза или концентрация (LD, LC): | |||
ЛД 50 ( средняя доза )
|
300 мг/кг (крыса, перорально) | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
ПЭЛ (допустимо)
|
никто [4] | ||
РЕЛ (рекомендуется)
|
СВВ 5 частей на миллион (20 мг/м 3 ) [кожа] [4] | ||
IDLH (Непосредственная опасность)
|
без даты [4] | ||
| Паспорт безопасности (SDS) | Сигма-Олдрич | ||
| Родственные соединения | |||
Родственные бензолдиолы
|
Резорцин гидрохинон | ||
Родственные соединения
|
1,2-бензохинон | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
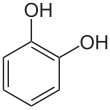
Катехин ( / ˈ k æ t ɪ tʃ ɒ l / или / ˈ k æ t ɪ k ɒ l / ), также известный как пирокатехин или 1,2-дигидроксибензол , представляет собой органическое соединение с молекулярной формулой С 6 Н 4 (ОН) 2 . Это орто- изомер трех изомерных бензолдиолов . Это бесцветное соединение встречается в природе в следовых количествах. Впервые он был обнаружен путем деструктивной перегонки растительного экстракта катехина . В настоящее время ежегодно синтетическим путем производится около 20 000 тонн катехола в качестве товарного органического химиката, главным образом в качестве прекурсора пестицидов, ароматизаторов и ароматизаторов. Небольшое количество катехола содержится во фруктах и овощах . [2]
Выделение и синтез
[ редактировать ]Катехол был впервые выделен в 1839 году Эдгаром Хьюго Эмилем Рейншем (1809–1884) путем перегонки его из твердого дубильного препарата катехина , который представляет собой остаток катехина , вареного или концентрированного сока мимозы катеху ( Acacia catechu ). [5] При нагревании катехина выше точки его разложения вещество, которое Райнш впервые назвал Brenz-Katechusäure (сожженная катехиновая кислота), сублимировалось в виде белых высолов . Это был продукт термического разложения флаванолов катехина . В 1841 году Вакенродер и Цвенгер независимо друг от друга заново открыли катехол; сообщая о своих открытиях, Philosophical Magazine придумал название пирокатехин . [6] К 1852 году Эрдманн понял, что пирокатехин представляет собой бензол с добавленными к нему двумя атомами кислорода; В 1867 году Август Кекуле понял, что катехол представляет собой диол бензола, поэтому к 1868 году катехол был внесен в список пирокатехина . [7] В 1879 году Журнал Химического общества рекомендовал называть катехол «катехином», и в следующем году он был внесен в список таковых. [8]
С тех пор было показано, что катехол встречается в свободной форме в природе в кино и буковой смоле. Его сульфоновая кислота была обнаружена в моче лошадей и людей. [9]
Катехол получают в промышленности гидроксилирования фенола путем перекисью водорода . [2]
- C 6 H 5 OH + H 2 O 2 → C 6 H 4 (OH) 2 + H 2 O
Его можно получить реакцией салицилового альдегида с основанием и перекисью водорода ( окисление Дакина ). [10] а также гидролиз 2-замещенных фенолов, особенно 2-хлорфенола , горячими водными растворами, содержащими гидроксиды щелочных металлов. Его производное метилового эфира, гваякол , превращается в катехол путем гидролиза Связь CH 3 -O , активируемая иодистоводородной кислотой (HI). [10]
Реакции
[ редактировать ]Как и некоторые другие бифункциональные производные бензола, катехол легко конденсируется с образованием гетероциклических соединений . Например, использование трихлорида фосфора или оксихлорида фосфора дает циклический хлорфосфонит или хлорфосфонат соответственно ; сульфурилхлорид дает сульфат ; и фосген ( COCl 2 ) дает карбонат : [11]
- C 6 H 4 (OH) 2 + XCl 2 → C 6 H 4 (O 2 X) + 2 HCl, где X = PCl или POCl; СО 2 ; СО
Основные растворы катехола реагируют с железом(III) с образованием красного цвета. [Fe(C 6 H 4 O 2 ) 3 ] 3− . Хлорид железа придает водному раствору зеленую окраску, тогда как щелочной раствор при воздействии воздуха быстро меняет цвет на зеленый и, наконец, на черный. [12] железосодержащие диоксигеназы Ферменты катализируют расщепление . катехола
окислительно-восстановительная химия
[ редактировать ]Катехолы превращаются в семихиноновый радикал. При pH = 7 это преобразование происходит при 100 мВ: [ нужна ссылка ]
- C 6 H 4 (OH) 2 → C 6 H 4 (O)(OH) + ½ H 2
Семихиноновый радикал может быть восстановлен до катехолат-дианиона, потенциал которого зависит от pH:
- С 6 Н 4 (О)(ОН) + е − → [С 6 Н 4 О 2 ] 2− + Ч +
Катехол производится обратимым двухэлектронным двухпротонным восстановлением бензохинона 1,2- ( E 0 = +795 мВ относительно ОНА ; E m (при pH 7) = +380 мВ относительно SHE). [13]
Катехолат-дианион окислительно -восстановительного ряда, моноанионный семихинонат и бензохинон вместе называются диоксоленами . Диоксолены могут действовать как лиганды для ионов металлов. [14]
Производные катехола
[ редактировать ]- Катехины природного происхождения
-
Катехин , компонент чая.
-
Пикеатанол — антиоксидант, содержащийся в некоторых красных винах.
-
урушиолы , активный агент ядовитого плюща (R = (CH 2 ) 14 CH 3 , (CH 2 ) 7 CH=CHCH 2 CH=CHCH 2 CH=CH 2 и другие)
-
Кверцетин , который содержится во многих продуктах питания.
Производные катехола широко распространены в природе. Они часто возникают при гидроксилировании фенолов. [17] членистоногих Кутикула состоит из хитина, связанного катехоловым фрагментом с белком . Кутикулу можно укрепить путем сшивания ( дубления и склеротизации ), в частности у насекомых , и, конечно же, биоминерализации . [18]
4-трет-Бутилкатехин , который является синтетическим, а не природным, используется в качестве антиоксиданта и ингибитора полимеризации .
Использование
[ редактировать ]Примерно 50% синтетического катехола потребляется при производстве пестицидов , остальная часть используется в качестве прекурсора для тонких химикатов, таких как парфюмерия и фармацевтические препараты. [2] Это обычный строительный блок в органическом синтезе . [19] несколько промышленно значимых ароматизаторов и ароматизаторов На основе катехина получают . Гваякол получают путем метилирования катехола, а затем преобразуют в ванилин в объеме около 10 миллионов кг в год (1990). Родственный моноэтиловый эфир катехола, гетола , преобразуется в этилванилин , компонент шоколадных кондитерских изделий. 3- транс -изокамфилциклогексанол, широко используемый в качестве заменителя сандалового масла , получают из катехина с помощью гваякола и камфоры . Пиперональ с цветочным ароматом получают из метилен-диэфира катехола с последующей конденсацией с глиоксалем и декарбоксилированием . [20]
Катехин используется в качестве проявителя черно-белых фотографий , но, за исключением некоторых приложений специального назначения, его использование во многом имеет историческое значение. По слухам, он некоторое время использовался в проявителе HC-110 компании Eastman Kodak и является компонентом Tetenal . проявителя Neofin Blau компании [21] Это ключевой компонент Finol от Moersch Photochemie в Германии. Современная разработка катехола была инициирована известным фотографом Сэнди Кингом . Его формула «PyroCat» популярна среди современных черно-белых кинофотографов. [22] С тех пор работа Кинга вдохновила на дальнейшую разработку в 21 веке других людей, таких как Джей Де Фер с разработчиками Hypercat и Obsidian Acqua и других. [21]
Номенклатура
[ редактировать ]Хотя оно встречается редко, официальное «предпочтительное название ИЮПАК » (ПИН) катехола — бензол-1,2-диол . [23] Тривиальное название пирокатехин является сохраненным названием ИЮПАК в соответствии с Рекомендациями по номенклатуре органической химии 1993 года . [24] [25]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б «Фронт материи». Номенклатура органической химии: рекомендации ИЮПАК и предпочтительные названия 2013 г. (Синяя книга) . Кембридж: Королевское химическое общество . 2014. с. 691. дои : 10.1039/9781849733069-FP001 . ISBN 978-0-85404-182-4 .
- ^ Jump up to: а б с д Фигель, Хельмут и др. (2002) «Производные фенола» в Энциклопедии промышленной химии Ульмана , Wiley-VCH: Weinheim. два : 10.1002/14356007.a19_313 .
- ^ Ландер, Джон Дж.; Свирбелый, WJ (1945). «Дипольные моменты катехола, резорцина и гидрохинона». Журнал Американского химического общества . 67 (2): 322–324. дои : 10.1021/ja01218a051 .
- ^ Jump up to: а б с д Карманный справочник NIOSH по химическим опасностям. «#0109» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Хьюго Рейнш (1839) «Некоторые наблюдения о катеху» , Repertory für die Pharmacie , 68 : 49-58. Рейнш описывает получение катехина на стр. 56: «Хорошо известно, что катехиновая кислота разрушается при перегонке, а небольшая ее часть сублимируется в виде кристаллического следа, который, однако, еще не исследован подробно. Эта кислота, возможно, та самая, которую я получил при деструктивной перегонке катехуса...» (Как известно, катеховая кислота при перегонке разрушается, при этом небольшая ее часть сублимируется в виде кристаллических высолов, которые, однако, до сих пор не исследованы близко. Эта кислота, возможно, и есть тот самый, который я получил путем деструктивной перегонки катеху ;…). На стр. 58, Рейнш называет новое соединение: «Свойства этой кислоты настолько определены, что можно с полным основанием считать ее своеобразной кислотой и дать ей название пирокатеховая кислота». (Свойства этой кислоты настолько определенны, что ее можно с полным основанием считать странной кислотой и дать ей название «обожженная катехуовая кислота».)
- ^ См.:
- Х. Вакенродер (1841) «Свойства катехиновой кислоты», Annals of Chemistry and Pharmacie , 37 : 306-320.
- Константин Цвенгер (1841) «Уэбер-катехин» (О катехине), Анналы химии и фармации , 37 : 320-336.
- (Анон.) (1841) «О катехине (катехиновой кислоте) и пирокатехине (пирокатехиновой кислоте)» , Философский журнал , 19 : 194-195.
- ^ См.:
- Рудольф Вагнер (1852) «О красящем веществе шелковицы Дайера (Morustinctoria.)», Журнал практической химии , 55 : 65-76. Озеро п. 65.
- Август Кекуле (1867) «О сульфонатах фенола» Химический журнал , новая серия, 3 : 641–646; см. стр. 643.
- Жозеф Альфред Наке с Уильямом Кортисом, пер. и Томас Стивенсон, изд., «Принципы химии, основанные на современных теориях » (Лондон, Англия: Генри Реншоу, 1868), стр. 657. См. также с. 720.
- ^ См.:
- В 1879 году Издательский комитет Журнала Химического общества дал инструкции его референтам: «Различать все спирты, т. е. гидроксильные производные углеводородов, по именам, оканчивающимся на ол, например , хинол, катехол…» См.: Альфред Х. Аллен (20 июня 1879 г.) «Номенклатура органических тел», English Mechanic and World of Science , 29 (743): 369.
- Уильям Аллен Миллер, редактор, Элементы химии: теоретические и практические, Часть III: Химия углеродных соединений или органическая химия, Раздел I… , 5-е изд. (Лондон, Англия: Лонгманс, Грин и Ко, 1880), стр.524.
- ^ Чжэн, LT; Рю, генеральный менеджер; Квон, Б.М.; Ли, Вашингтон; Сук, К. (2008). «Противовоспалительное действие катехолов в стимулированных липополисахаридами клетках микроглии: ингибирование микроглиальной нейротоксичности». Европейский журнал фармакологии . 588 (1): 106–13. дои : 10.1016/j.ejphar.2008.04.035 . ПМИД 18499097 .
- ^ Jump up to: а б Х. Д. Дакин, Х. Т. Кларк, Э. Р. Тейлор (1923). «Катехин». Органические синтезы . 3 : 28. дои : 10.15227/orgsyn.003.0028 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Р. С. Ханслик, В. Ф. Брюс, А. Масцитти (1953). «о-фениленкарбонат». Орг. Синтез . 33 : 74. дои : 10.15227/orgsyn.033.0074 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Андерсон, Брайан Ф.; Бэкингем, Дэвид А.; Робертсон, Глен Б.; Уэбб, Джон; Мюррей, Кейт С.; Кларк, Пол Э. (1976). «Модели бактериального хелата-переносчика железа энтерохелина» . Природа . 262 (5570): 722–724. Бибкод : 1976Natur.262..722A . дои : 10.1038/262722a0 . ПМИД 134287 . S2CID 3045676 .
- ^ Швайгерт, Нина; Цендер, Александр Дж.Б .; Эгген, Рик И.Л. (2001). «Химические свойства катехолов и их молекулярные механизмы токсического действия в клетках от микроорганизмов до млекопитающих. Миниобзор». Экологическая микробиология . 3 (2): 81–91. дои : 10.1046/j.1462-2920.2001.00176.x . ПМИД 11321547 .
- ^ Гриффит, WP (1993). «Последние достижения в химии диоксолена». Химия переходных металлов . 18 (2): 250–256. дои : 10.1007/BF00139966 . S2CID 93790780 .
- ^ ВВП : 2ZI8 ; Ям К.С., Д'Анджело И., Калшойер Р., Чжу Х., Ван Дж.К., Сниекус В., Ли Л.Х., Конверс П.Дж., Джейкобс В.Р., Стринадка Н., Элтис Л.Д. (март 2009 г.). «Исследование диоксигеназы, расщепляющей кольцо, проливает свет на роль метаболизма холестерина в патогенезе микобактерий туберкулеза» . ПЛОС Патог . 5 (3): e1000344. дои : 10.1371/journal.ppat.1000344 . ПМЦ 2652662 . ПМИД 19300498 .
- ^ Саис-Посо, Ж.; Мансебо-Арасил, Дж.; Надор, Ф.; Буске, Ф.; Руис-Молина, Д. (2019). «Химия адгезии на основе катехолов». Angewandte Chemie, международное издание . 58 (3): 696–714. дои : 10.1002/anie.201801063 . hdl : 11336/94743 . ПМИД 29573319 . S2CID 4228374 .
- ^ Болтон, Джуди Л.; Данлэп, Тарейша Л.; Дитц, Биргит М. (2018). «Формирование и биологические мишени ботанических о-хинонов» . Пищевая и химическая токсикология . 120 : 700–707. дои : 10.1016/j.fct.2018.07.050 . ПМК 6643002 . ПМИД 30063944 . S2CID 51887182 .
- ^ Бриггс ДЭГ (1999). «Молекулярная тафономия кутикулы животных и растений: избирательная консервация и диагенез» . Философские труды Королевского общества B: Биологические науки . 354 (1379): 7–17. дои : 10.1098/rstb.1999.0356 . ПМК 1692454 .
- ^ Барнер, BA (2004) «Катехин» в Энциклопедии реагентов для органического синтеза (под ред.: Л. Пакетт), J. Wiley & Sons, Нью-Йорк. дои : 10.1002/047084289X .
- ^ Фальбуш, Карл-Георг и др. (2003) «Вкусы и ароматы» в Энциклопедии промышленной химии Ульмана , Wiley-VCH: Weinheim дои : 10.1002/14356007.a11_141 .
- ^ Jump up to: а б Стивен Г. Анчелл (10 сентября 2012 г.). Поваренная книга темной комнаты . Тейлор и Фрэнсис. ISBN 978-1136092770 .
- ^ Стивен Г. Анчелл; Билл Труп (1998). Поваренная книга по созданию фильмов . ISBN 978-0240802770 .
- ^ Предпочтительные имена IUPAC . Сентябрь 2004 г., глава 6, разделы 60–64, с. 38
- ^ ИЮПАК, Комиссия по номенклатуре органической химии. Руководство по номенклатуре органических соединений ИЮПАК (Рекомендации 1993 г.) R-5.5.1.1 Спирты и фенолы.
- ^ Панико, Р.; Пауэлл, WH, ред. (1994). Руководство по номенклатуре органических соединений ИЮПАК, 1993 г. Оксфорд: Блэквелл Сайенс. ISBN 978-0-632-03488-8 .
В эту статью включен текст из публикации, которая сейчас находится в свободном доступе : Чисхолм, Хью , изд. (1911). « Катеху ». Британская энциклопедия (11-е изд.). Издательство Кембриджского университета.


![3,4-дигидрокси-9,10-секоандроста-1,3,5(10)-триен-9,17-дион, метаболит холестерина[15]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d8/DHSA.svg/89px-DHSA.svg.png)




![Дофамин, полученный из аминокислоты тирозина, клея, используемого мидиями.[16]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2f/Dopamine.svg/180px-Dopamine.svg.png)
