топоизомераза
| Идентификаторы | |||
|---|---|---|---|
| Номер ЕС. | 5.6.2.1 | ||
| Номер CAS. | 80449-01-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
| ДНК-топоизомераза, АТФ-зависимая (тип II) | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 5.6.2.2 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
ДНК-топоизомеразы (или топоизомеразы ) — это ферменты, которые катализируют изменения топологического состояния ДНК , взаимно превращая расслабленные и сверхспиральные формы, связанные (цепные) и несвязанные виды, а также завязанную и развязанную ДНК. [ 1 ] [ 2 ] Топологические проблемы в ДНК возникают из-за переплетенной природы ее двойной спиральной структуры, что, например, может привести к перекручиванию дуплекса ДНК во время репликации и транскрипции ДНК . Если оставить его неизменным, это скручивание в конечном итоге остановит ДНК- или РНК-полимеразы, участвующие в этих процессах, от продолжения движения по спирали ДНК. Вторая топологическая проблема возникает из-за связывания или запутывания ДНК во время репликации. Если не решить проблему, связи между реплицируемой ДНК будут препятствовать делению клеток. ДНК-топоизомеразы предотвращают и исправляют топологические проблемы такого типа. Они делают это путем связывания с ДНК и разрезания сахарофосфатного остова либо одной (топоизомеразы типа I), либо обеих (топоизомеразы типа II) нитей ДНК. Этот временный разрыв позволяет ДНК распутаться или раскрутиться, и в конце этих процессов остов ДНК снова запечатывается. Поскольку общий химический состав и связность ДНК не изменяются, субстрат и продукт ДНК представляют собой химические изомеры, различающиеся только топологией.
Открытие
[ редактировать ]Первая ДНК-топоизомераза была обнаружена у бактерий Джеймсом К. Вангом в 1971 году и первоначально называлась ω (омега)-белком; [ 3 ] теперь она называется топоизомеразой I (topo I) Escherichia coli ( E. coli ) и является представителем семейства ферментов типа IA. Впоследствии аналогичная активность была обнаружена в эукариотических клетках (печень крысы) Джеймсом Шампу и Ренато Дульбекко; [ 4 ] ответственный за это фермент, эукариотический топо I, имеет особый механизм и является представителем семейства типа IB. Первой открытой топоизомеразой типа II была ДНК-гираза бактерий Мартином Геллертом и его коллегами в 1976 году. [ 5 ] а также охарактеризован Николасом Коццарелли и его сотрудниками. [ 6 ] ДНК-гираза катализирует введение отрицательных суперспиралей в ДНК и является единственным ферментом типа II, который делает это, все остальные катализируют релаксацию ДНК. Ферменты типа II механически отличаются от типа I тем, что они АТФ-зависимы и временно расщепляют обе цепи ДНК, а не только одну. Впоследствии топоизомеразы типа II были идентифицированы из бактериальных вирусов и эукариот. [ 7 ] [ 8 ] [ 9 ] EC-коды Topo следующие: АТФ-независимый (тип I), EC 5.6.2.1; АТФ-зависимый (тип II): EC 5.6.2.2. Исключением среди топоизомераз типа I является обратная гираза, которая содержит геликазный домен (EC 3.6.4.12) и вызывает положительную суперспирализацию АТФ-зависимым образом. Следовательно, это единственная топоизомераза I типа, классифицированная как EC 5.6.2.2 (таблица 1).
Топология ДНК
[ редактировать ]Двойная спиральная структура ДНК предполагает переплетение двух полинуклеотидных цепей друг вокруг друга, что потенциально приводит к топологическим проблемам. Топология ДНК относится к пересечению двух нитей ДНК, которое изменяет закручивание двойной спирали и приводит к образованию третичных конформаций ДНК, таких как суперспирали, узлы и катенаны. [ 10 ] Потенциальные топологические проблемы, связанные с двойной спиральной структурой ДНК, были признаны вскоре после того, как ее структура была впервые объяснена в 1953 году Джеймсом Уотсоном, Фрэнсисом Криком и Розалиндой Франклин. [ 11 ] [ 12 ] [ 13 ] и получил дальнейшее развитие в работах Макса Дельбрука и Джона Кэрнса. [ 14 ] [ 15 ] Замкнуто-кольцевая двухцепочечная ДНК может быть описана тремя параметрами: числом связи (Lk), скручиванием (Tw) и скручиванием (Wr) (рис. 1). Где Lk относится к количеству раз, когда две цепи соединяются, Tw относится к количеству витков спирали в ДНК, измеренному относительно оси спирали, а Wr количественно определяет намотку пути спирали ДНК в пространстве и часто приравнивается к «суперспирализации».

Эти 3 параметра связаны следующим образом: Lk = Tw +Wr. Это математическое тождество, первоначально полученное Кэлугэряну в 1959 году. [ 16 ] и называется теоремой Кэлугэряну или Кэлугэряну – Уайта – Фуллера. [ 17 ] [ 18 ] Lk нельзя изменить, не разорвав одну или обе нити спирали; Tw и Wr взаимоконвертируемы и зависят от условий решения. Суперспирализация — это просторечий термин, обозначающий ДНК с ненулевой разницей в связывании, которую правильнее называть специфической разницей в связывании (σ = ΔLk/Lk 0 , где Лк 0 — среднее число связей релаксированного круга ДНК). Говорят, что ДНК положительно сверхспиральна, если ее Lk выше, чем Lk. 0 для расслабленного состояния (Лк-Лк тот = ΔLk, ΔLk>0); это означает, что Tw и/или Wr увеличиваются по сравнению с релаксированной молекулой. И наоборот, ДНК имеет отрицательную сверхспираль, если Lk молекулы ниже, чем Lk. 0 (ΔLk<0).
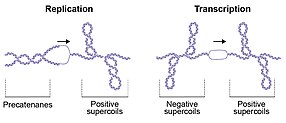
Последствия топологических нарушений в ДНК иллюстрируются репликацией ДНК, в ходе которой цепи дуплекса разделяются; это разделение приводит к образованию положительных суперспиралей (перекручиванию или перекручиванию ДНК) перед репликационной вилкой и переплетению дочерних цепей (прекатенанов) позади [ 10 ] [ 19 ] (рис. 2). Если положительные суперспирали не расслаблены, развитие репликационной вилки затруднено, тогда как неспособность разъединить дочерние цепи предотвращает сегрегацию генома, необходимую для деления клеток. [ 20 ] Транскрипция с помощью РНК-полимеразы также генерирует положительную сверхспирализацию перед транскрипционным комплексом и отрицательную суперспирализацию позади нее (рис. 2). Этот эффект известен как модель домена с двойной суперспиралью, описанная Лероем Лю и Джеймсом Вангом в 1987 году. [ 21 ] Эти топологические возмущения должны быть устранены для продолжения метаболизма ДНК, что позволит клетке эффективно реплицировать, транскрибировать и разделять геном, обеспечивая клеточное деление и жизнеспособность. Узлы ДНК можно обнаружить в бактериофагах и как продукты реакций рекомбинации. [ 10 ] В общем, узлы в ДНК вредны и их необходимо удалять (с помощью топоизомераз). Катенаны ДНК образуются при репликации кольцевых молекул и должны расщепляться топоизомеразами или рекомбиназами, чтобы обеспечить правильное разделение дочерних молекул во время деления клеток. Помимо вредных аспектов топологии ДНК, требующих разрешения, есть и полезные аспекты. Например, репликация плазмиды требует отрицательной суперспирализации начала, что облегчает локальное плавление и обнажает одноцепочечную ДНК, необходимую для инициации репликации. Сходным образом, инициация репликации от основного бактериального происхождения oriC также требует отрицательной суперспирализации. [ 22 ] [ 23 ] Более того, уплотнение генома E. coli частично достигается за счет отрицательной сверхспирализации.
Типы
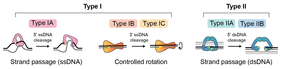
[ редактировать ]ДНК-топоизомеразы — это ферменты, которые эволюционировали для решения топологических проблем ДНК (таблица 2). [ 10 ] Они делают это посредством временного разрыва одной или обеих нитей ДНК. Это привело к классификации топосов на два типа: тип I, катализирующий реакции с преходящими одноцепочечными разрывами, и тип II, катализирующий реакции с преходящими двухцепочечными разрывами (рис. 3; табл. 2). Внутри этих классификаций существуют подтипы.
Тип I
[ редактировать ]Эти ферменты катализируют изменения топологии ДНК посредством временных одноцепочечных разрывов ДНК. Реакции могут происходить как на одно-, так и на двухцепочечных субстратах ДНК и протекать по механизму «поворота» или «прохождения цепи» (рис. 3). Диапазон реакций включает: релаксацию суперспирали ДНК, развязывание одноцепочечных колец и декатенацию при условии, что хотя бы у одного партнера имеется одноцепочечный участок. В случае архейного фермента обратной гиразы возможна положительная сверхспирализация ДНК. [ 24 ]
Тип IA
[ редактировать ]Тип IA являются мономерными и связываются с одноцепочечными сегментами ДНК. Они вводят временный одноцепочечный разрыв за счет образования тирозилфосфатной связи между тирозином фермента и 5'-фосфатом ДНК. Сегмент ДНК, внутри которого происходит разрыв, называется «воротами» или G-сегментом, и его расщепление позволяет пройти другому сегменту ДНК, «транспортному» или Т-сегменту, по «цепи». процесс прохождения. [ 25 ] Далее следует перевязка G-сегмента. Чтобы произошел переход цепи, topo IA должен претерпеть конформационные изменения, чтобы открыть ворота ДНК и обеспечить перенос Т-сегмента. В ходе реакции релаксации ДНК этот процесс изменяет число связей ДНК на +/-1 (рис. 4). Примеры топоизомераз типа IA включают прокариотические топо I и III, эукариотические топо IIIα и IIIβ и архейный фермент обратную гирузу. Обратная гираза, которая встречается у термофильных архей, включает топос типа IA, связанный с геликазой, и является единственным известным ферментом, который может вводить положительные суперспирали в ДНК. [ 24 ] Ген, кодирующий обратную гиразу, также обнаружен у некоторых групп термофильных бактерий, куда он, вероятно, был перенесен путем горизонтального переноса генов от архей. [ 26 ]

Тип IB
[ редактировать ]Топоизомеразы типа IB катализируют реакции, включающие временные одноцепочечные разрывы ДНК посредством образования тирозилфосфатной связи между тирозином в ферменте и 3'-фосфатом в ДНК. Вместо использования механизма прохождения цепи эти ферменты действуют посредством «поворота» или «контролируемого вращения» расщепленной цепи вокруг неповрежденной цепи. [ 27 ] Этот механизм контролируемого вращения был впервые описан для Vaccinia topo I. [ 27 ] [ 28 ] и позволяет ДНК вращать свободный конец вокруг неповрежденной цепи, причем скорость контролируется «трением» внутри полости фермента, прежде чем разрыв будет повторно лигирован (рис. 3). Это приводит к переменному изменению числа связей в зависимости от события расщепления и повторного лигирования. Этот механизм отличается от механизма ферментов типа IA, и эти две группы ферментов структурно и эволюционно не связаны. Примеры топоизомераз типа IB включают эукариотический ядерный и митохондриальный топо I в дополнение к вирусному топо I , хотя они были идентифицированы во всех трех сферах жизни.
Тип ИС
[ редактировать ]Топоизомеразы типа IC имеют тот же механизм, что и ферменты типа IB, но структурно отличаются. Единственный представитель — topo V, обнаруженный у гипертермофила Methanopyrus kandleri . [ 29 ]
Тип II
[ редактировать ]Топоизомеразы типа II катализируют изменения топологии ДНК посредством временных двухцепочечных разрывов ДНК. Реакции происходят на двухцепочечных субстратах ДНК и протекают по механизму прохождения цепи (рис. 5). Диапазон реакций включает релаксацию ДНК, сверхспирализацию ДНК, развязывание и декатенацию. В то время как все топоизомеразы типа II могут катализировать релаксацию ДНК, гираза, типичная бактериальная топоизомераза, также может создавать отрицательные суперспирали. В отличие от топоизомераз типа I, которые обычно являются мономерами, топоизомеразы типа II представляют собой гомодимеры или гетеротетрамеры. Их разделяют на два подтипа на основе эволюционных, структурных и механистических соображений. Общий механизм прохождения цепи для топоса типа II начинается со связывания одного дуплекса ДНК, называемого сегментом ворот (G-сегмент), у ворот ДНК. Другой дуплекс, называемый транспортным сегментом (Т-сегмент), захватывается АТФ-управляемым зажимом и проходит через временный разрыв в G-сегменте, вовлекая 5'-фосфотирозиновые связи в обеих цепях, прежде чем он высвобождается через С-ворота. и G-сегмент повторно лигируется (рис. 5). Оборот ферментов требует связывания и гидролиза АТФ.

Тип IIA
[ редактировать ]Топоизомеразы типа IIA катализируют временные двухцепочечные разрывы ДНК посредством образования тирозилфосфатных связей между тирозинами фермента (по одному на каждую субъединицу) и 5'-фосфатами, расположенными в шахматном порядке на 4 основания в противоположных цепях ДНК. Реакция прохождения цепи может быть внутри- или межмолекулярной (рис. 5), что позволяет изменять суперскрученность и завязывание или развязывание соответственно. Этот процесс изменяет число связей ДНК на +/-2. Примеры топоизомераз типа IIA включают эукариотические топо IIα и топо IIβ , помимо бактериальной гиразы и топо IV. ДНК-гираза соответствует тому же механизму двухцепочечного пассажа, что и другие ферменты типа II, но обладает уникальными особенностями, связанными с ее способностью вводить отрицательные суперспирали в ДНК. Сегмент G является частью гораздо более длинного участка ДНК (>100 пар оснований), обернутого вокруг фермента, одно плечо которого образует Т-сегмент, проходящий через двухцепочечный разрыв (рис. 5). В случае гиразы значительное количество свободной энергии гидролиза АТФ преобразуется в торсионное напряжение ДНК, т.е. сверхспирализация является энергозатратным процессом. [ 30 ] Кроме того, в отсутствие АТФ гираза способна удалять отрицательные суперспирали в ходе более медленной реакции релаксации ДНК.
Тип IIB
[ редактировать ]Тип IIB также катализирует временные двухцепочечные разрывы за счет образования тирозилфосфатных связей между тирозинами фермента и 5'-фосфатами в противоположных цепях ДНК, но в случае ферментов IIB двухцепочечные разрывы имеют 2-цепочечный разрыв. базовое шатание. Ферменты типа IIB демонстрируют важные структурные различия, но эволюционно родственны ферментам типа IIA. Эти различия включают отсутствие одних из белковых «ворот» (ворот С) (рис. 5). Первоначально обнаруженные у архей, они были обнаружены также у эукариот и, в частности, у растений; примеры включают топо VI и топо VIII. Topo VI является наиболее изученным ферментом этого подтипа и считается предпочтительной декатеназой. [ 31 ]
В качестве мишени для наркотиков
[ редактировать ]Для неспециалиста, возможно, наиболее важным аспектом топоизомераз является их роль в качестве мишени для лекарств как для антибактериальной, так и для противораковой химиотерапии; Несколько антибактериальных и противораковых препаратов, нацеленных на топоизомеразу, включены в Примерный список основных лекарственных средств Всемирной организации здравоохранения 2019 года . Причина такой известности заключается в том, что их реакции протекают через временные разрывы в ДНК, которые, если они стабилизированы связыванием лекарств, могут привести к гибели клеток из-за образования токсичных одно- или двухцепочечных разрывов в геномной ДНК. Большинство топо-направленных препаратов действуют таким образом, т.е. стабилизируют промежуточный продукт ковалентного расщепления фермент-ДНК. [ 32 ] [ 33 ] [ 34 ]
Антибактериальные соединения
[ редактировать ]Хотя топосы типа I, такие как бактериальный топо I, являются жизнеспособными мишенями для антибиотиков, [ 35 ] в настоящее время в клинической практике не существует соединений, нацеленных на эти ферменты. Однако ферменты типа II, ДНК-гираза и ДНК-топоизомераза IV, добились огромного успеха в качестве мишеней для широко используемых фторхинолоновых антибиотиков (рис. 6).
Фторхинолоны (FQ)
[ редактировать ]Хинолоновые антибактериальные соединения были впервые разработаны в 1960-х годах и используются в клинической практике с 1980-х годов. [ 36 ] Производные FQ, такие как ципрофлоксацин, левофлоксацин и моксифлоксацин (рис. 6), оказались весьма успешными. Эти соединения действуют путем взаимодействия со своей мишенью (гиразой или топо IV) и ДНК в месте расщепления, чтобы стабилизировать промежуточное соединение ковалентного расщепления ДНК-белок. В частности, они интеркалируют в ДНК и предотвращают стадию религирования ДНК топоизомеразной реакции (рис. 5). Это высокоэффективный механизм ингибирования, который также используется в некоторых противораковых препаратах, нацеленных на топоизомеразу. Несмотря на впечатляющий успех, сопротивление FQ является серьезной проблемой. [ 36 ] Ряд других соединений, таких как хиназолиндионы и имидазолпиразиноны, [ 37 ] работают аналогичным образом, и есть надежда, что некоторые из них заменят FQ в будущем.
Аминокумарины
[ редактировать ]Аминокумарины (рис. 6), такие как новобиоцин, клоробиоцин и кумермицин А 1 , являются природными продуктами Streptomyces, которые ингибируют АТФазную реакцию гиразы и топо IV. [ 37 ] Хотя они могут быть очень эффективными против своей цели, они страдают от проблем с проницаемостью и токсичностью и, следовательно, не имеют такого уровня клинического успеха, как FQ.
Белковые ингибиторы
[ редактировать ]Существует ряд белковых ингибиторов гиразы, включая бактериальные токсины CcdB, McB17 и ParE. [ 38 ] [ 39 ] [ 40 ] которые стабилизируют комплекс расщепления аналогично FQ. Хотя эти белки не являются антибактериальными средствами, их способ действия может вдохновить на разработку новых антибактериальных соединений. Другие белковые ингибиторы гиразы предотвращают связывание ДНК топоизомеразой, а не стабилизируют комплексы расщепления. К ним относятся ЯкГ [ 41 ] и белки с пентапептидными повторами, такие как QnrB1 и MfpA; [ 42 ] [ 43 ] эти белковые ингибиторы также придают устойчивость к фторхинолонам.

Противораковые соединения
[ редактировать ]Как топо I, так и топо II человека (как α-, так и β-изоформы) могут быть нацелены на противораковую химиотерапию (рис. 7). [ 32 ] [ 33 ] [ 44 ] [ 45 ] [ 46 ] [ 47 ] Большинство этих соединений действуют аналогично FQ, т.е. стабилизируют комплекс ковалентного расщепления ДНК-белок; по этой причине они стали известны как яды топоизомеразы, в отличие от каталитических ингибиторов. [ 33 ] [ 34 ] [ 48 ] Несколько ингибиторов топоизомеразы человека включены в Список основных лекарственных средств Всемирной организации здравоохранения .
Камптотецин (CPT)
[ редактировать ]Камптотецин (рис. 7), первоначально полученный из дерева Camptotheca acuminata , нацелен на топо I человека, а его производные, такие как топотекан и иринотекан, широко используются в химиотерапии рака. [ 33 ] Камптотецин и его производные действуют путем стабилизации комплекса расщепления топо I, предотвращая повторное лигирование опосредованного белком разрыва в ДНК. Эти межфазные ингибиторы стабилизируются за счет стекинговых взаимодействий с разорванной ДНК и водородных связей с ферментом. Хотя производные CPT стабилизируют комплекс одноцепочечного расщепления, считается, что последующие столкновения с механизмами репликации или транскрипции вызывают токсичные разрывы двухцепочечной ДНК. Эти соединения используются в качестве терапии первой или второй линии для лечения рака, включая рак прямой кишки, яичников, легких, молочной железы и шейки матки. Однако производные CPT имеют ограничения, связанные с токсичностью и ограниченным терапевтическим периодом полураспада из-за химической нестабильности. Новые ингибиторы топо I, инденоизохинолины и фторинденоизохинолины, преодолевают ограничения производных CPT и в настоящее время проходят клинические испытания. [ 49 ]
Этопозид (VP-16)
[ редактировать ]Этопозид (рис. 7) и его близкий родственник тенипозид (VM-26) представляют собой производные эпиподофиллотоксина, полученные из корневища дикой мандрагоры и воздействующие на топо II путем стабилизации комплекса ковалентного расщепления и предотвращения повторного лигирования расщепленной ДНК. [ 46 ] Они обычно используются в сочетании с другими химиотерапевтическими препаратами для лечения рака, включая опухоли яичек, мелкоклеточный рак легких и лейкемию. Лечение этопозидом может привести к вторичным лейкозам, возникающим в результате специфических геномных транслокаций, в основном с участием топо IIβ. [ 46 ]
Доксорубицин
[ редактировать ]
Доксорубицин (рис. 7) и родственные ему производные даунорубицин, эпирубицин и идарубицин представляют собой антрациклины, полученные из бактерии Streptomyces. [ 48 ] которые нацелены на топо II человека, стабилизируя комплекс расщепления аналогично другим ядам топоизомеразы. Митоксантрон представляет собой синтетический антрацендион, химически и функционально сходный с антрациклинами. [ 47 ] Антрациклины были первыми ингибиторами топоизомеразы, использованными для лечения рака, и остаются одними из наиболее широко используемых и эффективных методов лечения широкого спектра онкологических заболеваний, включая рак молочной железы, лимфому, лейкозы, карциномы, саркомы и другие опухоли. [ 47 ] Эти соединения являются агентами, интеркалирующими ДНК, и поэтому могут влиять на широкий спектр процессов клеточной ДНК в дополнение к специфическому отравлению топо II. [ 33 ] Дополнительная цитотоксичность обусловлена окислительно-восстановительными реакциями с участием антрациклинов, которые генерируют активные формы кислорода. Генерация активного кислорода наряду с отравлением топо IIβ приводит к дозолимитирующей кардиотоксичности антрациклинов. [ 33 ]
Мербарон
[ редактировать ]Мербарон является производным тиобарбитуровой кислоты, а дексразоксан (ICRF-187), одно из нескольких родственных производных бисдиоксопиперазина (рис. 7), являются примерами каталитических ингибиторов топо II, т.е. они предотвращают завершение каталитического цикла топо II, но не стабилизировать комплекс расщепления ДНК. Хотя эти каталитические ингибиторы проявляют цитотоксичность и прошли клинические испытания, в настоящее время они не используются в клинической практике для лечения рака. [ 47 ] Однако дексразоксан, который блокирует гидролиз АТФ топо II, используется для предотвращения кардиотоксичности, связанной с антрациклинами. [ 50 ] [ 51 ]
| топоизомераза | Тип подсемейства | Функция | Мультимерность | Металлическая зависимость | АТФ-зависимость | Одно- или двухцепочечное расщепление? | Полярность расщепления | Изменение номера ссылки (L) |
|---|---|---|---|---|---|---|---|---|
| Топоизомераза I
( Э. палочка ) |
Тип IA | Удаляет (-), но не (+) суперспирали. Предотвращает чрезмерную сверхспирализацию генома и поддерживает транскрипцию. | Мономер | Да (мг 2+ ) | Нет | SS | ||
| Топоизомераза III
( Э. палочка ) |
Удаляет (-), но не (+) суперспирали; перекрывающаяся функция с топоизомеразой IV | |||||||
| Топоизомераза IIIα
( Х. мудрый ) |
Удаляет (-), но не (+) суперспирали; способствует отсоединению прекатенанов при репликации клеточной ДНК; может катализировать завязывание, развязывание и переплетение одноцепочечных колец, а также завязывание, развязывание, сцепление и декатенацию дуплексных колец ДНК с разрывами или надрезами. | |||||||
| Топоизомераза IIIβ
( Х. мудрый ) |
Было показано, что это предполагаемая РНК-топоизомераза. Участвует в процессинге РНК | |||||||
| Обратная гираза
(Архея) |
Удаляет (-), но не (+) супервитушки, вводит положительные супервитки. | Мономер и гетеродимер | Да | |||||
| Топоизомераза I
( Х. мудрый ) |
Тип IB | Удаляет (+) и (-) суперспирали; поддерживает движение вилки во время репликации и транскрипции | Мономер | Нет | Нет | SS | 3' | ±n |
| Топоизомераза I
(вирус коровьей оспы) |
||||||||
| Топоизомераза V
(Архея) |
Тип ИС | Расслабляет (+) и (-) супервитки. Участвует в восстановлении ДНК. | Мономер | Нет | Нет | SS | 3' | ±n |
| Топоизомераза II ( ДНК-гираза )
( Э. палочка ) |
Тип IIA | Генерирует (-) суперспирали (единственная топоизомераза, которая, как известно, делает это) | гетеротетрамер | Да (мг 2+ ) | Да | ДС | 5' | ±2 |
| Топоизомераза IV
( Э. палочка ) |
Декатенирует реплицированную ДНК; расслабляет (+) суперспирали быстрее, чем (-) | гетеротетрамер | ||||||
| Топоизомераза IIα
( Х. мудрый ) |
Существенный; Разъединяет переплетенные дочерние дуплексы при репликации; способствует релаксации ДНК во время транскрипции | гомодимер | ||||||
| Топоизомераза IIβ
( Х. мудрый ) |
Роль в подавлении рекомбинации или поддержке транскрипции в нейронах | гомодимер | ||||||
| Топоизомераза VI
(Архея) |
Тип IIB | Расслабляет (+) и (-) супервитки; отвечает за декатенацию промежуточных продуктов репликации | гетеротетрамер | Да (мг 2+ ) | Да | ДС | 5' | ±2 |
Роль топоизомеразы в регуляции транскрипции
[ редактировать ]По крайней мере одна топоизомераза, ДНК-топоизомераза II бета (topo IIβ), играет регуляторную роль в транскрипции генов. Topo IIβ-зависимые двухцепочечные разрывы ДНК и компоненты механизма восстановления повреждений ДНК важны для быстрой экспрессии ранних ранних генов , а также для сигнально-зависимой регуляции генов. [ 52 ] [ 53 ] [ 54 ] [ 55 ] Topo IIβ с другими связанными ферментами, [ 54 ] по-видимому, важен для высвобождения приостановленной РНК-полимеразы в высокотранскрибируемых или длинных генах. [ 56 ] [ 57 ] [ 58 ]
Топо IIβ в инициации транскрипции
[ редактировать ]Индуцированные стимулом двухцепочечные разрывы ДНК (DSB), которые ограничены кратковременным периодом (от 10 минут до 2 часов), индуцируются топо IIβ в промоторных областях генов, регулируемых сигналом. Эти DSB позволяют быстро усиливать экспрессию таких чувствительных к сигналу генов в ряде систем (см. Таблицу ниже). Эти гены, регулирующие сигнал, включают гены, активируемые в ответ на стимуляцию эстрогеном , сывороткой , инсулином , глюкокортикоидами (такими как дексаметазон ) и активацию нейронов. Когда индуцированный двухцепочечный разрыв ДНК восстанавливается, транскрипция гена, реагирующего на сигнал, возвращается к низкому базальному уровню. [ 52 ]

Было обнаружено, что Topo IIβ и PARP-1 постоянно присутствуют на умеренном уровне вблизи места начала транскрипции промотора сигнально-зависимого гена. После появления сигнала топо IIβ вызвал двухцепочечный разрыв, и PARP-1 участвовал в замене гистона H1 на HMGB1 / HMGA2 , что может способствовать транскрипции. [ 55 ] Топо IIβ и PARP-1 увеличивались в месте двухцепочечного разрыва и компонентов негомологичного конца пути репарации ДНК, включая ДНК-PKcs, Ku70/Ku80 и ДНК-лигазу IV, собранную с топо IIβ и PARP-1. Вся эта совокупность присутствовала в линкерной ДНК, прилегающей к одной нуклеосоме в промоторной области гена (см. Рисунок). Нуклеосома располагалась близко к месту начала транскрипции гена. [ 55 ] Компоненты негомологичного пути репарации ДНК, соединяющего концы, были необходимы для закрытия двухцепочечного разрыва ДНК. [ 52 ]
| Лиганд или активирующий агент | Ген(ы), оцененные на DSB | DSB после активации, вызванной сигналом | DSB требовался для транскрипции | Расположение ДСБ | Белки, присутствующие в DSB | Продолжительность DSB после активации, вызванной сигналом | Ссылки |
|---|---|---|---|---|---|---|---|
| Эстрадиол | PS2 | да | да | промоутер | топо IIβ , PARP-1 , ДНК-PKcs , Ku70 , Ku80 | 10 минут | [ 59 ] |
| Инсулин | БАССЕЙН | да | да | промоутер | топо IIβ , PARP-1 , ДНК-PKcs , Ku70 , Ku80 , протеинфосфатаза 1 (PP1), P/CAF | 3 часа | [ 60 ] |
| Тепловой шок или сыворотка | HSPA1B , ИЮНЬ , FOS , EGR1 , MYC | да | да | промоутер и POLII приостанавливают сайт | ДНК-PKcs , Ku70 , γH2AX, TRIM28 | от 30 секунд до 5 минут | [ 61 ] |
| Дексаметазон или Эстрадиол | ПС2 , ММТВ, ПЛЗФ , HSD11B2 | да | да | промоутер | топо IIβ , PARP-1 , ДНК-PKcs , Ku70 , Ku80 , BRG1 | 15 минут | [ 62 ] |
| Активация KCl или NMDA культивируемых первичных корковых нейронов | ФОС , РОГ1 , НПАС4 , NR4A1 | да | да | промоутер | топо IIβ , PARP-1 , ДНК-PKcs , Ku70 , Ku80 , CTCF | До 2 часов | [ 52 ] |
| Обусловливание страхом (оценивалось в нейронах гиппокампа мыши и медиальной префонтальной коры) | >200 генов с новыми DSB и повышенной экспрессией | да | DSB коррелировали с транскрипцией | промоутеры | не проверено | 10 минут и второй пик на 30 минуте. | [ 63 ] |
Регуляция экспрессии генов Topo IIβ
[ редактировать ]РНК-полимераза II часто имеет сайт паузы, расположенный примерно на 30–60 нуклеотидов ниже сайт начала транскрипции гена. [ 64 ] [ 65 ] Считается, что приостановка действия РНК-полимеразы II в этих сайтах и контролируемое высвобождение паузы играют регуляторную роль в транскрипции генов. Как отмечают Сингх и др., [ 58 ] «около 80% высокоэкспрессируемых генов в клетках HeLa приостановлены». Очень кратковременные, но не немедленно закрывающиеся двухцепочечные разрывы ДНК, индуцированные топо IIβ, происходят в местах паузы РНК-полимеразы II и, по-видимому, необходимы для эффективного выхода из состояния паузы и перехода к транскрипции гена. [ 56 ] [ 57 ] [ 58 ] Считается, что для генов, в которых это происходит, двухцепочечный разрыв ДНК, индуцированный TOP2B, является частью процесса регуляции экспрессии генов.
См. также
[ редактировать ]- Топология ДНК
- Суперспираль
- Топоизомераза I типа
- Топоизомераза типа II
- Топоизомераза I
- Топоизомераза IIα
- Топоизомераза IIβ
- Топоизомераза IIIα
- Топоизомераза IIIβ
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Маккай С.Дж., Нойман К.К., Максвелл А. (апрель 2021 г.). «ДНК-топоизомеразы: достижения в понимании клеточных ролей и мультибелковых комплексов посредством структурно-функционального анализа» . Биоэссе . 43 (4): e2000286. doi : 10.1002/bies.202000286 . ПМЦ 7614492 . ПМИД 33480441 . S2CID 231679533 .
- ^ Сутормин Д.А., Галивонджян А.К., Полховский А.В., Камалян С.О., Северинов К.В., Дубилей С.А. (15.03.2021). «Разнообразие и функции топоизомераз типа II» . Акта Натурае . 13 (1): 59–75. дои : 10.32607/actanaturae.11058 . ПМК 8084294 . ПМИД 33959387 .
- ^ Ван Дж. К. (февраль 1971 г.). «Взаимодействие ДНК и омега-белка Escherichia coli». Журнал молекулярной биологии . 55 (3): 523–533. дои : 10.1016/0022-2836(71)90334-2 . ПМИД 4927945 .
- ^ Шампу Ж.Дж., Дульбекко Р. (январь 1972 г.). «Активность клеток млекопитающих, которая раскручивает суперспираль ДНК — возможный поворот для репликации ДНК (анализ связывания полиомы, бромида этидия, мышиных клеток эмбриона — красителя)» . Труды Национальной академии наук Соединенных Штатов Америки . 69 (1): 143–146. дои : 10.1073/pnas.69.1.143 . ПМК 427563 . ПМИД 4333036 .
- ^ Геллерт М., Мизуучи К., О'Ди М.Х., Нэш Х.А. (ноябрь 1976 г.). «ДНК-гираза: фермент, который вводит в ДНК суперспиральные повороты» . Труды Национальной академии наук Соединенных Штатов Америки . 73 (11): 3872–3876. Бибкод : 1976PNAS...73.3872G . дои : 10.1073/pnas.73.11.3872 . ПМЦ 431247 . ПМИД 186775 .
- ^ Сугино А., Пиблз К.Л., Кройцер К.Н., Коццарелли Н.Р. (ноябрь 1977 г.). «Механизм действия налидиксовой кислоты: очистка продукта гена Escherichia coli nalA и его связь с ДНК-гиразой и новым ферментом, закрывающим разрывы» . Труды Национальной академии наук Соединенных Штатов Америки . 74 (11): 4767–4771. Бибкод : 1977PNAS...74.4767S . дои : 10.1073/pnas.74.11.4767 . ПМК 432036 . ПМИД 200930 .
- ^ Бальди М.И., Бенедетти П., Матточча Э., Токкини-Валентини Г.П. (июнь 1980 г.). «Катенация и декатенация ДНК in vitro и новая эукариотическая АТФ-зависимая топоизомераза». Ячейка 20 (2): 461–467. дои : 10.1016/0092-8674(80)90632-7 . ПМИД 6248247 . S2CID 42645648 .
- ^ Лю Л.Ф., Лю CC, Альбертс Б.М. (октябрь 1979 г.). «ДНК-топоизомераза Т4: новый АТФ-зависимый фермент, необходимый для инициации репликации ДНК бактериофага Т4». Природа . 281 (5731): 456–461. Бибкод : 1979Natur.281..456L . дои : 10.1038/281456a0 . ПМИД 226889 . S2CID 4343962 .
- ^ Стетлер Г.Л., Кинг Г.Дж., Хуан В.М. (август 1979 г.). «Белки задержки ДНК Т4, необходимые для специфической репликации ДНК, образуют комплекс, обладающий АТФ-зависимой ДНК-топоизомеразной активностью» . Труды Национальной академии наук Соединенных Штатов Америки . 76 (8): 3737–3741. Бибкод : 1979PNAS...76.3737S . дои : 10.1073/pnas.76.8.3737 . ПМЦ 383908 . ПМИД 226976 .
- ^ Перейти обратно: а б с д Бейтс А.Д. (2005). Топология ДНК . Энтони Максвелл (2-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-154658-7 . OCLC 64239232 .
- ^ Уотсон Дж. Д., Крик Ф. Х. (май 1953 г.). «Генетическое значение структуры дезоксирибонуклеиновой кислоты». Природа . 171 (4361): 964–967. Бибкод : 1953Natur.171..964W . дои : 10.1038/171964b0 . ПМИД 13063483 . S2CID 4256010 .
- ^ Уотсон Дж. Д., Крик Ф. Х. (апрель 1953 г.). «Молекулярная структура нуклеиновых кислот; структура нуклеиновой кислоты дезоксирибозы». Природа . 171 (4356): 737–738. Бибкод : 1953Natur.171..737W . дои : 10.1038/171737a0 . ПМИД 13054692 . S2CID 4253007 .
- ^ Франклин Р.Э., Гослинг Р.Г. (июль 1953 г.). «Доказательства существования двухцепочечной спирали в кристаллической структуре дезоксирибонуклеата натрия». Природа . 172 (4369): 156–157. Бибкод : 1953Natur.172..156F . дои : 10.1038/172156a0 . ПМИД 13072614 . S2CID 4169572 .
- ^ Кэрнс Дж. (март 1963 г.). «Бактериальная хромосома и способ ее репликации, как видно с помощью авторадиографии». Журнал молекулярной биологии . 6 (3). Эльзевир: 208–213. дои : 10.1016/s0022-2836(63)80070-4 . ПМИД 14017761 .
- ^ Дельбрюк М. (сентябрь 1954 г.). «О репликации дезоксирибонуклеиновой кислоты (ДНК)» . Труды Национальной академии наук Соединенных Штатов Америки . 40 (9): 783–788. Бибкод : 1954PNAS...40..783D . дои : 10.1073/pnas.40.9.783 . ПМК 534166 . ПМИД 16589559 .
- ^ Кэлугэряну Г (1959). «Интеграл Гаусса и анализ трехмерных узлов». Журнал чистой и прикладной математики . 4 :5–20.
- ^ Фуллер Ф.Б. (апрель 1971 г.). «Извивающееся число пространственной кривой» . Труды Национальной академии наук Соединенных Штатов Америки . 68 (4): 815–819. Бибкод : 1971ПНАС...68..815Б . дои : 10.1073/pnas.68.4.815 . ПМК 389050 . ПМИД 5279522 .
- ^ Уайт Дж. Х. (1969). «Самосвязывание и интеграл Гаусса в высших измерениях». Американский журнал математики . 91 (3): 693–728. дои : 10.2307/2373348 . ISSN 0002-9327 . JSTOR 2373348 .
- ^ Постоу Л., Крисона, Нью-Джерси, Питер Б.Дж., Харди К.Д., Коццарелли Н.Р. (июль 2001 г.). «Топологические проблемы репликации ДНК: конформации на развилке» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (15): 8219–8226. Бибкод : 2001PNAS...98.8219P . дои : 10.1073/pnas.111006998 . ПМК 37424 . ПМИД 11459956 .
- ^ Сундин О., Варшавский А. (сентябрь 1981 г.). «Арест сегрегации приводит к накоплению сильно переплетенных цепных димеров: рассечение последних стадий репликации ДНК SV40». Клетка . 25 (3): 659–669. дои : 10.1016/0092-8674(81)90173-2 . ПМИД 6269752 . S2CID 24408315 .
- ^ Лю Л.Ф., Ван Дж.К. (октябрь 1987 г.). «Сверхспирализация матрицы ДНК во время транскрипции» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (20): 7024–7027. Бибкод : 1987PNAS...84.7024L . дои : 10.1073/pnas.84.20.7024 . ПМК 299221 . ПМИД 2823250 .
- ^ Кремер Дж.А., Сандерлин А.Г., Лауб М.Т. (июль 2019 г.). «Строгий ответ ингибирует инициацию репликации ДНК в E. coli путем модуляции суперспирализации oriC » . мБио . 10 (4). дои : 10.1128/mbio.01330-19 . ПМК 6606810 . PMID 31266875 .
- ^ фон Фрейслебен У, Расмуссен К.В. (сентябрь 1992 г.). «Уровень сверхспирализации влияет на регуляцию репликации ДНК у Escherichia coli» . Исследования в области микробиологии . 143 (7): 655–663. дои : 10.1016/0923-2508(92)90060-2 . ПМИД 1488550 .
- ^ Перейти обратно: а б Кикучи А., Асаи К. (1984). «Обратная гираза - топоизомераза, которая вводит положительные суперспиральные повороты в ДНК». Природа . 309 (5970): 677–681. Бибкод : 1984Natur.309..677K . дои : 10.1038/309677a0 . ПМИД 6328327 . S2CID 4242694 .
- ^ Лю Л.Ф., Лю CC, Альбертс Б.М. (март 1980 г.). «ДНК-топоизомеразы типа II: ферменты, которые могут развязать топологически завязанную молекулу ДНК посредством обратимого двухцепочечного разрыва». Клетка . 19 (3): 697–707. дои : 10.1016/s0092-8674(80)80046-8 . ПМИД 6244895 . S2CID 8921868 .
- ^ Брошье-Армане C, Forterre P (май 2007 г.). «Широко распространенное распространение архейной обратной гиразы в термофильных бактериях предполагает сложную историю вертикального наследования и латерального переноса генов» . Архея . 2 (2): 83–93. дои : 10.1155/2006/582916 . ПМК 2686386 . ПМИД 17350929 .
- ^ Перейти обратно: а б Стюарт Л., Рединбо М.Р., Цю X, Хол В.Г., Шампу Дж.Дж. (март 1998 г.). «Модель механизма топоизомеразы I человека». Наука . 279 (5356): 1534–1541. Бибкод : 1998Sci...279.1534S . дои : 10.1126/science.279.5356.1534 . ПМИД 9488652 .
- ^ Стиверс Дж.Т., Харрис Т.К., Милдван А.С. (апрель 1997 г.). «ДНК-топоизомераза I коровьей оспы: данные, подтверждающие механизм свободного вращения для релаксации суперспирали ДНК». Биохимия . 36 (17): 5212–5222. дои : 10.1021/bi962880t . ПМИД 9136883 .
- ^ Бейкер Н.М., Раджан Р., Мондрагон А. (февраль 2009 г.). «Структурные исследования топоизомераз I типа» . Исследования нуклеиновых кислот . 37 (3): 693–701. дои : 10.1093/нар/gkn1009 . ПМЦ 2647283 . ПМИД 19106140 .
- ^ Бейтс А.Д., Бергер Дж.М., Максвелл А. (август 2011 г.). «Наследственная роль гидролиза АТФ в топоизомеразах типа II: предотвращение двухцепочечных разрывов ДНК» . Исследования нуклеиновых кислот . 39 (15): 6327–6339. дои : 10.1093/nar/gkr258 . ПМК 3159449 . ПМИД 21525132 .
- ^ Маккай С.Дж., Десаи П.Р., Сол Ю., Аллен А.М., Максвелл А., Нойман К.С. (январь 2022 г.). «Топоизомераза VI представляет собой хирально-селективную избирательную ДНК-декатеназу» . электронная жизнь . 11 . doi : 10.7554/eLife.67021 . ПМЦ 8837201 . ПМИД 35076393 .
- ^ Перейти обратно: а б Помье Ю. (январь 2013 г.). «Лекарственное воздействие топоизомераз: уроки и проблемы» . АКС Химическая биология . 8 (1): 82–95. дои : 10.1021/cb300648v . ПМЦ 3549721 . ПМИД 23259582 .
- ^ Перейти обратно: а б с д и ж Помье Ю., Лео Э., Чжан Х., Маршан С. (май 2010 г.). «ДНК-топоизомеразы и их отравление противораковыми и антибактериальными препаратами» . Химия и биология . 17 (5): 421–433. doi : 10.1016/j.chembiol.2010.04.012 . ПМЦ 7316379 . ПМИД 20534341 .
- ^ Перейти обратно: а б Помье Ю., Маршан К. (декабрь 2011 г.). «Межфазные ингибиторы: воздействие на макромолекулярные комплексы» . Обзоры природы. Открытие наркотиков . 11 (1): 25–36. дои : 10.1038/nrd3404 . ПМЦ 7380715 . ПМИД 22173432 .
- ^ Це-Динь ЮК (2015). «Нацеливание на бактериальную топоизомеразу I для решения задачи поиска новых антибиотиков» . Будущая медицинская химия . 7 (4): 459–471. дои : 10.4155/fmc.14.157 . ПМЦ 4415981 . ПМИД 25875873 .
- ^ Перейти обратно: а б Буш Н.Г., Диес-Сантос I, Эбботт Л.Р., Максвелл А. (декабрь 2020 г.). «Хинолоны: механизм, летальность и их вклад в устойчивость к антибиотикам» . Молекулы . 25 (23): 5662. doi : 10,3390/molecules25235662 . ПМЦ 7730664 . ПМИД 33271787 .
- ^ Перейти обратно: а б Максвелл А., Буш Н.Г., Джерм Т., Маккай С.Дж. (2018). «Нехинолоновые ингибиторы топоизомеразы». В Фонг И.В., Дрлица К. (ред.). Устойчивость к противомикробным препаратам и ее последствия для XXI века . Нью-Йорк: Спрингер. стр. 593–618. ISBN 978-0-387-72417-1 . ОСЛК 227210110 .
- ^ Коллин Ф., Максвелл А. (август 2019 г.). «Микробный токсин микроцин В17: перспективы разработки новых антибактериальных средств» . Журнал молекулярной биологии . 431 (18): 3400–3426. дои : 10.1016/j.jmb.2019.05.050 . ПМК 6722960 . ПМИД 31181289 .
- ^ Цзян Ю, Польяно Дж, Хелински Д.Р., Конечный И. (май 2002 г.). «Токсин ParE, кодируемый плазмидой RK2 широкого круга хозяев, является ингибитором гиразы Escherichia coli» . Молекулярная микробиология . 44 (4): 971–979. дои : 10.1046/j.1365-2958.2002.02921.x . ПМИД 12010492 . S2CID 40019620 .
- ^ Смит А.Б., Максвелл А. (2006). «Конформация ДНК-гиразы, обеспечивающая прохождение цепи, необходима для того, чтобы бактериальный токсин CcdB мог получить доступ к своему сайту связывания» . Исследования нуклеиновых кислот . 34 (17): 4667–4676. дои : 10.1093/нар/gkl636 . ПМЦ 1635281 . ПМИД 16963775 .
- ^ Вос С.М., Любимов А.Я., Херши Д.М., Шеффлер А.Дж., Сенгупта С., Нагараджа В., Бергер Дж.М. (июль 2014 г.). «Прямой контроль активности топоизомеразы типа IIA с помощью регуляторного белка, кодируемого хромосомами» . Гены и развитие . 28 (13): 1485–1497. дои : 10.1101/gad.241984.114 . ПМК 4083091 . ПМИД 24990966 .
- ^ Фэн Л., Манди Дж. Э., Стивенсон С. Э., Митченалл Л. А., Лоусон Д. М., Ми К., Максвелл А. (март 2021 г.). «Белок с пентапептидными повторами, MfpA, взаимодействует с микобактериальной ДНК-гиразой как имитатор Т-сегмента ДНК» . Труды Национальной академии наук Соединенных Штатов Америки . 118 (11). Бибкод : 2021PNAS..11816705F . дои : 10.1073/pnas.2016705118 . ПМЦ 7980463 . ПМИД 33836580 .
- ^ Мазурек Л., Гиларов Д., Михальчик Е., Пакош З., Метелев М., Чищон В. и др. (февраль 2021 г.). «Белок QnrB1 с пентапептидным повтором требует гидролиза АТФ для омоложения отравленных гиразных комплексов» . Исследования нуклеиновых кислот . 49 (3): 1581–1596. дои : 10.1093/nar/gkaa1266 . ПМЦ 7897471 . ПМИД 33434265 .
- ^ Нельсон Э.М., Тьюи К.М., Лю Л.Ф. (март 1984 г.). «Механизм действия противоопухолевого препарата: отравление ДНК-топоизомеразы II млекопитающих на ДНК 4'-(9-акридиниламино)-метансульфон-м-анизидидом» . Труды Национальной академии наук Соединенных Штатов Америки . 81 (5): 1361–1365. Бибкод : 1984PNAS...81.1361N . дои : 10.1073/pnas.81.5.1361 . ПМЦ 344833 . ПМИД 6324188 .
- ^ Помье Ю., Танизава А., Кон К.В. (1994). «Механизмы ингибирования топоизомеразы I противораковыми препаратами». ДНК-топоизомеразы: препараты, нацеленные на топоизомеразы . Достижения фармакологии. Том. 29Б. Эльзевир. стр. 73–92. дои : 10.1016/s1054-3589(08)61132-1 . ISBN 978-0-12-032930-4 . ПМИД 8996602 .
- ^ Перейти обратно: а б с Ванн К.Р., Овиатт А.А., Ошерофф Н. (июнь 2021 г.). «Яды топоизомеразы II: превращение незаменимых ферментов в молекулярные ножницы» . Биохимия . 60 (21): 1630–1641. doi : 10.1021/acs.biochem.1c00240 . ПМК 8209676 . ПМИД 34008964 .
- ^ Перейти обратно: а б с д Мерфи М.Б., Мерсер С.Л., Дьюиз Дж.Э. (январь 2017 г.). «Ингибиторы и яды топоизомераз млекопитающих типа II». Достижения молекулярной токсикологии . Том. 11. Эльзевир. стр. 203–240. дои : 10.1016/b978-0-12-812522-9.00005-1 . ISBN 9780128125229 .
- ^ Перейти обратно: а б Рука КР (октябрь 1998 г.). «Клиническое применение противораковых препаратов, нацеленных на топоизомеразу II». Биохимия и биофизика Acta (BBA) - Структура и экспрессия генов . 1400 (1–3): 173–184. дои : 10.1016/s0167-4781(98) 00134-1 ПМИД 9748560 .
- ^ Помье Ю., Кушман М. (май 2009 г.). «Индиноизохинолин-нонкамптотецин-топоизомераза I: обновленная информация и перспективы» . Молекулярная терапия рака . 8 (5): 1008–1014. дои : 10.1158/1535-7163.mct-08-0706 . ПМЦ 2888777 . ПМИД 19383846 .
- ^ Спейер Дж.Л., Грин М.Д., Крамер Э., Рей М., Сэнгер Дж., Уорд С. и др. (сентябрь 1988 г.). «Защитный эффект биспиперазиндиона ICRF-187 против сердечной токсичности, вызванной доксорубицином, у женщин с распространенным раком молочной железы». Медицинский журнал Новой Англии . 319 (12): 745–752. дои : 10.1056/nejm198809223191203 . ПМИД 3137469 .
- ^ Цветкович Р.С., Скотт Л.Дж. (2005). «Дексразоксан: обзор его использования для кардиопротекции во время химиотерапии антрациклинами». Наркотики . 65 (7): 1005–1024. дои : 10.2165/00003495-200565070-00008 . ПМИД 15892593 .
- ^ Перейти обратно: а б с д Мадабхуши Р., Ким Т.К. (март 2018 г.). «Новые темы экспрессии генов, зависящей от активности нейронов» . Мол клеточные нейроны . 87 : 27–34. дои : 10.1016/j.mcn.2017.11.009 . ПМЦ 5894330 . ПМИД 29254824 .
- ^ Банч Х, Чон Дж, Кан К, Джо Д.С., Конг А.Т., Ким Д., Ким Д., Чо Д.Х., Ли Ю.М., Чен Б.П., Шелленберг М.Дж., Колдервуд С.К. (октябрь 2021 г.). «BRCA1-BARD1 регулирует транскрипцию посредством модуляции топоизомеразы IIβ» . Открытая Биол . 11 :210221.doi : (10 ) 10.1098/rsob.210221 . ПМЦ 8492178 . ПМИД 34610268 .
- ^ Перейти обратно: а б Остин Калифорния, Коуэлл И.Г., Хазим М.М., Лок Д., Нг ХТ (декабрь 2021 г.). «Вклад TOP2B в транскрипцию» . Биохим Соц Транс . 49 (6): 2483–2493. дои : 10.1042/BST20200454 . ПМИД 34747992 . S2CID 243846627 .
- ^ Перейти обратно: а б с Джу Б.Г., Луняк В.В., Перисси В., Гарсиа-Бассетс И., Роуз Д.В., Гласс С.К., Розенфельд М.Г. (июнь 2006 г.). «Разрыв дцДНК, опосредованный бета-топоизомеразой II, необходимый для регулируемой транскрипции». Наука . 312 (5781): 1798–802. Бибкод : 2006Sci...312.1798J . дои : 10.1126/science.1127196 . ПМИД 16794079 . S2CID 206508330 .
- ^ Перейти обратно: а б Деллино Дж.И., Паллуцци Ф., Кьяриелло А.М., Пиччиони Р., Бьянко С., Фурия Л., Де Конти Дж., Бауман Б.А., Меллони Дж., Гвидо Д., Джако Л., Лузи Л., Читтаро Д., Фаретта М., Никодеми М., Крозетто Н., Пеличчи ПГ (июнь 2019 г.). «Высвобождение приостановленной РНК-полимеразы II в определенных локусах способствует образованию двухцепочечных разрывов ДНК и способствует транслокации рака» . Нат Жене . 51 (6): 1011–1023. дои : 10.1038/s41588-019-0421-z . ПМИД 31110352 . S2CID 256819778 .
- ^ Перейти обратно: а б Гиттенс WH, Джонсон DJ, Эллисон RM, Купер TJ, Томас Х, Нил MJ (октябрь 2019 г.). «Карта нуклеотидного разрешения разрывов ДНК, связанных с Top2, в геноме дрожжей и человека» . Нат Коммун . 10 (1): 4846. Бибкод : 2019NatCo..10.4846G . дои : 10.1038/s41467-019-12802-5 . ПМК 6813358 . ПМИД 31649282 .
- ^ Перейти обратно: а б с Сингх С., Шлахта К., Манукян А., Раймер Х.М., Динда М., Бекиранов С., Ван Й.Х. (март 2020 г.). «Участки паузы РНК-полимеразы II на активно транскрибируемых генах обогащены двухцепочечными разрывами ДНК» . J Биол Хим . 295 (12): 3990–4000. дои : 10.1074/jbc.RA119.011665 . ПМК 7086017 . ПМИД 32029477 .
- ^ Джу Б.Г., Луняк В.В., Перисси В., Гарсиа-Бассетс И., Роуз Д.В., Гласс С.К., Розенфельд М.Г. (июнь 2006 г.). «Разрыв дцДНК, опосредованный топоизомеразой IIbeta, необходимый для регулируемой транскрипции». Наука . 312 (5781): 1798–802. Бибкод : 2006Sci...312.1798J . дои : 10.1126/science.1127196 . ПМИД 16794079 . S2CID 206508330 .
- ^ Вонг Р.Х., Чанг И, Худак К.С., Хён С., Кван Х.И., Сул Х.С. (март 2009 г.). «Роль ДНК-ПК в регуляции метаболических генов в ответ на инсулин» . Клетка . 136 (6): 1056–72. дои : 10.1016/j.cell.2008.12.040 . ПМЦ 2768498 . ПМИД 19303849 .
- ^ Банч Х., Лоуни Б.П., Лин Ю.Ф., Асайтамби А., Муршид А., Ван Й.Е., Чен Б.П., Колдервуд С.К. (декабрь 2015 г.). «Элонгация транскрипции требует передачи сигналов, индуцированных разрывом ДНК» . Нат Коммун . 6 : 10191. Бибкод : 2015NatCo...610191B . дои : 10.1038/ncomms10191 . ПМК 4703865 . ПМИД 26671524 .
- ^ Троттер К.В., Кинг Х.А., Арчер Т.К. (август 2015 г.). «Активация транскрипции глюкокортикоидных рецепторов посредством BRG1-зависимого рекрутирования TOP2β и Ku70/86» . Мол Клеточная Биол . 35 (16): 2799–817. дои : 10.1128/MCB.00230-15 . ПМК 4508321 . ПМИД 26055322 .
- ^ Стотт РТ, Крицкий О, Цай ЛХ (2021). «Профилирование сайтов разрывов ДНК и транскрипционных изменений в ответ на контекстуальное обучение страху» . ПЛОС ОДИН . 16 (7): e0249691. Бибкод : 2021PLoSO..1649691S . дои : 10.1371/journal.pone.0249691 . ПМЦ 8248687 . ПМИД 34197463 .
- ^ Доллинджер Р., Гилмор Д.С. (июль 2021 г.). «Регуляция проксимальной паузы промотора РНК-полимеразы II у многоклеточных животных» . Дж Мол Биол . 433 (14): 166897. doi : 10.1016/j.jmb.2021.166897 . ПМЦ 8184617 . ПМИД 33640324 .
- ^ Цена DH (май 2018 г.). «Транзиторная пауза РНК-полимеразы II» . Proc Natl Acad Sci США . 115 (19): 4810–4812. Бибкод : 2018PNAS..115.4810P . дои : 10.1073/pnas.1805129115 . ПМК 5949015 . ПМИД 29691322 .
Дальнейшее чтение
[ редактировать ]- Ван Дж. К. (2009). Распутывание двойной спирали: перепутывание ДНК и действие ДНК-топоизомераз . Колд-Спринг-Харбор: Лабораторный пресс Колд-Спринг-Харбор. п. 245. ИСБН 978-0-87969-879-9 .
Внешние ссылки
[ редактировать ]- ДНК + топоизомеразы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)