Экзополифосфатаза
| Экзополифосфатаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 3.6.1.11 | ||
| Номер CAS. | 9024-85-5 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Экзополифосфатаза (PPX) представляет собой фосфатазу фермент , который катализирует гидролиз неорганического полифосфата , линейной молекулы, состоящей из до 1000 или более мономеров, связанных фосфоангидридными связями. [ 1 ] PPX представляет собой процессивную экзофосфатазу, что означает, что она начинается на концах полифосфатной цепи и расщепляет фосфоангидридные связи с высвобождением ортофосфата по мере его движения вдоль молекулы полифосфата. [ 1 ] PPX имеет несколько характеристик, которые отличают его от других известных полифосфатаз, а именно то, что он не действует на АТФ , сильно отдает предпочтение длинноцепочечным полифосфатам и имеет очень низкое сродство к молекулам полифосфата с менее чем 15 фосфатными мономерами. [ 2 ]
PPX играет важную роль в метаболизме фосфатов и энергии во всех живых организмах. [ 3 ] Это особенно важно для поддержания соответствующих уровней внутриклеточного полифосфата , который участвует в различных клеточных функциях, включая реакцию на стрессоры, такие как дефицит аминокислот , ортофосфата или азота , изменения pH , понижение уровня питательных веществ и высокое содержание соли. и как неорганический молекулярный шаперон . [ 2 ] [ 4 ]
PPX классифицируется как полифосфатаза, которая является частью большого семейства фосфоэстераз DHH. [ 5 ] Оба подсемейства в этом суперсемействе имеют общие четыре N-концевых мотива, но имеют разные С-концевые фрагменты . [ 6 ]
Активность PPX количественно определяют путем измерения потери радиоактивно меченых 32 П- полифосфат . [ 1 ] ППК смешивают с известным количеством меченого полифосфата и реакцию гидролиза останавливают хлорной кислотой (HClO 4 ). [ 1 ] Затем количество оставшегося меченого полифосфата измеряют с помощью жидкостного сцинтилляционного счетчика . [ 1 ]
История
[ редактировать ]PPX был открыт лабораторией нобелевского лауреата Артура Корнберга в 1993 году и входит в состав полифосфатного оперона наряду с полифосфаткиназой , [ 1 ] фермент, синтезирующий полифосфат . Лаборатория Корнберга очень заинтересовалась полифосфатом и опубликовала серию статей, разъясняющих метаболизм и роль полифосфата in vivo . Их интерес к полифосфатам побудил их идентифицировать и охарактеризовать полифосфатный оперон (который включает полифосфаткиназу [PPK] и PPX) и разработать широкий спектр анализов и методов количественной оценки производства и деградации полифосфата in vitro и in vivo . Структура экзополифосфатазы была дополнительно расшифрована Лабораторией структурной вирусологии Purdue с участием Сандерса, Яницки и др. На конце имеется 7-10 атомов фосфата. Результаты исследований полифосфата в лаборатории Корнберга привели Корнберга к предположению, что из-за его высокой энергии и содержания фосфатов, а также степени, в которой он сохраняется у разных видов, полифосфат мог быть предшественником РНК , ДНК и белков . [ 2 ]
Структура
[ редактировать ]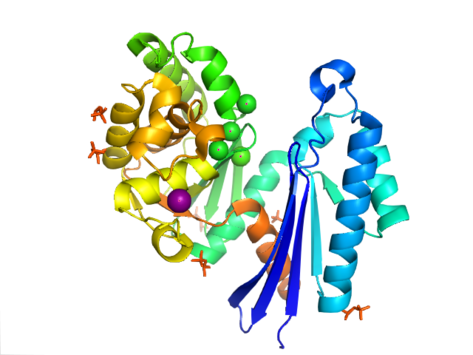
Структура PPX характеризуется актинподобным доменом АТФазы , который является частью этого суперсемейства. У Aquifex aeolicus он содержит H-подобный мотив рибонуклеазы , который состоит из пятинитевого β -листа , вторая цепь которого антипараллельна остальным. Некоторые из нитей соединены спиральными сегментами, которые длиннее в С-концевом домене, чем в N-концевом домене. Пять альфа-спиралей расположены в С-концевом домене и только две — в N-концевом домене. Закрытая конфигурация фермента называется структурой типа I. Эта конфигурация имеет сходные характеристики с другими членами этого суперсемейства, включая N-концевой и C-концевой домены, разделенные двумя альфа-спиралями, сосредоточенными в структуре. Более открытое расположение доменов отображает вращательное движение двух доменов вокруг одной шарнирной области. Структурная гибкость была описана как расщелина, подобная «бабочке», открывающаяся вокруг активного сайта . [ 8 ]
В E. coli экзополифосфатаза существует в виде димера , каждый мономер которого состоит из четырех доменов. Первые два домена состоят из трех бета-листов, за которыми следует складка альфа-бета-альфа-бета-альфа. Это отличается от ранее описанного гомолога Aquifex aeolicus , у которого отсутствуют третий и четвертый домены. [ 9 ] На сегодняшний день для этого класса ферментов решены 4 структуры с в банке данных белков кодами доступа 1T6C , 1T6D , 1U6Z и 2FLO .

Активный сайт
[ редактировать ]Активный центр экзополифосфатазы расположен в щелях между доменами I и II. У E. coli эта область содержит петлю между нитями бета-1 и бета-2 с аминокислотами глутаматом и аспартатом (E121, D143 и E150). Эти остатки, наряду с K197, имеют решающее значение для связывания фосфатов и ионов, что обычно наблюдается среди других ASKHA (ацетатных и сахарных киназ, Hsp70 , актина ). У A. aeolicus активный центр фермента находится в щели между двумя доменами. Видно, что каталитические карбоксильные группы в этой щели важны для активности ферментов, в частности Asp141 и Glu148. Предпочтение экзополифосфатазы связываться с полифосфатом, а не с АТФ, способствовало столкновению, которое могло произойти между рибозой и аденозином АТФ и боковыми цепями N21, C169 и R267. [ 9 ]
Механизм
[ редактировать ]Экзополифосфатаза отщепляет концевой фосфат полифосфата через боковые цепи аминокислот глутамата и лизина. Глутамат активирует воду, позволяя ей действовать как нуклеофил и атаковать концевой фосфат. Кислород, который ранее соединял два атома фосфата, затем отрывает водород от близлежащего остатка лизина. [ 9 ]

Функция
[ редактировать ]Полифосфаты используются ферментами экзополифосфатазами, которые расщепляют части цепи фосфатов. Эти белки играют важную роль в метаболизме и поддержании полифосфатов. [ 11 ] Полифосфат расположен в цитозоле клетки каждой клетки, а также присутствует в органеллах . Существует множество классов экзополифосфатаз, каждый из которых имеет свою уникальную локализацию и свойства. Было высказано предположение, что после расщепления полифосфатов они участвуют в работе сигнальных молекул, выступая в качестве вторичных мессенджеров . [ 6 ] [ 12 ] У E. coli регуляция метаболизма полифосфатов изучена плохо. [ 13 ]
Полифосфат представляет собой линейную цепь фосфатов, связанных между собой фосфоангидридными связями. Полифосфат содержится во всех живых организмах и играет важную роль в их выживании. У бактерий полифосфат используется для хранения энергии, заменяя аденозинтрифосфат . Также было показано, что он участвует в формировании и функционировании клеточных мембран, регуляции ферментов и контроле транскрипции генов. У млекопитающих полифосфаты участвуют в свертывании крови и воспалении, иммунном ответе, развитии костной ткани и функции мозга. [ 11 ] [ 14 ]
модели было показано На дрожжевой , что мутантные дрожжи, дефицитные по активности экзополифосфатазы, имеют проблемы с функциями дыхания и метаболизмом неорганических полифосфатов. [ 15 ] И наоборот, показано, что штаммы дрожжей, которые имеют более высокие уровни фермента экзополифосфатазы, не имеют явных дефектов роста в условиях дефицита или избытка фосфата, однако уровень полифосфата в дрожжах был намного ниже из-за увеличения количества ферментов, разрушающих полифосфатные цепи. [ 16 ]
Потенциальная клиническая/промышленная значимость
[ редактировать ]Мутанты E. coli , неспособные синтезировать полифосфат, погибают всего через несколько дней в стационарной фазе . [ 2 ] Поэтому стратегии ингибирования накопления полифосфатов в бактериях представляют интерес как потенциальное антибактериальное лечение. [ 2 ] [ 17 ] Этого можно достичь путем ингибирования полифосфаткиназы, усиления активности экзополифосфатазы или того и другого.
Накопление полифосфата также представляет интерес для различных промышленных применений, включая удаление Pi из водной среды посредством усиленного биологического удаления фосфора , а также его роль в качестве молекулярного шаперона в экспрессии рекомбинантного белка . Благодаря активности полифосфата как молекулярного шаперона, [ 4 ] Штаммы E. coli , накапливающие полифосфат, могут быть использованы для увеличения выхода растворимого рекомбинантного белка . [ 18 ]
Рекомбинантная экзополифосфатаза из Saccharomyces cerevisiae защищает от смертности и восстанавливает защитные иммунные реакции в доклинических моделях сепсиса. [ 14 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж Акияма, М; Крук, Э; Корнберг, А (1993). «Экзополифосфатаза E. coli: фермент и его ген ppx в полифосфатном опероне» . Журнал биологической химии . 268 (1): 633–639. дои : 10.1016/S0021-9258(18)54198-3 .
- ^ Перейти обратно: а б с д и Корнберг, А; Рао, Н.Н.; О-Риш, Д. (1999). «Неорганический полифосфат: молекула многих функций». Ежегодный обзор биохимии . 68 : 89–125. doi : 10.1146/annurev.biochem.68.1.89 . ПМИД 10872445 .
- ^ Браун, Майкл Р.В.; Корнберг, Артур (июнь 2008 г.). «Вкратце: полифосфат, ППК и выживание бактерий». Тенденции биохимических наук . 33 (6): 284–290. дои : 10.1016/j.tibs.2008.04.005 . ПМИД 18487048 .
- ^ Перейти обратно: а б Грей, MJ; Уоли, Вайоминг; Вагнер, НЕТ; Кремерс, CM; Мюллер-Шикерт, А; Хок, Северная Каролина; Кригер, АГ; Смит, Э.М.; Бендер, РА; Бардуэлл, Дж. К.; Якоб, У (6 марта 2014 г.). «Полифосфат – изначальный шаперон» . Молекулярная клетка . 53 (5): 689–99. doi : 10.1016/j.molcel.2014.01.012 . ПМЦ 3996911 . ПМИД 24560923 .
- ^ Аравинд, Л; Кунин Е.В. (январь 1998 г.). «Новое семейство предсказанных фосфоэстераз включает белок чернослива дрозофилы и бактериальную экзонуклеазу RecJ». Тенденции биохимических наук . 23 (1): 17–9. дои : 10.1016/s0968-0004(97)01162-6 . ПМИД 9478130 .
- ^ Перейти обратно: а б Лугинбюль Э., Кунц С., Вентцингер Л., Фреймозер Ф., Зеебек Т. (январь 2011 г.). «Экзополифосфатаза TbrPPX1 Trypanosoma brucei» . БМК Микробиология . 11 :4. дои : 10.1186/1471-2180-11-4 . ПМК 3022644 . ПМИД 21208463 .
- ^ Кристенсен, О.; Лаурберг, М.; Лильяс, А.; Каструп, Дж.С.; Гаджхеде, М. (2004). «1Т6С» . Биохимия . 43 : 8894–8900. дои : 10.2210/pdb1t6c/pdb .
- ^ Кристенсен, Оле; Лаурберг, Мартин; Лильяс, Андерс; Каструп, Джетт С.; Гаджхеде, Майкл (2004). «Структурная характеристика семейства белков экзополифосфата/гуанозинпентафосфатфосфогидролазы, связанных со строгой реакцией». Биохимия . 43 (28): 8894–8900. дои : 10.1021/bi049083c . ПМИД 15248747 .
- ^ Перейти обратно: а б с Альварадо, Джонджефф; Гош, Анита; Яновиц, Тайлер; Хореги, Эндрю; Хэссон, Мириам С.; Сандерс, Дэвид А. (2006). «Структура экзополифосфатазы (PPX) из Escherichia coli O157: H7 предполагает способ связывания длинных полифосфатных цепей». Журнал молекулярной биологии . 359 (5): 1249–1260. дои : 10.1016/j.jmb.2006.04.031 . ПМИД 16678853 .
- ^ Хэссон, MS; Альварадо, Дж.; Сандерс, Д.А.; Яновиц, Т.; Гош, А.; Альварадо, Дж. (2005). «1У6З » Структура 14 : 1263–1272. дои : 10.2210/pdb1u6z/pdb .
- ^ Перейти обратно: а б Докампо Морено. «Функции полифосфата (Poly P), синтез и распад» . Проверено 1 февраля 2015 г.
- ^ Кулаев (2005). «Особенности метаболизма и функции высокомолекулярных неорганических полифосфатов у дрожжей как представителей низших эукариот». Молекулярная биология . 39 (4): 482–494. дои : 10.1007/s11008-005-0065-1 . S2CID 23045458 .
- ^ Шарфштейн (2006). «Метаболизм полифосфатов в Escherichia coli». Анналы Нью-Йоркской академии наук . 745 : 77–91. дои : 10.1111/j.1749-6632.1994.tb44365.x . ПМИД 7832534 . S2CID 22489348 .
- ^ Перейти обратно: а б Роу Дж., Ставридес Г., Струев М., Шарма А., Марини Ф., Манн А., Смит С.А., Кая З., Штробль Б., Мюллер М., Рейнхардт С., Моррисси Дж.Х., Босманн М. (август 2020 г.). «Бактериальные полифосфаты мешают врожденной защите хозяина от инфекции» . Природные коммуникации . 11 (1): 4035. doi : 10.1038/s41467-020-17639-x . ПМЦ 7423913 . PMID 32788578 .
- ^ Пестов Н.А., Кулаковская Т.В., Кулаев И.С. (июнь 2005 г.). «Влияние инактивации гена PPN1 на экзополифосфатазы, неорганические полифосфаты и функцию митохондрий в дрожжах Saccharomyces cerevisiae» . Исследование дрожжей FEMS . 5 (9): 823–8. дои : 10.1016/j.femsyr.2005.03.002 . ПМИД 15925310 .
- ^ Андреева Н, Трилисенко Л, Кулаковская Т, Думина М, Эльдаров М (январь 2015 г.). «Очистка и свойства рекомбинантной экзополифосфатазы PPN1 и влияние ее сверхэкспрессии на полифосфат в Saccharomyces cerevisiae». Журнал бионауки и биоинженерии . 119 (1): 52–6. дои : 10.1016/j.jbiosc.2014.06.006 . ПМИД 25034634 .
- ^ Тайил, Сима М.; Моррисон, Норман; Шехтер, Норман; Рубин, Харви; Каракусис, Петрос К. (2011). «Роль новой экзополифосфатазы MT0516 в толерантности и персистенции лекарств микобактерий туберкулеза» . ПЛОС ОДИН . 6 (11): e28076. дои : 10.1371/journal.pone.0028076 . ПМК 3221697 . ПМИД 22132215 .
- ^ Кокс, Дэвид Л. Нельсон, Майкл М. (2013). Ленингерские принципы биохимии (6-е изд.). Нью-Йорк: WH Freeman. ISBN 9781429234146 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )