Дронедарон
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Мултак |
| Другие имена | SR33589 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а609034 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | 15% (при приеме пищи с высоким содержанием жиров) [ 2 ] |
| Связывание с белками | >98% |
| Метаболизм | Печень (в основном CYP3A ) |
| Период полувыведения | 13–19 часов |
| Экскреция | Кал (84%), моча (~6%) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.109.411 |
| Химические и физические данные | |
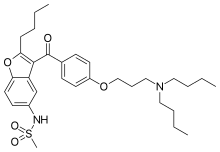
| Формула | С 31 Н 44 Н 2 О 5 С |
| Молярная масса | 556.76 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Дронедарон , продаваемый под торговой маркой Multaq III класса, , представляет собой антиаритмический препарат разработанный компанией Sanofi-Aventis . [ нужна ссылка ] Он был одобрен Управлением по контролю за продуктами и лекарствами США (FDA) в июле 2009 года. [ нужна ссылка ] Помимо того, что он показан при аритмиях , он был рекомендован в качестве альтернативы амиодарону для лечения фибрилляции предсердий и трепетания предсердий у людей, чье сердце либо вернулось к нормальному ритму, либо проходят медикаментозную терапию или лечение электрошоком, постоянным током то есть кардиоверсию (DCCV). поддерживать нормальный ритм. [ нужна медицинская ссылка ] Это антиаритмический препарат III класса. [ 3 ] Маркировка FDA включает заявление о сокращении госпитализаций, но не о снижении смертности, поскольку снижение смертности не было продемонстрировано в программе клинических исследований. [ 4 ] Испытание препарата при сердечной недостаточности было прекращено, поскольку промежуточный анализ показал возможное увеличение смертности от сердечной недостаточности у людей с застойной сердечной недостаточностью средней и тяжелой степени. [ 5 ]
На этикетке дронедарона FDA имеется предупреждение в рамке , в котором говорится, что дронедарон противопоказан пациентам с сердечной недостаточностью IV класса по NYHA , сердечной недостаточностью II и III классов по NYHA с недавней декомпенсацией, требующей госпитализации или направления в специализированную клинику по сердечной недостаточности, или с постоянной предсердной недостаточностью. фибрилляция». [ 2 ] Дронедарон также связан с редкими случаями тяжелого поражения печени, включая печеночную недостаточность. [ 6 ]
Он одобрен как непатентованный препарат . [ 7 ]
Механизм действия
[ редактировать ]Дронедарон называют «многоканальным блокатором». [ нужна ссылка ] Однако неясно, какие каналы играют решающую роль в его успехе. [ 8 ] Таким образом, действие дронедарона на клеточном уровне противоречиво, при этом большинство исследований предполагают ингибирование множественных внешних токов калия, включая быстрое выпрямление с задержкой, медленное выпрямление с задержкой и ACh-активируемое внутреннее выпрямление. [ 9 ] Также считается, что он уменьшает входящий внутрь быстрый ток Na и каналы Ca L-типа. [ нужна медицинская ссылка ] В некоторых исследованиях было показано, что снижение тока К обусловлено ингибированием канала К-АХ или связанных с ним ГТФ-связывающих белков. [ 8 ] Снижение К+-тока на 69% приводило к увеличению длительности ПД и увеличению эффективных рефрактерных периодов, что приводило к подавлению пейсмекерного потенциала СА-узла и возвращению пациентов к нормальному сердечному ритму. [ 9 ] В европейском исследовании среднее время до рецидива аритмии составило 41 день в группе плацебо против 96 дней в группе дронедарона (аналогичные результаты были получены в неевропейском исследовании — 59 и 158 дней соответственно). [ 10 ]
Химия
[ редактировать ]По химическому составу дронедарон представляет собой производное бензофурана, родственное амиодарону , популярному антиаритмическому средству . [ нужна медицинская ссылка ] Применение амиодарона ограничено из-за его токсичности из-за высокого содержания йода ( фиброз легких , заболевания щитовидной железы ), а также из-за заболеваний печени . [ нужна медицинская ссылка ] В дронедароне отсутствуют йодные фрагменты, что снижает токсическое воздействие на щитовидную железу и другие органы. [ нужна медицинская ссылка ] Метилсульфонамидная группа добавляется для снижения растворимости в жирах (липофобности) и, таким образом, уменьшения нейротоксических эффектов. [ 4 ]
Дронедарон проявляет амиодароноподобную антиаритмическую активность III класса in vitro. [ 11 ] и в клинических испытаниях. [ 5 ] Препарат также проявляет активность в каждом из 4 антиаритмических классов Воана-Вильямса. [ 12 ]
Фармакокинетика
[ редактировать ]Дронедарон менее липофильен, чем амиодарон, имеет гораздо меньший объем распределения и имеет период полувыведения 13–19 часов, что контрастирует с периодом полувыведения амиодарона, составляющим несколько недель. [ 2 ] [ 13 ] В результате этих фармакокинетических характеристик дозирование дронедарона может быть менее сложным, чем дозирование амиодарона. [ нужна медицинская ссылка ]
Противопоказания
[ редактировать ]- Постоянная ФП (пациенты, у которых нормальный синусовый ритм не может быть восстановлен) [ 2 ]
- Недавно декомпенсированная сердечная недостаточность, требующая госпитализации, или сердечная недостаточность IV класса. [ 2 ]
- АВ-блокада второй или третьей степени или синдром слабости синусового узла (кроме случаев использования в сочетании с работающим кардиостимулятором) [ 2 ]
- Брадикардия [ 2 ]
- Одновременный прием сильных ингибиторов CYP3A. [ 2 ]
- Одновременный прием лекарственных средств или продуктов растительного происхождения, которые удлиняют интервал QT и могут вызвать Torsade de Pointes. [ 2 ]
- Токсичность печени или легких, связанная с предыдущим применением амиодарона. [ 2 ]
- Тяжелая печеночная недостаточность [ 2 ]
- QTc интервал Базетта ≥500 мс, [ 2 ] или использовать с лекарствами или травяными добавками, которые удлиняют интервал QT или повышают риск развития тахикардии (антиаритмические средства класса I или III, фенотиазины, трициклические антидепрессанты, некоторые пероральные макролиды, эфедра). [ нужна ссылка ]
- Беременные и кормящие матери [ 2 ]
- Повышенная чувствительность к дронедарону. [ 2 ]
- Печеночная недостаточность. В январе 2011 года FDA сообщило о случаях редкого, но тяжелого поражения печени, включая два случая острой печеночной недостаточности, приведшей к трансплантации печени у пациентов, получавших дронедарон (Multaq). Неизвестно, предотвратит ли рутинный периодический мониторинг сывороточных ферментов печени (АЛТ, АСТ и щелочная фосфатаза) и билирубина у пациентов, принимающих дронедарон, развитие тяжелого поражения печени. [ 6 ]
- Интервал PR превышает 280 мс [ нужна ссылка ]
- Использование ингибиторов изофермента цитохрома P-450 (CYP) 3a (включая: кларитромицин, циклоспорин, итраконазол, кетоконазол, нефазодон, ритонавир, телитромицин, вориконазол)
Клинические испытания
[ редактировать ]В клинических испытаниях дронедарон сравнивали с плацебо и амиодароном на предмет его способности уменьшать фибрилляцию предсердий, снижать общую смертность и смертность от сердечных причин, а также его побочные эффекты, включая повышенную смертность. [ 4 ] [ 8 ] Дронедарон — нейодированный антиаритмический препарат III класса , который помогает пациентам вернуться к нормальному синусовому ритму . [ нужна медицинская ссылка ] Также известно, что это лечение ФП снижает связанную с ним смертность и количество госпитализаций по сравнению с другими аналогичными антиаритмическими препаратами . [ 14 ]
В исследованиях EURIDIS и ADONIS при фибрилляции предсердий (2007 г.) дронедарон был значительно эффективнее плацебо в поддержании синусового ритма без каких-либо изменений в функции легких и щитовидной железы в краткосрочной перспективе. [ 15 ]
Однако в исследовании ANDROMEDA (2007) дронедарон удвоил уровень смертности по сравнению с плацебо, и исследование было прекращено досрочно. [ 5 ] В исследование ANDROMEDA были включены пациенты с застойной сердечной недостаточностью от умеренной до тяжелой степени — относительно более тяжелая группа пациентов. [ нужна медицинская ссылка ]
В более позднем исследовании фибрилляции предсердий , ATHENA, с участием 4628 участников, дронедарон был значительно более эффективен, чем плацебо, в снижении комбинированной конечной точки первой госпитализации из-за сердечно-сосудистых событий или смерти. [ 16 ] Произошло значительное снижение уровня смертности от сердечно-сосудистых заболеваний, но не уровня смертности от любой причины. [ 4 ] Более поздний апостериорный анализ результатов ATHENA показал значительное снижение частоты инсультов. [ 14 ]
У пациентов, рандомизированных для приема дронедарона, чаще развивалась брадикардия и удлинение интервала QT (но только 1 случай приема Торсада ). [ нужна медицинская ссылка ] Тошнота, диарея, сыпь и повышение креатинина также чаще наблюдались в группе дронедарона. [ нужна медицинская ссылка ]
Исследование PALLAS (2011) было остановлено из соображений безопасности в связи с открытием, что «дронедарон увеличивает частоту сердечной недостаточности, инсульта и смертности от сердечно-сосудистых причин у пациентов с постоянной фибрилляцией предсердий, которые подвергались риску серьезных сосудистых событий». [ 17 ] Впоследствии FDA добавило предупреждение «черный ящик», в котором говорилось, что риск смерти, инсульта и госпитализации по поводу застойной сердечной недостаточности удваивается у пациентов с постоянной фибрилляцией предсердий. [ нужна медицинская ссылка ]
Результаты кардиоверсии постоянным током
[ редактировать ]Дронедарон был протестирован в некоторых исследованиях как способ повысить вероятность успеха электрической кардиоверсии. [ нужна медицинская ссылка ] В одном таком исследовании, проведенном Управлением по делам ветеранов, его использовали для подготовки пациентов к электрическому преобразованию в синусовый ритм. [ нужна медицинская ссылка ] В исследовании ATHENA 25% пациентов начали прием дронедарона перед кардиоверсией . [ 16 ] Результаты недавно завершившегося рандомизированного исследования (ELECTRA) могут прояснить безопасность и идеальные методы использования дронедарона во время кардиоверсии. [ 18 ]
Нормативный обзор
[ редактировать ]Первоначально поданный в качестве заявки на новое лекарственное средство в 2005 году, дронедарон был рассмотрен и рекомендован к одобрению в марте 2009 года Консультативным комитетом Управления по контролю за продуктами и лекарствами США (FDA). [ 19 ] FDA одобрило дронедарон в июле 2009 года. [ нужна ссылка ]
Министерство здравоохранения Канады было вторым крупным регулирующим органом, одобрившим препарат: оно было одобрено в августе 2009 года. [ нужна ссылка ] Одобрение предназначено для «лечения пациентов с фибрилляцией предсердий в анамнезе или в настоящее время с целью снижения риска госпитализации по сердечно-сосудистым причинам из-за этого состояния». [ 20 ]
В сентябре 2009 года Европейское агентство лекарственных средств опубликовало сводку положительного заключения в отношении дронедарона, рекомендовав Европейской комиссии выдать регистрационное удостоверение на территории Европейского Союза. [ 21 ]
Исследовать
[ редактировать ]В июле 2019 года новый препарат под названием пойендарон был запатентован фармацевтическим факультетом Национального университета Сингапура (NUS). [ 22 ] Он был разработан путем модификации молекулы дронедарона, чтобы устранить ее склонность вызывать желудочковую аритмию . [ 23 ] [ 24 ]
Ссылки
[ редактировать ]- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»).» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот «Мультак-дронедарон таблетка, покрытая пленочной оболочкой» . ДейлиМед . 15 октября 2020 г. . Проверено 18 ноября 2020 г.
- ^ «FDA одобрило Multaq для лечения нарушений сердечного ритма» (пресс-релиз). США Управление по контролю за продуктами и лекарствами (FDA). 2 июля 2009 года. Архивировано из оригинала 4 июля 2009 года . Проверено 2 июля 2009 г.
- ^ Jump up to: а б с д Циметбаум П.Дж. (апрель 2009 г.). «Дронедарон при мерцательной аритмии – одиссея». Медицинский журнал Новой Англии . 360 (18): 1811–1813. дои : 10.1056/NEJMp0902248 . ПМИД 19403901 .
- ^ Jump up to: а б с Кобер Л., Торп-Педерсен С., МакМюррей Дж.Дж., Гётше О., Леви С., Крайнс Х. и др. (июнь 2008 г.). «Повышение смертности после терапии дронедароном при тяжелой сердечной недостаточности» . Медицинский журнал Новой Англии . 358 (25): 2678–2687. doi : 10.1056/NEJMoa0800456 . ПМИД 18565860 .
- ^ Jump up to: а б «Сообщение FDA о безопасности лекарственных средств: тяжелое повреждение печени, связанное с использованием дронедарона (продаваемого как Multaq). Сообщение о безопасности» . США Управление по контролю за продуктами и лекарствами (FDA). 14 января 2011 г.
- ^ «Первые одобрения генерических лекарств в 2024 году» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 8 марта 2024 г. . Проверено 9 марта 2024 г.
- ^ Jump up to: а б с Гиймар Э., Марион А., Нисато Д., Готье П. (декабрь 2000 г.). «Ингибирующее действие дронедарона на мускариновый К+ ток в предсердных клетках морских свинок» . Журнал сердечно-сосудистой фармакологии . 36 (6): 802–5. дои : 10.1097/00005344-200012000-00017 . ПМИД 11117382 .
- ^ Jump up to: а б Эймонд Ф., Бек Л., Готье П., Шериф ОК, Дэви Дж.М., Лоренте П. и др. (январь 2000 г.). «Клеточные и электрофизиологические эффекты дронедарона in vivo у нормальных и перенесших инфаркт миокарда крыс». Журнал фармакологии и экспериментальной терапии . 292 (1): 415–424. ПМИД 10604978 .
- ^ Сингх Б.Н., Коннолли С.Дж., Крайнс Х.Дж., Рой Д., Коуи П.Р., Капуччи А. и др. (Следователи EURIDIS и ADONIS) (сентябрь 2007 г.). «Дронедарон для поддержания синусового ритма при мерцательной аритмии или трепетании предсердий» . Медицинский журнал Новой Англии . 357 (10): 987–999. doi : 10.1056/NEJMoa054686 . ПМИД 17804843 .
- ^ Сунь В., Сарма Дж.С., Сингх Б.Н. (ноябрь 1999 г.). «Электрофизиологические эффекты дронедарона (SR33589), нейодированного производного бензофурана, на сердце кролика: сравнение с амиодароном» . Тираж . 100 (22): 2276–2281. дои : 10.1161/01.CIR.100.22.2276 . ПМИД 10578003 .
- ^ «Medscape Drugs & Diseases — комплексные рецензируемые статьи о состоянии здоровья, хирургии и клинических процедурах с симптомами, диагнозом, стадией, лечением, лекарствами и лекарствами, прогнозом, последующим наблюдением и фотографиями» .
- ^ Дейл К.М., Уайт CM (апрель 2007 г.). «Дронедарон: аналог амиодарона для лечения мерцательной аритмии и трепетания предсердий». Анналы фармакотерапии . 41 (4): 599–605. дои : 10.1345/aph.1H524 . ПМИД 17389667 . S2CID 22339555 .
- ^ Jump up to: а б Коннолли С.Дж., Крайнс Х.Дж., Торп-Педерсен С., ван Эйкельс М., Годен С., Пейдж Р.Л. и др. (сентябрь 2009 г.). «Анализ инсульта в ATHENA: плацебо-контролируемое двойное слепое исследование с параллельными группами для оценки эффективности дронедарона в дозе 400 мг два раза в день для предотвращения сердечно-сосудистых госпитализаций или смерти по любой причине у пациентов с фибрилляцией предсердий/трепетанием предсердий» . Тираж . 120 (13): 1174–1180. doi : 10.1161/CIRCULATIONAHA.109.875252 . ПМИД 19752319 .
- ^ Сингх Б.Н., Коннолли С.Дж., Крайнс Х.Дж., Рой Д., Коуи П.Р., Капуччи А. и др. (сентябрь 2007 г.). «Дронедарон для поддержания синусового ритма при мерцательной аритмии или трепетании предсердий». Медицинский журнал Новой Англии . 357 (10): 987–999. doi : 10.1056/NEJMoa054686 . hdl : 11566/54713 . ПМИД 17804843 .
- ^ Jump up to: а б Хонлозер С.Х., Крайнс Х.Дж., ван Эйкельс М., Годин С., Пейдж Р.Л., Торп-Педерсен С. и др. (февраль 2009 г.). «Влияние дронедарона на сердечно-сосудистые события при фибрилляции предсердий» . Медицинский журнал Новой Англии . 360 (7): 668–678. doi : 10.1056/NEJMoa0803778 . ПМИД 19213680 .
- ^ Коннолли С.Дж., Камм А.Дж., Гальперин Дж.Л., Джойнер С., Алингс М., Амерена Дж. и др. (декабрь 2011 г.). «Дронедарон при постоянной фибрилляции предсердий высокого риска» . Медицинский журнал Новой Англии . 365 (24): 2268–2276. дои : 10.1056/NEJMoa1109867 . ПМЦ 3860949 . ПМИД 22082198 .
- ^ Номер клинического исследования NCT01026090 для «Двойного слепого плацебо-контролируемого канадского многоцентрового исследования фазы IV, сравнивающего две стратегии лечения введением дронедарона после элективной кардиоверсии для профилактики симптоматического рецидива фибрилляции предсердий (ФП)» на сайте ClinicalTrials.gov
- ^ «Информационный документ FDA по дронедарону» (PDF) . Управление по контролю за продуктами и лекарствами . Архивировано из оригинала (PDF) 3 марта 2017 года . Проверено 16 декабря 2019 г.
- ^ «Multaq® (Дронедарон) для лечения фибрилляции предсердий теперь одобрен в Канаде - наука» . Архивировано из оригинала 18 июля 2011 года . Проверено 13 августа 2009 г.
- ^ «Сводка положительного мнения о Multaq» (PDF) . Европейское агентство лекарственных средств. 24 сентября 2009 года . Проверено 1 декабря 2009 г.
- ^ US20220267288A1 , Чан, Чун Ён Эрик; Карханис, Аниш Видьядхар и Венкатесан, Гопалакришнан, «Пойендарон, сердечное терапевтическое средство», выпущено 25 августа 2022 г.
- ^ Карханис А.В., Венкатесан Г., Камбаяши Р., Леоу Дж.В., Хан М.К., Идзуми-Накасеко Х. и др. (октябрь 2022 г.). «Местонаправленное дейтерирование дронедарона сохраняет активность цитохрома P4502J2 и смягчает его побочные эффекты на сердце у собак с аритмией» . Акта Фармасьютика Синика. Б 12 (10): 3905–3923. дои : 10.1016/j.apsb.2022.03.008 . ПМЦ 9532722 . ПМИД 36213535 .
- ^ «Новая молекула препарата для лечения фибрилляции предсердий» . Медикалэкспресс . 18 июля 2022 г.