Глиома
Эту статью может потребовать очистки Википедии , чтобы она соответствовала стандартам качества . Конкретная проблема: Статья полна грамматических и тональных ошибок. ( январь 2022 г. ) |
| Глиома | |
|---|---|
 | |
| Глиома левой теменной доли (КТ головного мозга), 2 степень по ВОЗ | |
| Специальность | Онкология , Неврология |
| Факторы риска | Пожилой возраст, ионизирующая радиация [ 1 ] |
| Метод диагностики | Визуализация мозга [ 1 ] |
Глиома — это тип первичной опухоли , которая начинается в глиальных клетках головного мозга или спинного . Они являются раковыми , но некоторые из них развиваются очень медленно. [ 2 ] [ 3 ] Глиомы составляют около 30 процентов всех опухолей головного мозга и опухолей центральной нервной системы, а также 80 процентов всех злокачественных опухолей головного мозга. [ 4 ]
Признаки и симптомы
[ редактировать ]Симптомы глиом зависят от того, какой отдел центральной нервной системы поражен. Глиома головного мозга может вызывать головные боли , рвоту , судороги и расстройства черепных нервов в результате повышения внутричерепного давления. Глиома зрительного нерва может привести к потере зрения. Глиомы спинного мозга могут вызывать боль , слабость или онемение конечностей. Глиомы обычно не метастазируют через кровоток, но могут распространяться через спинномозговую жидкость и вызывать «капельные метастазы» в спинной мозг. Сложные зрительные галлюцинации были описаны как симптом глиомы низкой степени злокачественности. [ 5 ]
Ребенок с подострым заболеванием центральной нервной системы, вызывающим аномалии черепных нервов (особенно VII черепного нерва и нижнебульбарных нервов), симптомы длинных путей, неустойчивую походку вследствие спастичности и некоторые изменения в поведении, скорее всего, будет иметь понтинная глиома. [ 6 ]
Причины
[ редактировать ]Наследственные заболевания
[ редактировать ]Точные причины возникновения глиом не известны. наследственные заболевания, такие как нейрофиброматозы (тип 1 и тип 2) и туберозный склероз . Известно, что к их развитию предрасполагают [ 7 ] Различные онкогены могут сотрудничать в развитии глиом. [ 8 ]
Радиация
[ редактировать ]Наиболее известным фактором риска является воздействие ионизирующего излучения, а радиация при компьютерной томографии является важной причиной. [ 9 ] [ 10 ] Взаимосвязь между низкими дозами ионизирующего излучения и риском глиомы зависит от дозы на 55% на 100 миллигрей радиации. [ 9 ] Связь между глиомами и электромагнитным излучением мобильных телефонов окончательно не доказана. [ 11 ] Считалось возможным, [ 12 ] [ 13 ] NIH хотя несколько крупных исследований не нашли убедительных доказательств, как резюмируется в обзоре Национального института рака по этой теме. [ 14 ] и его многочисленные цитаты, [ 15 ] и ФКС . [ 16 ] Тем не менее, дальнейшие исследования все еще продолжаются, чтобы получить более надежные доказательства и подтвердить отсутствие связи (в последнем пресс-релизе Национального института наук о здоровье окружающей среды НИЗ обсуждалось продолжающееся исследование). [ 17 ] показывающие умеренно положительные результаты, [ 18 ] хотя похоже, что могли быть проблемы с преждевременной смертью контрольной группы [ 19 ] ).
Заражение цитомегаловирусом
[ редактировать ]В некоторых исследованиях сообщалось, что глиобластомы инфицированы цитомегаловирусом , и предполагается, что это может ускорить развитие опухолей. [ 20 ] [ 21 ] [ 22 ] Однако это противоречивое мнение: недавние углубленные исследования не смогли обнаружить связь между вирусной инфекцией и ростом глиомы. [ 23 ] Есть также свидетельства того, что на предыдущие исследования могли повлиять ложноположительные артефакты окрашивания антителами. [ 24 ]
Сельское хозяйство
[ редактировать ]Исследования показали, что у фермеров более высокий уровень заболеваемости глиомами по сравнению с населением в целом. В метаанализе 2021 года в 40 из 52 исследований, начиная с 1998 года, сообщалось о положительной связи между сельским хозяйством и раком головного мозга с оценками эффекта от 1,03 до 6,53, из которых 80% составляют глиомы. Животноводство было связано с большим риском по сравнению с растениеводством. Фермеры с документально подтвержденным воздействием пестицидов имели повышенный риск рака мозга более чем на 20%. [ 25 ] [ ненадежный источник? ] Исследование проекта TRACTOR, включающее 1017 опухолей головного мозга среди 1 036 069 руководителей ферм, опубликованное в 2022 году, показало повышенный риск развития глиомы в свиноводстве (HR = 2,28), растениеводстве (HR = 1,28) и фруктовом садоводстве (HR = 1,72). [ 26 ] [ нужна медицинская ссылка ]
Другие причины
[ редактировать ]Данные показывают, что архитекторы, геодезисты, работники розничной торговли, мясники и инженеры имеют более высокий уровень заболеваемости глиомами. [ 27 ]
Наследственный полиморфизм генов репарации ДНК
[ редактировать ]Зародышевый (наследственный) полиморфизм генов репарации ДНК ERCC1 , ERCC2 ( XPD ) и XRCC1 увеличивает риск развития глиомы. [ 28 ] Это указывает на то, что измененная или недостаточная репарация повреждений ДНК способствует образованию глиом. Повреждения ДНК, вероятно, являются основной основной причиной развития рака в целом. [ 29 ] Избыточные повреждения ДНК могут привести к мутациям в результате синтеза транслейкоза . Более того, неполная репарация ДНК может привести к эпигенетическим изменениям или эпимутациям. [ 30 ] [ 31 ] Такие мутации и эпимутации могут обеспечить клетке пролиферативное преимущество, которое затем, в процессе естественного отбора, может привести к прогрессированию рака. [ 29 ]
Эпигенетическая репрессия генов репарации ДНК часто обнаруживается при прогрессировании спорадической глиобластомы . Например, метилирование гена репарации ДНК MGMT промотора наблюдалось в 51–66% образцов глиобластомы. [ 32 ] [ 33 ] Кроме того, в некоторых глиобластомах белок MGMT дефицитен из-за другого типа эпигенетических изменений. Экспрессия белка MGMT также может снижаться из-за повышенных уровней микроРНК , которая ингибирует способность MGMT информационной РНК продуцировать белок MGMT. [ 33 ] Чжан и др. [ 34 ] обнаружили в глиобластомах без метилированных MGMT промоторов , что уровень микроРНК miR-181d обратно коррелирует с экспрессией белка MGMT и что прямой мишенью miR-181d является 3'UTR мРНК MGMT (три основных нетранслируемых региона MGMT). информационная РНК). [ 35 ]
Эпигенетическое снижение экспрессии другого белка репарации ДНК, ERCC1 , было обнаружено в 32 глиомах. [ 36 ] Для 17 из 32 (53%) протестированных глиом экспрессия белка ERCC1 была снижена или отсутствовала. В случае 12 глиом (37,5%) такое снижение произошло за счет метилирования промотора ERCC1 . Для других 5 глиом со сниженной экспрессией белка ERCC1 снижение могло быть связано с эпигенетическими изменениями в микроРНК , которые влияют на экспрессию ERCC1 . [ 37 ]
Когда экспрессия генов репарации ДНК снижается, повреждения ДНК накапливаются в клетках на уровне, превышающем нормальный, и такие избыточные повреждения вызывают увеличение частоты мутаций. [ 38 ] [ 39 ] [ 40 ] Мутации в глиомах часто происходят в генах изоцитратдегидрогеназы ( IDH ) 1 или 2 . [ 41 ] Одна из этих мутаций (в основном в IDH1 ) встречается примерно в 80% глиом низкой степени злокачественности и вторичных глиом высокой степени злокачественности. [ 42 ] Ван и др. [ 43 ] отметили, что мутантные клетки IDH1 и IDH2 производят избыток промежуточного метаболического продукта, 2-гидроксиглутарата, который связывается с каталитическими сайтами ключевых ферментов, которые важны для изменения метилирования гистонов и промотора ДНК . Таким образом, мутации в IDH1 и IDH2 создают «фенотип метилатора островков CpG ДНК или CIMP». [ 44 ] [ 45 ] это вызывает гиперметилирование промотора и сопутствующее молчание генов-супрессоров опухоли, таких как гены репарации ДНК MGMT и ERCC1 . С другой стороны, Коэн и др. [ 42 ] и Моленаар и др. [ 41 ] отметили, что мутации в IDH1 или IDH2 могут вызывать усиление окислительного стресса. Повышенное окислительное повреждение ДНК может быть мутагенным. Это подтверждается увеличением количества двухцепочечных разрывов ДНК в IDH1 . клетках глиомы с мутацией [ 46 ] Таким образом, мутации IDH1 или IDH2 действуют как драйверные мутации в канцерогенезе глиомы, хотя неясно, какую роль они играют в первую очередь. Исследование, в котором участвовал 51 пациент с глиомами головного мозга, у которых в течение определенного периода времени были проведены две или более биопсии, показало, что мутация в гене IDH1 произошла до появления мутации p53 или потери гетерозиготности 1p/19q, что указывает на то, что мутация IDH1 является ранняя мутация драйвера. [ 47 ]
Патофизиология
[ редактировать ]Глиомы высокой степени злокачественности представляют собой опухоли с высокой васкуляризацией и имеют тенденцию к диффузной инфильтрации. [ 48 ] Они имеют обширные участки некроза и гипоксии . Нередко рост опухоли вызывает нарушение гематоэнцефалического барьера вблизи опухоли. Как правило, глиомы высокой степени злокачественности почти всегда вырастают вновь даже после полного хирургического удаления, поэтому их принято называть рецидивирующим раком головного мозга. [ нужна медицинская ссылка ] [ 49 ]
И наоборот, глиомы низкой степени злокачественности растут медленно, часто в течение многих лет, и их можно наблюдать без лечения, если они не растут и не вызывают симптомов. [ нужна медицинская ссылка ]
В глиомах обнаружено несколько приобретенных (не наследственных) генетических мутаций. Белок-супрессор опухоли 53 (p53) мутирует на ранних стадиях заболевания. [ 50 ] p53 является «хранителем генома», который во время дупликации ДНК и клеток следит за правильностью копирования ДНК и уничтожает клетку ( апоптоз ), если ДНК мутирует и не может быть исправлена. Когда сам р53 мутирует, другие мутации могут выжить. Гомолог фосфатазы и тензина (PTEN), еще один ген-супрессор опухоли, сам утрачен или мутирован. Рецептор эпидермального фактора роста , фактор роста, который обычно стимулирует деление клеток, амплифицируется и стимулирует клетки к слишком сильному делению. В совокупности эти мутации приводят к бесконтрольному делению клеток, что является признаком рака. В 2009 году было обнаружено, что мутации IDH1 и IDH2 являются частью механизма и связаны с менее благоприятным прогнозом. [ 51 ]
Диагностика
[ редактировать ]Классификация
[ редактировать ]По типу клетки
[ редактировать ]Глиомы называются в соответствии с конкретным типом клеток, с которыми они имеют общие гистологические особенности, но не обязательно из которых они происходят. Основными типами глиомы являются: [ 52 ]
- Эпендимомы : эпендимальные клетки.
- Астроцитомы : астроциты ( мультиформная глиобластома — злокачественная астроцитома и наиболее распространенная первичная опухоль головного мозга среди взрослых).
- Олигодендроглиомы : олигодендроциты.
- Глиома ствола мозга : развивается в стволе мозга.
- Глиома зрительного нерва : развивается внутри или вокруг зрительного нерва.
- Хордоидная глиома, редкая опухоль низкой степени злокачественности третьего желудочка. [ 53 ]
- Смешанные глиомы, такие как олигоастроцитомы , содержат клетки разных типов глии.
По классам
[ редактировать ]Глиомы далее классифицируются в зависимости от их степени , которая определяется патологоанатомической оценкой опухоли. Нейропатологическое обследование и диагностика образцов опухолей головного мозга проводится в соответствии с Классификацией опухолей центральной нервной системы ВОЗ. [ 54 ] [ 55 ]

- Биологически доброкачественные глиомы [класс I по ВОЗ] представляют собой сравнительно низкий риск и могут быть удалены хирургическим путем в зависимости от их локализации. [ 48 ]
- Глиомы низкой степени злокачественности [II степень по ВОЗ] хорошо дифференцированы (не анапластичны ); они имеют тенденцию проявлять доброкачественные тенденции и предвещают лучший прогноз для пациента. Однако они имеют одинаковую частоту рецидивов и со временем увеличиваются в степени, поэтому их следует классифицировать как злокачественные.
- Глиомы высокой степени злокачественности [классы III–IV по ВОЗ] являются недифференцированными или анапластическими ; они злокачественны и имеют худший прогноз. Несмотря на то, что глиомы полушарий младенческого типа классифицируются как глиомы высокой степени злокачественности, они имеют относительно хорошие клинические результаты, однако они страдают от значительных недостатков, что делает их хорошими кандидатами для деэскалации терапии и испытаний молекулярной таргетной терапии. [ 56 ]
Из многочисленных используемых систем классификации наиболее распространенной является система классификации астроцитомы Всемирной организации здравоохранения (ВОЗ), согласно которой опухоли классифицируются от I (наименее запущенное заболевание – лучший прогноз) до IV (наиболее запущенное заболевание – худший прогноз).
По местоположению
[ редактировать ]Глиомы можно классифицировать в зависимости от того, находятся ли они над или под мембраной головного мозга, называемой тенториумом . [ 57 ] Тенториум отделяет головной мозг (вверху) от мозжечка (внизу).
- Супратенториал . находится над наметом, в головном мозге и чаще всего встречается у взрослых (70%) [ 58 ]
- Инфратенториал находится ниже намета , в мозжечке, чаще всего встречается у детей (70%). [ 58 ]
- Опухоли моста расположены в мосту ствола мозга. Ствол мозга состоит из трех частей (мост, средний мозг и продолговатый мозг); мост контролирует важные функции, такие как дыхание, что делает операцию на них чрезвычайно опасной. [ 59 ]
Комплексная диагностика
[ редактировать ]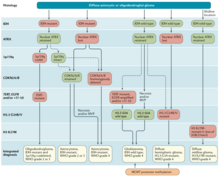
Современный подход к диагностике диффузных глиом учитывает главным образом гистопатологию и молекулярный профиль. [ 60 ] Образцы тканей, полученные при биопсии у пациентов с диффузными глиомами, обычно оцениваются иммуногистохимически на наличие R132H-мутанта IDH1 и потерю ядерного ATRX. [ 60 ] У пациентов в возрасте > 55 лет с гистологически типичной глиобластомой, без ранее существовавшей глиомы более низкой степени злокачественности, с несрединным расположением опухоли и с сохраненной ядерной экспрессией ATRX, иммуногистохимической отрицательности по IDH1 R132H достаточно для классификации как IDH-дикого типа. глиобластома. [ 60 ] Во всех других случаях диффузных глиом отсутствие иммунопозитивности к IDH1 R132H должно сопровождаться секвенированием ДНК IDH1 и IDH2 для обнаружения или исключения наличия неканонических мутаций. [ 60 ] Диффузные астроцитарные глиомы IDH-дикого типа без микрососудистой пролиферации или некроза должны быть проверены на амплификацию EGFR, мутацию промотора TERT и цитогенетическую подпись +7/–10 в качестве молекулярных характеристик глиобластом IDH-дикого типа. [ 60 ] Кроме того, наличие мутаций гистона H3.3 G34R/V следует оценивать с помощью иммуногистохимии или секвенирования ДНК для выявления диффузных полушарных глиом с мутацией H3.3 G34 , особенно у молодых пациентов с глиомами IDH-дикого типа (такими как <50 лет с потерей ядерного ATRX в опухолевых клетках). [ 60 ] Диффузные глиомы таламуса, ствола головного мозга или спинного мозга следует оценивать на наличие мутаций гистона H3 K27M и потери ядерного K27-триметилированного гистона H3 (H3K27me3) для выявления диффузных глиом средней линии с мутацией H3 K27M. [ 60 ]
Уход
[ редактировать ]

Лечение глиом головного мозга зависит от локализации, типа клеток и степени злокачественности. Текущие варианты лечения включают хирургическое удаление, лучевую терапию ( лучевую терапию ) и химиотерапию . В некоторых случаях можно использовать поля для лечения опухолей ( терапия переменным электрическим полем ), недавно разработанную технологию. [ 61 ] Часто лечение представляет собой комбинированный подход с использованием хирургического вмешательства, лучевой терапии и химиотерапии . Для многих лечение состоит только из хирургического вмешательства или даже «бдительного ожидания» (ожидания того, когда вмешательство будет оправдано из-за прогрессирования опухоли). Врачи тщательно взвешивают специфику опухоли пациента и недостатки вмешательства, поскольку медикаментозное вмешательство может иметь значительные побочные эффекты, несмотря на недавние попытки предсказать результаты. [ 62 ]
Лучевая и химиотерапия остаются основой лечения после хирургического вмешательства. Лучевая терапия проводится в виде внешнего лучевого облучения или стереотаксического подхода с использованием радиохирургии . Темозоломид — распространенный химиотерапевтический препарат, который легко вводится в амбулаторных условиях и способен эффективно преодолевать гематоэнцефалический барьер .
В настоящее время в клинических испытаниях проходит широкий спектр новых методов лечения: от ингибиторов ИДГ, таких как ивозидениб , до недавно одобренной вакцины против рака на основе дендритных клеток . [ 63 ] Лечение с использованием иммунотерапии — еще один многообещающий путь исследований, который может помочь в лечении глиомы в ближайшем будущем. [ 64 ] [ 65 ] Экспериментальные методы лечения, такие как онколитические вирусы, показали потенциальную терапевтическую пользу в клинических испытаниях (но не были одобрены для использования в неэкспериментальных условиях). [ 66 ]
Рефрактерное заболевание
[ редактировать ]В недавних исследованиях при рецидивирующей глиобластоме высокой степени злокачественности применялись ангиогенные блокаторы, такие как бевацизумаб, в сочетании с традиционной химиотерапией, что дало обнадеживающие результаты. [ 67 ]
Относительная эффективность
[ редактировать ]В метаанализе 2017 года хирургическая резекция сравнивалась с биопсией как первоначальным вариантом хирургического лечения человека с глиомой низкой степени злокачественности. [ 68 ] Результаты показывают, что доказательств недостаточно для принятия надежного решения. [ 68 ] Относительная эффективность хирургической резекции по сравнению с биопсией у людей со злокачественной глиомой (высокая степень злокачественности) неизвестна. [ 69 ]
В метаанализе 2003 года при глиомах высокой степени злокачественности лучевую терапию сравнивали с лучевой терапией и химиотерапией. Было продемонстрировано небольшое, но явное улучшение от использования химиотерапии с лучевой терапией. [ 70 ] Метаанализ 2019 года показал, что для людей с менее агрессивными глиомами лучевая терапия может увеличить риск долгосрочных нейрокогнитивных побочных эффектов. [ 71 ] Хотя данные о наличии долгосрочных нейрокогнитивных побочных эффектов, связанных с химиолучевой терапией, неясны. [ 71 ]
Темозоломид эффективен при лечении мультиформной глиобластомы (ГБМ) по сравнению с только лучевой терапией. [ 63 ] Метаанализ 2013 года показал, что темозоломид продлевает выживаемость и замедляет прогрессирование, но связан с увеличением побочных эффектов, таких как осложнения со стороны крови, усталость и инфекции. [ 63 ] У людей с рецидивирующей ГБМ при сравнении темозоломида с химиотерапией может наблюдаться улучшение времени до прогрессирования и качества жизни человека, но не улучшение общей выживаемости при лечении темозоломидом. [ 63 ] Имеющиеся данные свидетельствуют о том, что у людей с рецидивирующими глиомами высокой степени злокачественности, которые ранее не проходили химиотерапию, существуют схожие результаты по выживаемости и времени до прогрессирования при лечении темозоломидом или химиотерапевтическим комплексом, известным как ПКВ (прокарвазин, ломустин и винкристин). [ 72 ]
Мутационный анализ 23 исходных глиом низкой степени злокачественности и рецидивирующих опухолей у одних и тех же пациентов поставил под сомнение преимущества и эффективность темозоломида. Исследование показало, что при удалении опухолей головного мозга более низкой степени злокачественности и дальнейшем лечении пациентов темозоломидом в 6 из 10 случаев рецидивирующие опухоли были более агрессивными и приобретали альтернативные и большее количество мутаций. [ 73 ] Как заявил один из последних авторов, Костелло: «У них наблюдалось увеличение числа мутаций в 20–50 раз. У пациента, перенесшего только операцию, могло быть 50 мутаций в начальной опухоли и 60 при рецидиве. Но у пациентов, получивших TMZ, может быть 2000 мутаций в рецидиве». [ 74 ] Кроме того, было подтверждено, что новые мутации несут известные признаки мутаций, индуцированных темозоломидом. Исследования показывают, что следует тщательно продумать применение темозоломида для лечения некоторых опухолей головного мозга. Неоправданное использование темозоломида может еще больше ухудшить прогноз пациентов или увеличить их бремя. Дальнейшее понимание механизмов мутаций, индуцированных темозоломидом, и новые комбинированные подходы могут быть многообещающими. [ нужна медицинская ссылка ]
Новые направления исследований
[ редактировать ]болезнь Ньюкасла полезна в некоторых случаях глиомы. Было отмечено, что [ 75 ] испытания III фазы В ближайшее время ожидаются вакцины против вируса болезни Ньюкасла (MTH-68/H). Штаммы вируса болезни Ньюкасла также использовались для создания кандидатов на вирусные векторные вакцины против Эболы и Covid-19 . [ 76 ] Кривошея при фоле показывает уровень птичьей жестокости.
Прогноз
[ редактировать ]Этот раздел необходимо обновить . ( сентябрь 2020 г. ) |
Прогноз глиомы дается в зависимости от степени опухоли (по шкале Всемирной организации здравоохранения) у пациента. Как правило, любая опухоль, имеющая степень выше I по ВОЗ (т.е. злокачественная опухоль в отличие от доброкачественной опухоли), имеет прогноз, приводящий к возможной смерти, варьирующийся от нескольких лет (степень II/III по ВОЗ) до месяцев (степень IV по ВОЗ). [ 48 ] [ 77 ] Прогноз также может быть дан на основе клеточного подтипа, что также может повлиять на прогноз.
Низкая оценка
[ редактировать ]Для опухолей низкой степени злокачественности прогноз несколько более оптимистичный. Вероятность смерти пациентов с глиомой низкой степени злокачественности в 17 раз выше, чем у соответствующих пациентов в общей популяции. [ 78 ] По данным исследования 2014 года, стандартизированная по возрасту 10-летняя относительная выживаемость составила 47%. [ 78 ] низкой степени злокачественности В одном исследовании сообщалось, что у пациентов с олигодендроглиомой медиана выживаемости составляет 11,6 года; [ 79 ] другой сообщил о средней выживаемости 16,7 лет. [ 80 ] К сожалению, примерно 70% опухолей низкой степени злокачественности (II степень по ВОЗ) перерастают в опухоли высокой степени злокачественности в течение 5–10 лет. [ 48 ] Глиомы II степени, несмотря на то, что их часто называют доброкачественными, всегда считаются смертельным заболеванием. [ 81 ]
Высокий класс
[ редактировать ]В эту группу входят анапластические астроцитомы и мультиформная глиобластома . В то время как медиана общей выживаемости анапластических глиом (класс III по ВОЗ) составляет примерно 3 года, мультиформная глиобластома имеет плохую медиану общей выживаемости — c. 15 месяцев. [ 82 ]
Послеоперационная традиционная ежедневная лучевая терапия улучшает выживаемость взрослых с хорошим функциональным благополучием и глиомой высокой степени злокачественности по сравнению с отсутствием послеоперационной лучевой терапии. Гипофракционированная лучевая терапия имеет такую же эффективность в отношении выживаемости, как и традиционная лучевая терапия, особенно для лиц в возрасте 60 лет и старше с глиобластомой. [ 83 ]
Диффузная срединная глиома
[ редактировать ]Диффузная срединная глиома (ДМГ), также известная как диффузная внутренняя глиома моста (ДИПГ), в первую очередь поражает детей, обычно в возрасте от 5 до 7 лет. [ 84 ] Среднее время выживания при ДИПГ составляет менее 12 месяцев. [ 85 ] При глиомах моста хирургическое вмешательство по удалению опухоли обычно невозможно или нежелательно. По самой своей природе эти опухоли диффузно проникают по всему стволу мозга, прорастая между нормальными нервными клетками. Агрессивная операция может привести к серьезному повреждению нервных структур, жизненно важных для движений рук и ног, движения глаз, глотания, дыхания и даже сознания. [ 86 ] [ 87 ] [ ненадежный медицинский источник? ] Испытания кандидатов на лекарства оказались безуспешными. [ 88 ] Заболевание в первую очередь лечат только лучевой терапией. [ нужна медицинская ссылка ]
IDH1 и IDH2 Глиома с мутацией
[ редактировать ]Пациенты с глиомой, несущей мутации IDH1 или IDH2 , имеют относительно благоприятную выживаемость по сравнению с пациентами с глиомой с IDH1/2 генами дикого типа. При глиоме III степени по классификации ВОЗ глиома с мутацией IDH1/2 имеет средний прогноз ~3,5 года, тогда как IDH1/2 глиома дикого типа имеет плохие результаты со средней общей выживаемостью c. 1,5 года. [ 41 ] [ 89 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б «Глиома» . Обзоры природы. Учебники по болезням . 10 (1): 34. 9 мая 2024 г. doi : 10.1038/s41572-024-00524-y . ISSN 2056-676X . ПМИД 38724549 .
- ^ «Глиома» . www.cancerresearchuk.org . Проверено 24 июля 2024 г.
- ^ «Первичные и вторичные опухоли головного мозга» . www.cancerresearchuk.org . Проверено 24 июля 2024 г.
- ^ Гуденбергер М.Л., Дженкинс Р.Б. (декабрь 2012 г.). «Генетика глиомы взрослых». Генетика рака . 205 (12): 613–21. дои : 10.1016/j.cancergen.2012.10.009 . ПМИД 23238284 .
- ^ Лим А., Вейр П., О'Брайен Т.Дж., Кэй А.Х. (январь 2011 г.). «Сложные зрительные галлюцинации как проявление височной глиомы низкой степени злокачественности». Журнал клинической неврологии . 18 (1): 157–9. дои : 10.1016/j.jocn.2010.07.112 . ПМИД 20965734 . S2CID 34392868 .
- ^ ПРЕТЕСТ педиатрия с. 224
- ^ Ройсс Д., фон Даймлинг А. (2009). «Наследственные опухолевые синдромы и глиомы». Глиомы . Последние результаты исследований рака. Том. 171. стр. 83–102. дои : 10.1007/978-3-540-31206-2_5 . ISBN 978-3-540-31205-5 . ПМИД 19322539 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Раднер Х., Эль-Шабрави Ю., Эйбл Р.Х., Брюстле О., Кеннер Л., Клейхуэс П., Вистлер О.Д. (1993). «Индукция опухоли онкогенами ras и myc в мозге плода и новорожденного: модулирующее влияние стадии развития и дозы ретровируса». Акта Нейропатологика . 86 (5): 456–65. дои : 10.1007/bf00228580 . ПМИД 8310796 . S2CID 2972931 .
- ^ Перейти обратно: а б Смолл Н.Р., Брэйди З., Скурра К.Дж., Ли С., Беррингтон де Гонсалес А., Мэтьюз Дж.Д. Компьютерная томография, радиация и заболеваемость раком головного мозга. Нейроонкология. 2023, 14 января; https://doi.org/10.1093/neuonc/noad012
- ^ Смолл Н.Р., Брэди З., Скурра К., Мэтьюз Дж.Д. Воздействие ионизирующего излучения и заболеваемость раком головного мозга: когорта исследования продолжительности жизни. Эпидемиология рака. Июнь 2016 г.; 42:60–5.
- ^ Седерквист Ф., Карлберг М., Ханссон Милд К., Харделл Л. (декабрь 2011 г.). «Риск опухоли головного мозга у детей и его связь с беспроводными телефонами: комментарий» . Экологическое здоровье . 10 (106): 106. Бибкод : 2011EnvHe..10..106S . дои : 10.1186/1476-069X-10-106 . ПМЦ 3278351 . ПМИД 22182218 .
- ^ Морган Л.Л., Кесари С., Дэвис Д.Л. (2014). «Почему дети поглощают больше микроволнового излучения, чем взрослые: последствия» . Журнал микроскопии и ультраструктуры . 4 (2): 197–204. дои : 10.1016/j.jmau.2014.06.005 .
- ^ «МАИР классифицирует радиочастотные электромагнитные поля как потенциально канцерогенные для человека» (PDF) (пресс-релиз). МАИР. 31 мая 2011 г. Архивировано (PDF) из оригинала 1 июня 2011 г. . Проверено 1 июня 2011 г.
- ^ «Сотовые телефоны и риск рака» . Национальный институт рака . Архивировано из оригинала 2 июня 2016 года . Проверено 29 мая 2016 г.
- ^ «Сотовые телефоны и риск рака (ссылки)» . Национальный институт рака . Архивировано из оригинала 2 июня 2016 года . Проверено 29 мая 2016 г.
- ^ «Беспроводные устройства и проблемы со здоровьем» . Федеральная комиссия по связи (FCC) . 26 мая 2011 года . Проверено 29 мая 2016 г.
- ^ «Телебрифинг для СМИ: Исследование радиочастотного излучения сотовых телефонов NTP: частичная публикация результатов» . niehs.nih.gov (пресс-релиз). Архивировано из оригинала 6 июня 2016 года . Проверено 29 мая 2016 г.
- ^ Wyde M, Cesta M, Blystone C и др. (1 января 2018 г.). «Отчет о частичных результатах исследований канцерогенеза радиочастотного излучения мобильных телефонов в рамках Национальной токсикологической программы у HSD: крысы Sprague Dawley SD (воздействие на все тело)». bioRxiv 10.1101/055699 .
- ^ Сторрс С (27 мая 2016 г.). «Излучение сотового телефона увеличивает риск возникновения рака у крыс, но стоит ли нам беспокоиться?» . Си-Эн-Эн. Архивировано из оригинала 29 мая 2016 года . Проверено 29 мая 2016 г.
- ^ Михаэлис М., Баумгартен П., Миттельбронн М., Дривер П.Х., Дорр Х.В., Чинатль Дж. (февраль 2011 г.). «Онкомодуляция цитомегаловирусом человека: новые клинические данные открывают новые пути». Медицинская микробиология и иммунология . 200 (1): 1–5. дои : 10.1007/s00430-010-0177-7 . ПМИД 20967552 . S2CID 22444291 .
- ^ Барами К. (июль 2010 г.). «Онкомодуляторные механизмы цитомегаловируса человека в глиомах». Журнал клинической неврологии . 17 (7): 819–23. дои : 10.1016/j.jocn.2009.10.040 . ПМИД 20427188 . S2CID 6952978 .
- ^ Дзюржински К., Чанг С.М., Хеймбергер А.Б., Калейта Р.Ф., МакГрегор Даллас С.Р., Смит М. и др. (март 2012 г.). «Консенсус о роли цитомегаловируса человека в глиобластоме» . Нейроонкология . 14 (3). Симпозиум по ЦМВЦ и глиомам: 246–55. дои : 10.1093/neuonc/nor227 . ПМК 3280809 . ПМИД 22319219 .
- ^ Стронг, MJ; Бланшар Э, 4-е; Лин, З; Моррис, Калифорния; Бадду, М; Тейлор, CM; Уэр, ML; Флемингтон, EK (11 июля 2016 г.). «Комплексная оценка вирома следующего поколения в тканях головного мозга на основе секвенирования нового поколения предполагает отсутствие связи между крупным вирусом и опухолью» . Acta Neuropathologica Communications . 4 (1): 71. дои : 10.1186/s40478-016-0338-z . ПМЦ 4940872 . ПМИД 27402152 .
{{cite journal}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Холдхофф, М; Гюнер, Г; Родригес, Ф.Дж.; Хикс, Дж.Л.; Чжэн, Вопрос; Форман, М.С.; Да, Х; Гроссман, SA; Микер, АК; Хифи, СМ; Эберхарт, КГ; Де Марзо, AM; Арав-Богер, Р. (15 июня 2017 г.). «Отсутствие цитомегаловируса в глиобластоме и других глиомах высокой степени злокачественности по данным ПЦР в реальном времени, иммуногистохимии и in situ гибридизации » . Клинические исследования рака . 23 (12): 3150–3157. дои : 10.1158/1078-0432.CCR-16-1490 . ПМЦ 5474132 . ПМИД 28034905 .
- ^ Гатто, Николь М.; Огата, Памела; Литл, Бретань (5 сентября 2021 г.). «Сельское хозяйство, пестициды и рак мозга: 20-летний обновленный систематический обзор литературы и метаанализ» . Раки . 13 (17): 4477. doi : 10.3390/cancers13174477 . ISSN 2072-6694 . ПМЦ 8431399 . ПМИД 34503287 .
- ^ Пети, Паскаль; Гандон, Джеральд; Шабардес, Стефан; Боннетер, Винсент (15 ноября 2022 г.). «Сельскохозяйственная деятельность и риск опухолей центральной нервной системы среди французских менеджеров ферм: результаты проекта ТРАКТОР» . Международный журнал рака . 151 (10): 1737–1749. дои : 10.1002/ijc.34197 . ISSN 1097-0215 . ПМЦ 9796624 . ПМИД 35781883 .
- ^ Остром К.Т., Боше Л., Дэвис Ф.Г., Дельтур И., Фишер Дж.Л., Лангер К.Э. и др. (июль 2014 г.). «Эпидемиология глиомы у взрослых: обзор «состояния науки» . Нейроонкология . 16 (7): 896–913. дои : 10.1093/neuonc/nou087 . ПМК 4057143 . ПМИД 24842956 .
- ^ Адель Фахмиде М., Шварцбаум Дж., Фрументо П., Фейхтинг М. (июнь 2014 г.). «Связь между полиморфизмом генов репарации ДНК и риском развития глиомы: систематический обзор и метаанализ» . Нейроонкология . 16 (6): 807–14. дои : 10.1093/neuonc/nou003 . ПМК 4022225 . ПМИД 24500421 .
- ^ Перейти обратно: а б Бернштейн, Кэрол; Р., Анил; Нфонсам, Валентин; Бернстей, Харрис (22 мая 2013 г.), Чен, Кларк (редактор), «Повреждение ДНК, восстановление ДНК и рак» , Новые направления исследований в области восстановления ДНК , InTech, doi : 10.5772/53919 , ISBN 978-953-51-1114-6 , заархивировано из оригинала 29 января 2021 года , получено 3 июля 2022 года.
- ^ Куоццо С., Порчеллини А., Ангризано Т., Морано А., Ли Б., Ди Пардо А. и др. (июль 2007 г.). «Повреждение ДНК, репарация, направленная на гомологию, и метилирование ДНК» . ПЛОС Генетика . 3 (7): е110. дои : 10.1371/journal.pgen.0030110 . ЧВК 1913100 . ПМИД 17616978 .
- ^ О'Хаган Х.М., Мохаммад Х.П., Бэйлин С.Б. (август 2008 г.). «Двухнитевые разрывы могут инициировать молчание генов и SIRT1-зависимое начало метилирования ДНК на экзогенном промоторном острове CpG» . ПЛОС Генетика . 4 (8): е1000155. дои : 10.1371/journal.pgen.1000155 . ПМЦ 2491723 . ПМИД 18704159 .
- ^ Скириуте Д., Вайткиене П., Саферис В., Асмониене В., Скауминас К., Дельтува В.П., Тамасаускас А. (июнь 2012 г.). «Метилирование промоторов генов MGMT, GATA6, CD81, DR4 и CASP8 при глиобластоме» . БМК Рак . 12 :218. дои : 10.1186/1471-2407-12-218 . ПМК 3404983 . ПМИД 22672670 .
- ^ Перейти обратно: а б Шпигль-Крейнекер С., Пиркер С., Филипитс М., Лётш Д., Бухройтнер Дж., Пихлер Дж. и др. (январь 2010 г.). «Экспрессия белка O6-метилгуанин-ДНК-метилтрансферазы в опухолевых клетках предсказывает результат терапии темозоломидом у пациентов с глиобластомой» . Нейроонкология . 12 (1): 28–36. дои : 10.1093/neuonc/nop003 . ПМЦ 2940563 . ПМИД 20150365 .
- ^ Чжан В., Чжан Дж., Ходли К., Кушваха Д., Рамакришнан В., Ли С. и др. (июнь 2012 г.). «миР-181d: прогнозирующий биомаркер глиобластомы, который подавляет экспрессию MGMT» . Нейроонкология . 14 (6): 712–9. дои : 10.1093/neuonc/nos089 . ПМЦ 3367855 . ПМИД 22570426 .
- ^ Чжан, Вэй; Чжан, Цзин; Ходли, Кэтрин; Кушваха, Дипа; Рамакришнан, Валя; Ли, Шовэй; Кан, Чуньшэн; Ты, Юнпин; Цзян, Чуанлу; Сун, Соня Вэй; Цзян, Тао (1 июня 2012 г.). «миР-181d: прогнозирующий биомаркер глиобластомы, который подавляет экспрессию MGMT» . Нейроонкология . 14 (6): 712–719. дои : 10.1093/neuonc/nos089 . ISSN 1522-8517 . ПМЦ 3367855 . ПМИД 22570426 .
- ^ Чен ХИ, Шао С.Дж., Чен Ф.Р., Кван А.Л., Чен З.П. (апрель 2010 г.). «Роль гиперметилирования промотора ERCC1 в лекарственной устойчивости к цисплатину в глиомах человека» . Международный журнал рака . 126 (8): 1944–1954. дои : 10.1002/ijc.24772 . ПМИД 19626585 .
- ^ Гао, Дэн; Герман, Джеймс Г.; Го, Минчжоу (7 марта 2016 г.). «Клиническое значение аберрантных эпигенетических изменений генов восстановления повреждений ДНК при раке человека» . Онкотаргет . 7 (24): 37331–37346. дои : 10.18632/oncotarget.7949 . ISSN 1949-2553 . ПМК 5095080 . ПМИД 26967246 . Архивировано из оригинала 15 июня 2022 года . Проверено 3 июля 2022 г.
- ^ Нарайанан Л., Фритцелл Дж.А., Бейкер С.М., Лискай Р.М., Глейзер П.М. (апрель 1997 г.). «Повышенные уровни мутаций во многих тканях мышей с дефицитом гена репарации несоответствия ДНК Pms2» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (7): 3122–7. Бибкод : 1997PNAS...94.3122N . дои : 10.1073/pnas.94.7.3122 . ЧВК 20332 . ПМИД 9096356 .
- ^ Хеган Д.К., Нараянан Л., Жирик Ф.Р., Эдельманн В., Лискай Р.М., Глейзер П.М. (декабрь 2006 г.). «Различные модели генетической нестабильности у мышей с дефицитом генов репарации ошибочного спаривания Pms2, Mlh1, Msh2, Msh3 и Msh6» . Канцерогенез . 27 (12): 2402–8. doi : 10.1093/carcin/bgl079 . ПМК 2612936 . ПМИД 16728433 .
- ^ Тутт А.Н., ван Остром КТ, Росс ГМ, ван Стиг Х., Эшворт А. (март 2002 г.). «Нарушение Brca2 увеличивает частоту спонтанных мутаций in vivo: синергизм с ионизирующим излучением» . Отчеты ЭМБО . 3 (3): 255–60. дои : 10.1093/embo-reports/kvf037 . ПМК 1084010 . ПМИД 11850397 .
- ^ Перейти обратно: а б с Моленаар Р.Дж., Радивоевич Т., Мациевски Дж.П., ван Норден К.Дж., Бликер Ф.Е. (декабрь 2014 г.). «Драйвер и пассажирские эффекты мутаций изоцитратдегидрогеназы 1 и 2 в онкогенезе и продлении выживаемости». Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1846 (2): 326–41. дои : 10.1016/j.bbcan.2014.05.004 . ПМИД 24880135 .
- ^ Перейти обратно: а б Коэн А.Л., Холмен С.Л., Колман Х. (май 2013 г.). «Мутации IDH1 и IDH2 в глиомах» . Текущие отчеты по неврологии и нейробиологии . 13 (5): 345. doi : 10.1007/s11910-013-0345-4 . ПМК 4109985 . ПМИД 23532369 .
- ^ Ван П., Донг К., Чжан С., Куан П.Ф., Лю Ю., Джек В.Р. и др. (июнь 2013 г.). «Мутации изоцитратдегидрогеназы 1 и 2 часто встречаются при внутрипеченочных холангиокарциномах и имеют общие мишени гиперметилирования с глиобластомами» . Онкоген . 32 (25): 3091–100. дои : 10.1038/onc.2012.315 . ПМЦ 3500578 . ПМИД 22824796 .
- ^ Тойота М, Ахуджа Н , Охе-Тойота М, Герман Дж.Г. , Байлин С.Б., Исса Дж.П. (июль 1999 г.). «Фенотип метилатора CpG-островков при колоректальном раке» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (15): 8681–6. Бибкод : 1999PNAS...96.8681T . дои : 10.1073/pnas.96.15.8681 . ПМК 17576 . ПМИД 10411935 .
- ^ Наземальхоссейни Моджарад Э., Куппен П.Дж., Агдаи Х.А., Зали М.Р. (2013). «Фенотип метилатора CpG-островков (CIMP) при колоректальном раке» . Гастроэнтерология и гепатология от койки до койки . 6 (3): 120–8. ПМК 4017514 . ПМИД 24834258 .
- ^ Моленаар Р.Дж., Ботман Д., Смитс М.А., Хира В.В., ван Лит С.А., Стап Дж. и др. (ноябрь 2015 г.). «Радиозащита раковых клеток с мутацией IDH1 с помощью ингибитора мутации IDH1 AGI-5198» (PDF) . Исследования рака . 75 (22): 4790–802. дои : 10.1158/0008-5472.CAN-14-3603 . ПМИД 26363012 .
- ^ Ватанабэ Т., Нобусава С., Клейхуэс П., Огаки Х. (апрель 2009 г.). «Мутации IDH1 являются ранними событиями в развитии астроцитом и олигодендроглиом» . Американский журнал патологии . 174 (4): 1149–53. дои : 10.2353/ajpath.2009.080958 . ПМЦ 2671348 . ПМИД 19246647 .
- ^ Перейти обратно: а б с д Махер Э.А., Фурнари Ф.Б., Бачу Р.М., Рович Д.Х., Луис Д.Н., Кавени В.К., ДеПиньо Р.А. (июнь 2001 г.). «Злокачественная глиома: генетика и биология серьезного вопроса» . Гены и развитие . 15 (11): 1311–33. дои : 10.1101/gad.891601 . ПМИД 11390353 .
- ^ Паскуалини, Клаудия; Козаки, Тацуя; Бруски, Марко; Нгуен, Тхи Хай Хоа; Минар-Колен, Вероника; Кастель, Дэвид; Гриль, Жак; Жину, Флоран (декабрь 2020 г.). «Моделирование взаимодействия микроокружения и опухолевых клеток при опухолях головного мозга» . Нейрон . 108 (6): 1025–1044. дои : 10.1016/j.neuron.2020.09.018 . ISSN 0896-6273 . ПМИД 33065047 . S2CID 222413763 .
- ^ фон Даймлинг А., Эйбл Р.Х., Огаки Х., Луис Д.Н., фон Аммон К., Петерсен I и др. (май 1992 г.). «Мутации p53 связаны с потерей аллеля 17p при астроцитоме II и III степени». Исследования рака . 52 (10): 2987–90. ПМИД 1349850 .
- ^ Ян Х., Парсонс Д.В., Джин Дж., МакЛендон Р., Рашид Б.А., Юань В. и др. (февраль 2009 г.). «Мутации IDH1 и IDH2 в глиомах» . Медицинский журнал Новой Англии . 360 (8): 765–73. дои : 10.1056/NEJMoa0808710 . ПМЦ 2820383 . ПМИД 19228619 .
- ^ «Глиомы» . Медицинская библиотека здоровья Джонса Хопкинса . Архивировано из оригинала 10 мая 2017 года . Проверено 19 апреля 2017 г.
- ^ Заргуни, М; Вандергрифф, К; Лейтон, К.Ф.; Макгоуэн, Дж.Б.; Коимбра, К; Бхакти, А; Опатовский, MJ (июль 2012 г.). «Хордоидная глиома третьего желудочка» . Труды (Университет Бэйлора. Медицинский центр) . 25 (3): 285–6. дои : 10.1080/08998280.2012.11928853 . ПМЦ 3377302 . ПМИД 22754136 .
- ^ Луи Д.Н., Перри А., Райфенбергер Г., фон Даймлинг А., Фигарелла-Брангер Д., Кавени В.К. и др. (июнь 2016 г.). «Классификация опухолей центральной нервной системы Всемирной организации здравоохранения 2016 года: краткое изложение» . Акта Нейропатологика . 131 (6): 803–20. дои : 10.1007/s00401-016-1545-1 . ПМИД 27157931 .
- ^ Луи Д.Н., Огаки Х., Вистлер О.Д., Кавени В.К., ред. (2016). Классификация ВОЗ опухолей центральной нервной системы . Всемирная организация здравоохранения (пересмотренное 4-е изд.). Лион: Международное агентство по исследованию рака. ISBN 9789283244929 . OCLC 951745876 . [ нужна страница ]
- ^ Нейроонкология, том 25, Приложение к выпуску_1, июнь 2023 г., страницы i38–i39, https://doi.org/10.1093/neuonc/noad073.152
- ^ Фюллинген, Эвен Ховиг; Бё, Ларс Эйрик; Райнертсен, Ингерид; Якола, магазин Асгейр; Сагберг, Лиза Миллгорд; Бернтсен, Эрик Магнус; Салвесен, Эйвинд; Сольхейм, Оле (1 июля 2021 г.). «Выживаемость глиобластомы в зависимости от локализации опухоли: статистический атлас опухолей популяционной когорты» . Акта Нейрохирургика . 163 (7): 1895–1905. дои : 10.1007/s00701-021-04802-6 . ISSN 0942-0940 . ПМЦ 8195961 . ПМИД 33742279 .
- ^ Перейти обратно: а б Персо-Шарма, Дхарам; Бернс, Джозеф; Траангл, Джеран; Мулик, Сабьясачи (сентябрь 2017 г.). «Различия в распространенности рака головного мозга в Соединенных Штатах: обзор литературы по глиомам» . Медицинские науки . 5 (3): 16. doi : 10.3390/medsci5030016 . ISSN 2076-3271 . ПМЦ 5635804 . ПМИД 29099032 .
- ^ Лю, Хуаньбин; Цинь, Сяовэй; Чжао, Лиян; Чжао, Банда; Ван, Юбо (2021). «Эпидемиология и выживаемость пациентов с глиомами ствола мозга: популяционное исследование с использованием базы данных SEER» . Границы онкологии . 11 . дои : 10.3389/fonc.2021.692097 . ISSN 2234-943X . ПМЦ 8237753 . ПМИД 34195093 .
- ^ Перейти обратно: а б с д и ж г час я дж Веллер М., ван ден Бент М., Пройссер М., Ле Рун Э., Тонн Дж. К., Миннити Дж.; и др. (2021). «Руководство ЕАНО по диагностике и лечению диффузных глиом взрослого возраста» . Nat Rev Clin Oncol . 18 (3): 170–186. дои : 10.1038/s41571-020-00447-z . ПМЦ 7904519 . ПМИД 33293629 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )
«Эта статья доступна по международной лицензии Creative Commons Attribution 4.0» - ^ Тан А.С. и др. (июль 2020 г.). «Лечение глиобластомы: современное состояние и будущие направления» . CA: Журнал рака для врачей . 70 (4): 299–312. дои : 10.3322/caac.21613 . hdl : 10536/DRO/DU:30138185 . ПМИД 32478924 .
- ^ Фалько-Роже, Жоан; Каччиола, Альберто; Самбатаро, Фабио; Крими, Алессандро (2024). «Функциональная и структурная реорганизация при опухолях головного мозга: подход машинного обучения с использованием десинхронизированных функциональных колебаний» . Биология природных коммуникаций . 7 (1): 419. doi : 10.1038/s42003-024-06119-3 . ПМЦ 10998892 . ПМИД 38582867 .
- ^ Перейти обратно: а б с д Харт М.Г., Гарсайд Р., Роджерс Дж., Стейн К., Грант Р. (апрель 2013 г.). «Темозоломид при глиоме высокой степени злокачественности» . Кокрановская база данных систематических обзоров . 4 (4): CD007415. дои : 10.1002/14651858.CD007415.pub2 . ПМЦ 6457743 . ПМИД 23633341 .
- ^ Платтен М., Бунсе Л., Вик В., Бунсе Т. (октябрь 2016 г.). «Концепции иммунотерапии глиомы» . Иммунология рака, иммунотерапия . 65 (10): 1269–75. дои : 10.1007/s00262-016-1874-x . ПМЦ 11029493 . ПМИД 27460064 . S2CID 22635893 .
- ^ Патель М.А., Пардолл Д.М. (июль 2015 г.). «Концепции иммунотерапии глиомы» . Журнал нейроонкологии . 123 (3): 323–30. дои : 10.1007/s11060-015-1810-5 . ПМЦ 4498978 . ПМИД 26070552 .
- ^ Сурьяванши Ю.Р., Шульце А.Дж. (июль 2021 г.). «Онколитические вирусы для злокачественной глиомы: на грани успеха?» . Вирусы . 13 (7): 1294. дои : 10.3390/v13071294 . ПМК 8310195 . ПМИД 34372501 .
- ^ Вонг Э.Т., Брем С. (октябрь 2007 г.). «Укрощение глиобластомы: воздействие на ангиогенез» . Журнал клинической онкологии . 25 (30): 4705–6. дои : 10.1200/JCO.2007.13.1037 . ПМИД 17947716 . S2CID 6164155 .
- ^ Перейти обратно: а б Цзян Б., Чайчана К., Вееравагу А., Чанг С.Д., Блэк К.Л., Патил К.Г. (апрель 2017 г.). «Биопсия и резекция в лечении глиом низкой степени злокачественности» . Кокрановская база данных систематических обзоров . 4 (6): CD009319. дои : 10.1002/14651858.CD009319.pub3 . ПМК 6478300 . ПМИД 28447767 .
- ^ Харт М.Г., Грант Г.Р., Шойом Э.Ф., Грант Р. (июнь 2019 г.). «Биопсия против резекции при глиоме высокой степени злокачественности» . Кокрановская база данных систематических обзоров . 2019 (6): CD002034. дои : 10.1002/14651858.CD002034.pub2 . ПМК 6553559 . ПМИД 31169915 .
- ^ Группа экспертов по метаанализу глиомы (GMT); и др. (Группа экспертов по метаанализу глиомы) (2002). Стюарт, Лесли (ред.). «Химиотерапия глиом высокой степени злокачественности» . Кокрановская база данных систематических обзоров . 2014 (4): CD003913. дои : 10.1002/14651858.CD003913 . ПМЦ 10625440 . ПМИД 12519620 .
- ^ Перейти обратно: а б Лори Т.А., Гиллеспи Д., Доусвелл Т., Эванс Дж., Эрридж С., Вейл Л. и др. (август 2019 г.). «Долгосрочные нейрокогнитивные и другие побочные эффекты лучевой терапии с химиотерапией или без нее при глиоме» . Кокрановская база данных систематических обзоров . 8 (8): CD013047. дои : 10.1002/14651858.cd013047.pub2 . ПМК 6699681 . ПМИД 31425631 .
- ^ Парашрамка С., Талари Г., Розенфельд М., Го Дж., Виллано Дж.Л. (июль 2017 г.). «Прокарбазин, ломустин и винкристин при рецидиве глиомы высокой степени злокачественности» . Кокрановская база данных систематических обзоров . 2017 (7): CD011773. дои : 10.1002/14651858.cd011773.pub2 . ПМК 6483418 . ПМИД 28744879 .
- ^ Джонсон Б.Е., Мазор Т., Хонг С., Барнс М., Айхара К., Маклин С.Ю. и др. (январь 2014 г.). «Мутационный анализ раскрывает происхождение и эволюцию рецидивирующей глиомы, обусловленную терапией» . Наука . 343 (6167): 189–193. Бибкод : 2014Sci...343..189J . дои : 10.1126/science.1239947 . ПМЦ 3998672 . ПМИД 24336570 .
- ^ «Рецидивирующий рак мозга следует определенным генетическим путям» . Калифорнийский университет Санта-Крус . Калифорнийский университет Сан-Франциско. 17 декабря 2013 года. Архивировано из оригинала 20 апреля 2015 года . Проверено 17 июня 2015 г.
- ^ Чатари, ЛК; Мосс, RW; Бет, Дж; Тёрёкчик, Б; Себереньи, Дж; Бакач, Т. (1999). «Полезное лечение пациентов с поздними стадиями рака с использованием вакцины против вируса болезни Ньюкасла» . Противораковые исследования . 19 (1Б): 635–638. ПМИД 10216468 .
- ^ Ким, Шин Хи; Самал, Сиба К (2016). «Вирус болезни Ньюкасла как вакцинный вектор для разработки человеческих и ветеринарных вакцин» . Вирусы . 8 (7): 183. дои : 10.3390/v8070183 . ПМЦ 4974518 . ПМИД 27384578 .
- ^ Санаи Н., Чанг С., Бергер М.С. (ноябрь 2011 г.). «Низкосортные глиомы у взрослых». Журнал нейрохирургии . 115 (5): 948–65. дои : 10.3171/2011.7.JNS101238 . ПМИД 22043865 .
- ^ Перейти обратно: а б Смолл Н.Р., Гаучи О.П., Шатло Б., Шаллер К., Вебер Д.С. (август 2012 г.). «Относительная выживаемость пациентов с супратенториальными глиомами низкой степени злокачественности» . Нейроонкология . 14 (8): 1062–9. дои : 10.1093/neuonc/nos144 . ПМК 3408266 . ПМИД 22773277 .
- ^ Огаки Х., Клейхуес П. (июнь 2005 г.). «Популяционные исследования заболеваемости, выживаемости и генетических изменений при астроцитарных и олигодендроглиальных глиомах» . Журнал невропатологии и экспериментальной неврологии . 64 (6): 479–89. дои : 10.1093/jnen/64.6.479 . ПМИД 15977639 .
- ^ Олсон Дж. Д., Ридель Э., ДеАнджелис Л. М. (апрель 2000 г.). «Отдаленный результат олигодендроглиомы низкой степени злокачественности и смешанной глиомы». Неврология . 54 (7): 1442–8. дои : 10.1212/WNL.54.7.1442 . ПМИД 10751254 . S2CID 26335770 .
- ^ Клаус, Элизабет Б.; Уолш, Кайл М.; Винке, Джон К.; Молинаро, Аннетт М.; Вимелс, Джозеф Л.; Шильдкраут, Джоэллен М.; Бонди, Мелисса Л.; Бергер, Митчел; Дженкинс, Роберт; Ренш, Маргарет (январь 2015 г.). «Выживание и низкосортная глиома: появление генетической информации» . Нейрохирургический фокус . 38 (1): Е6. дои : 10.3171/2014.10.FOCUS12367 . ISSN 1092-0684 . ПМК 4361022 . ПМИД 25552286 .
- ^ Бликер Ф.Е., Моленаар Р.Дж., Леенстра С. (май 2012 г.). «Последние достижения в молекулярном понимании глиобластомы» . Журнал нейроонкологии . 108 (1): 11–27. дои : 10.1007/s11060-011-0793-0 . ПМЦ 3337398 . ПМИД 22270850 .
- ^ Хан Л., Солиман Х., Сахгал А., Перри Дж., Сюй В., Цао М.Н. (май 2020 г.). «Эскалация дозы внешнего лучевого облучения при глиоме высокой степени злокачественности» . Кокрейновская база данных систематических обзоров . 5 (8): CD011475. дои : 10.1002/14651858.CD011475.pub3 . ПМЦ 7389526 . ПМИД 32437039 .
- ^ «Пациенты и семьи: основные факты» . Реестр ДИПГ . Архивировано из оригинала 2 мая 2014 года . Проверено 1 мая 2014 г.
- ^ Кебуди Р., Чакир ФБ (октябрь 2013 г.). «Лечение диффузных глиом моста у детей: последние разработки». Педиатрические препараты . 15 (5): 351–62. дои : 10.1007/s40272-013-0033-5 . ПМИД 23719782 . S2CID 207491201 .
- ^ Фишер П.Г., Брейтер С.Н., Карсон Б.С., Варам М.Д., Уильямс Дж.А., Вайнгарт Дж.Д. и др. (октябрь 2000 г.). «Клинико-патологическая переоценка классификации опухолей ствола головного мозга. Идентификация пилоцистной астроцитомы и фибриллярной астроцитомы как отдельных образований» . Рак . 89 (7): 1569–76. doi : 10.1002/1097-0142(20001001)89:7<1569::aid-cncr22>3.0.co;2-0 . ПМИД 11013373 . S2CID 25562391 .
- ^ Дональдсон С.С., Лэнингем Ф., Фишер П.Г. (март 2006 г.). «Прогресс в понимании глиомы ствола мозга». Журнал клинической онкологии . 24 (8): 1266–72. дои : 10.1200/jco.2005.04.6599 . ПМИД 16525181 .
- ^ Янсен М.Х., ван Вурден Д.Г., Вандертоп В.П., Касперс Г.Дж. (февраль 2012 г.). «Диффузные внутренние глиомы моста: систематические обновления клинических исследований и биологии». Обзоры лечения рака . 38 (1): 27–35. дои : 10.1016/j.ctrv.2011.06.007 . ПМИД 21764221 .
- ^ Моленаар Р.Дж., Вербаан Д., Ламба С., Занон С., Джеукен Дж.В., Бутс-Спренгер Ш. и др. (сентябрь 2014 г.). «Сочетание мутаций IDH1 и статуса метилирования MGMT предсказывает выживаемость при глиобластоме лучше, чем только IDH1 или MGMT» . Нейроонкология . 16 (9): 1263–73. дои : 10.1093/neuonc/nou005 . ПМК 4136888 . ПМИД 24510240 .
Внешние ссылки
[ редактировать ]- Глиома. Архивировано 25 сентября 2017 года в Wayback Machine в Атласе белков человека. Архивировано 4 марта 2020 года в Wayback Machine.
- Американская ассоциация опухолей головного мозга: Злокачественные глиомы
- Опухоли головного и спинного мозга: надежда через исследования (Национальный институт неврологических расстройств и инсульта)
- Классификация глиом ВОЗ
- Изображения глиомы База данных MedPix