Радикальный (химия)


В химии радикал молекулу , также известный как свободный радикал , представляет собой атом , , или ион который имеет по крайней мере один непарной валентный электрон . [ 1 ] [ 2 ] За некоторыми исключениями эти непарные электроны делают радикалы очень химически реактивными . Многие радикалы спонтанно димеризуются . Большинство органических радикалов имеют короткие сроки.
Примечательным примером радикала является гидроксильный радикал (HO · ), молекула, которая имеет один непарный электрон на атом кислорода. Два других примера - триплетный кислород и триплетный карбен ( ꞉ CH
2 ), которые имеют два непарных электрона.
Радикалы могут генерироваться несколькими способами, но типичные методы включают окислительно -восстановительные реакции , ионизирующее излучение , тепло, электрические разряды и электролиз , как известно, продуцируют радикалы. Радикалы являются промежуточными звенами во многих химических реакциях, в большей степени, чем видно из сбалансированных уравнений.
Радикалы важны для сжигания , химии атмосферы , полимеризации , плазмы химии , биохимии и многих других химических процессов. Большинство натуральных продуктов генерируются с помощью радикальных ферментов. радикалов В живых организмах супероксид и оксид азота и их продукты реакции регулируют многие процессы, такие как контроль тонуса сосудов и, следовательно, кровяное давление. Они также играют ключевую роль в промежуточном метаболизме различных биологических соединений. Такие радикалы могут быть даже посланниками в процессе, названном окислительно -восстановительной передачей сигналов . Радикал может быть пойман в клетке растворителя или быть связанным.
Формация
[ редактировать ]Радикалы либо (1) образуются из спин-паровых молекул, либо (2) из других радикалов. Радикалы образуются из спин-паровых молекул посредством гомолиза слабых связей или переноса электронов, также известных как восстановление. Радикалы образуются из других радикалов посредством замены, добавления и элиминационных реакций.
Радикальное образование из молекул с прямыми парой
[ редактировать ]Гомолиз
[ редактировать ]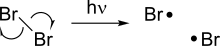
Гомолиз делает два новых радикала из молекулы с прядили, разбивая ковалентную связь, оставляя каждый из фрагментов с одним из электронов в связи. [ 3 ] Поскольку нарушение химической связи требует энергии, гомолиз происходит при добавлении тепла или света. Энергия диссоциации связи, связанная с гомолизом, зависит от стабильности данного соединения, а некоторые слабые связи способны гомолизу при относительно более низких температурах.
Некоторые реакции гомолиза особенно важны, потому что они служат инициатором для других радикальных реакций. Одним из таких примеров является гомолиз галогенов, который встречается под светом и служит движущей силой для радикальных реакций галогенирования.
Другой заметной реакцией является гомолиз дибензоил -пероксида, что приводит к образованию двух бензоилоксидикал и действует как инициатор для многих радикальных реакций. [ 4 ]
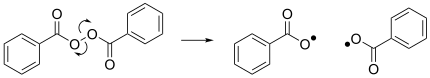
Снижение
[ редактировать ]
Классически радикалы образуются с помощью одноэлектронного восстановления . Как правило, одноэлектронные пониженные органические соединения нестабильны. Стабильность передается радикальному аниону, когда заряд может быть делокализован . Примеры включают щелочные металлические нафтениды , антракениды и кетил .
Радикальное образование из других радикалов
[ редактировать ]Абстракция
[ редактировать ]
Абстракция водорода генерирует радикалы. Чтобы достичь этой реакции, связь СН донора H-Atom должна быть слабой, что редко имеет место в органических соединениях. Аллизические и особенно вдвойне аллильные СН -связи склонны к абстракции с помощью O 2 . Эта реакция является основой сушильных масел , таких как линолевой кислоты производные .
Добавление
[ редактировать ]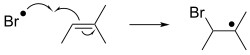
В свободных дополнениях радикал добавляет подложку с спин-парой. При применении к органическим соединениям реакция обычно влечет за собой дополнение к алкене. Это дополнение генерирует новый радикал, который может добавить к еще одному алкене и т. Д. Это поведение лежит в основе радикальной полимеризации , технологии, которая производит много пластмасс . [ 5 ] [ 6 ]
Устранение
[ редактировать ]Радикальное устранение можно рассматривать как обратное радикальное добавление. При радикальной элиминации нестабильное радикальное соединение разбивается в молекулу с спин-парой и новое радикальное соединение. Ниже показан пример реакции радикала элиминации, где бензоилокси -радикал разбивается на фенильный радикал и молекулу углекислого газа. [ 7 ]
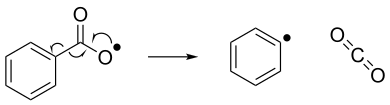
Стабильность
[ редактировать ]Стабильность органических радикалов
[ редактировать ]
Генерация и реакционная способность органических радикалов зависят как от их термодинамической стабильности, так и от кинетической стабильности, также известных как стойкость. Это различие необходимо, потому что эти два типа стабильности не всегда коррелируют друг с другом. Например, бензиловые радикалы, которые известны своей слабой силой связей C -H, термодинамически стабилизированы из -за резонансной делокализации. Тем не менее, эти радикалы являются кинетически преходящими, потому что они могут подвергаться быстрой, ограниченной диффузии димеризации, что приводит к жизни, которая составляет менее нескольких наносекунд. Чтобы избежать путаницы, особенно для углеродных радикалов, Гриллер и Ингольд представили следующие определения: [ 8 ] «Стабилизированный должен использоваться для описания углеродного радикала R · , когда прочность связи R-H слабее, чем соответствующая связь C-H алкана». «Постоянное следует использовать для описания радикала, который имеет время жизни, которое значительно больше, чем метил [радикал] в том же состоянии». В то время как взаимосвязь между термодинамической стабильностью и кинетической стойкостью зависят от конкретных случаев, органические радикалы обычно могут быть стабилизированы любыми или всеми этими факторами: наличие электроотрицательности, делокализации и стерического препятствия. [ 8 ] Соединение 2,2,6,6-тетраметилпиперидинилоксил иллюстрирует комбинацию всех трех факторов. Это коммерчески доступное твердое вещество, которое, кроме магнитного, ведет себя как нормальное органическое соединение.
Электроотрицательность
[ редактировать ]Органические радикалы по своей природе дефицит электронов, поэтому тем выше электроотрицательность атома, на котором непарная электрон находится менее стабильный радикал. [ 9 ] Например, между углеродом, азотом и кислородом углерод является наиболее стабильным и кислородом наименьшим стабильным.
Электроотрицательность также учитывается в стабильности атомов углерода различных гибридизаций. Более высокий S-характер коррелирует с более высокой электроотрицательностью атома углерода (из-за непосредственной близости S-орбиталей к ядру), и чем больше электроотрицательность, тем менее стабильным радикалом. [ 9 ] SP-гибридизированные углероды (50% S-характер) образуют наименьшие стабильные радикалы по сравнению с SP 3 -Сибридизированные углероды (25% S-Шарактер), которые образуют наиболее стабильные радикалы.
Делокализация
[ редактировать ]Делокализация электронов по структуре радикала, также известной как его способность образовывать одну или несколько резонансных структур, позволяет распространять дефицит электрона по нескольким атомам, сводя к минимуму нестабильность. Делокализация обычно встречается в присутствии электронов-доново-доносов, таких как гидроксильные группы (-OH), эфиры (-или соседние алкены и амины (-nh 2 или -nr) или группы электронов, такие как c = O или C≡N. [ 3 ]

Эффекты делокализации также можно понять с использованием молекулярной орбитальной теории в качестве линзы, более конкретно, путем изучения внутримолекулярного взаимодействия непарного электрона с парой электронов пожертвовательной группы или пустой π* орбитальной группой электронов в форме Молекулярная орбитальная диаграмма. Homo радикала в отличие от того, что орбиталь удачно называется Somo, или в односторонней молекулярной орбитале. Для электронов-доносительной группы Somo взаимодействует с Lower Energy Lone Pare, образуя новую нижнюю энергию, заполненную связующим, и новым сомо сомо, выше, чем в оригинале. В то время как энергия непарного электрона увеличилась, снижение энергии одиночной пары, образуя новую орбитунскую орбиту, перевешивает увеличение энергии нового сомо, что приводит к чистому снижению энергии молекулы. Следовательно, электроно-доновые группы помогают стабилизировать радикалы.

С группой, которая вместо этого находится в электронном плане, Somo взаимодействует с пустой π* орбиталом. Нет никаких электронов, занимающих образованную орбиталь с более высокой энергией, в то время как новые формы сомо, которая ниже энергии. Это приводит к более низкой энергии и более высокой стабильности радикальных видов. Как пожертвования групп, так и группы снятия стабилизируют радикалы.
Еще одна известная, хотя и более слабая форма делокализации- гиперконъюгация . В радикальной химии радикалы стабилизируются гиперконъюгацией с соседними алкильными группами. Пожертвование связей Sigma (σ) C - H в частично пустые радикальные орбитали помогает дифференцировать стабильность радикалов на третичных, вторичных и первичных углеродах. Третичные углеродные радикалы имеют три связи σ CH, которые жертвуют, вторичные радикалы только две, а первичные радикалы только один. Следовательно, третичные радикалы являются наиболее стабильными и первичными радикалами наименее стабильными.
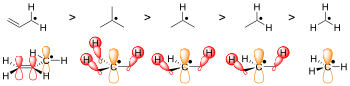
Стерические помехи
[ редактировать ]
Больше всего, чем больше стерическое препятствие, тем сложнее возникать реакции, и радикальная форма предпочитается по умолчанию. Например, сравните водородную форму N -гидроксипиперидина молекулы с темпом . [ 3 ] Tempo, OR (2,2,6,6-тетраметилпиперидин-1-ил) оксил, слишком стерически затруднен дополнительными метильными группами, чтобы отреагировать, делая его достаточно стабильным, чтобы продавать коммерчески в его радикальной форме. N -гидроксипиперидин, однако, не имеет четырех метильных групп, чтобы препятствовать тому, чтобы реагирующая молекула, поэтому структура была нестабильной. [ 3 ]
Формальные доноры H-Atom
[ редактировать ]Стабильность многих (или большинства) органических радикалов не обозначена их изолированностью, но проявляется в их способности функционировать как доноры H • Полем Это свойство отражает ослабленную связь с водородом, обычно O -H, но иногда N -H или C -H. Это поведение важно, потому что эти h • Доноры служат антиоксидантами в биологии и в торговле. Иллюстративным является α-токоферол ( витамин Е ). Сам радикал токоферола недостаточно стабилен для изоляции, но родительская молекула является высокоэффективным донором атома водорода. Связь C - H ослаблена в трифенилметил производных (Trityl).

Неорганические радикалы
[ редактировать ]Большое разнообразие неорганических радикалов стабильнее и на самом деле выделяется. Примеры включают в себя большинство первых комплексов переходных металлов.
Что касается радикалов основной группы, наиболее распространенный радикал во вселенной также является наиболее распространенным химическим веществом во вселенной, h • Полем Большинство основных групповых радикалов, однако, не являются изолированными , несмотря на их внутреннюю стабильность. Водородные радикалы, например, с нетерпением объединяются, чтобы сформировать H 2 . Оксид азота (NO) является хорошо известным примером выделяемого неорганического радикала. Соль Фреми (нитрозодисульфонат калия (KSO 3 ) 2 нет) является связанным примером. Многие тиазильные радикалы известны, несмотря на ограниченную степень π -резонансной стабилизации . [ 10 ] [ 11 ]
Многие радикалы можно рассматривать как продукты разрыва ковалентных связей путем гомолиза . Энергии диссоциации гомолитической связи , обычно сокращенные как «Δ H °», являются мерой прочности связи. Разделение H 2 на 2 часа • , например, требуется Δ H ° +435 кДж/моль , при разделении Cl 2 на два Cl • Требуется Δ H ° +243 кДж/моль. Для слабых связей гомолиз может быть индуцирован термически. Сильные связи требуют высокоэнергетических фотонов или даже пламени, чтобы вызвать гомолиз.
Дирадикалы
[ редактировать ]Дирадикалы - это молекулы, содержащие два радикальных центра. Dioxygen (O 2 ) является важным примером стабильного дирадикала. Синглет-кислород , нерадикальное состояние диоксина с самой низкой энергией, менее стабильно, чем дирадикальное из-за правила максимальной множественности Hund . Относительная стабильность кислородного дирадикала связана в первую очередь из-за спиновой природы триплетного перехода, необходимого для его захвата электронов, то есть « окисляется ». Дирадическое состояние кислорода также приводит к своему парамагнитному характеру, который демонстрируется его притяжением к внешнему магниту. [ 12 ] Diradicals также могут возникать в комплексах металлов-оксо , предоставляя себя для исследований запрещенных реакций в химии переходных металлов . [ 13 ] Карбены в их триплетном состоянии можно рассматривать как дирадикалы, сосредоточенные на одном и том же атом, в то время как это обычно известны высокореактивные постоянные карбены , причем наиболее распространенным примером являются N-гетероциклические карбены.
Триплетные карбены и нитрены - это дирадикалы. Их химические свойства отличаются от свойств их одиночных аналогов.
Появление радикалов
[ редактировать ]Сжигание
[ редактировать ]
Знакомым радикальной реакцией является сжигание . Молекула кислорода - стабильная дирадикальная , лучше всего представлена • O - o • Полем Поскольку вращения электронов параллельны, эта молекула стабильна. В то время как основным состоянием кислорода является это нереактивное вращение с спином ( триплета ) дирадикальное, чрезвычайно реактивное вращаемое (синглетное ) состояние ( синглет ). Чтобы сгорание произошло, энергетический барьер между ними должен быть преодолен. Этот барьер может быть преодолен путем тепла, требуя высоких температур. Переход триплета также « запрещен ». Это представляет собой дополнительный барьер для реакции. Это также означает, что молекулярный кислород относительно нереактивен при комнатной температуре, за исключением присутствия каталитического тяжелого атома, такого как железо или медь.
Сжигание состоит из различных радикальных цепных реакций, которые может инициировать синглетный радикал. Плавельность сжиганию данного материала сильно зависит от концентрации радикалов, которые должны быть получены до доминирования реакций инициации и распространения, приводя к материала . После того, как горючий материал был употреблен, реакции прекращения снова доминируют, и пламя умирает. Как указано, продвижение реакций распространения или прекращения изменяет воспламеняемость. Например, поскольку сам свинец деактивирует радикалы в смеси бензин-воздуха, тетраэтиловый свинец когда-то обычно добавлял к бензину. Это предотвращает сжигание не инициировать неконтролируемым образом или несгоревшие остатки ( стук двигателя ) или преждевременное зажигание ( предварительное признание ).
Когда углеводород сжигается, участвует большое количество различных кислородных радикалов. Первоначально гидропероксильный радикал (HOO • ) формируются. Затем они реагируют далее, чтобы дать органические гидропероксиды , которые распадаются на гидроксильные радикалы (HO • ).
Полимеризация
[ редактировать ]Многие реакции полимеризации инициируются радикалами. Полимеризация включает в себя начальный радикал, добавляя к нерадикальному (обычно алкен), чтобы получить новые радикалы. Этот процесс является основой радикальной цепной реакции . Искусство полимеризации влечет за собой метод, с помощью которого вводится инициационный радикал. Например, метилметакрилат (MMA) может быть полимеризован для получения поли (метилметакрилат) (PMMA - Plexiglas или Perspex) посредством повторяющегося ряда стадий радикального добавления :
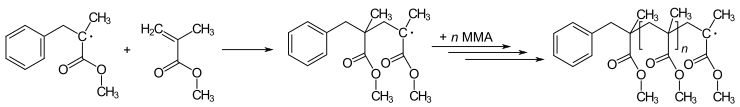
Новые методы радикальной полимеризации известны как живая радикальная полимеризация . Варианты включают обратимую перенос цепи с добавлением фрагментации ( RAFT ) и радикальную полимеризацию переноса атома ( ATRP ).
Будучи распространенным радикалом, O 2 реагирует со многими органическими соединениями для генерации радикалов вместе с гидропероксидным радикалом. Высыхающие масла и алкидные краски затвердевают из -за радикального сшивания, инициированного кислородом из атмосферы.
Атмосферные радикалы
[ редактировать ]Наиболее распространенным радикалом в нижней атмосфере является молекулярный диоксиген. Фотодиссоциация молекул источников продуцирует другие радикалы. В нижней атмосфере, важные радикалы продуцируются фотодиссоциацией диоксида азота в атом кислорода и оксидом азота (см . Уравнение 1.1 ниже), которое играет ключевую роль в образовании смога - и фотодиссоциация озона с получением возбужденного кислорода. O (1d) (см . Уравнение 1.2 ниже). Чистые и возвратные реакции также показаны ( уравнение 1.3 и уравнение 1.4 соответственно).
| ( уравнение 1.1 ) |
| ( уравнение 1.2 ) |
| ( уравнение 1.3 ) |
| ( уравнение 1.4 ) |
В верхней атмосфере фотодиссоциация нормально нереактивных хлорфторуглеродов (CFC) с помощью солнечного ультрафиолетового излучения является важным источником радикалов (см. Уравнение 1 ниже). Эти реакции дают радикал хлора , Cl • , который катализирует превращение озона в O 2 , таким образом, облегчает истощение озона ( уравнение 2.2 - уравнение 2.4 ниже).
| ( уравнение 2.1 ) |
| ( уравнение 2.2 ) |
| ( уравнение 2.3 ) |
| ( уравнение 2.4 ) |
| ( уравнение 2.5 ) |
Такие реакции вызывают истощение озонового слоя , тем более что радикал хлора может свободно участвовать в другой реакционной цепи; Следовательно, использование хлорфторуглеродов в качестве хладагентов было ограничено.
В биологии
[ редактировать ]
Радикалы играют важную роль в биологии. Многие из них необходимы для жизни, такие как внутриклеточное убийство бактерий фагоцитарными клетками, такими как гранулоциты и макрофаги . Радикалы участвуют в процессах передачи сигналов клеток , [ 15 ] известен как окислительно -восстановительная сигнализация . Например, радикальная атака линолевой кислоты вызывает серию 13-гидроксиоктадекадиеновых кислот и 9-гидроксиоктадекадиеновых кислот , которые могут действовать для регулирования локализованных воспалительных и/или заживающих реакций тканей, восприятия боли и распространения злокачественных клеток. Радикальные атаки на арахидоновую кислоту и докозагексаеновую кислоту дают аналогичный, но более широкий спектр сигнальных продуктов. [ 16 ]
Радикалы также могут быть вовлечены в болезнь Паркинсона , сжизную и вызванную наркотиками глухота , шизофрения и болезнь Альцгеймера . [ 17 ] заболевания железа Классический синдром свободного радикала, гемохроматоз , обычно связан с созвездием симптомов, связанных с свободным радикалом, включая нарушение движения, психоз, пигментальные аномалии меланина , глухоту, артрит и сахарный диабет. Свободная радикальная теория старения предлагает, чтобы радикалы лежат в основе самого процесса старения . Аналогичным образом, процесс митомезиса предполагает , что повторное воздействие радикалов может продлить срок службы.
Поскольку радикалы необходимы для жизни, организм имеет ряд механизмов, чтобы минимизировать повреждение, вызванное радикалами, и восстанавливать повреждение, такие как ферменты супероксиддисмутаза , каталаза , глутатион пероксидаза и глутатион редуктаза . Кроме того, антиоксиданты играют ключевую роль в этих защитных механизмах. Часто это три витамина, витамин А , витамин С и витамин Е и полифенольные антиоксиданты . Кроме того, есть хорошие доказательства, свидетельствующие о том, что билирубин и мочевая кислота могут действовать как антиоксиданты, чтобы помочь нейтрализовать определенные радикалы. Билирубин происходит из -за разрушения содержания эритроцитов , в то время как мочевая кислота является изготовлением пробивки пуринов . Слишком много билирубина, однако, может привести к желтухи , которая может в конечном итоге повредить центральную нервную систему, в то время как слишком много мочевой кислоты вызывает подагра . [ 18 ]
Реактивные виды кислорода
[ редактировать ]Реактивные формы кислорода или АФК являются видами, такими как супероксид , перекись водорода и гидроксильные радикалы , обычно связанные с повреждением клеток. АФК образуются как естественный побочный продукт нормального метаболизма кислорода и играют важную роль в передаче сигналов клеток. Двумя важными радикалами, ориентированными на кислород, являются супероксид и гидроксильные радикалы . Они вытекают из молекулярного кислорода в условиях восстановления. Однако из -за их реакционной способности эти же радикалы могут участвовать в нежелательных побочных реакциях, приводящих к повреждению клеток. Чрезмерное количество этих радикалов может привести к повреждению клеток и смерти , что может способствовать многим заболеваниям, таким как рак , инсульт , инфаркт миокарда , диабет и основные расстройства. [ 19 ] Считается, что многие формы рака являются результатом реакций между радикалами и ДНК , что потенциально приводит к мутациям , которые могут отрицательно влиять на клеточный цикл и потенциально привести к злокачественности. [ 20 ] Некоторые из симптомов старения , таких как атеросклероз, также связаны с радикальным индуцированным окислением холестерина до 7-кетохолестерина. [ 21 ] Кроме того, радикалы способствуют алкоголем , вызванным повреждению печени , возможно, больше, чем сам алкоголь. Радикалы, продуцируемые сигаретным дымом , вовлечены в инактивацию альфа 1-антитрипсина в легком . Этот процесс способствует развитию эмфиземы .
оксибензон Было обнаружено, что образует радикалы при солнечном свете и, следовательно, также может быть связан с повреждением клеток. Это произошло только тогда, когда он был в сочетании с другими ингредиентами, обычно встречающимися в солнцезащитных кремах, таких как оксид титана и октил метоксициннамат . [ 22 ]
АФК атакует полиненасыщенную жирную кислоту , линолевую кислоту , образуя серию из продуктов 13-гидроксиоктадекадиеновой кислоты и 9-гидроксиоктадекадиеновой кислоты , которые служат сигнальными молекулами, которые могут вызывать ответы, противопоставляющие травму ткани, что вызвало их образование. АФК атакует другие полиненасыщенные жирные кислоты, например, арахидоновую кислоту и докозагексаеновую кислоту , чтобы получить аналогичную серию сигнальных продуктов. [ 23 ]
Реактивные формы кислорода также используются в контролируемых реакциях, включающих диоксиген синглета типа фотоооксигенации Известный как реакции Декстера после переноса энергии ( Аннигиляция триплета ) и тройное возбужденное состояние фотосенсибилизатора. Типичные химические преобразования с этими видами диоксигена синглета включают, среди прочего, превращение целлюлозной биовасте в новые пойлметиновые красители. [ 24 ]
История и номенклатура
[ редактировать ]
До конца 20 -го века слово «радикал» использовалось в химии, чтобы указать любую подключенную группу атомов, таких как метильная группа или карбоксил , будь то часть более крупной молекулы или молекулы самостоятельно. Радикал часто известен как R. группа Затем был необходим квалификатор «бесплатный» для указания несвязанного случая. После недавних изменений номенклатуры часть более крупной молекулы теперь называется функциональной группой или заместителем , и «радикал» теперь подразумевает «свободный». Тем не менее, старая номенклатура все еще может появиться в некоторых книгах.
Термин радикал уже использовался, когда была разработана устаревшая радикальная теория . Луи-Бернард Гайтон де Морво представил фразу «радикал» в 1785 году, и эта фраза была использована Антуан Лавуазье в 1789 году в его The Elementaire de Chimie . Затем был идентифицирован радикал как корневое основание определенных кислот (латинское слово «radix», что означает «корень»). Исторически термин радикал в радикальной теории также использовался для связанных частей молекулы, особенно когда они остаются неизменными по реакциям. Теперь они называются функциональными группами . Например, метиловый спирт был описан как состоящий из метила «радикала» и гидроксильного «радикала». Ни один из них не являются радикалами в современном химическом смысле, так как они постоянно связаны друг с другом и не имеют непарных реактивных электронов; Тем не менее, их можно наблюдать в виде радикалов в масс -спектрометрии , когда разбивается на части путем облучения энергетическими электронами.
В современном контексте первым органическим (содержащим углеродом) идентифицированным радикалом был трифенилметиловый радикал , (C 6 H 5 ) 3 C • Полем Этот вид был обнаружен Моисеем Гомбергом в 1900 году. В 1933 году Моррис С. Хараш и Фрэнк Майо предложили, чтобы свободные радикалы были ответственны за борьбу против Марковникова в добавление бромида водорода к бромиду аллил . [ 25 ] [ 26 ]
В большинстве областей химии историческое определение радикалов утверждает, что молекулы имеют ненулевое электронное вращение. Однако в полях, включая спектроскопию и астрохимию , определение немного отличается. Герхард Херцберг , получивший Нобелевскую премию за исследование электронов и геометрию радикалов, предложил более слабое определение свободных радикалов: «Любые временные (химически нестабильные) виды (атом, молекула или ион)». [ 27 ] Основной момент его предположения состоит в том, что существует много химически нестабильных молекул, которые имеют нулевое вращение, такие как C 2 , C 3 , CH 2 и так далее. Это определение более удобно для обсуждений переходных химических процессов и астрохимии; Поэтому исследователи в этих областях предпочитают использовать это свободное определение. [ 28 ]
Изображение в химических реакциях
[ редактировать ]В химических уравнениях радикалы часто обозначаются точкой, расположенной непосредственно справа от атомного символа или молекулярной формулы следующим образом:
Радикальные механизмы реакции используют одноголовые стрелки для изображения движения отдельных электронов:

Гомолитическое . расщепление разбивающейся связи нарисовано стрелкой для «рыбного крючка», чтобы отличить обычное движение двух электронов, изображенных стандартной вьющейся стрелкой Второй электрон разбитой связи также перемещается в сочетании с атакующим радикальным электроном.
Радикалы также участвуют в радикальной добавлении и радикальной замене в качестве реактивных промежуточных соединений . Цепные реакции с участием радикалов обычно могут быть разделены на три различных процесса. Это инициация , распространение и прекращение .
- Реакции инициации - это те, которые приводят к чистому увеличению количества радикалов. Они могут включать образование радикалов из стабильных видов, как в реакции 1 выше, или они могут включать реакции радикалов со стабильными видами с образованием большего количества радикалов.
- Реакции распространения - это те реакции, включающие радикалы, в которых общее количество радикалов остается неизменным.
- Реакции завершения - это те реакции, приводящие к чистому уменьшению количества радикалов. Как правило, два радикала объединяются, например, более стабильный вид:
- 2 кл • → CL 2
Смотрите также
[ редактировать ]- Электронная пара
- Глобально гармонизированная система классификации и маркировки химических веществ
- Hofmann - Реакция Löffler
- Свободное радикальное исследование
Ссылки
[ редактировать ]- ^ IUPAC Gold Book Radical (свободный радикал) PDF Архивировал 2017-03-02 на машине Wayback
- ^ Hayyan, M.; Хашим, Массачусетс; Anjkut, IM (2016). «Супероксид ион: генерация и химические последствия» . Химический Преподобный 116 (5): 3029–85. doi : 10.1021/acs.chemrev.5b00407 . PMID 26875845 .
- ^ Jump up to: а беременный в дюймовый Клейден, Джонатан; Гривз, Ник; Уоррен, Стюарт Г. (2012). Органическая химия (2 -е изд.). Оксфорд: издательство Оксфордского университета. ISBN 978-0-19-927029-3 Полем OCLC 761379371 .
- ^ "Диацил пероксиды" . polymerdatabase.com . Получено 2020-12-08 .
- ^ Gridnev, Alexei A.; Иттель, Стивен Д. (2001). «Передача каталитической цепи при полимеризации свободного радикала». Химические обзоры . 101 (12): 3611–3660. doi : 10.1021/cr9901236 . PMID 11740917 .
- ^ Монро, Брюс М.; Weed, Грегори С. (1993). «Фотоинициаторы для систем фотоизображения свободных радикал». Химические обзоры . 93 : 435–448. doi : 10.1021/cr00017a019 .
- ^ Su, Wei-Fang (2013), Su, Wei-Fang (ed.), «Полимеризация радикальной цепи», принципы дизайна и синтеза полимеров , лекционные заметки в химии, вып. 82, Берлин, Гейдельберг: Спрингер, с. 137–183, doi : 10.1007/978-3-642-38730-2_7 , ISBN 978-3-642-38730-2
- ^ Jump up to: а беременный Гриллер, Дэвид; Инголд, Кит У. (1976). «Постоянные углеродные радикалы». Счета химических исследований . 9 : 13–19. doi : 10.1021/ar50097a003 .
- ^ Jump up to: а беременный Forrester, AR (1968). Органическая химия стабильных свободных радикалов . Лондон: академическая пресса. С. 1–6.
- ^ Окли, Ричард Т. (1988). «Циклические и гетероциклические тиазены» (PDF) . Прогресс в неорганической химии . Циклические и гетероциклические тиазены (раздел). Тол. 36. С. 299–391. doi : 10.1002/9780470166376.ch4 . ISBN 978-0-470-16637-6 Полем Архивировано из оригинала (PDF) 2015-09-23 . Получено 2011-03-31 .
- ^ Rawson, J; Банистер, а; Лаванда, я (1995). Химия дитиадиазолилиум и дитиадиазолил-колец **, посвященная доктору Зва-Хауптману, в оценке его важного вклада в химию серы-азота и углерод-сульфур-азота . Достижения в области гетероциклической химии. Тол. 62. С. 137–247. doi : 10.1016/s0065-2725 (08) 60422-5 . ISBN 978-0-12-020762-6 .
- ^ Однако парамагнетизм не обязательно подразумевает радикальный характер.
- ^ Линде, С.; Åkermark, B.; Норрби, П.-О.; Свенссон М. (1999). «Время имеет решающее значение: влияние спиновых изменений на диастереоселективность в эпоксидировании Mn (Сален)». Журнал Американского химического общества . 121 (21): 5083–84. doi : 10.1021/ja9809915 .
- ^ Бродерик, JB; Duffus, Br; Duschene, KS; Шепард, Эм (2014). «Радикальные S-аденозилметиониновые ферменты» . Химические обзоры . 114 (8): 4229–317. doi : 10.1021/cr4004709 . PMC 4002137 . PMID 24476342 .
- ^ Pacher P, Beckman JS, Liaudet L (2007). «Оксид азота и пероксинитрит в здоровье и заболеваниях» . Физиол. Преподобный 87 (1): 315–424. doi : 10.1152/physrev.00029.2006 . PMC 2248324 . PMID 17237348 .
- ^ Njie-mbye, ya fatou; Кулкарни-Читнис, Мадхура; Opere, Кэтрин А.; Барретт, Аарон; Ohia, Sunny E. (2013). «Перекисное окисление липидов: патофизиологические и фармакологические последствия в глаза» . Границы в физиологии . 4 : 366. DOI : 10.3389/fphys.2013.00366 . PMC 3863722 . PMID 24379787 .
- ^ Флойд, Р.А. (1999). «Нейроинфлярирующие процессы важны при нейродегенеративных заболеваниях: гипотеза, объясняющая повышенное образование реактивного кислорода и видов азота в качестве основных факторов, связанных с развитием нейродегенеративных заболеваний». Свободная радикальная биология и медицина . 26 (9–10): 1346–55. doi : 10.1016/s0891-5849 (98) 00293-7 . PMID 10381209 .
- ^ Обзор роли радикалов в биологии и использования электронного спинового резонанса в их обнаружении может быть найден в Rhodes CJ (2000). Токсикология окружающей среды человека - критическая роль свободных радикалов . Лондон: Тейлор и Фрэнсис. ISBN 978-0-7484-0916-7 .
- ^ Раджамани Картикеян; Манивасагам Т; Anantharaman P; Баласубраманян T; Somasundaram St (2011). «Химиопрофилактическое влияние экстрактов Падины Бугесении на нитрилотриаковое (Fe-NTA), индуцированное окислительным повреждением, у крыс Wistar». J. Appl. Фикол . 23 (2): 257–63. doi : 10.1007/s10811-010-9564-0 . S2CID 27537163 .
- ^ Мукерджи, PK; Marcheselli, VL; Серхан, CN; Bazan, NG (2004). «Нейропротецин D1: докосагексановая кислота, полученный из докозагексановой кислоты, защищает эпителиальные клетки пигментов сетчатки человека от окислительного стресса» . Труды Национальной академии наук США . 101 (22): 8491–96. Bibcode : 2004pnas..101.8491m . doi : 10.1073/pnas.0402531101 . PMC 420421 . PMID 15152078 .
- ^ Лион, Массачусетс; Браун, AJ (1999). «7-кетохолестерин». Инт. J. Biochem. Клеточная биол . 31 (3–4): 369–75. doi : 10.1016/s1357-2725 (98) 00123-x . PMID 10224662 .
- ^ Serpone, n; Салинаро, а; Emeline, Av; Horikoshi, S; Hidaka, H; Чжао, JC (2002). «Систематическое спектроскопическое исследование in vitro на фотостабильности случайных наборов коммерческих лосьонов солнцезащитного крема и их химических активных агентов UVB/UVA». Фотохимические и фотобиологические науки . 1 (12): 970–81. doi : 10.1039/b206338g . PMID 12661594 . S2CID 27248506 .
- ^ Njie-mbye, ya fatou; Кулкарни-Читнис, Мадхура; Opere, Кэтрин А.; Барретт, Аарон; Ohia, Sunny E. (2013). «Перекисное окисление липидов: патофизиологические и фармакологические последствия в глаза» . Границы в физиологии . 4 : 366. DOI : 10.3389/fphys.2013.00366 . PMC 3863722 . PMID 24379787 .
- ^ Десвалы, Артур; Фортино, Мариагразия; Lefebvre, Corentin; Родье, Иоганн; Мишлен, Климент; Алиуи, Сами; Руссет, Элоди; Педоне, Альфонсо; Lemercier, Жиль; Хоффманн, Норберт (2022-05-16). «Синтез и характеристика полиметиновых красителей, несущих тиобарбитурические и карбоновые кислоты» (PDF) . Новый журнал химии . 46 (19): 8971–8980. doi : 10.1039/d2nj00684g . ISSN 1369-9261 . S2CID 248165785 .
- ^ Kharasch, MS (1933). «Эффект перекиси при добавлении реагентов к ненасыщенным соединениям. I. добавление водородного бромида к аллил бромид». Журнал Американского химического общества . 55 (6): 2468–2496. doi : 10.1021/ja01333a041 .
- ^ Ян, м; LO, JC; Эдвардс, JT; Баран, PS (2016). «Радикалы: реактивные промежуточные соединения с трансляционным потенциалом» . J Am Chem Soc . 138 (39): 12692–12714. doi : 10.1021/jacs.6b08856 . PMC 5054485 . PMID 27631602 .
- ^ Г. Герцберг (1971), «Спектры и структуры простых свободных радикалов», ISBN 0-486-65821-X .
- ^ 28-й Международный симпозиум о свободных радикалах Архивировал 2007-07-16 на машине Wayback .




![{\ displaystyle {\ ce {cfcs-> [h \ nu] cl^{\ bullet}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bdfdc999e29261e922e3863cdfa3b4bf84fb5a2)

![{\ displayStyle {\ что {o3 -> [h \ n] o + o2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd85b4a5f671e0a421576bf91c3352bec070c1)

![{\ DisplayStyle {\ What {2O3 -> [H \ na] 3O2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afc621f0abb1c9cfc08b3cf82f43d9fc60a29c40)


