13-гидроксиоктадекадиеновая кислота
| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
(9 Z , 11 E , 13 S )-13-Гидроксиоктадека-9,11-диеновая кислота | |
| Другие имена
ГОЛОВКА 13(S), ГОЛОВКА 13S
| |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| КЭБ |
|
| ХЭМБЛ |
|
| ХимическийПаук | |
| КЕГГ |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 18 Н 32 О 3 | |
| Молярная масса | 296.451 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
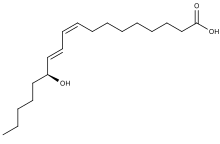
13-Гидроксиоктадекадиеновая кислота ( 13-HODE ) — это обычно используемый термин для обозначения 13( S )-гидрокси-9 Z ,11 E -октадекадиеновой кислоты (13( S )-HODE). Производство 13( S )-ОДЭ часто сопровождается образованием его стереоизомера , 13( R )-гидрокси-9 Z ,11 E -октадекадиеновой кислоты (13( R )-НОДЭ). На соседнем рисунке показана структура ( S ) стереоизомера 13-HODE. Два других встречающихся в природе 13-HODE, которые могут сопровождать образование 13( S )-HODE, представляют собой его цис-транс (т.е. 9E , 11E ) изомеры, а именно 13( ) -гидрокси- 9E , 11E- S октадекадиеновая кислота (13( S ) -EE -HODE) и 13( R )-гидрокси-9 E ,11 E -октадекадиеновая кислота (13( R ) -EE -HODE). Исследования подтверждают, что 13( S )-HODE обладает рядом клинически значимых биологических активностей; недавние исследования установили, что активность 13( R )-HODE отличается от активности 13( S )-HODE; и другие исследования предположили, что один или несколько из этих HODE опосредуют физиологические и патологические реакции, являются маркерами различных заболеваний человека и/или способствуют прогрессированию определенных заболеваний у людей. Однако, поскольку многие исследования по идентификации, количественной оценке и действию 13( S )-HODE в клетках и тканях использовали методы, которые не различали эти изомеры. 13-HODE используется здесь, когда фактический изучаемый изомер неясен.
Аналогичный набор метаболитов 9-гидроксиоктадекадиеновой кислоты (9-HODE) (т.е. 9(S)-HODE), 9(R)-HODE, 9(S)-EE-HODE) и 9(R)-EE- HODE) возникает в природе и особенно в условиях окислительного стресса, образующегося одновременно с 13-HODE; 9-HODE имеют перекрывающуюся и дополняющую, но не идентичную деятельность с 13-HODE. Некоторые недавние исследования, измеряющие уровни HODE в тканях, объединили четыре 9-HODE с четырьмя 13-HODE, чтобы сообщить только об общем количестве HODE (tHODE). Было предложено, чтобы tHODE были маркерами некоторых заболеваний человека. Другие исследования объединили 9-( S ), 9( R ), 13( S )- и 13( R )-ОДЭ вместе с двумя кетоновыми метаболитами этих ОДЭ, 13-оксоОДЭ (13-оксо-9 Z ,12 E -октадекадиеновая кислота) и 9-оксоODE, сообщающие только об общем количестве OXLAM (окисленных метаболитов линолевой кислоты); OXLAM участвуют в совместной работе, сигнализируя о восприятии боли.
Пути создания 13-HODE
[ редактировать ]15-липоксигеназа 1
[ редактировать ]15-липоксигеназа 1 ( ALOX15 ), наиболее известная тем, что превращает 20-углеродную полиненасыщенную жирную кислоту , арахидоновую кислоту , в серию 15-гидроксилированных метаболитов арахидоновой кислоты (см. 15-гидроксикозатетраеновую кислоту ), на самом деле предпочитает в качестве своего субстрата 18-углеродную полиненасыщенную кислоту. жирную кислоту, линолевую кислоту , над арахидоновой кислотой, превращая ее в 13-гидроперокси-9 Z ,11 E -октадекадиеновую кислоту (13-HpODE). [ 1 ] [ 2 ] Фермент действует очень стереоспецифично, образуя 13( S )-гидроперокси-9 Z ,11E - октадекадиеновую кислоту (13( S )-HpODE), но сравнительно мало или вообще не образует 13( R )-гидроперокси-9 Z ,11E . -октадекадиеновая кислота (13( R )-HpODE)-. [ 3 ] [ 4 ] В клетках 13( S )-HpODE быстро восстанавливается пероксидазами до 13( S )-HODE. [ 1 ] [ 5 ] ALOX15 полностью способен метаболизировать линолевую кислоту, связанную с фосфолипидом. [ 6 ] или холестерин [ 7 ] с образованием 13(S)-HpODE-связанных фосфолипидов и холестерина, которые быстро превращаются в соответствующие им 13(S)-HODE-связанные продукты.
15-липоксигеназа 2
[ редактировать ]15-липоксигеназа типа 2 ( ALOX15B ) явно предпочитает арахидоновую кислоту линолевой кислоте и, как следствие, относительно плохо метаболизирует линолевую кислоту до 13( S )-HpODE (который затем превращается в 13( S )-HODE) по сравнению с 15-липоксигеназой. 1; [ 8 ] тем не менее, он может способствовать выработке этих метаболитов. [ 2 ] [ 9 ]
Циклооксигеназы 1 и 2
[ редактировать ]Циклооксигеназа 1 (ЦОГ-1) и циклооксигеназа 2 (ЦОГ-2) метаболизируют линолевую кислоту до 13(S)-HODE, причем ЦОГ-2 проявляет большее предпочтение линолевой кислоте и, следовательно, производит гораздо больше этого продукта, чем его аналог ЦОГ-1. ; [ 10 ] следовательно, ЦОГ-2, по-видимому, является основным ЦОГ, образующим 13( S )-HODE в клетках, экспрессирующих оба фермента. [ 11 ] Одновременно с производством 13( S )-HODE эти ферменты также производят меньшие количества 9( R )-HODE. [ 12 ] [ 11 ]
Цитохром P450
[ редактировать ]ферменты цитохрома P450 Микросомальные метаболизируют линолевую кислоту до смеси 13-HODE и 9-HODE; эти реакции приводят к образованию рацемических смесей, в которых преобладает стереоизомер R , например, при соотношении R / S 80%/20% как для 13-HODE, так и для 9-HODE в микросомах печени человека. [ 13 ] [ 14 ] [ 15 ]
Свободнорадикальное и синглетное окисление кислорода
[ редактировать ]Окислительный стресс в клетках и тканях вызывает свободнорадикальное и синглетное кислородное окисление линолевой кислоты с образованием 13-HpODE, 9-HpODE, 13-HODE и 9-HODE; эти неферментативные реакции производят или предполагают, но не доказано, что они производят примерно равные количества их S- и R -стереоизомеров. [ 16 ] [ 17 ] [ 18 ] Свободнорадикальное окисление линолевой кислоты также приводит к образованию 13-EE-HODE, 9-гидрокси-10 E , 12 -E октадекадиеновой кислоты, 9-гидрокси-10 E , 12 -Z -октадекадиеновой кислоты и 11-гидрокси-9 Z. - 12 Z -октадекадиеновая кислота при атаке синглетного кислорода на линолевую кислоту образует (предположительно) рацемические смеси 9-гидрокси-10 E , 12 -Z -октадекадиеновой кислоты, 10-гидрокси-8 E , 12 Z -октадекадиеновой кислоты и 12-гидрокси. -9 Z -13- E -октадекадиеновая кислота. [ 19 ] 4-Гидроксиноненаль (т.е. 4-гидрокси-2Е - ноненаль или HNE) также является продуктом перекисного окисления 13-HpODE. [ 20 ] Поскольку окислительный стресс обычно приводит к образованию как свободных радикалов, так и синглетного кислорода, большая часть или все эти продукты могут образовываться вместе в тканях, подвергающихся окислительному стрессу. Свободнорадикальное и синглетное окисление линолевой кислоты приводит к образованию аналогичного набора метаболитов 13-HODE (см. 9-гидроксиоктадекадиеновая кислота ). Исследования показывают, что эти окисления вносят основной вклад в выработку 13-HODE в тканях, подвергающихся окислительному стрессу, в том числе у людей в очагах воспаления, стеатогепатите , сердечно-сосудистыми заболеваниями бляшках , связанных с атеромных , нейродегенеративных заболеваниях и т. д. (см. окислительный стресс ). [ 21 ] [ 19 ]
Метаболизм 13( S )-HODE
[ редактировать ]Как и большинство полиненасыщенных жирных кислот и моногидроксильных полиненасыщенных жирных кислот, 13( S )-HODE быстро и количественно включается в фосфолипиды ; [ 22 ] уровни 13( S )-HODE, этерифицированного в sn-2 -положении фосфатидилхолина , фосфатидилинозитола и фосфатидилэтаноламина , в поражениях псориаза человека значительно ниже, чем в нормальной коже; этот путь укорочения цепи может быть ответственен за инактивацию 13( S )-HODE. [ 23 ] 13( S )-HODE также метаболизируется посредством пероксисомо -зависимого β-окисления с образованием 16-, 14- и 12-углеродных продуктов с укороченной цепью, которые высвобождаются из клетки; [ 24 ] этот путь укорочения цепи может служить для инактивации и утилизации 13( S )-HODE.
13( S )-HODE окисляется до 13-оксо-9 Z ,11 E -октадекадиеновой кислоты (13-оксо-HODE или 13-oxoODE) NAD+ -зависимой 13-HODE дегидрогеназой, белок которой частично очищен. из толстой кишки крысы. [ 25 ] [ 26 ] [ 27 ] Образование 13-оксо-ОДЭ может представлять собой первый этап 13( S )-ОДЭ, но у 13-оксо-ОДЭ есть свои области биологического значения: он накапливается в тканях, пероксисомозависимого укорочения цепи [ 28 ] [ 29 ] является биоактивным, [ 30 ] [ 31 ] и может иметь клиническое значение в качестве маркера [ 32 ] [ 33 ] и потенциальный участник [ 33 ] болезнь человека. Сам 13-оксо-ОДЭ может реагировать с глутатионом в неферментативной реакции Михаэля или в реакции, зависящей от глутатионтрансферазы , с образованием продуктов 13-оксо-ОДЭ, содержащих 11 транс-двойную связь и глутатион, присоединенный к углероду 9 в смеси S и R диастереомеры ; эти два диастереомера являются основными метаболитами 13( S )-HODE в культивируемых клетках рака толстой кишки человека HT-29 . [ 34 ] Эксплантаты слизистой оболочки толстой кишки крыс Sprague-Dawley и клетки рака толстой кишки человека HT29 добавляют глутатион к 13-оксо-ODE в реакции Михаэля с образованием 13-оксо-9-глутатион-11( E )-октадеценовой кислоты; эта реакция конъюгации, по-видимому, является ферментативной и опосредована глутатионтрансферазой . [ 35 ] [ 36 ] Поскольку этот конъюгат может быть быстро экспортирован из клетки и его биологическая активность еще не охарактеризована, неясно, выполняет ли эта трансферазная реакция какую-либо функцию, кроме удаления 13-оксо-ОДЭ из клетки для ограничения ее активности. [ 34 ]
Деятельность
[ редактировать ]Стимуляция рецепторов, активируемых пролифератором пероксисом
[ редактировать ]13-HODE, 13-oxoODE и 13-EE-HODE (наряду с их аналогами 9-HODE) напрямую активируют гамма-рецептор, активирующий пролифератор пероксисомы (PPARγ). [ 37 ] [ 38 ] [ 39 ] Эта активация, по-видимому, отвечает за способность 13-HODE (и 9-HODE) индуцировать транскрипцию PPARγ-индуцируемых генов в моноцитах человека , а также стимулировать созревание этих клеток в макрофаги . [ 37 ] 13( S )-HODE (и 9( S )-HODE) также стимулируют активацию бета-рецептора, активируемого пролифератором пероксисом (PPARβ), в модельной клеточной системе; Предполагается, что 13-HODE (и 9-HODE) также способствуют способности окисленного липопротеина низкой плотности (ЛПНП) активировать PPARβ1: ЛПНП, содержащие связанный с фосфолипидами 13-HODE (и 9-HODE), поглощаются клеткой. а затем под действием фосфолипаз высвобождаются HODE, которые, в свою очередь, напрямую активируют PPARβ1. [ 40 ]
Стимуляция рецептора TRPV1
[ редактировать ]13( S )-HODE, 13( R )-HODE и 13-oxoODE вместе со своими аналогами 9-HODE также действуют на клетки через TRPV1 . TRPV1 представляет собой рецептор члена 1 подсемейства V катионного канала временного рецепторного потенциала (также называемый рецептором капсаицина или ваниллоидным рецептором 1). Эти 6 HODE, получившие название окисленных метаболитов линолевой кислоты (OXLAM), индивидуально, но также и, возможно, в большей степени, действуя вместе, стимулируют TRPV1-зависимые реакции в нейронах грызунов, эпителиальных клетках бронхов грызунов и человека, а также в модельных клетках, предназначенных для экспрессии TRPV1 грызуна или человека. Эта стимуляция возникает из-за прямого взаимодействия этих агентов с TRPV1, хотя отчеты расходятся в отношении эффективности (OXLAM), например, с самым мощным OXLAM, 9( S )-HODE, требующим не менее 10 микромоль/литр. [ 41 ] или более физиологическая концентрация 10 наномоль/литр. [ 30 ] для активации TRPV1 в нейронах грызунов. Считается, что взаимодействие OXLAM-TRPV1 обеспечивает ощущение боли у грызунов (см. Ниже).
Стимуляция рецептора GPR132
[ редактировать ]13( S )-HpODE и 13( S )-HODE напрямую активируют GPR132 человека (но не мыши) (рецептор 132, связанный с G-белком, также называемый G2A) в клетках яичника китайского хомячка, предназначенных для экспрессии этих рецепторов; однако они являются гораздо более слабыми активаторами GPR132, чем 9( S )-HpODE или 9( S )-HODE. [ 42 ] [ 43 ] GPR132 первоначально был описан как рецептор, чувствительный к pH; роль(и) 13( S )-HpODE и 13( S )-HODE, а также 9( S )-HpODE, 9( S )HODE и ряда или GPR132-активирующих арахидоновой кислоты гидроксиметаболитов (т.е. HETE) в активации G2A при физиологических и патологических состояниях, в которых участвует G2A (перечень этих состояний см. в GPR132 ), еще не определено. Это определение, поскольку оно могло бы быть применимо к людям, затруднено из-за неспособности этих HODE активировать GPR132 грызунов и, следовательно, быть проанализированным на моделях грызунов.
Участие в деградации митохондрий
[ редактировать ]При созревании линии эритроцитов (см. Эритропоэз ) от митохондриально -несущих ретикулоцитов до зрелых безмитохондриальных эритроцитов у кроликов митохондрии накапливают в своих мембранах фосфолипид -связанный 13( S )-HODE за счет действия липоксигеназы, которая (у кроликов, мышей и других субприматных позвоночных) непосредственно метаболизирует фосфолипид, связанный с линолевой кислотой, до 13( S )-HpODE-связанного фосфолипида, который быстро восстанавливается до 13( S )-HODE-связанного фосфолипида. [ 44 ] Предполагается, что накопление связанных с фосфолипидами 13( S )-HpODE и/или 13( S )-HODE является критическим шагом в повышении проницаемости митохондрий, тем самым запуская их деградацию и, следовательно, созревание в эритроциты. [ 44 ] [ 45 ] Однако функциональная инактивация гена липоксигеназы, атакующей фосфолипиды, у мышей не вызывает серьезных нарушений эритропоэза. [ 46 ] Предполагается, что деградация митохондрий происходит по крайней мере через два резервных пути, помимо того, который запускается липоксигеназно-зависимым образованием 13( S )-HpODE- и 13( S )-HODE-связанных фосфолипидов, а именно: митохондриальное расщепление посредством аутофагии и митохондриального экзоцитоза . [ 47 ] В любом случае образование 13( S )-HODE, связанного с фосфолипидом в митохондриальных мембранах, является одним из путей, благодаря которому они становятся более проницаемыми и, таким образом, подвергаются деградации и, как следствие высвобождения вредных элементов, вызывают повреждение клеток. [ 48 ]
Стимуляция лейкоцитов крови
[ редактировать ]13-HODE (и 9-HODE) являются умеренно сильными стимуляторами направленной миграции (т.е. хемотаксиса коровы и человека ) нейтрофилов in vitro. [ 49 ] тогда как 13( R )-HODE (а также 9( R )-HODE и 9( S )-HODE) являются слабыми стимуляторами направленной in vitro миграции цитотоксических и потенциально повреждающих ткани лимфоцитов человека , т.е. естественных клеток-киллеров . [ 50 ] Эти эффекты могут способствовать провоспалительному и повреждающему ткани действию, приписываемому 13-HODE (и 9-HODE).
Участие в заболеваниях человека
[ редактировать ]Атеросклероз
[ редактировать ]При атеросклерозе , основной причине ишемической болезни сердца и инсультов , атероматозные бляшки накапливаются в интиме сосудистой оболочки, тем самым сужая размер кровеносных сосудов и уменьшая кровоток. На животных моделях и у людей 13-HODE (в основном этерифицированный до холестерина , фосфолипидов и, возможно, других липидов) является доминирующим компонентом этих бляшек. [ 51 ] [ 52 ] [ 53 ] [ 54 ] Поскольку эти исследования показали, что на ранних стадиях развития бляшек 13-HODE состоит в основном из стереоизомера S , тогда как более зрелые бляшки содержат равные количества стереоизомеров S и R , было высказано предположение, что 15-LOX-1 способствует раннему накоплению, в то время как цитохром и/или пути свободных радикалов способствует более позднему накоплению бляшек. Дальнейшие исследования показывают, что 13( S )-HODE способствует образованию бляшек путем активации фактора транскрипции , а PPARγ (13( R )-HODE лишен этой способности. [ 55 ] ), что, в свою очередь, стимулирует выработку двух рецепторов на поверхности макрофагов , находящихся в бляшках: 1) CD36 , рецептора-поглотителя окисленных липопротеинов низкой плотности, нативных липопротеинов, окисленных фосфолипидов и длинноцепочечных жирных кислот, и 2) белок адипоцитов 2 (aP2), белок, связывающий жирные кислоты; это может привести к увеличению поглощения макрофагами этих липидов, переходу к нагруженным липидами пенистым клеткам и тем самым к увеличению размера бляшек. [ 56 ] Ось 13( S )-HODE/PPARγ также вызывает саморазрушение макрофагов путем активации путей, индуцирующих апоптоз ; этот эффект также может способствовать увеличению размера бляшек. [ 57 ] Эти исследования показывают, что метаболические пути, продуцирующие 13-HODE, [ 56 ] ППАРγ, [ 56 ] [ 57 ] CD36, [ 58 ] и ап2 [ 59 ] могут быть терапевтическими мишенями для лечения заболеваний, связанных с атеросклерозом. Действительно, статины , которые, как известно, подавляют синтез холестерина путем ингибирования фермента пути синтеза холестерина, 3-гидрокси-3-метилглутарил-КоА-редуктазы HMG-CoA-редуктазы , широко используются для предотвращения атеросклероза и заболеваний, связанных с атеросклерозом. Статины также ингибируют PPARγ в макрофагах человека, эндотелиальных клетках сосудов и гладкомышечных клетках; это действие может способствовать их антиатерогенному эффекту. [ 60 ]
Астма
[ редактировать ]У морских свинок 13( S )-HODE при внутривенном введении вызывает сужение дыхательных путей в легких, а при вдыхании в виде аэрозоля имитирует астматическую гиперчувствительность к агентам, вызывающим бронхоспазм , за счет усиления реакции сужения дыхательных путей на метахолин и гистамин . [ 61 ] В мышиной модели астмы, вызванной аллергеном, уровни 13-HODE повышены. [ 62 ] в последней мышиной модели инъекция антитела, направленного против 13( S )-HODE, уменьшала многие патологические и физиологические особенности астмы. [ 48 ] у мышей, которых заставили сверхэкспрессировать в легких мышиный фермент (12/15-липоксигеназу), который метаболизирует линолевую кислоту до 13( S )-HODE, наблюдались повышенные уровни этого метаболита в легких, а также различные патологические и физиологические особенности астмы, [ 62 ] и введение 13( S )HODE воспроизводило многие из этих особенностей астмы, [ 48 ] В мышиной модели астмы и при заболевании человека эпителиальные клетки дыхательных путей легких демонстрируют различные патологические изменения, включая разрушение их митохондрий. [ 48 ] [ 62 ] [ 63 ] 13( S )-HODE вызывает аналогичные разрушительные изменения в митохондриях культивируемых эпителиальных клеток дыхательных путей человека Beas 2B. [ 48 ] Кроме того, у людей, страдающих астмой, наблюдаются повышенные уровни 13-HODE в крови, мокроте и смывах из альвеол легких (т.е. жидкости бронхоальвеолярного лаважа БАЛ), а эозинофилы человека , которые участвуют в развитии астмы у человека, метаболизируют линолевую кислоту до 13 -HODE (и 9-HODE) в гораздо большей степени, чем любой другой тип лейкоцитов . [ 64 ] Механизм, ответственный за воздействие 13-HODE на эпителиальные клетки дыхательных путей, может включать активацию им рецептора TRPV1 (см. предыдущий раздел о TRPV1): этот рецептор высоко экспрессируется в эпителиальных клетках дыхательных путей мыши и человека, а также в эпителиальных клетках дыхательных путей человека Beas 2B и, кроме того, подавление экспрессии TRPV1, а также ингибитор рецептора TPRV1 (капсазепан) блокируют реакцию дыхательных путей мышей на 13(S)-HODE. [ 48 ] Хотя необходима дальнейшая работа, эти доклинические исследования позволяют предположить, что 13( S )-HODE, вырабатываемый, по крайней мере частично, эозинофилами и действующий через TRPV1, может быть ответственен за повреждение дыхательных путей, которое возникает при более тяжелых формах астмы и бронхиальной астме. что фармакологические ингибиторы TRPV1 могут в конечном итоге оказаться полезным дополнением к лечению астмы.
Рак
[ редактировать ]Рак толстой кишки
[ редактировать ]Семейный аденоматозный полипоз — это синдром, который включает в себя склонность к развитию колоректального рака (и других видов рака) из-за наследования дефектных мутаций либо в гене APC ( аденоматозный полипоз coli ), либо в гене MUTYH . Эти мутации приводят к ряду нарушений регуляции роста эпителиальных клеток толстой кишки, что в конечном итоге приводит к развитию кишечных полипов , которые имеют высокий риск превращения в рак. [ 65 ] Одним из отклонений, обнаруженных при заболевании APC, является прогрессивное снижение уровня 15-липоксигеназы 1 вместе с ее продуктом 13-HODE (предположительно, но не однозначно показано, что это S -стереоизомер) по мере перехода заболевания толстой кишки от полипа к злокачественной стадии; 15-НЕТЕ, 5-липоксигеназа, 12-липоксигеназа и 15-липоксигеназа-2, а также отдельные метаболиты последних липоксигеназ не обнаруживают такой ассоциации. [ 66 ] [ 67 ] [ 68 ] Аналогичным образом избирательное снижение уровня 15-липоксигеназы 1 и 13-HODE происходит при ненаследственном раке толстой кишки. [ 69 ] [ 70 ] [ 66 ] 13( S )-HODE ингибирует пролиферацию и вызывает гибель ( апоптоз ) культивируемых клеток рака толстой кишки человека. [ 55 ] [ 69 ] [ 71 ] [ 70 ] Исследования на животных моделях также показывают, что ось 15-липоксигеназа 1/13-HODE ингибирует развитие лекарственно-индуцированного рака толстой кишки, а также рост эксплантатов клеток рака толстой кишки человека. [ 67 ] Эти результаты позволяют предположить, что 15-липоксигеназа 1 и ее продукт 13( S )-HODE являются факторами, способствующими развитию генетически-ассоциированного и неассоциированного рака толстой кишки; они действуют, способствуя подавлению развития и/или роста этого рака, а в случае уменьшения или отсутствия способствуют его безудержному злокачественному росту.
Рак молочной железы
[ редактировать ]13( S )-HODE стимулирует пролиферацию MCF-7 линий клеток рака молочной железы человека, положительных по рецептору эстрогена , и отрицательных по рецептору эстрогена MBA-MD-231 (см. Список клеточных линий рака молочной железы ) в культуре; [ 72 ] его производство, по-видимому, необходимо для эпидермального фактора роста и фактора роста опухоли α, чтобы стимулировать пролиферацию культивируемых клеток рака молочной железы человека BT-20. [ 73 ] рака молочной железы человека на мышах; ксенотрансплантатов и выращивание [ 74 ] и среди серии из 10 метаболитов полиненасыщенных жирных кислот, количественно определенных в ткани рака молочной железы человека, только 13-HODE (стереоизомер не определен) был значительно повышен при быстро растущих раковых заболеваниях по сравнению с медленно растущими. [ 72 ] Результаты этих исследований показывают, что 13( S )-HODE может способствовать росту рака молочной железы у людей.
Рак простаты
[ редактировать ]15-LOX 1 сверхэкспрессируется в раковой ткани простаты по сравнению с нераковой тканью простаты, и уровни его экспрессии в культивируемых различных клеточных линиях рака простаты человека положительно коррелируют со скоростью их пролиферации и увеличивают пролиферационный ответ клеток рака простаты на эпидермальный фактор роста. и инсулиноподобный фактор роста 1); его уровни в тканях рака простаты человека также положительно коррелируют с тяжестью рака, судя по шкале Глисона ; а сверхэкспрессия 15-LOX 1, по-видимому, не только увеличивает пролиферацию клеток рака простаты, но также способствует выживанию их клеток, стимулируя выработку инсулиноподобного фактора роста 1 и, возможно, изменяя путь клеточного апоптоза Bcl-2 , а также увеличивает опухоль простаты. васкуляризация и, следовательно, метастазирование путем стимуляции выработки фактора роста эндотелия сосудов . Эти эффекты 15-LOX 1 возникают из-за продукции ферментом 13( S )-HODE. [ 75 ] [ 76 ] [ 77 ] Ось 15-LOX 1/13( S )-HODE также способствует росту рака простаты на различных моделях животных. [ 78 ] [ 79 ] В одной модели на животных стимулирующий рост эффект 15-LOX 1 был изменен в результате диетического воздействия: увеличение содержания в пище линолевой кислоты, жирной кислоты омега-6 , способствовало, в то время как увеличение содержания в пище стеаридоновой кислоты, жирной кислоты омега-3, снижало рост. эксплантатов рака простаты человека. [ 80 ] Эти эффекты могут быть связаны со способностью диеты с линолевой кислотой увеличивать выработку метаболита 15-Lox 1, 13-HODE. [ 80 ] и способность стеаридоновой кислоты увеличивать выработку докозагексаеновой кислоты и 15-LOX-1 метаболитов докозагексаеновой кислоты, 17S-гидропероксидокоза-гекса-4Z,7Z,10Z,13 Z,15E,19Z-еноат(17 -ГпДГК, 17S-гидрокси-докозагекса-4Z,7Z,10Z,13Z,15E,19Z-еноат(17-HDHA), 10S,17S-дигидрокси-докозагекса-4Z,7Z,11E,13Z,15E,19Z-еноат(10,17 -diHDHA, протектин DX) и 7S,17S-дигидрокси-доксагекса-4Z,8E,10Z,13Z,15E,19Z-еноат (7,17-диHDHA, протектин D5), все из которых являются ингибиторами пролиферации культивируемых клеток рака простаты человека. [ 81 ] [ 82 ] [ 83 ]
Маркеры болезней
[ редактировать ]Уровни 13-HODE повышены по сравнению с соответствующим контролем в липопротеинах низкой плотности, выделенных у людей с ревматоидным артритом . [ 84 ] во фракции липопротеинов высокой плотности у больных сахарным диабетом , [ 85 ] в сыворотке крови лиц с поликистозом почек . [ 86 ] или хронический панкреатит, [ 87 ] и в плазме лиц с алкогольным и неалкогольным стеатогепатитом . [ 88 ] [ 89 ] Уровень общего количества HODE, включающего различные изомеры 13-HODE и 9-HODE, повышен в плазме и эритроцитах пациентов с болезнью Альцгеймера и в плазме, но не в эритроцитах пациентов с сосудистой деменцией по сравнению с нормальными добровольцами. [ 90 ] Дополнительную информацию см . в разделе о 9-гидроксиоктадекадиеновой кислоте , посвященном 9-HODE как маркерам заболеваний, связанных с окислительным стрессом. Эти исследования показывают, что высокие уровни HODE могут быть полезны для указания на наличие и прогрессирование указанных заболеваний. Однако, поскольку абсолютные значения HODE, обнаруженные в различных исследованиях, сильно различаются, поскольку уровни HODE варьируются в зависимости от потребления линолевой кислоты с пищей, поскольку HODE могут образовываться во время обработки тканей и поскольку аномальные уровни HODE не связаны с конкретным заболеванием, использование этих метаболитов в качестве маркеров не достигло клинической пользы. [ 21 ] [ 91 ] [ 92 ] [ 19 ] Маркеры HODE могут оказаться полезными в качестве маркеров конкретного заболевания, типа заболевания и/или прогрессирования заболевания в сочетании с другими маркерами заболеваний. [ 19 ] [ 93 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б Соберман, Р.Дж.; Харпер, Т.В.; Беттеридж, Д; Льюис, Р.А.; Остин, К.Ф. (1985). «Характеристика и разделение 5-липоксигеназы арахидоновой кислоты и липоксигеназы омега-6 линолевой кислоты (15-липоксигеназы арахидоновой кислоты) полиморфноядерных лейкоцитов человека» . Журнал биологической химии . 260 (7): 4508–15. дои : 10.1016/S0021-9258(18)89293-6 . ПМИД 3920219 .
- ^ Jump up to: а б Векслер, Аарон Т; Кеньон, Виктор; Дешам, Джошуа Д; Холман, Теодор Р. (2008). «Изменения субстратной специфичности ретикулоцитов и эпителиальных 15-липоксигеназ человека показывают регуляцию аллостерического продукта» . Биохимия . 47 (28): 7364–75. дои : 10.1021/bi800550n . ПМК 2603187 . ПМИД 18570379 .
- ^ Рейно, О; Делафорж, М; Баучер, Дж.Л.; Роккиччоли, Ф; Мансуи, Д. (1989). «Окислительный метаболизм линолевой кислоты лейкоцитами человека». Связь с биохимическими и биофизическими исследованиями . 161 (2): 883–91. дои : 10.1016/0006-291X(89)92682-X . ПМИД 2735926 .
- ^ Кюн, Хартмут; Барнетт, Джим; Грюнбергер, Дорит; Беккер, Престон; Чоу, Джоан; Нгуен, Бинь; Бурштын-Петтегрю, Хела; Чан, Харди; Сигал, Эллиотт (1993). «Сверхэкспрессия, очистка и характеристика рекомбинантной 15-липоксигеназы человека». Biochimica et Biophysical Acta (BBA) - Липиды и липидный обмен . 1169 (1): 80–89. дои : 10.1016/0005-2760(93)90085-N . ПМИД 8334154 .
- ^ Кун, Хартмут; Вальтер, Матиас; Кубань, Ральф Юрген (2002). «Арахидонат-15-липоксигеназы млекопитающих». Простагландины и другие липидные медиаторы . 68–69: 263–290. дои : 10.1016/S0090-6980(02)00035-7 . ПМИД 12432923 .
- ^ Бурри, Л.; Хоэм, Н.; Банни, С.; Берге, К. (2012). «Морские фосфолипиды омега-3: метаболизм и биологическая активность» . Международный журнал молекулярных наук . 13 (11): 15401–15419. дои : 10.3390/ijms131115401 . ПМЦ 3509649 . ПМИД 23203133 .
- ^ Холестерин Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH).
- ^ Браш, А.Р.; Боглин, В.Е.; Чанг, MS (1997). «Открытие второй 15S-липоксигеназы у человека» . Труды Национальной академии наук . 94 (12): 6148–52. Бибкод : 1997PNAS...94.6148B . дои : 10.1073/pnas.94.12.6148 . ЧВК 21017 . ПМИД 9177185 .
- ^ Векслер, Аарон Т; Кеньон, Виктор; Гарсия, Натали К; Дешам, Джошуа Д; Ван дер Донк, Уилфред А.; Холман, Теодор Р. (2009). «Кинетические и структурные исследования аллостерического сайта эпителиальной 15-липоксигеназы-2 человека» . Биохимия . 48 (36): 8721–30. дои : 10.1021/bi9009242 . ПМЦ 2746553 . ПМИД 19645454 .
- ^ Ланевиль, О; Брейер, Д.К.; Сюй, Н; Хуанг, ZH; Гейдж, Д.А.; Уотсон, Дж. Т.; Лагард, М; Девитт, Д.Л.; Смит, WL (1995). «Специфичность жирнокислотного субстрата человеческой простагландин-эндопероксид-синтазы-1 и -2. Образование 12-гидрокси-(9Z, 13E/Z, 15Z)-октадекатриеновых кислот из альфа-линоленовой кислоты» . Журнал биологической химии . 270 (33): 19330–6. дои : 10.1074/jbc.270.33.19330 . ПМИД 7642610 .
- ^ Jump up to: а б Годессар, Нурия; Камачо, Мерседес; Лопес-Бельмонте, Хесус; Антон, Роза; Гарсия, Монтсеррат; Де Морагас, Хосеп-Мария; Вила, Луис (1996). «Простагландин H-синтаза-2 является основным ферментом, участвующим в биосинтезе октадеканоидов из линолевой кислоты в дермальных фибробластах человека, стимулированных интерлейкином-1β» . Журнал исследовательской дерматологии . 107 (5): 726–32. дои : 10.1111/1523-1747.ep12365616 . ПМИД 8875957 .
- ^ Хамберг, Матс; Самуэльссон, Бенгт (1980). «Стереохимия образования 9-гидрокси-10,12-октадекадиеновой кислоты и 13-гидрокси-9,11-октадекадиеновой кислоты из линолевой кислоты циклооксигеназой жирных кислот». Biochimica et Biophysical Acta (BBA) - Липиды и липидный обмен . 617 (3): 545–7. дои : 10.1016/0005-2760(80)90022-3 . ПМИД 6768399 .
- ^ Линдстрем, Терри Д; Ост, Стивен Д. (1984). «Исследования цитохрома P-450-зависимого восстановления гидропероксида липидов». Архив биохимии и биофизики . 233 (1): 80–7. дои : 10.1016/0003-9861(84)90603-9 . ПМИД 6431911 .
- ^ Олив, Эрнст Х (1993). «Бис-аллиловое гидроксилирование линолевой кислоты и арахидоновой кислоты монооксигеназами печени человека». Biochimica et Biophysical Acta (BBA) - Липиды и липидный обмен . 1166 (2–3): 258–63. дои : 10.1016/0005-2760(93)90106-J . ПМИД 8443245 .
- ^ Рупарел, Шивани; Грин, Дастин; Чен, Пол; Харгривз, Кеннет М. (2012). «Ингибитор цитохрома P450, кетоконазол, подавляет периферическую воспалительную боль, опосредованную метаболитом окисленной линолевой кислоты» . Молекулярная боль . 8 : 1744–8069–8–73. дои : 10.1186/1744-8069-8-73 . ПМЦ 3488501 . ПМИД 23006841 .
- ^ Франкель, Э.Н. (1984). «Химия свободнорадикального и синглетного окисления липидов». Прогресс в исследованиях липидов . 23 (4): 197–221. дои : 10.1016/0163-7827(84)90011-0 . ПМИД 6100997 .
- ^ Шпителлер, Питер; Шпителлер, Герхард (1998). «Сильная зависимость спектра продуктов перекисного окисления липидов от того, используется ли Fe2+/O2 или Fe3+/O2 в качестве окислителя». Biochimica et Biophysical Acta (BBA) - Липиды и липидный обмен . 1392 (1): 23–40. дои : 10.1016/S0005-2760(97)00209-9 . ПМИД 9593808 .
- ^ Пунта, Карло; ректор Кристофер Л.; Портер, Нед А. (2005). «Перекисное окисление метиловых эфиров полиненасыщенных жирных кислот, катализируемое N-метилбензогидроксамовой кислотой: новый и удобный метод селективного синтеза гидропероксидов и спиртов». Химические исследования в токсикологии . 18 (2): 349–56. дои : 10.1021/tx049685x . ПМИД 15720142 .
- ^ Jump up to: а б с д Ёсида, Ясуказу; Умено, Ая; Акадзава, Йоко; Ситири, Мототада; Муротоми, Кадзутоши; Хориэ, Масанори (2015). «Химия продуктов перекисного окисления липидов и их использование в качестве биомаркеров при раннем выявлении заболеваний» . Журнал Oleo Science . 64 (4): 347–56. дои : 10.5650/jos.ess14281 . ПМИД 25766928 .
- ^ Риахи, Яэль; Коэн, Гай; Шамни, Офер; Сассон, Шломо (2010). «Сигнальные и цитотоксические функции 4-гидроксиалкеналей». Американский журнал физиологии. Эндокринология и обмен веществ . 299 (6): E879–86. дои : 10.1152/ajpendo.00508.2010 . ПМИД 20858748 . S2CID 6062445 .
- ^ Jump up to: а б Рамсден, Кристофер Э; Рингель, Амит; Фельдштейн, Ариэль Э; Таха, Амир Ю; Макинтош, Бет А; Хиббельн, Джозеф Р.; Майчрзак-Хонг, Шэрон Ф; Фаурот, Кетура Р; Рапопорт, Стэнли I; Чхон, Йевон; Чунг, Юн-Ми; Берк, Майкл; Дуглас Манн, Дж (2012). «Снижение содержания линолевой кислоты в рационе снижает уровень биоактивных метаболитов окисленной линолевой кислоты у людей» . Простагландины, лейкотриены и незаменимые жирные кислоты . 87 (4–5): 135–41. дои : 10.1016/j.plefa.2012.08.004 . ПМЦ 3467319 . ПМИД 22959954 .
- ^ Чо, Ю; Зибо, В.А. (1994). «Включение 13-гидроксиоктадекадиеновой кислоты (13-HODE) в эпидермальные церамиды и фосфолипиды: катализируемое фосфолипазой C высвобождение нового 13-HODE-содержащего диацилглицерина» . Журнал исследований липидов . 35 (2): 255–62. дои : 10.1016/S0022-2275(20)41214-3 . ПМИД 8169529 .
- ^ Грён, Б; Иверсен, Л; Зибо, В; Крагбалле, К. (1993). «Моногидроксижирные кислоты, этерифицированные в фосфолипиды, уменьшаются в пораженной псориатической коже». Архив дерматологических исследований . 285 (8): 449–54. дои : 10.1007/BF00376816 . ПМИД 8274032 . S2CID 25517644 .
- ^ Фанг, Х; Кадуче, Т.Л; Спектор, А.А. (1999). «Включение 13-(S)-гидроксиоктадекадиеновой кислоты (13-HODE) и превращение эндотелиальных клеток в новые продукты» . Журнал исследований липидов . 40 (4): 699–707. дои : 10.1016/S0022-2275(20)32149-0 . ПМИД 10191294 .
- ^ Булл, AW; Эрлз, С.М.; Бронштейн, Дж. К. (1991). «Метаболизм окисленной линолевой кислоты: Распределение активности ферментативного окисления 13-гидроксиоктадекадиеновой кислоты в 13-оксооктадекадиеновую кислоту в тканях крысы». Простагландины . 41 (1): 43–50. дои : 10.1016/0090-6980(91)90103-М . ПМИД 2020745 .
- ^ Булл, AW; Брантинг, К; Бронштейн, Дж. К.; Блэкберн, ML; Рафтер, Дж (1993). «Увеличение активности дегидрогеназы 13-гидроксиоктадекадиеновой кислоты во время дифференцировки культивируемых клеток». Канцерогенез . 14 (11): 2239–43. дои : 10.1093/carcin/14.11.2239 . ПМИД 8242849 .
- ^ Эрлз, Соня М; Бронштейн, Джоэл С; Победитель, Дэвид Л.; Булл, Артур В. (1991). «Метаболизм окисленной линолевой кислоты: характеристика активности дегидрогеназы 13-гидроксиоктадекадиеновой кислоты из ткани толстой кишки крысы». Biochimica et Biophysical Acta (BBA) - Липиды и липидный обмен . 1081 (2): 174–80. дои : 10.1016/0005-2760(91)90023-B . ПМИД 1998735 .
- ^ Кюн, Х; Белкнер, Дж; Визнер, Р; Олдер, Л. (1990). «Наличие 9- и 13-кетооктадекадиеновой кислоты в биологических мембранах, оксигенированных ретикулоцитарной липоксигеназой». Архив биохимии и биофизики . 279 (2): 218–24. дои : 10.1016/0003-9861(90)90484-G . ПМИД 2112367 .
- ^ Уоддингтон, Эмма; Сенуарин, Кишор; Падди, Ян; Крофт, Кевин (2001). «Идентификация и количественное определение уникальных продуктов окисления жирных кислот в атеросклеротических бляшках человека с использованием высокоэффективной жидкостной хроматографии». Аналитическая биохимия . 292 (2): 234–44. дои : 10.1006/abio.2001.5075 . ПМИД 11355856 .
- ^ Jump up to: а б Патвардхан, AM; Шотландия, Пенсильвания; Акопян А. Н.; Харгривз, К.М. (2009). «Активация TRPV1 в спинном мозге окисленными метаболитами линолевой кислоты способствует воспалительной гипералгезии» . Труды Национальной академии наук . 106 (44): 18820–4. дои : 10.1073/pnas.0905415106 . ПМЦ 2764734 . ПМИД 19843694 .
- ^ Альтманн, Рейнхольд; Хаусманн, Мартин; Шпеттль, Таня; Грубер, Майкл; Булл, Артур В.; Мензель, Катрин; Фогль, Даниэла; Херфарт, Ганс; Шёльмерих, Юрген; Фальк, Вернер; Роглер, Герхард (2007). «13-Оксо-ОДЭ является эндогенным лигандом PPARγ в эпителиальных клетках толстой кишки человека». Биохимическая фармакология . 74 (4): 612–22. дои : 10.1016/j.bcp.2007.05.027 . ПМИД 17604003 .
- ^ Гувейя-Фигейра, Сандра; Шпет, Яна; Живкович, Анжела М; Нординг, Малин Л. (2015). «Профилирование метаболома оксилипина и эндоканнабиноидов с помощью UPLC-ESI-MS/MS в плазме человека для мониторинга постпрандиального воспаления» . ПЛОС ОДИН . 10 (7): e0132042. Бибкод : 2015PLoSO..1032042G . дои : 10.1371/journal.pone.0132042 . ПМК 4506044 . ПМИД 26186333 .
- ^ Jump up to: а б Зейн, Клаудия О; Лопес, Росио; Фу, Сяомин; Кирван, Джон П; Ериан, Лиза М; Маккалоу, Артур Дж; Хейзен, Стэнли Л; Фельдштейн, Ариэль Э (2012). «Пентоксифиллин снижает количество окисленных липидных продуктов при неалкогольном стеатогепатите: новые данные о потенциальном терапевтическом механизме» . Гепатология . 56 (4): 1291–9. дои : 10.1002/hep.25778 . ПМЦ 3430813 . ПМИД 22505276 .
- ^ Jump up to: а б Мерфи, Роберт С; Зарини, Симона (2002). «Глутатионовые аддукты оксиэйкозаноидов». Простагландины и другие липидные медиаторы . 68–69: 471–82. дои : 10.1016/S0090-6980(02)00049-7 . ПМИД 12432937 .
- ^ Булл, Артур В.; Бронштейн, Джоэл С; Эрлз, Соня М; Блэкберн, Мэри Л. (1996). «Образование аддуктов между 13-оксооктадекадиеновой кислотой (13-OXO) и тиолами белкового происхождения in vivo и in vitro». Науки о жизни . 58 (25): 2355–65. дои : 10.1016/0024-3205(96)00236-6 . ПМИД 8649225 .
- ^ Блэкберн, Мэри Л; Подгорский, Изабела; Булл, Артур В. (1999). «Специфические белковые мишени 13-оксооктадекадиеновой кислоты (13-OXO) и экспорт конъюгата 13-OXO-глутатион в клетках HT-29». Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1440 (2–3): 225–34. дои : 10.1016/S1388-1981(99)00123-7 . ПМИД 10521706 .
- ^ Jump up to: а б Надь, Ласло; Тонтоноз, Питер; Альварес, Жаклин Дж.А.; Чен, Хунву; Эванс, Рональд М. (1998). «Окисленный ЛПНП регулирует экспрессию генов макрофагов посредством активации лигандом PPARγ» . Клетка . 93 (2): 229–40. дои : 10.1016/S0092-8674(00)81574-3 . ПМИД 9568715 . S2CID 7573475 .
- ^ Ито, Т; Фэйролл, Л; Амин, К; Инаба, Ю; Санто, А; Балинт, Б.Л.; Надь, Л; Ямамото, К; Швабе, JW (2008). «Структурные основы активации PPARgamma окисленными жирными кислотами» . Структурная и молекулярная биология природы . 15 (9): 924–31. дои : 10.1038/nsmb.1474 . ПМЦ 2939985 . ПМИД 19172745 .
- ^ Ёкои, Хироши; Мизуками, Хадзиме; Нагацу, Акито; Оно, Такамаса; Танабе, Хироки; Иноуэ, Макото (2009). «γ-лиганды рецептора, активирующего пролифератор пероксисом, выделенные из семян Адлая (Coix lacryma-jobi L. Var. Ma-yuen STAPF.)» . Биологический и фармацевтический вестник . 32 (4): 735–40. дои : 10.1248/bpb.32.735 . ПМИД 19336916 .
- ^ Делерив, Филипп; Фурман, Кристоф; Тейсье, Элизабет; Фрюшар, Жан-Шарль; Дюрье, Патрик; Стелс, Барт (2000). «Окисленные фосфолипиды активируют PPARα зависимым от фосфолипазы А2 образом». Письма ФЭБС . 471 (1): 34–8. дои : 10.1016/S0014-5793(00)01364-8 . ПМИД 10760508 . S2CID 85113031 .
- ^ Де Петрочеллис, Лучано; Скиано Мориелло, Аньелло; Императоре, Роберта; Кристино, Луиджия; Старович, Катажина; Ди Марцо, Винченцо (2012). «Переоценка активности 9-HODE в каналах TRPV1 по сравнению с анандамидом: энантиоселективность и эффекты на других каналах TRP и в сенсорных нейронах» . Британский журнал фармакологии . 167 (8): 1643–51. дои : 10.1111/j.1476-5381.2012.02122.x . ПМЦ 3525867 . ПМИД 22861649 .
- ^ Обината, Хидеру; Идзуми, Такаши (2009). «G2A как рецептор окисленных свободных жирных кислот». Простагландины и другие липидные медиаторы . 89 (3–4): 66–72. doi : 10.1016/j.prostaglandins.2008.11.002 . ПМИД 19063986 .
- ^ Инь, Хун; Чу, Алан; Ли, Вэй; Ван, Бин; Шелтон, Фабиола; Отеро, Франселла; Нгуен, Дебора Дж; Колдуэлл, Джереми С; Чен, Ю Алиса (2009). «Идентификация лиганда рецептора, связанного с липидом G-белком, с использованием пути охотника анализа за β-аррестином» . Журнал биологической химии . 284 (18): 12328–38. дои : 10.1074/jbc.M806516200 . ПМЦ 2673301 . ПМИД 19286662 .
- ^ Jump up to: а б Кюн, Х; Браш, А.Р. (1990). «Наличие продуктов липоксигеназы в мембранах ретикулоцитов кролика. Доказательства роли ретикулоцитарной липоксигеназы в созревании эритроцитов» . Журнал биологической химии . 265 (3): 1454–8. дои : 10.1016/S0021-9258(19)40037-9 . ПМИД 2104842 .
- ^ Ван Лейен, Клаус; Дювуазен, Роберт М; Энгельхардт, Харальд; Видманн, Мартин (1998). «Функция липоксигеназы в запрограммированной деградации органелл». Природа . 395 (6700): 392–5. Бибкод : 1998Природа.395..392В . дои : 10.1038/26500 . ПМИД 9759730 . S2CID 4366265 .
- ^ Солнце, Д; Фанк, CD (1996). «Нарушение экспрессии 12/15-липоксигеназы в перитонеальных макрофагах. Усиление использования пути 5-липоксигеназы и снижение окисления липопротеинов низкой плотности» . Журнал биологической химии . 271 (39): 24055–62. дои : 10.1074/jbc.271.39.24055 . ПМИД 8798642 .
- ^ Иванов Игорь; Кун, Хартмут; Хейдек, Дагмар (2015). «Структурная и функциональная биология 15-липоксигеназы-1 арахидоновой кислоты (ALOX15)» . Джин . 573 (1): 1–32. дои : 10.1016/j.gene.2015.07.073 . ПМК 6728142 . ПМИД 26216303 .
- ^ Jump up to: а б с д и ж Мабалираджан, Улаганатан; Рехман, Рахшинда; Ахмад, Танвир; Кумар, Сарвеш; Сингх, Сухата; Лейшангтем, Гита Д; Айч, Джотирмой; Кумар, Маниш; Ханна, Критика; Сингх, Виджай П; Динда, Амит К; Бисвал, Шьям; Агравал, Анураг; Гош, Баларам (2013). «Метаболит линолевой кислоты вызывает тяжелую астму, вызывая повреждение эпителия дыхательных путей» . Научные отчеты . 3 : 1349. Бибкод : 2013NatSR...3E1349M . дои : 10.1038/srep01349 . ПМК 3583002 . ПМИД 23443229 .
- ^ Хенрикс, Пенсильвания; Энгельс, Ф; Ван Дер Влит, Х; Нейкамп, Ф.П. (1991). «9- и 13-гидроксилинолевая кислота обладают хемотаксической активностью в отношении полиморфноядерных лейкоцитов быка и человека». Простагландины . 41 (1): 21–7. дои : 10.1016/0090-6980(91)90101-К . ПМИД 2020743 .
- ^ Ролин, Йоханнес; Аль-Джадери, Зайдун; Магхазачи, Аззам А (2013). «Окисленные липиды и лизофосфатидилхолин индуцируют хемотаксис и внутриклеточный приток кальция в естественные клетки-киллеры». Иммунобиология . 218 (6): 875–83. дои : 10.1016/j.imbio.2012.10.009 . ПМИД 23200035 . S2CID 37940201 .
- ^ Кюн, Х; Белкнер, Дж; Зайсс, С; Ференклемпер, Т; Вольфейл, С. (1994). «Участие 15-липоксигеназы на ранних стадиях атерогенеза» . Журнал экспериментальной медицины . 179 (6): 1903–11. дои : 10.1084/jem.179.6.1903 . ПМК 2191515 . ПМИД 8195716 .
- ^ Фолчик, Вирджиния; Нивар-Аристы, РА; Краевский, Л.П.; Кэткарт, МК (1995). «Липоксигеназа способствует окислению липидов в атеросклеротических бляшках человека» . Журнал клинических исследований . 96 (1): 504–10. дои : 10.1172/JCI118062 . ПМК 185224 . ПМИД 7615823 .
- ^ Уоддингтон, Эмма I; Крофт, Кевин Д; Сенуарин, Кишор; Лэтэм, Брюс; Падди, Ян Б. (2003). «Продукты окисления жирных кислот в атеросклеротических бляшках человека: анализ клинических и гистопатологических коррелятов». Атеросклероз . 167 (1): 111–20. дои : 10.1016/S0021-9150(02)00391-X . ПМИД 12618275 .
- ^ Кюн, Х; Хайдек, Д; Хьюго, я; Гнивотта, К. (1997). «Действие 15-липоксигеназы in vivo на ранних стадиях атерогенеза человека» . Журнал клинических исследований . 99 (5): 888–93. дои : 10.1172/JCI119253 . ПМК 507896 . ПМИД 9062346 .
- ^ Jump up to: а б Кабрал, Марисоль; Мартин-Венегас, Ракель; Морено, Хуан Хосе (2014). «Дифференциальный рост клеток/поведение апоптоза энантиомеров 13-гидроксиоктадекадиеновой кислоты в линии клеток колоректального рака». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 307 (6): G664–71. дои : 10.1152/ajpgi.00064.2014 . ПМИД 25035111 .
- ^ Jump up to: а б с Ли Кеннеди, R; Вангавети, Венкат; Джаррод, Гассан; Шашидхар, Венкатеш; Шашидхар, Венкатеш; Бауне, Бернхард Т (2010). «Обзор: Рецепторы свободных жирных кислот: новые цели лечения диабета и его осложнений» . Терапевтические достижения в эндокринологии и обмене веществ . 1 (4): 165–75. дои : 10.1177/2042018810381066 . ПМЦ 3474614 . ПМИД 23148161 .
- ^ Jump up to: а б Вангавети, Венкат Н; Шашидхар, Венкатеш М; Раш, Кэтрин; Малабу, Усман Х; Расалам, Рой Р; Кольер, Фиона; Бауне, Бернхард Т; Кеннеди, Ричард Л. (2014). «Гидроксиоктадекадиеновые кислоты регулируют апоптоз в клетках THP-1 человека PPARγ-зависимым образом». Липиды . 49 (12): 1181–92. дои : 10.1007/s11745-014-3954-z . ПМИД 25330944 . S2CID 4062623 .
- ^ Феббрайо, Мария; Подрез, Юджин А; Смит, Джонатан Д.; Хаджар, Дэвид П.; Хейзен, Стэнли Л; Хофф, Генри Ф; Шарма, Кавита; Сильверстайн, Рой Л. (2000). «Направленное разрушение рецептора-поглотителя CD36 класса B защищает от развития атеросклеротических поражений у мышей» . Журнал клинических исследований . 105 (8): 1049–56. дои : 10.1172/JCI9259 . ПМК 300837 . ПМИД 10772649 .
- ^ Маковский, Лиза; Борд, Джеффри Б; Маэда, Казухиса; Бабаев Владимир Р; Уйсал, К. Теоман; Морган, Морин А; Паркер, Рекс А; Саттлс, Джилл; Фасио, Серхио; Хотамислигил, Гёкхан С; Линтон, Макрэ Ф (2001). «Отсутствие белка aP2, связывающего жирные кислоты макрофагов, защищает мышей с дефицитом аполипопротеина E от атеросклероза» . Природная медицина . 7 (6): 699–705. дои : 10.1038/89076 . ПМК 4027052 . ПМИД 11385507 .
- ^ Фукуда, Казуки; Мацумура, Такеши; Сенокучи, Такафуми; Исии, Норио; Киносита, Хироюки; Ямада, Сари; Мураками, Сайко; Накао, Сая; Мотошима, Хироюки; Кондо, Тацуя; Кикудоме, Дайсуке; Кавасаки, Сюдзи; Кавада, Теруо; Нисикава, Такеши; Араки, Эйичи (2015). «Статины опосредуют антиатеросклеротическое действие в гладкомышечных клетках путем активации рецептора-γ, активируемого пролифератором пероксисом». Связь с биохимическими и биофизическими исследованиями . 457 (1): 23–30. дои : 10.1016/j.bbrc.2014.12.063 . ПМИД 25529449 .
- ^ Хенрикс, П; Энгельс, Ф; Вандерлинде, Х; Гарссен, Дж; Нейкамп, Ф (1995). «13-Гидроксилинолевая кислота вызывает гиперреактивность дыхательных путей на гистамин и метахолин у морских свинок in vivo». Журнал аллергии и клинической иммунологии . 96 (1): 36–43. дои : 10.1016/S0091-6749(95)70030-7 . ПМИД 7622761 .
- ^ Jump up to: а б с Мабалираджан, У; Динда, АК; Кумар, С; Рошан, Р; Гупта, П; Шарма, СК; Гош, Б (2008). «Митохондриальные структурные изменения и дисфункция связаны с экспериментальной аллергической астмой» . Журнал иммунологии . 181 (5): 3540–8. дои : 10.4049/jimmunol.181.5.3540 . ПМИД 18714027 .
- ^ Томас, Биджу; Рутман, Эндрю; Херст, Роберт А; Халдар, Пранаб; Уордлоу, Эндрю Дж; Банкарт, Джон; Брайтлинг, Кристофер Э; О'Каллаган, Кристофер (2010). «Цилиарная дисфункция и ультраструктурные нарушения являются признаками тяжелой астмы». Журнал аллергии и клинической иммунологии . 126 (4): 722–729.e2. дои : 10.1016/j.jaci.2010.05.046 . ПМИД 20673980 .
- ^ Энгельс, Ф; Кессельс, GC; Хенрикс, Пенсильвания; Нейкамп, Ф.П. (1996). «Преимущественное образование 13-гидроксилинолевой кислоты эозинофилами периферической крови человека». Простагландины . 52 (2): 117–24. дои : 10.1016/0090-6980(96)00057-3 . ПМИД 8880897 .
- ^ Лунг, MS; Тренер, А.Х.; Кэмпбелл, я; Липтон, Л. (2015). «Семейный колоректальный рак» . Журнал внутренней медицины . 45 (5): 482–91. дои : 10.1111/imj.12736 . ПМИД 25955461 .
- ^ Jump up to: а б Шурейци, я; Чен, Д; Дэй, Р.С.; Цзо, X; Хохман, Флорида; Росс, Вашингтон; Коул, Р.А.; Мой, О; Моррис, Дж. С.; Сяо, Л; Ньюман, Р.А.; Ян, П; Липпман, С.М. (2010). «Профилирование метаболизма липоксигеназы на конкретных этапах колоректального опухогенеза» . Исследования по профилактике рака . 3 (7): 829–38. дои : 10.1158/1940-6207.CAPR-09-0110 . ПМК 2900425 . ПМИД 20570882 .
- ^ Jump up to: а б Цзо, Сяншэн; Шурейки, Имад (2013). «Профилирование эйкозаноидов при раке толстой кишки: появление закономерности» . Простагландины и другие липидные медиаторы . 104–105: 139–43. doi : 10.1016/j.prostaglandins.2012.08.004 . ПМЦ 3532570 . ПМИД 22960430 .
- ^ Кун, Хартмут; Бантия, Свати; Ван Лейен, Клаус (2015). «Липоксигеназы млекопитающих и их биологическое значение» . Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1851 (4): 308–30. дои : 10.1016/j.bbalip.2014.10.002 . ПМК 4370320 . ПМИД 25316652 .
- ^ Jump up to: а б Шурейци, я; Войно, К.Дж.; Пур, Дж. А.; Редди, Р.Г.; Муссалли, MJ; Шпиндлер, С.А.; Гринсон, Дж. К.; Нормоль, Д; Хасан, А.А.; Лоуренс, Т.С; Бреннер, Д.Э. (1999). «Снижение уровня 13-S-гидроксиоктадекадиеновой кислоты и экспрессии 15-липоксигеназы-1 при раке толстой кишки человека» . Канцерогенез . 20 (10): 1985–95. doi : 10.1093/carcin/20.10.1985 . ПМИД 10506115 .
- ^ Jump up to: а б Никсон, Дженнифер Б; Ким, Кён Су; Лэмб, Патрисия В; Боттон, Фрэнк Дж.; Элинг, Томас Э (2004). «15-липоксигеназа-1 оказывает противоопухолевое действие при колоректальном раке». Простагландины, лейкотриены и незаменимые жирные кислоты . 70 (1): 7–15. дои : 10.1016/j.plefa.2003.06.001 . ПМИД 14643174 .
- ^ Шурейци, я; Цзян, В; Цзо, X; Ву, Ю; Стиммель, Дж. Б.; Лиснитцер, Л.М.; Моррис, Дж. С.; Фан, Х.-З; Фишер, С.М.; Липпман, С.М. (2003). «Продукт 15-липоксигеназы-1, 13-S-гидроксиоктадекадиеновая кислота, подавляет PPAR-δ, вызывая апоптоз в клетках колоректального рака» . Труды Национальной академии наук . 100 (17): 9968–73. Бибкод : 2003PNAS..100.9968S . дои : 10.1073/pnas.1631086100 . ПМК 187904 . ПМИД 12909723 .
- ^ Jump up to: а б О'Флаэрти, Джозеф Т.; Вутен, Ронда Э; Сэмюэл, Майкл П; Томас, Майкл Дж; Левин, Эдвард А; Кейс, Л. Дуглас; Акман, Стивен А; Эдвардс, Ирис Дж (2013). «Метаболиты жирных кислот при быстро распространяющемся раке молочной железы» . ПЛОС ОДИН . 8 (5): e63076. Бибкод : 2013PLoSO...863076O . дои : 10.1371/journal.pone.0063076 . ПМК 3642080 . ПМИД 23658799 .
- ^ Редди, Наги; Эверхарт, Анджела; Элинг, Томас; Глазго, Уэйн (1997). «Характеристика 15-липоксигеназы в клетках карциномы молочной железы человека BT-20: стимуляция образования 13-HODE с помощью TGFα/EGF». Связь с биохимическими и биофизическими исследованиями . 231 (1): 111–6. дои : 10.1006/bbrc.1997.6048 . ПМИД 9070230 .
- ^ Хилл, Стивен М; Бласк, Дэвид Э; Сян, Шулин; Юань, Линь; Мао, Лулу; Даучи, Роберт Т; Даучи, Эрин М; Фраш, Трипп; Дуплесис, Тамика (2011). «Мелатонин и связанные с ним сигнальные пути, которые контролируют нормальный эпителий молочной железы и рак молочной железы». Журнал биологии молочной железы и неоплазии . 16 (3): 235–45. дои : 10.1007/s10911-011-9222-4 . ПМИД 21773809 . S2CID 22711432 .
- ^ Келавкар, У; Глазго, Вт; Элинг, Т.Е. (2002). «Влияние экспрессии 15-липоксигеназы-1 на раковые клетки». Текущие отчеты по урологии . 3 (3): 207–14. дои : 10.1007/s11934-002-0066-8 . ПМИД 12084190 . S2CID 21497252 .
- ^ Си, Линда С; Уилсон, Ли С; Элинг, Томас Э (2002). «Противоположное влияние метаболитов 15-липоксигеназы-1 и -2 на передачу сигналов МАРК в предстательной железе» . Журнал биологической химии . 277 (43): 40549–56. дои : 10.1074/jbc.M203522200 . ПМИД 12189136 .
- ^ Келавкар, У.П.; Коэн, К. (2004). «Экспрессия 15-липоксигеназы-1 усиливает и активирует рецептор инсулиноподобного фактора роста-1 в клетках рака простаты» . Неоплазия . 6 (1): 41–52. дои : 10.1016/S1476-5586(04)80052-6 . ПМК 1508629 . PMID 15068670 .
- ^ Келавкар, Уддхав П; Парвани, Анил В.; Шаппелл, Скотт Б; Мартин, В. Дэвид (2006). «Условная экспрессия человеческой 15-липоксигеназы-1 в простате мыши вызывает интраэпителиальную неоплазию предстательной железы: модель мыши FLiMP» . Неоплазия . 8 (6): 510–22. дои : 10.1593/neo.06202 . ПМК 1601466 . ПМИД 16820097 .
- ^ Сен, Малабика; Макхью, Кевин; Хатцли, Джастин; Филипс, Брайан Дж; Дхир, Раджив; Парвани, Анил В.; Келавкар, Уддхав П. (2006). «Ортотопическая экспрессия человеческой 15-липоксигеназы (LO)-1 в дорсолатеральной простате нормальной мыши C57BL/6 дикого типа вызывает PIN-подобные поражения». Простагландины и другие липидные медиаторы . 81 (1–2): 1–13. doi : 10.1016/j.prostaglandins.2006.05.024 . ПМИД 16997127 .
- ^ Jump up to: а б Келавкар, У.П.; Хатцли, Дж; Макхью, К; Аллен, К.Г.; Парвани, А. (2009). «Рост опухоли простаты можно модулировать, воздействуя на диету ферментами 15-липоксигеназы-1 и циклооксигеназы-2» . Неоплазия . 11 (7): 692–9. дои : 10.1593/neo.09334 . ПМЦ 2697355 . ПМИД 19568414 .
- ^ Эдвардс, Ай-Джей; Беркен, И.М.; Солнце, Ч; О'Флаэрти, Дж. Т.; Дэниел, Л.В.; Томас, MJ; Рудель, Л.Л.; Вайкл, Р.Л; Чен, Ю.К. (2004). «Дифференциальные эффекты доставки жирных кислот омега-3 в раковые клетки человека липопротеинами низкой плотности по сравнению с альбумином» . Клинические исследования рака . 10 (24): 8275–83. дои : 10.1158/1078-0432.CCR-04-1357 . ПМИД 15623603 .
- ^ о'Флаэрти, Джозеф Т.; Ху, Юнпин; Вутен, Ронда Э; Хорита, Дэвид А; Сэмюэл, Майкл П; Томас, Майкл Дж; Сунь, Хайго; Эдвардс, Ирис Дж (2012). «15-липоксигеназные метаболиты докозагексаеновой кислоты ингибируют пролиферацию и выживание клеток рака простаты» . ПЛОС ОДИН . 7 (9): е45480. Бибкод : 2012PLoSO...745480O . дои : 10.1371/journal.pone.0045480 . ПМЦ 3447860 . ПМИД 23029040 .
- ^ Ху, Юньпин; Сунь, Хайго; о'Флаэрти, Джозеф Т.; Эдвардс, Ирис Дж (2013). «Опосредованный 15-липоксигеназой-1 метаболизм докозагексаеновой кислоты необходим для передачи сигналов синдекана-1 и апоптоза в клетках рака простаты» . Канцерогенез . 34 (1): 176–82. дои : 10.1093/carcin/bgs324 . ПМЦ 3584949 . ПМИД 23066085 .
- ^ Йира, Вольфганг; Шпителлер, Герхард; Рихтер, Андреас (1997). «Повышение уровня продуктов окисления липидов в липопротеинах низкой плотности у больных ревматоидным артритом». Химия и физика липидов . 87 (1): 81–9. дои : 10.1016/S0009-3084(97)00030-3 . ПМИД 9219348 .
- ^ Ле, Куанг Хай; Эль-Алауи, Медди; Верисель, Эвелин; Сегрестен, Беренис; Сулер, Лоран; Гишардан, Мишель; Лагард, Мишель; Мулен, Филипп; Кальсада, Кэтрин (2015). «Гликоксидированные ЛПВП, ЛПВП, обогащенные окисленными фосфолипидами, и ЛПВП от пациентов с диабетом ингибируют функцию тромбоцитов» . Журнал клинической эндокринологии и метаболизма . 100 (5): 2006–14. дои : 10.1210/jc.2014-4214 . ПМЦ 4803888 . ПМИД 25794249 .
- ^ Клавиттер, Елена; Клавиттер, Йост; Макфанн, Ким; Пеннингтон, Александр Т; Абебе, Калеаб З; Броснахэн, Годела; Каднапафорнчай, Мелисса А; Чончоль, Мишель; Гитомер, Беренис; Христиане, Уве; Шриер, Роберт В. (2014). «Биоактивные липидные медиаторы при поликистозе почек» . Журнал исследований липидов . 55 (6): 1139–49. дои : 10.1194/jlr.P042176 . ПМК 4031945 . ПМИД 24343898 .
- ^ Стивенс, Тайлер; Берк, Майкл П; Лопес, Росио; Чунг, Юн-Ми; Чжан, Жэньлян; Парси, Мансур А; Броннер, Мэри П.; Фельдштейн, Ариэль Э (2012). «Липидомный профиль сыворотки и панкреатической жидкости при хроническом панкреатите». Поджелудочная железа . 41 (4): 518–22. дои : 10.1097/MPA.0b013e31823ca306 . ПМИД 22504378 . S2CID 42972163 .
- ^ Ян, Лили; Лачумикандан, Каливаратан; Макмаллен, Меган Р.; Пратт, Брайан Т; Чжан, Жэньлян; Папучадо, Беттина Дж; Надь, Лаура Э; Фельдштейн, Ариэль Э; Макинтайр, Томас М. (2010). «Хроническое воздействие алкоголя увеличивает уровень циркулирующих биоактивных окисленных фосфолипидов» . Журнал биологической химии . 285 (29): 22211–20. дои : 10.1074/jbc.M110.119982 . ПМК 2903350 . ПМИД 20460374 .
- ^ Фельдштейн, Ариэль Э; Лопес, Росио; Тамими, Тарек Абу-Раджаб; Ериан, Лиза; Чунг, Юн-Ми; Берк, Майкл; Чжан, Жэньлян; Макинтайр, Томас М.; Хейзен, Стэнли Л. (2010). «Масс-спектрометрическое профилирование окисленных липидных продуктов при неалкогольной жировой болезни печени и неалкогольном стеатогепатите человека» . Журнал исследований липидов . 51 (10): 3046–54. дои : 10.1194/jlr.M007096 . ПМЦ 2936759 . ПМИД 20631297 .
- ^ Ёсида, Ясуказу; Ёсикава, Ацуши; Кинуми, Томоя; Огава, Йоко; Сайто, Ёсиро; Охара, Казуюки; Ямамото, Хирокадзу; Имаи, Ясухару; Ники, Эцуо (2009). «Гидроксиоктадекадиеновая кислота и окислительно-модифицированные пероксиредоксины в крови пациентов с болезнью Альцгеймера и их потенциал в качестве биомаркеров». Нейробиология старения . 30 (2): 174–85. doi : 10.1016/j.neurobiolaging.2007.06.012 . ПМИД 17688973 . S2CID 23418993 .
- ^ Ёсида, Ясуказу; Умено, Ая; Ситири, Мототада (2013). «Биомаркеры перекисного окисления липидов для оценки окислительного стресса и оценки антиоксидантной способности in vivo » . Журнал клинической биохимии и питания . 52 (1): 9–16. дои : 10.3164/jcbn.12-112 . ПМЦ 3541426 . ПМИД 23341691 .
- ^ Ники, Эцуо (2014). «Биомаркеры перекисного окисления липидов в клиническом материале». Биохимия и биофизика Acta (BBA) – общие предметы 1840 (2): 809–17. дои : 10.1016/j.bbagen.2013.03.020 . ПМИД 23541987 .
- ^ Лю, Ян; Ван, Дуань; Ли, Ди; Сунь, Жуйфан; Ся, Мин (2014). «Связь ретинол-связывающего белка 4 с окислительным стрессом, маркерами воспаления и метаболическим синдромом у населения Китая среднего и пожилого возраста» . Диабетология и метаболический синдром . 6 (1): 25. дои : 10.1186/1758-5996-6-25 . ПМЦ 3938900 . ПМИД 24559154 .