Электрическая батарея
 Различные элементы и батареи (слева вверху справа внизу): две батареи типа АА , одна батарея типа D , одна батарея для портативной радиолюбительской радиостанции , две батареи на 9 В (PP3), две батареи типа ААА , одна батарея типа C , одна батарея для видеокамеры , одна для беспроводного телефона . батарея | |
| Тип | Источник питания |
|---|---|
| Working principle | Электрохимические реакции , Электродвижущая сила |
| Первое производство | 1800-е годы |
| Электронный символ | |
 Символ принципиальной батареи на схеме . Оно возникло как схематический рисунок самого раннего типа батареи — гальванической батареи . | |
Электрическая батарея — источник электрической энергии, состоящий из одного или нескольких электрохимических элементов с внешними соединениями. [1] для питания электроприборов . Когда батарея подает питание, ее положительная клемма является катодом , а отрицательная клемма — анодом . [2] Клемма с отрицательной маркировкой является источником электронов, которые будут течь через внешнюю электрическую цепь к положительной клемме. Когда батарея подключена к внешней электрической нагрузке, окислительно-восстановительная реакция преобразует реагенты с высокой энергией в продукты с более низкой энергией, а разница свободной энергии передается во внешнюю цепь в виде электрической энергии. Исторически термин «батарея» конкретно относился к устройству, состоящему из нескольких ячеек; однако в настоящее время в него вошли устройства, состоящие из одной ячейки. [3]
Первичные (одноразовые или «одноразовые») батарейки используются один раз и выбрасываются , так как при разрядке материалы электродов необратимо изменяются; Типичным примером является щелочная батарея, используемая в фонариках и множестве портативных электронных устройств. Вторичные (перезаряжаемые) батареи можно многократно разряжать и перезаряжать с помощью приложенного электрического тока; первоначальный состав электродов можно восстановить обратным током. Примеры включают свинцово-кислотные аккумуляторы, используемые в транспортных средствах, и литий-ионные аккумуляторы, используемые в портативной электронике, такой как ноутбуки и мобильные телефоны .
Батареи бывают разных форм и размеров: от миниатюрных элементов, используемых для питания слуховых аппаратов и наручных часов, до, в крайнем случае, огромных аккумуляторных батарей размером с комнату, которые обеспечивают резервное или аварийное питание для телефонных станций и компьютерных центров обработки данных . Батареи имеют гораздо более низкую удельную энергию (энергию на единицу массы), чем обычное топливо, такое как бензин. В автомобилях это несколько компенсируется более высокой эффективностью электродвигателей при преобразовании электрической энергии в механическую работу по сравнению с двигателями внутреннего сгорания.
История
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( февраль 2022 г. ) |
Изобретение
Бенджамин Франклин впервые использовал термин «батарея» в 1749 году, когда проводил эксперименты с электричеством, используя набор связанных конденсаторов лейденской банки . [4] Франклин сгруппировал несколько банок в то, что он назвал «батареей», используя военный термин для обозначения совместного функционирования оружия. [5] Умножив количество емкостей-держателей, можно будет хранить более сильный заряд, а при разрядке будет доступно больше энергии.
Итальянский физик Алессандро Вольта построил и описал первую электрохимическую батарею — вольтов столб — в 1800 году. [6] Это была стопка медных и цинковых пластин, разделенных пропитанными рассолом бумажными дисками, которые могли производить постоянный ток в течение значительного периода времени. Вольта не понимал, что напряжение возникло в результате химических реакций. Он думал, что его клетки — неиссякаемый источник энергии. [7] и что связанные с этим эффекты коррозии на электродах были просто неприятностью, а не неизбежным последствием их работы, как показал Майкл Фарадей в 1834 году. [8]
Хотя первые батареи имели большую ценность для экспериментальных целей, [9] на практике их напряжение колебалось, и они не могли обеспечивать большой ток в течение длительного периода. Ячейка Дэниела , изобретенная в 1836 году британским химиком Джоном Фредериком Дэниелом , стала первым практическим источником электроэнергии , став отраслевым стандартом и получив широкое распространение в качестве источника энергии для электрических телеграфных сетей. [10] Он представлял собой медный котел, наполненный раствором медного купороса , в который была погружена неглазурованная глиняная емкость, наполненная серной кислотой , и цинковый электрод. [11]
В этих влажных элементах использовались жидкие электролиты, которые при неправильном обращении были склонны к утечкам и разливам. Многие использовали стеклянные банки для хранения компонентов, что делало их хрупкими и потенциально опасными. Эти характеристики сделали влажные элементы непригодными для портативных приборов. Ближе к концу девятнадцатого века изобретение сухих батарей , в которых жидкий электролит был заменен пастой, сделало портативные электрические устройства практичными. [12]
В батареях в устройствах с электронными лампами исторически использовалась мокрая ячейка для батареи «А» (для обеспечения питания нити накала) и сухая ячейка для батареи «В» (для обеспечения напряжения на пластине). [ нужна ссылка ]
Будущее
В период с 2010 по 2018 год годовой спрос на аккумуляторы вырос на 30%, достигнув в общей сложности 180 ГВтч в 2018 году. По консервативным оценкам, ожидается, что темпы роста сохранятся на уровне примерно 25%, а кульминацией станет достижение 2600 ГВтч в 2030 году. Ожидается, что снижение затрат приведет к дальнейшему увеличению спроса до 3562 ГВтч. [13]
Важными причинами таких высоких темпов роста индустрии электрических аккумуляторов являются электрификация транспорта, [13] и крупномасштабное развертывание в электросетях, [13] Поддерживаемый антропогенным изменением климата, переходом от источников энергии, сжигаемых ископаемым топливом, к более чистым, возобновляемым источникам и более строгим режимам выбросов.
Распределенные электрические батареи, такие как те, которые используются в аккумуляторных электромобилях ( автомобиль-сеть ) и в домашних накопителях энергии , с интеллектуальным измерением и которые подключены к интеллектуальным сетям для реагирования на спрос , являются активными участниками интеллектуальных сетей электроснабжения. [14] Новые методы повторного использования, такие как поэтапное использование частично использованных батарей, повышают общую полезность электрических батарей, снижают затраты на хранение энергии, а также уменьшают воздействие загрязнения/выбросов за счет увеличения срока службы. При эшелонированном использовании аккумуляторов электрические аккумуляторы транспортных средств , емкость которых снижается до менее чем 80%, обычно после 5–8 лет эксплуатации, перепрофилируются для использования в качестве резервного источника питания или для систем хранения возобновляемой энергии. [15]
Хранение энергии в масштабе сети предполагает широкомасштабное использование батарей для сбора и хранения энергии из сети или электростанции, а затем разрядки этой энергии в более позднее время для обеспечения электроэнергии или других сетевых услуг, когда это необходимо. Сетевое хранилище энергии (под ключ или распределенное) является важным компонентом интеллектуальных сетей электроснабжения. [16]
Химия и принципы
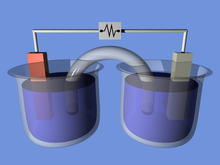
Батареи преобразуют химическую энергию непосредственно в электрическую . Во многих случаях выделяемая электрическая энергия представляет собой разницу в силе сцепления. [17] или энергии связи металлов, оксидов или молекул, подвергающихся электрохимической реакции. Например, энергия может храниться в Zn или Li, которые являются высокоэнергетическими металлами, поскольку в отличие от переходных металлов они не стабилизируются d-электронными связями . Батареи устроены так, что энергетически выгодная окислительно-восстановительная реакция может происходить только при движении электронов через внешнюю часть цепи.
Батарея состоит из некоторого количества гальванических элементов . Каждая ячейка состоит из двух полуячеек, соединенных последовательно проводящим электролитом, металлов содержащим катионы . Одна полуячейка включает в себя электролит и отрицательный электрод, электрод, к которому мигрируют анионы (отрицательно заряженные ионы); другая полуячейка включает электролит и положительный электрод, к которому катионы (положительно заряженные ионы мигрируют ). Катионы восстанавливаются (присоединяются электроны) на катоде, а атомы металлов окисляются (удаляются электроны) на аноде. [18] В некоторых ячейках для каждой полуячейки используются разные электролиты; затем используется сепаратор, чтобы предотвратить смешивание электролитов, позволяя ионам течь между полуэлементами, замыкая электрическую цепь.
Каждая полуячейка имеет электродвижущую силу ( ЭДС , измеряемую в вольтах) относительно эталона . Чистая ЭДС ячейки — это разница между ЭДС ее полуячеек. [19] Таким образом, если электроды имеют ЭДС и , то чистая ЭДС равна ; это разница между потенциалами восстановления полуреакций другими словами, чистая ЭДС — . [20]
Электрическая движущая сила или между клеммами ячейки называется напряжением на клеммах (разницей) и измеряется в вольтах . [21] Напряжение на клеммах элемента, который не заряжается и не разряжается, называется напряжением холостого хода и равно ЭДС элемента. Из-за внутреннего сопротивления [22] напряжение на выводах разряжающегося элемента меньше по величине, чем напряжение холостого хода, а напряжение на выводах заряжающегося элемента превышает напряжение холостого хода. [23] Идеальный элемент имеет незначительное внутреннее сопротивление, поэтому на его клеммах будет поддерживаться постоянное напряжение до полного изнеможения, а затем снижается до нуля. Если бы такой элемент поддерживал напряжение 1,5 вольта и производил заряд в один кулон , то при полной разрядке он совершил бы 1,5 джоуля . работу [21] В реальных элементах внутреннее сопротивление увеличивается при разряде. [22] и напряжение холостого хода также уменьшается при разряде. Если построить график зависимости напряжения и сопротивления от времени, полученные графики обычно представляют собой кривую; форма кривой варьируется в зависимости от используемого химического состава и внутреннего устройства.
Напряжение , развиваемое на клеммах ячейки, зависит от выделения энергии в результате химических реакций ее электродов и электролита. Щелочные и цинк-углеродные элементы имеют разный химический состав, но примерно одинаковую ЭДС - 1,5 вольт; аналогично NiCd и NiMH элементы имеют разный химический состав, но примерно одинаковую ЭДС 1,2 вольта. [24] Высокие изменения электрохимического потенциала в реакциях соединений лития создают в литиевых элементах ЭДС 3 В и более. [25]
Электролитом для элемента может служить практически любая жидкость или влажный объект, имеющий достаточное количество ионов для электропроводности. В качестве новинки или демонстрации науки можно вставить в лимон два электрода из разных металлов . [26] картофель, [27] и т. д. и генерируют небольшое количество электроэнергии.
Вольтову стопку можно сделать из двух монет (например, пятака и пенни ) и куска бумажного полотенца, смоченного в соленой воде . Такая стопка генерирует очень низкое напряжение, но, когда их соединяют последовательно , они могут на короткое время заменить обычные батареи. [28]
Типы
Первичные и вторичные батареи

Аккумуляторы подразделяются на первичные и вторичные формы:
- Первичные батареи предназначены для использования до тех пор, пока не исчерпается энергия, а затем выбрасываются. Их химические реакции, как правило, необратимы, поэтому их нельзя перезарядить. Когда запас реагентов в батарее исчерпан, батарея перестает вырабатывать ток и становится бесполезной. [29]
- Вторичные батареи можно перезаряжать; то есть они могут обратить свои химические реакции вспять, подав электрический ток на клетку . Это регенерирует исходные химические реагенты, поэтому их можно использовать, перезаряжать и использовать снова несколько раз. [30]
Некоторые типы первичных батарей, применявшихся, например, для телеграфных цепей, восстанавливали работоспособность путем замены электродов. [31] Аккумуляторные батареи не могут перезаряжаться бесконечно из-за рассеивания активных материалов, потери электролита и внутренней коррозии.
Первичные батареи или первичные элементы могут производить ток сразу после сборки. Они чаще всего используются в портативных устройствах с низким потреблением тока, используются только с перерывами или вдали от альтернативного источника питания, например, в цепях сигнализации и связи, где другая электроэнергия доступна только с перерывами. Одноразовые первичные элементы не могут быть надежно перезаряжены, поскольку химические реакции трудно обратимы, а активные материалы не могут вернуться в свою первоначальную форму. Производители аккумуляторов не рекомендуют пытаться перезарядить первичные элементы. [32] Как правило, они имеют более высокую плотность энергии , чем перезаряжаемые батареи. [33] но одноразовые батареи плохо себя чувствуют в приложениях с высоким потреблением тока и нагрузкой менее 75 Ом (75 Ом). К распространенным типам одноразовых батарей относятся угольно-цинковые батареи и щелочные батареи .
Вторичные батареи, также известные как вторичные элементы или аккумуляторные батареи , необходимо зарядить перед первым использованием; они обычно собираются с активными материалами в разряженном состоянии. Аккумуляторные батареи (пере)заряжаются путем подачи электрического тока, который обращает вспять химические реакции, происходящие во время разрядки/использования. Устройства для подачи соответствующего тока называются зарядными устройствами. Самой старой формой аккумуляторной батареи являются свинцово-кислотные батареи , которые широко используются в автомобилях и лодках . Эта технология содержит жидкий электролит в незапечатанном контейнере, поэтому аккумулятор необходимо держать в вертикальном положении, а помещение хорошо проветривать, чтобы обеспечить безопасное рассеивание газообразного водорода , который он производит во время перезарядки . Свинцово-кислотная батарея относительно тяжела для того количества электрической энергии, которую она может обеспечить. Низкая стоимость производства и высокий уровень импульсного тока делают его распространенным там, где его емкость (более примерно 10 Ач) важнее, чем проблемы с весом и обращением. Распространенным применением является современный автомобильный аккумулятор , который вообще может выдавать пиковый ток в 450 ампер .
Состав

Было произведено множество типов электрохимических элементов с различными химическими процессами и конструкциями, включая гальванические элементы , электролитические элементы , топливные элементы , проточные элементы и гальванические батареи. [34]
Батарея с мокрыми элементами имеет жидкий электролит . Другие названия — затопленная ячейка , поскольку жидкость покрывает все внутренние части, или вентилируемая ячейка , поскольку образующиеся во время работы газы могут выходить в воздух. Влажные элементы были предшественниками сухих элементов и обычно используются в качестве инструмента обучения электрохимии . Их можно изготовить из обычных лабораторных принадлежностей, таких как химические стаканы , для демонстрации работы электрохимических ячеек. Особый тип влажной ячейки, известный как концентрационная ячейка, важен для понимания коррозии . Мокрые элементы могут быть первичными (неперезаряжаемыми) или вторичными (перезаряжаемыми). Первоначально все практические первичные батареи, такие как элемент Даниэля, были построены как мокрые элементы в стеклянной банке с открытым верхом. Другими первичными влажными клетками являются клетки Лекланша , клетки Гроува , клетки Бунзена , клетки хромовой кислоты , клетки Кларка и клетки Вестона . Химический состав клеток Leclanche был адаптирован к первым сухим клеткам. Мокрые элементы до сих пор используются в автомобильных аккумуляторах и в промышленности для резервного питания распределительных устройств. , телекоммуникации или крупные источники бесперебойного питания , но во многих местах батареи с гелевыми элементами вместо них используются . В этих приложениях обычно используются свинцово-кислотные или никель-кадмиевые элементы. Батареи с расплавленной солью — это первичные или вторичные батареи, в которых в качестве электролита используется расплавленная соль. Они работают при высоких температурах и должны быть хорошо изолированы для сохранения тепла.
В сухом элементе используется пастообразный электролит с достаточным количеством влаги, чтобы обеспечить протекание тока. В отличие от влажного элемента, сухой элемент может работать в любом положении, не проливая жидкость, поскольку он не содержит свободной жидкости, что делает его пригодным для портативного оборудования. Для сравнения, первые влажные камеры обычно представляли собой хрупкие стеклянные контейнеры со свинцовыми стержнями, свисающими с открытого верха, и требовали осторожного обращения, чтобы избежать утечки. Свинцово-кислотные батареи не обладали безопасностью и портативностью сухих элементов до тех пор, пока не были разработаны гелевые батареи . Обычным сухим элементом является цинк-углеродная батарея , иногда называемая сухим элементом Лекланше , с номинальным напряжением 1,5 В , таким же, как и у щелочной батареи (поскольку в обеих используется одна и та же комбинация цинка и диоксида марганца ). Стандартный сухой элемент содержит цинковый анод, обычно в форме цилиндрического горшка, и угольный катод в форме центрального стержня. Электролит — хлорид аммония в виде пасты рядом с цинковым анодом. Оставшееся пространство между электролитом и угольным катодом занимает вторая паста, состоящая из хлорида аммония и диоксида марганца, причем последний действует как деполяризатор . В некоторых конструкциях хлорид аммония заменен хлоридом цинка .
Резервную батарею можно хранить в разобранном виде (неактивированном и не подающем электропитания) в течение длительного периода (возможно, лет). Когда аккумулятор необходим, то его собирают (например, путем добавления электролита); После сборки аккумулятор заряжен и готов к работе. Например, батарея электронного артиллерийского взрывателя может активироваться от выстрела из пушки. Ускорение разрушает капсулу с электролитом, которая активирует батарею и питает цепи взрывателя. Резервные батареи обычно рассчитаны на короткий срок службы (секунды или минуты) после длительного хранения (годы). для Активируемая водой батарея океанографических инструментов или военного применения активируется при погружении в воду.
28 февраля 2017 года Техасский университет в Остине выпустил пресс-релиз о новом типе твердотельной батареи , разработанной командой под руководством изобретателя литий-ионных батарей Джона Гуденаф , «которая может привести к более безопасной и быстрой зарядке». аккумуляторы с более длительным сроком службы для портативных мобильных устройств, электромобилей и стационарных накопителей энергии». [35] Также утверждается, что твердотельная батарея имеет «в три раза большую плотность энергии», что увеличивает срок ее службы, например, в электромобилях. Это также должно быть более экологически безопасным, поскольку в технологии используются менее дорогие, экологически чистые материалы, такие как натрий, добываемый из морской воды. Они также имеют гораздо более длительный срок службы. [36]
Sony разработала биологическую батарею , которая генерирует электричество из сахара способом, аналогичным процессам, наблюдаемым в живых организмах. Батарея вырабатывает электричество за счет использования ферментов, расщепляющих углеводы. [37]
с герметичным Свинцово-кислотная батарея клапаном и регулируемым клапаном (батарея VRLA) популярна в автомобильной промышленности в качестве замены свинцово-кислотных мокрых элементов. В аккумуляторе VRLA используется иммобилизованный электролит серной кислоты , что снижает вероятность утечки и продлевает срок хранения . [38] Аккумуляторы VRLA иммобилизуют электролит. Два типа:
- В гелевых батареях (или «гелевых элементах») используется полутвердый электролит.
- Батареи с абсорбированным стекломатом (AGM) поглощают электролит специальным матом из стекловолокна.
Другие портативные перезаряжаемые батареи включают несколько типов герметичных «сухих элементов», которые используются в таких устройствах, как мобильные телефоны и портативные компьютеры . К элементам этого типа (в порядке возрастания удельной мощности и стоимости) относятся никель-кадмиевые (NiCd), никель-цинковые (NiZn), никель-металлогидридные (NiMH) и литий-ионные (Li-ion) элементы. Литий-ионные аккумуляторы занимают на сегодняшний день самую большую долю на рынке перезаряжаемых аккумуляторов с сухими элементами. NiMH заменил NiCd в большинстве применений из-за его более высокой емкости, но NiCd по-прежнему используется в электроинструментах , радиостанциях двусторонней связи и медицинском оборудовании .
В 2000-х годах разработки включали батареи со встроенной электроникой, такие как USBCELL , которая позволяет заряжать батарею типа АА через USB- разъем, батареи с наношариками , обеспечивающие скорость разряда примерно в 100 раз большую, чем современные батареи, и интеллектуальные аккумуляторные блоки с отслеживанием состояния заряда. мониторы и схемы защиты аккумулятора, которые предотвращают повреждение при чрезмерной разрядке. Низкий саморазряд (LSD) позволяет заряжать аккумуляторные элементы перед отправкой.
литий-серные батареи . В самом длинном и высоком полете на солнечной энергии использовались [39]
Потребительские и промышленные сорта
Аккумуляторы всех типов производятся потребительского и промышленного назначения. В более дорогих батареях промышленного класса могут использоваться химические составы, которые обеспечивают более высокое соотношение мощности к размеру, имеют меньший саморазряд и, следовательно, более длительный срок службы, когда они не используются, большую устойчивость к утечкам и, например, способность выдерживать высокие температуры и влажность, связанные с ними. с медицинской стерилизацией в автоклаве. [40]
Комбинирование и управление
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( февраль 2022 г. ) |
Батареи стандартного формата вставляются в отсек для батарей устройства, в котором они используются. Если в устройстве не используются батареи стандартного формата, их обычно объединяют в специальный аккумуляторный блок , который вмещает несколько батарей в дополнение к таким функциям, как система управления батареями и изолятор батареи , которые обеспечивают равномерную зарядку и разрядку батарей.
Размеры
Первичные батареи, легко доступные потребителям, варьируются от крошечных кнопочных элементов, используемых в электрических часах, до элементов № 6, используемых в сигнальных цепях или других устройствах длительного действия. Вторичные ячейки изготавливаются очень больших размеров; очень большие батареи могут питать подводную лодку или стабилизировать электрическую сеть и помочь выровнять пиковые нагрузки.
По состоянию на 2017 год [update]Самая большая в мире батарея была построена в Южной Австралии компанией Tesla . Он может хранить 129 МВтч. [41] Батарея в провинции Хэбэй , Китай, которая может хранить 36 МВт электроэнергии, была построена в 2013 году и обошлась в 500 миллионов долларов. [42] Другая большая батарея, состоящая из никель-кадмиевых элементов, находилась в Фэрбенксе, Аляска . Он занимал площадь 2000 квадратных метров (22 000 квадратных футов) — больше футбольного поля — и весил 1300 тонн. Он был изготовлен компанией ABB для обеспечения резервного питания в случае отключения электроэнергии. Аккумулятор может обеспечить мощность 40 МВт в течение семи минут. [43] Натриево-серные батареи использовались для хранения энергии ветра . [44] Аккумуляторная система емкостью 4,4 МВтч, способная выдавать 11 МВт в течение 25 минут, стабилизирует мощность ветряной электростанции Аувахи на Гавайях. [45]
Сравнение
Эта статья нуждается в дополнительных цитатах для проверки . ( июнь 2021 г. ) |
Многие важные свойства элементов, такие как напряжение, плотность энергии, воспламеняемость, доступные конструкции элементов, диапазон рабочих температур и срок хранения, определяются химическим составом аккумуляторов. [46]
| Химия | Анод (-) | Катод (+) | Макс. напряжение, теоретическое (В) | Номинальное напряжение, практическое (В) | Удельная энергия (кДж/кг) | Разработка | Срок хранения при 25 °C, 80% емкости (месяцы) |
|---|---|---|---|---|---|---|---|
| Цинк-углерод | Зн | С | 1.6 | 1.2 | 130 | Недорого. | 18 |
| Цинк-хлорид | Зн | С | 1.5 | Также известен как «сверхмощный», недорогой. | |||
| Щелочная (диоксид цинка и марганца) | Зн | МnО 2 | 1.5 | 1.15 | 400-590 | Умеренная плотность энергии. Подходит для использования с высокими и низкими расходами. | 30 |
| Оксигидроксид никеля (диоксид цинка-марганца/оксигидроксид никеля) | 1.7 | Умеренная плотность энергии. Хорошо подходит для использования с высоким расходом воды. | |||||
| Литий (оксид лития-меди) Li-CuO | Что | CuO | 1.7 | Больше не производится. Заменены аккумуляторами из оксида серебра ( IEC типа «SR»). | |||
| Литий (дисульфид лития-железа) LiFeS 2 | Что | ФеС 2 | 1.8 | 1.5 | 1070 | Дорогой. Используется в батареях типа «плюс» или «дополнительно». | 337 [47] |
| Литий (литий-диоксид марганца) LiMnO 2 | Что | МnО 2 | 3.0 | 830–1010 | Дорогой. Используется только в устройствах с высоким расходом тока или при длительном сроке хранения из-за очень низкой скорости саморазряда. Один только «литий» обычно относится к этому типу химии. | ||
| Литий (литий-фторид углерода) Li–(CF) n | Что | (КФ) н | 3.6 | 3.0 | 120 | ||
| Литий (оксид лития-хрома) Li-CrO 2 | Что | КрО 2 | 3.8 | 3.0 | 108 | ||
| Литий ( литий-кремний ) | Ли 22 Си 5 | ||||||
| Оксид ртути | Зн | HgO | 1.34 | 1.2 | Высокий сток и постоянное напряжение. Запрещен в большинстве стран из-за проблем со здоровьем. | 36 | |
| Цинк-воздух | Зн | Около 2 | 1.6 | 1.1 | 1590 [48] | Используется в основном в слуховых аппаратах. | |
| Стеки Замбони | Зн | Ag или Au | 0.8 | Очень долгая жизнь. Очень низкий (наноампер, нА) ток | >2000 | ||
| Оксид серебра (серебро-цинк) | Зн | Аг 2 О | 1.85 | 1.5 | 470 | Очень дорого. Используется только в коммерческих целях в «кнопочных» элементах. | 30 |
| Магний | мг | МnО 2 | 2.0 | 1.5 | 40 |
| Химия | Напряжение ячейки | Удельная энергия (кДж/кг) | Плотность энергии (кДж/литр) | Комментарии |
|---|---|---|---|---|
| NiCd | 1.2 | 140 | Недорого. Высокий/низкий сток, умеренная плотность энергии. Может выдерживать очень высокие скорости разряда практически без потери емкости. Умеренная скорость саморазряда. Экологическая опасность из-за кадмия, использование которого сейчас практически запрещено в Европе. | |
| Свинцово-кислотный | 2.1 | 140 | Умеренно дорого. Умеренная плотность энергии. Умеренная скорость саморазряда. Более высокие скорости разряда приводят к значительной потере емкости. Экологическая опасность из-за свинца. Общее использование: автомобильные аккумуляторы. | |
| NiMH | 1.2 | 360 | Недорого. Работают лучше, чем щелочные батареи, в устройствах с более высоким потреблением энергии. Традиционная химия имеет высокую плотность энергии, но также и высокую скорость саморазряда. Новые химические элементы имеют низкую скорость саморазряда , но также и плотность энергии примерно на 25 % ниже. Используется в некоторых автомобилях. | |
| НиЦн | 1.6 | 360 | Умеренно недорого. Подходит устройство с высоким сливом. Низкая скорость саморазряда. Напряжение ближе к щелочным первичным элементам, чем к другим вторичным элементам. Никаких токсичных компонентов. Недавно представлен на рынке (2009 г.). Еще не установил послужной список. Наличие ограниченного размера. | |
| AgZn | 1.86 1.5 | 460 | Меньший объем, чем у эквивалентного литий-ионного аккумулятора. Очень дорогой из-за серебра. Очень высокая плотность энергии. Возможность очень высокого дренажа. Многие годы считался устаревшим из-за высоких цен на серебро. Ячейка страдает от окисления, если не используется. Реакции не до конца понятны. Напряжение на клеммах очень стабильное, но внезапно падает до 1,5 В при заряде 70–80% (предположительно, это связано с присутствием как оксида серебра, так и оксида серебра в положительной пластине; один из них потребляется первым). Использовался вместо основного аккумулятора (луноход). Вновь разрабатывается как замена Li-ion. | |
| ЛиФеПО 4 | 3.3 3.0 | 360 | 790 | Литий-железо-фосфатная химия. |
| Литий-ионный | 3.6 | 460 | Очень дорого. Очень высокая плотность энергии. Обычно не доступны батареи «обычных» размеров. Литий-полимерный аккумулятор часто используется в портативных компьютерах, цифровых фотоаппаратах, видеокамерах и мобильных телефонах. Очень низкий уровень саморазряда. Во время разряда напряжение на клеммах варьируется от 4,2 до 3,0 вольт. Летучий: возможен взрыв при коротком замыкании, перегреве или изготовлении с нарушением строгих стандартов качества. |
Производительность, емкость и разряд

Характеристики батареи могут меняться в зависимости от цикла нагрузки, цикла зарядки и срока службы из-за многих факторов, включая внутренний химический состав, ток потребления и температуру. При низких температурах батарея не может обеспечить такую большую мощность. Таким образом, в холодном климате некоторые автовладельцы устанавливают подогреватели аккумулятора, которые представляют собой небольшие электрические грелки, поддерживающие автомобильный аккумулятор в тепле.
аккумулятора Емкость — это количество электрического заряда, которое он может передать при номинальном напряжении. Чем больше электродного материала содержится в ячейке, тем больше ее емкость. Маленькая ячейка имеет меньшую емкость, чем большая ячейка с тем же химическим составом, хотя они развивают одинаковое напряжение холостого хода. [49] Емкость измеряется в таких единицах, как ампер-час (А·ч). Номинальная емкость батареи обычно выражается как произведение 20 часов работы на ток, который новая батарея может последовательно обеспечивать в течение 20 часов при температуре 20 °C (68 °F), оставаясь при этом выше указанного напряжения на клеммах на элемент. Например, аккумулятор емкостью 100 А·ч может выдавать ток 5 А в течение 20 часов при комнатной температуре . Доля накопленного заряда, которую может доставить аккумулятор, зависит от множества факторов, включая химический состав аккумулятора, скорость доставки заряда (ток), требуемое напряжение на клеммах, период хранения, температуру окружающей среды и другие факторы. [49]
Чем выше скорость разряда, тем ниже емкость. [50] Зависимость между током, временем разряда и емкостью свинцово-кислотной батареи аппроксимируется (в типичном диапазоне значений тока) законом Пейкерта :
где
- - емкость при разряде током 1 ампер.
- ток, потребляемый от аккумулятора ( А ).
- — это время (в часах), в течение которого может работать батарея.
- является постоянной величиной около 1,3.
Аккумуляторы, хранящиеся в течение длительного времени или разряжаемые на небольшую долю емкости, теряют емкость из-за наличия, как правило, необратимых побочных реакций , которые потребляют носители заряда без образования тока. Это явление известно как внутренний саморазряд. Кроме того, при перезарядке аккумуляторов могут возникнуть дополнительные побочные реакции, снижающие емкость для последующих разрядов. После достаточного количества перезарядок вся емкость теряется, и аккумулятор перестает вырабатывать энергию. Внутренние потери энергии и ограничения скорости прохождения ионов через электролит приводят к изменению эффективности батареи . Выше минимального порога разрядка с низкой скоростью обеспечивает большую емкость аккумулятора, чем с более высокой скоростью. Установка аккумуляторов с различной емкостью А·ч не влияет на работу устройства (хотя может повлиять на интервал работы), рассчитанного на определенное напряжение, если не превышены пределы нагрузки. Нагрузки с высоким потреблением энергии, такие как цифровые камеры, могут снизить общую емкость, как это происходит с щелочными батареями. Например, аккумулятор емкостью 2 А·ч при разрядке в течение 10 или 20 часов не выдержит ток 1 А в течение полных двух часов, как предполагает его заявленная емкость.
C -rate — это мера скорости, с которой аккумулятор заряжается или разряжается. Он определяется как ток через батарею, разделенный на теоретическое потребление тока, при котором батарея обеспечит свою номинальную номинальную емкость за один час. [51] Он имеет единицы h −1 . Из-за потери внутреннего сопротивления и химических процессов внутри элементов батарея редко обеспечивает номинальную емкость всего за один час. Обычно максимальная емкость достигается при низком уровне C, а зарядка или разрядка при более высоком уровне C сокращает срок службы и емкость аккумулятора. Производители часто публикуют таблицы данных с графиками, показывающими кривые мощности и C-rate. C-rate также используется в качестве рейтинга батарей для обозначения максимального тока, который батарея может безопасно отдавать в цепи. Стандарты для перезаряжаемых батарей обычно оценивают емкость и циклы зарядки в течение 4 часов (0,25C), 8 часов (0,125C) или более длительного времени разрядки. Типы, предназначенные для специальных целей, например, в компьютерных источниках бесперебойного питания , могут быть рассчитаны производителями на периоды разряда намного меньше одного часа (1C), но могут иметь ограниченный срок службы.
По состоянию на 2012 год [update], фосфат лития-железа ( LiFePO
4 ) аккумуляторная технология оказалась самой быстрой зарядкой/разрядкой, полностью разряжаясь за 10–20 секунд. [52]
Продолжительность жизни

Срок службы батареи (и его синоним срока службы батареи) имеет два значения для перезаряжаемых батарей и только одно для незаряжаемых. Для аккумуляторных батарей это может означать либо время, в течение которого устройство может работать от полностью заряженной батареи, либо количество возможных циклов зарядки/разрядки, прежде чем элементы перестанут работать удовлетворительно. Для неперезаряжаемых аккумуляторов эти два срока службы равны, поскольку по определению ячейки служат только один цикл. Термин « срок годности» используется для описания того, как долго батарея будет сохранять свои рабочие характеристики между изготовлением и использованием. Доступная емкость всех аккумуляторов падает с понижением температуры. В отличие от большинства современных батарей, батарея Замбони , изобретенная в 1812 году, обеспечивает очень длительный срок службы без ремонта и подзарядки, хотя она обеспечивает ток только в диапазоне наноампер. Оксфордский электрический звонок звонит почти непрерывно с 1840 года на своей оригинальной паре батареек, предположительно, сваях Замбони. [ нужна ссылка ]
Одноразовые батареи обычно теряют 8–20% своего первоначального заряда в год при хранении при комнатной температуре (20–30 °C). [53] Это известно как скорость «саморазряда» и обусловлено бестоковыми «побочными» химическими реакциями, которые происходят внутри элемента даже при отсутствии нагрузки. Скорость побочных реакций снижается для батарей, хранящихся при более низких температурах, хотя некоторые из них могут быть повреждены при замерзании, а хранение в холодильнике не продлит существенно срок годности и может привести к повреждению конденсата. [54] Старые аккумуляторные батареи саморазряжаются быстрее, чем одноразовые щелочные батареи, особенно батареи на основе никеля; только что заряженная никель-кадмиевая (NiCd) батарея теряет 10% своего заряда в течение первых 24 часов, а затем разряжается со скоростью около 10% в месяц. Однако новые никель-металлогидридные (NiMH) батареи с низким саморазрядом и современные литиевые батареи имеют более низкую скорость саморазряда (но все же выше, чем у первичных батарей).
Активный материал на пластинах аккумулятора меняет химический состав при каждом цикле зарядки и разрядки; активный материал может быть потерян из-за физических изменений объема, что еще больше ограничивает количество перезарядок аккумулятора. Большинство аккумуляторов на основе никеля при покупке частично разряжены, и перед первым использованием их необходимо зарядить. [55] Новые NiMH аккумуляторы готовы к использованию при покупке и разряжаются всего на 15% в год. [56]
Некоторое ухудшение происходит при каждом цикле зарядки-разрядки. Деградация обычно происходит из-за миграции электролита от электродов или из-за отделения активного материала от электродов. NiMH-аккумуляторы малой емкости (1700–2000 мА·ч) можно заряжать около 1000 раз, тогда как NiMH-аккумуляторы большой емкости (свыше 2500 мА·ч) служат около 500 циклов. [57] NiCd-аккумуляторы обычно рассчитаны на 1000 циклов, прежде чем их внутреннее сопротивление навсегда превысит допустимые значения. Быстрая зарядка увеличивает необходимость замены компонентов, сокращая срок службы батареи. [57] Если зарядное устройство не может определить, когда аккумулятор полностью заряжен, то, скорее всего, перезарядка приведет к его повреждению. [58]
NiCd-элементы, если их использовать определенным образом, могут проявлять снижение емкости, называемое « эффектом памяти ». [59] Эффекта можно избежать с помощью простых практик. NiMH-элементы, хотя и схожи по химическому составу, меньше страдают от эффекта памяти. [60]
Автомобильные свинцово-кислотные аккумуляторные батареи должны выдерживать нагрузки из-за вибрации, ударов и температурного диапазона. Из-за этих напряжений и сульфатации свинцовых пластин немногие автомобильные аккумуляторы служат более шести лет при регулярном использовании. [61] Автомобильные пусковые аккумуляторы ( SLI : стартер, освещение, зажигание ) имеют множество тонких пластин для максимизации тока. В общем, чем толще пластины, тем дольше срок службы. Обычно они разряжаются лишь незначительно перед перезарядкой. Свинцово-кислотные батареи «глубокого цикла», такие как те, которые используются в электрических тележках для гольфа, имеют гораздо более толстые пластины, что увеличивает срок их службы. [62] Основным преимуществом свинцово-кислотного аккумулятора является его низкая стоимость; его основные недостатки – большие габариты и вес для заданной мощности и напряжения. Свинцово-кислотные аккумуляторы ни в коем случае нельзя разряжать ниже 20% своей емкости. [63] поскольку внутреннее сопротивление приведет к перегреву и повреждению при перезарядке. Свинцово-кислотные системы с глубоким циклом часто используют сигнальную лампу низкого заряда или выключатель питания при низком заряде, чтобы предотвратить тип повреждения, который сокращает срок службы аккумулятора. [64]
Срок службы батарей можно продлить, храня их при низкой температуре, например, в холодильнике или морозильной камере , что замедляет побочные реакции. Такое хранение может продлить срок службы щелочных батарей примерно на 5%; Аккумуляторные батареи могут удерживать заряд гораздо дольше, в зависимости от типа. [65] Чтобы достичь максимального напряжения, батареи необходимо вернуть к комнатной температуре; разрядка щелочной батареи током 250 мА при 0 °C вдвое менее эффективна, чем при 20 °C. [33] Производители щелочных батарей, такие как Duracell, не рекомендуют охлаждать батареи. [32]
Опасности
Этот раздел нуждается в дополнительных цитатах для проверки . ( Апрель 2017 г. ) |

Взрыв батареи обычно вызван неправильным использованием или неисправностью, например, попыткой перезарядить основную (неперезаряжаемую) батарею или коротким замыканием .
Когда аккумулятор перезаряжается с чрезмерной скоростью, взрывоопасная газовая смесь водорода и кислорода может образоваться быстрее, чем она сможет выйти из аккумулятора (например, через встроенное вентиляционное отверстие), что приведет к повышению давления и возможному взрыву аккумулятора. корпус батареи. В крайних случаях химикаты аккумуляторной батареи могут сильно разбрызгиваться из корпуса и причинять травмы. Экспертное заключение о проблеме указывает на то, что этот тип использует «жидкие электролиты для транспортировки ионов лития между анодом и катодом. Если аккумуляторная батарея заряжается слишком быстро, это может вызвать короткое замыкание, приводящее к взрывам и пожарам». [66] [67] Автомобильные аккумуляторы чаще всего взрываются, когда короткое замыкание генерирует очень большие токи. Такие батареи выделяют водород , который очень взрывоопасен при перезарядке (из-за электролиза воды в электролите). При нормальном использовании степень перезарядки обычно очень мала и выделяется мало водорода, который быстро рассеивается. Однако при запуске автомобиля от внешнего источника высокий ток может вызвать быстрое выделение больших объемов водорода, который может воспламениться от ближайшей искры, например, при отсоединении соединительного кабеля .
Перезарядка (попытка зарядить батарею сверх ее электрической емкости) также может привести к взрыву батареи, помимо утечки или необратимого повреждения. Это также может привести к повреждению зарядного устройства или устройства, в котором впоследствии будет использоваться перезаряженный аккумулятор.
Утилизация батареи путем сжигания может привести к взрыву из-за скопления пара внутри герметичного корпуса.

Многие химические вещества для аккумуляторов являются коррозийными, ядовитыми или и тем, и другим. Если утечка произойдет спонтанно или случайно, высвободившиеся химические вещества могут быть опасными. Например, в одноразовых батареях часто используется цинковая «банка» как в качестве реагента, так и в качестве контейнера для хранения других реагентов. Если батарея такого типа чрезмерно разряжена, реагенты могут выйти через картон и пластик, образующие остальную часть контейнера. Утечка активных химикатов может привести к повреждению или выводу из строя оборудования, питаемого от батарей. По этой причине многие производители электронных устройств рекомендуют извлекать батареи из устройств, которые не будут использоваться в течение длительного времени.
Во многих типах батарей используются токсичные материалы, такие как свинец, ртуть и кадмий в качестве электрода или электролита . Когда срок службы каждой батареи подходит к концу, ее необходимо утилизировать, чтобы предотвратить ущерб окружающей среде. [68] Батарейки являются одной из форм электронных отходов (электронных отходов). Службы по переработке электронных отходов восстанавливают токсичные вещества, которые затем можно использовать для изготовления новых батарей. [69] Из почти трёх миллиардов батарей, приобретаемых ежегодно в США, около 179 000 тонн оказываются на свалках по всей стране. [70]
батареек может нанести вред или привести к летальному исходу Проглатывание . [71] Маленькие кнопочные батарейки могут быть проглочены, особенно маленькими детьми. Электрический разряд батареи в пищеварительном тракте может привести к повреждению тканей; [72] такие повреждения иногда являются серьезными и могут привести к смерти. Проглатывание дисковых батарей обычно не вызывает проблем, если только они не застревают в желудочно-кишечном тракте . Наиболее частым местом застревания дисковых батарей является пищевод, что приводит к клиническим последствиям . Батарейки, успешно прошедшие через пищевод, вряд ли окажутся где-либо еще. Вероятность того, что дисковая батарея застрянет в пищеводе, зависит от возраста пациента и размера батареи. У детей постарше проблем с батарейками размером менее 21–23 мм не возникает. Может возникнуть разжижающий некроз, поскольку гидроксид натрия генерируется током, вырабатываемым батареей (обычно на аноде). Перфорация произошла уже через 6 часов после проглатывания. [73]
Некоторые производители аккумуляторов добавляют в аккумуляторы неприятный привкус, чтобы предотвратить их проглатывание. [74]
Законодательство и регулирование
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( февраль 2022 г. ) |
Законодательство об электрических батареях включает такие темы, как безопасная утилизация и переработка.
В Соединенных Штатах Закон об управлении ртутьсодержащими и перезаряжаемыми батареями 1996 года запретил продажу ртутьсодержащих батарей, ввел единые требования к маркировке аккумуляторных батарей и потребовал, чтобы аккумуляторные батареи можно было легко снимать. [75] Калифорния и Нью-Йорк запрещают выбрасывать аккумуляторы вместе с твердыми отходами. [76] [77] Производители аккумуляторных батарей реализуют общенациональные программы утилизации в США и Канаде с пунктами приема у местных розничных продавцов. [78]
Директива по батареям Европейского Союза содержит аналогичные требования, а также требует увеличения переработки батарей и содействия исследованиям улучшенных методов переработки батарей . [79] В соответствии с этой директивой все батареи, продаваемые на территории ЕС, должны быть отмечены «символом сбора» (перечеркнутый мусорный бак на колесиках). Оно должно покрывать не менее 3% поверхности призматических батарей и 1,5% поверхности цилиндрических батарей. Вся упаковка должна быть маркирована аналогичным образом. [80]
В связи с сообщениями об авариях и сбоях, иногда возгораниях или взрывах, в последние годы все чаще стали отзываться об устройствах, использующих литий-ионные батареи. [81] [82]
9 декабря 2022 г. Парламент ЕС достиг соглашения, согласно которому с 2026 г. производители должны проектировать все электроприборы, продаваемые в ЕС (и не используемые преимущественно во влажных условиях), так, чтобы потребители могли легко извлекать и заменять батареи самостоятельно. [83] [84]
См. также
Ссылки
- ^ Кромптон, TR (20 марта 2000 г.). Справочник по батареям (третье изд.). Ньюнес. п. Глоссарий 3. ISBN 978-0-08-049995-6 . Проверено 18 марта 2016 г.
- ^ Полинг, Лайнус (1988). «15: Окислительно-восстановительные реакции. Электролиз». Общая химия . Нью-Йорк: Dover Publications, Inc., с. 539 . ISBN 978-0-486-65622-9 .
- ^ Пистойя, Джанфранко (25 января 2005 г.). Аккумуляторы для портативных устройств . Эльзевир. п. 1. ISBN 978-0-08-045556-3 . Проверено 18 марта 2016 г.
- ^ «История и развитие аккумуляторов» . 30 апреля 2015 г.
- ^ « Электрическая батарея» из лейденских банок – Трехсотлетие Бенджамина Франклина» . www.benfranklin300.org .
- ^ Беллис, Мэри. Биография Алессандро Вольты, изобретателя батареи. О сайте.com . Проверено 7 августа 2008 г.
- ^ Стиннер, Артур. Алессандро Вольта и Луиджи Гальвани. Архивировано 10 сентября 2008 года в Wayback Machine (PDF). Проверено 11 августа 2008 г.
- ^ Увлекательные факты об изобретении Алессандро Вольтой электрической батареи в 1800 году. Поиск великой идеи . Проверено 11 августа 2008 г.
- ^ например, при открытии электромагнетизма в 1820 году.
- ^ История батареи, технологии, приложения и разработки . Компания MPower Solutions Ltd. Проверено 19 марта 2007 г.
- ^ Борвон, Жерар (10 сентября 2012 г.). «История электрических агрегатов» . Ассоциация С-ЕАУ-С.
- ^ «Колумбийская сухая батарея» . Национальные исторические химические достопримечательности . Американское химическое общество. Архивировано из оригинала 23 февраля 2013 года . Проверено 25 марта 2013 г.
- ^ Jump up to: а б с Брудермюллер, Мартин; Соботка, Бенедикт; Доминик, Ворей (сентябрь 2019 г.). Аналитический отчет — Видение цепочки создания стоимости устойчивых аккумуляторов в 2030 году: раскрытие всего потенциала для обеспечения устойчивого развития и смягчения последствий изменения климата (PDF) (Отчет). Всемирный экономический форум и Глобальный аккумуляторный альянс. стр. 11, 29 . Проверено 2 июня 2021 г.
- ^ Сиано, Пьерлуиджи (2014). «Реакция спроса и интеллектуальные сети – исследование». Обзоры возобновляемой и устойчивой энергетики . 30 . Эльзевир: 461–478. дои : 10.1016/j.rser.2013.10.022 . ISSN 1364-0321 .
- ^ Пан, AQ; Ли, XZ; Шан, Дж; Фэн, Дж. Х.; Тао, Ю.Б.; Да, Джей Эл; Ян, Х; Ли, С; Ляо, QQ (2019). В приложениях эшелона используются аккумуляторы от электромобилей до распределенных систем хранения энергии . Международная конференция 2019 года по новой энергетике и энергетическим системам будущего (серия IOP Conf.: Наука о Земле и окружающей среде). Том. 354. IOP Publishing Ltd. doi : 10.1088/1755-1315/354/1/012012 . 012012.
- ^ Лейш, Дженнифер Э.; Черняховский, Илья (сентябрь 2019 г.). Сетчатое аккумуляторное хранилище: часто задаваемые вопросы (PDF) (отчет). Национальная лаборатория возобновляемых источников энергии (NREL) и greeningthegrid.org . Проверено 21 мая 2021 г.
- ^ Эшкрофт, Северо-Запад; Мермин (1976). Физика твердого тела . Северная Дакота, Бельмонт, Калифорния: Брукс/Коул.
- ^ Динграндо 665.
- ^ Саслоу 338.
- ^ Динграндо 666.
- ^ Jump up to: а б Рыцарь 943.
- ^ Jump up to: а б Рыцарь 976.
- ^ Напряжение на клеммах. Справочник по Тискали. Первоначально из Энциклопедии Хатчинсона . Проверено 7 апреля 2007 г.
- ^ Динграндо 674.
- ^ Динграндо 677.
- ^ «Лимонный аккумулятор» . ushistory.org . Архивировано из оригинала 9 мая 2007 года . Проверено 10 апреля 2007 г.
- ^ Деятельность ZOOM: Phenom Potato Battery . По состоянию на 10 апреля 2007 г.
- ^ Howstuffworks «Эксперименты с батареями: Вольтов столб» . По состоянию на 10 апреля 2007 г.
- ^ Динграндо 675.
- ^ Финк, Ч. 11, разд. «Батареи и топливные элементы».
- ^ Франклин Леонард Поуп , Современная практика электрического телеграфа, 15-е издание , Компания Д. Ван Ностранда, Нью-Йорк, 1899, стр. 7–11. Доступно в Интернет-архиве.
- ^ Jump up to: а б Duracell: уход за аккумулятором . Проверено 10 августа 2008 г.
- ^ Jump up to: а б Справочник и руководство по применению щелочного диоксида марганца (PDF). Энергайзер . Проверено 25 августа 2008 г.
- ^ «В центре внимания фотоэлектрические элементы и топливные элементы: интернет-исследование и сравнение» (PDF) . стр. 1–2 . Проверено 14 марта 2007 г.
- ^ «Изобретатель литий-ионных аккумуляторов представляет новую технологию быстрой зарядки негорючих аккумуляторов» . Техасский университет в Остине . Техасский университет. 28 февраля 2017 года . Проверено 15 марта 2017 г.
- ^ Хислоп, Мартин (1 марта 2017 г.). «Прорыв в создании твердотельных аккумуляторов для электромобилей от изобретателя литий-ионных аккумуляторов Джона Гуденаф» . Новости энергетики Северной Америки . Американские энергетические новости . Проверено 15 марта 2017 г.
Но даже работа Джона Гуденаф не меняет моего прогноза, что электромобилям потребуется как минимум 50 лет, чтобы занять от 70 до 80 процентов мирового автомобильного рынка.
- ^ Sony разрабатывает биобатарею, работающую на сахаре. Архивировано 11 октября 2007 года в Wayback Machine . По состоянию на 24 августа 2007 г.
- ^ Батареи Dynasty VRLA и их применение. Архивировано 6 февраля 2009 года в Wayback Machine . C&D Technologies, Inc. Проверено 26 августа 2008 г.
- ^ Амос, Дж. (24 августа 2008 г.) «Самолет на солнечной энергии совершил рекордный полет» BBC News
- ^ Адамс, Луи (ноябрь 2015 г.). «Энергия для медицины завтрашнего дня: критические решения для батарей в медицинских целях» . Медицинские дизайнерские записки .
- ^ «Илон Маск выиграл пари на 50 миллионов долларов с гигантской батареей для Южной Австралии» . Небесные новости . 24 ноября 2017 года . Проверено 20 сентября 2018 г.
- ^ Диллоу, Клей (21 декабря 2012 г.). «Китай строит самую большую в мире батарею, чудовище размером со здание, мощностью 36 мегаватт-час | Научно-популярная статья» . Popsci.com . Проверено 31 июля 2013 г.
- ↑ Конвей, Э. (2 сентября 2008 г.) «Самая большая батарея в мире включилась на Аляске» Telegraph.co.uk
- ↑ Бьелло, Д. (22 декабря 2008 г.) «Сохранение бриза: новая батарея может сделать энергию ветра более надежной» Scientific American
- ^ «Auwahi Wind | Energy Solutions | Sempra US Gas & Power, LLC» . Semprausgp.com. Архивировано из оригинала 2 мая 2014 года . Проверено 31 июля 2013 г.
- ^ «Как работает аккумулятор» . Любопытный . 25 февраля 2016 г. Архивировано из оригинала 26 марта 2022 г.
- ^ «Справочник и руководство по применению дисульфида лития и железа» (PDF) . energizer.com . Архивировано из оригинала (PDF) 17 марта 2006 года . Проверено 20 сентября 2018 г.
- ^ Без учета массы воздушного окислителя.
- ^ Jump up to: а б Знания о батареях - AA Portable Power Corp. Проверено 16 апреля 2007 г. Архивировано 23 мая 2007 г. на Wayback Machine.
- ^ «Емкость аккумулятора» . techlib.com .
- ^ Руководство по пониманию характеристик аккумуляторов , команда MIT по электромобилям, декабрь 2008 г.
- ^ Канг, Б.; Седер, Г. (2009). «Аккумуляторные материалы для сверхбыстрой зарядки и разрядки». Природа . 458 (7235): 190–193. Бибкод : 2009Natur.458..190K . дои : 10.1038/nature07853 . ПМИД 19279634 . S2CID 20592628 . 1:00–6:50 (аудио). Архивировано 22 февраля 2012 г. в Wayback Machine.
- ^ Саморазряд аккумуляторов. Коррозионные врачи. Проверено 9 сентября 2007 г.
- ^ Тугенд, Алина (10 ноября 2007 г.). «При покупке аккумуляторов необходимо принять достаточно решений, чтобы истощить этого кролика» . Нью-Йорк Таймс . Проверено 6 июля 2024 г.
- ^ Аккумуляторы и зарядные устройства Energizer: часто задаваемые вопросы. Архивировано 9 февраля 2009 г. в Wayback Machine . Энергайзер . Проверено 3 февраля 2009 г.
- ^ «eneloop, экологически чистые и энергосберегающие аккумуляторы | Panasonic eneloop» . www.panasonic-eneloop.eu . Архивировано из оригинала 2 февраля 2010 года.
- ^ Jump up to: а б Советы по использованию аккумуляторной батареи. Информация о технологии NIMH. Проверено 10 августа 2007 г.
- ^ Мифы о батареях против фактов о батареях. Проверено 10 августа 2007 г.
- ^ Филип М. Гещикевич. «Часто задаваемые вопросы по Sci.Electronics: дополнительная информация о батарее» . www.repairfaq.org .
- ^ RechargheableBatteryInfo.com, изд. (28 октября 2005 г.), Что означает «эффект памяти»? , архивировано из оригинала 15 июля 2007 г. , получено 10 августа 2007 г.
- ^ Рич, Винсент (1994). Международная торговля свинцом . Кембридж: Вудхед. 129.
- ^ Часто задаваемые вопросы по батареям глубокого цикла. Архивировано 22 июля 2010 г. в Wayback Machine . Северная Аризона Ветер и Солнце . Проверено 3 февраля 2009 г.
- ^ Часто задаваемые вопросы об автомобилях и аккумуляторах глубокого цикла. Архивировано 6 ноября 2020 г. на Wayback Machine . Радужная энергетическая компания . Проверено 3 февраля 2009 г.
- ^ Руководство по батареям глубокого цикла. Архивировано 17 февраля 2009 г. в Wayback Machine . Энергия имеет значение . Проверено 3 февраля 2009 г.
- ^ Спросите Yahoo: продлевает ли срок службы батарей, если положить их в морозильную камеру? Архивировано 27 апреля 2006 года в Wayback Machine . Проверено 7 марта 2007 г.
- ^ Хислоп, Мартин (1 марта 2017 г.). «Прорыв в создании твердотельных аккумуляторов для электромобилей от изобретателя литий-ионных аккумуляторов Джона Гуденаф» . Новости энергетики Северной Америки . Американские энергетические новости . Проверено 15 марта 2017 г.
- ^ «опасность аккумулятора» . Ютуб . Проверено 20 сентября 2018 г.
- ^ Батареи. Агентство по охране окружающей среды . Проверено 11 сентября 2007 г.
- ^ Переработка аккумуляторов »Земля 911. Архивировано 12 октября 2008 г. в Wayback Machine . Проверено 9 сентября 2007 г.
- ^ «Инспектор Сан-Франциско борется с токсичными отходами аккумуляторов» . Сеть экологических новостей (11 июля 2001 г.).
- ^ «Паспорт безопасности продукта. Energizer (стр. 2). Проверено 9 сентября 2007 г.» (PDF) . Архивировано из оригинала (PDF) 27 сентября 2007 года . Проверено 9 сентября 2007 г.
- ^ «Проглотил батарейку? | Батарея в носу или ухе?» . Яд.орг. 3 марта 2010 г. Архивировано из оригинала 16 августа 2013 г. . Проверено 26 июля 2013 г.
- ^ Дайр, Дэниел Дж. (9 июня 2016 г.), Верье, Дэвид (редактор), «Проглатывание дисковой батареи: предыстория, патофизиология, эпидемиология» , Medscape
- ^ Батти с горьким вкусом препятствует проглатыванию.
- ^ «Закон об обращении с ртутьсодержащими и перезаряжаемыми батареями» (PDF) . Агентство по охране окружающей среды . Проверено 15 февраля 2021 г.
- ^ «Переработка аккумуляторов в Нью-Йорке… это закон!» . call2recycle.org. 31 октября 2013 года . Проверено 2 июня 2021 г.
- ^ Законопроект № 1125 — Закон об утилизации аккумуляторных батарей 2006 г., штат Калифорния (PDF) , 2006 г. , получено 2 июня 2021 г.
- ^ «Корпорация по переработке аккумуляторных батарей» . www.rbrc.org . Архивировано из оригинала 12 августа 2008 года . Проверено 15 января 2022 г.
- ^ Утилизация отработанных батареек и аккумуляторов . Евросоюз . Проверено 27 июля 2009 г.
- ^ «Руководство по требованиям к маркировке портативных батарей в Европейском Союзе, 2008 г.» (PDF) . EPBA-ЕС. Архивировано из оригинала (PDF) 7 октября 2011 года.
- ^ Швебер, Билл (4 августа 2015 г.). «Литиевые батареи: плюсы и минусы» . ГлобалСпец . ГлобалСпец . Проверено 15 марта 2017 г.
- ^ Фаулер, Сюзанна (21 сентября 2016 г.). «Отзыв Samsung – проблема с литий-ионными батареями» . Нью-Йорк Таймс . Нью-Йорк . Проверено 15 марта 2016 г.
- ^ «Батарейки: договоренность о новых правилах ЕС в отношении проектирования, производства и переработки отходов» . Новости Европарламента (Пресс-релиз). Европейский парламент . 9 декабря 2022 года. Архивировано из оригинала 11 декабря 2022 года . Проверено 11 декабря 2022 г.
- ^ «Новые правила ЕС: каждый должен иметь возможность самостоятельно заменить аккумуляторы в смартфонах». Бизнес. Зеркало (на немецком языке). 9 декабря 2022 года. Архивировано из оригинала 11 декабря 2022 года . Проверено 11 декабря 2022 г.
Библиография
- Динграндо, Лорел; и др. (2007). Химия: материя и изменения . Нью-Йорк: Гленко/МакГроу-Хилл. ISBN 978-0-07-877237-5 . Ч. 21 (стр. 662–695) посвящен электрохимии.
- Финк, Дональд Г .; Х. Уэйн Бити (1978). Стандартный справочник для инженеров-электриков, одиннадцатое издание . Нью-Йорк: МакГроу-Хилл. ISBN 978-0-07-020974-9 .
- Найт, Рэндалл Д. (2004). Физика для ученых и инженеров: стратегический подход . Сан-Франциско: Pearson Education. ISBN 978-0-8053-8960-9 . Чс. 28–31 (стр. 879–995) содержат информацию об электрическом потенциале.
- Линден, Дэвид; Томас Б. Редди (2001). Справочник по батареям . Нью-Йорк: МакГроу-Хилл. ISBN 978-0-07-135978-8 .
- Саслоу, Уэйн М. (2002). Электричество, магнетизм и свет . Торонто: Thomson Learning. ISBN 978-0-12-619455-5 . Чс. 8–9 (стр. 336–418) содержат дополнительную информацию о батареях.
- Тернер, Джеймс Мортон. Обвинено: История батарей и уроки для будущего чистой энергетики (University of Washington Press, 2022). онлайн-обзор
Внешние ссылки
 СМИ, связанные с электрическими батареями, на Викискладе?
СМИ, связанные с электрическими батареями, на Викискладе? - Батарейки в Керли
- Неперезаряжаемые батареи (архивировано 22 октября 2013 г.)
- HowStuffWorks: Как работают батареи
- Другие типы аккумуляторных батарей
- Пакет обучения и обучения DoITPoMS - «Батареи»












