Органоурская химия
Органоаронная химия - химия соединений железа, содержащей углерода -железа химическую связь . [ 1 ] [ 2 ] Урганоронные соединения имеют отношение к органическому синтезу как реагенты, такие как железо пентакарбонил , дирон некарбонил и тетракарбонилферрат . Хотя железо, как правило, менее активно во многих каталитических применениях, оно менее дорого и « зеленее », чем другие металлы. [ 3 ] Урганоронные соединения оснащены широким спектром лигандов , которые поддерживают связь Fe-C; Как и в других органометалах, эти опорные лиганды заметно включают фосфины , угарный газ и циклопентадиенил , но твердые лиганды, также используются такие как амины.
Железо (–ii) и железо (0)
[ редактировать ]
Карбонильные комплексы
[ редактировать ]Важными железными карбонилами являются три нейтральных бинарных карбонилов, железный пентакарбонил , дирон некарбонил и Triiron Dodecacarbonyl . Один или несколько карбонильных лигандов в этих соединениях можно заменить множеством других лигандов, включая алкены и фосфины. Комплекс железа (–ii), тетракарбонилферрат дизодий (Na 2 [Fe (Co) 4 ]), также известный как «реагент -коллман», готовит путем снижения пентакарбонила железа с металлическим натрием. Высоко нуклеофильный анионный реагент может быть алкилированным и карбонилированным, чтобы дать ацильные производные, которые подвергаются протонолизу с получением альдегидов: [ 4 ]
- Жизнь (c) 4 (c (o) r) + h + → RCHO (+ железо, содержащие продукты)
Подобные железные ацилы можно получить путем обработки железа пентакарбонила с организмом организма:
- Arli + fe (co) 5 → Life (co) 4 c (o) ar
В этом случае Карбанион нападает на лиганд. В дополнительной реакции реагент Collman может быть использован для преобразования ацилхлоридов в альдегиды. Подобные реакции могут быть достигнуты с помощью [HFE (CO) 4 ] − соли [ 5 ]
Алкен-Fe (0) -co Деривативы
[ редактировать ]
Моноалкен
[ редактировать ]Железный пентакарбонил реагирует фотохимически с помощью алкенов с получением Fe (Co) 4 (Alkene). [ 6 ]
Diene-Fe (0) -co Деривативы
[ редактировать ]Железные комплексы обычно готовится из Fe (CO) 5 или Fe 2 (CO) 9 . Производные известны общими диенами, такими как циклогексадиен , [ 7 ] Норборндиен и циклооктадиен , но даже циклобутадиен может быть стабилизирован. В комплексе с бутадиеном диен принимает цис-конформацию . Железные карбонилы являются потенциальными защитными группами для диен, защищая их от гидрирования и реакций Дильса-Альдер . Cyclobutadieneiron Tricarbonyl готовится из 3,4-дихлорциклобутена и Fe 2 (Co) 9 .
Циклогексадиены, многие из которых получены от восстановления ароматических соединений, производных формы (диена) Fe (CO) 3 . Аффинность подразделения Fe (CO) 3 к конъюгированным диенам проявляется в способности железных карбонилов, катализирующих изомеризации 1,5 - циклоктадиена до 1,3-циклоктадиена . Комплексы циклогексадиенов подвергаются гидридной абстракции с получением циклогексадиенильных катионов, которые добавляют нуклеофилы. Абстракция гидридов из комплексов циклогексадиена (0) дает железные производные. [ 8 ] [ 9 ]
Комплекс Enone (бензилиденацетон) железный трикарбонил служит источником субъединицы Fe (Co) 3 и используется для подготовки других производных. Он используется аналогично Fe 2 (co) 9 .
Алкин-Фе (0) -co Деривативы
[ редактировать ]Алкины реагируют с железными карбонилами, чтобы дать большое разнообразие производных. Производные включают феррол (Fe 2 (C 4 R 4 ) (CO) 6 ), (P- Quinone ) Fe (CO) 3 , (Cyclobutadiene) Fe (CO) 3 и многие другие. [ 10 ]
Три- и полиеновые комплексы (0) комплексы
[ редактировать ]Стабильные железосодержащие комплексы с лигандами CO и без него известны широким спектром полиненасыщенных углеводородов, например , циклогептиен , азулен и бульвален . В случае циклооктатетраена (COT) производные включают Fe (COT) 2 , [ 11 ] Fe 3 (локоть) 3 , [ 12 ] и несколько смешанных кот-карбонилов (например, Fe (COT) (CO) 3 и Fe 2 (COT) (CO) 6 ).

Железо (i) и железо (II)
[ редактировать ]Поскольку Fe (II) является общим состоянием окисления для Fe, известны многие органоронный (II) соединения. Соединения Fe (i) часто показывают связи Fe-Fe, но происходят исключения, такие как [Fe (антрацен) 2 ] − . [ 13 ]
Ферроцена и его производные
[ редактировать ]Быстрый рост органометаллической химии в 20 -м веке может быть прослежен до открытия ферроцена , очень стабильного соединения, которое предвещало синтез многих связанных сэндвич -соединений . Ферроцен образуется реакцией циклопентадиенида натрия с хлоридом железа (II) :
- 2 NAC 5 H 5 + FECL 2 → FE (C 5 H 5 ) 2 + 2 NaCl
Ферроцен демонстрирует разнообразную реакционную способность, локализованную на циклопентадиенил -лигандах, включая реакции Фриделя -Крафта и литучение. Однако некоторые электрофильные реакции функционализации продолжаются посредством первоначальной атаки в центре FE, чтобы дать склонность [CP 2 Fe - Z] + виды (которые формально Fe (IV)). Например, HF: PF 5 и HG (OTFA) 2 , дают изолируемые или спектроскопически наблюдаемые комплексы [CP 2 Fe - H] + ПФ 6 – и CP 2 Fe + –Hg – (OTFA) 2 соответственно. [ 14 ] [ 15 ] [ 16 ]
Фероцена также является структурно необычным каркасом, как показано популярностью лигандов, таких как 1,1'-бис (дифенилфосфино) ферроцена , которые полезны в катализе. [ 17 ] Обработка ферроцена алюминиевым трихлоридом и бензолом дает катион [CPFE (C 6 H 6 )]]] + Полем Окисление ферроцена дает голубого вида 17e ферроцениум . Производные фуллерена также могут выступать в качестве сильно замещенного циклопентадиенил -лиганда.
FP 2 , FP − и FP + и производные
[ редактировать ]Fe (CO) 5 реагирует с циклопентадиеном Dinuclear Fe (I) , чтобы получить диван -дикарбонил дикарбониловый димер (FECP (CO) 2 ) , часто сокращается как FP 2 . Пиролиз FP 2 дает кубоидальный кластер [FECP (CO)] 4 .
Очень затрудненные замещенные циклопентадиенил -лиганды могут давать изоляционные мономерные виды Fe (I). Например, cp I-pr5 Fe (co) 2 (cp I-pr5 = I-PR 5 C 5 ) был охарактеризован кристаллографически. [ 18 ]
Сокращение FP 2 с помощью натрия дает «NAFP», содержащий мощный нуклеофил и предшественник многих производных типа CPFE (CO) 2 R. [ 19 ] Производная [FPCH 2 S (Ch 3 ) 2 ] + использовался в циклопропанациях . [ 20 ] FP + Фрагмент является кислым Льюисом и легко образует комплексы с эфирами, аминами, пиридинами и т. Д., Алки и алкины в η 2 Координационный режим. Комплекс FP + (или 2 - виниловый эфир )] + это виниловая катион в масках . [ 21 ] В последнее время комплекс метана , [FP (Ch 4 )] + [AL (OC (CF 3 ) 3 ) 4 ] – , был подготовлен и охарактеризован спектроскопически, используя перфтоороалкоксиалуминат в качестве неординирующего контрейона и 1,1,1,3,3,3,3-гексафторопропана в качестве неординирующего растворителя. [ 22 ]
Соединения FP-R являются прочеральными , и исследования использовали хиральные производные CPFE (PPH 3 ) (CO) ацил. [ 23 ]
Алкил, аллил и арильные соединения
[ редактировать ]Простые пералкильные и перарильские комплексы железа менее многочисленны, чем производные CP и CO. Одним из примеров является Tetramesityldiiron .

Соединения типа [(η 3 -allyl) Fe (Co) 4 ] + Х − являются аллильскими синнтонами в аллильной замене . [ 6 ] Напротив, соединения типа [(η 5 -C 5 H 5 ) Fe (co) 2 (ch 2 ch = chr)] обладание η 1 -Allyl Groups аналогичны основной групповой аллилмелальной виды (M = B, Si, SN и т. Д.) и реагируют с углеродными электрофилами с получением продуктов аллилирования с SE 2 'селективностью. [ 24 ] Точно так же дикарбонил -комплексы Allenyl (циклопентадиенилрон) демонстрируют реакционную способность, аналогичную основной группе видов Allenylemetal и служат в качестве нуклеофильных пропраргильных синн. [ 25 ]
Производные серы и фосфора
[ редактировать ]Комплексы типа Fe 2 (SR) 2 (CO) 6 и Fe 2 (PR 2 ) 2 (CO) 6 , обычно в результате реакции тиолов и вторичных фосфинов с карбонилами железа. [ 26 ] Тиолаты также могут быть получены из тетраэдрана Fe 2 S 2 (CO) 6 .
Железо (III)
[ редактировать ]Алкилирование FECL 3 с помощью бромида метилмагности дает [Fe (CH 3 ) 4 ] – , который термически лабил. [ 27 ] Такие соединения могут иметь отношение к механизму катализируемых Fe-катализируемых реакций поперечного соединения . [ 28 ]
Некоторые органоронный (III) соединения получают путем окисления органических (II) соединений. Давно известным примером является ферроцениум [(C 5 H 5 ) 2 Fe] + Полем Органоуронные (III) порфириновые комплексы, включая алкил и арил -производные, также являются многочисленными. [ 29 ] [ 30 ]
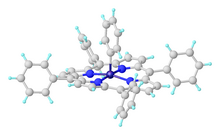
Железо (iv)
[ редактировать ]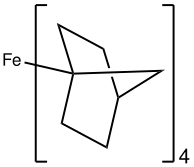
В Fe (Norbornyl) 4 Fe (IV) стабилизируется алкильным лигандом, который сопротивляется устранению бета-гидрида . [ 32 ] Удивительно, но Fecy 4 , который подвержен элиминации бета-гидридов, также был выделен и кристаллографически и стабилен при –20 ° C. Неожиданная стабильность была объяснена стабилизацией дисперсионных сил, а также конформационными эффектами, которые отключили элиминацию бета-гидрида. [ 33 ]
Двухэлектронное окисление декаметилферроцена дает декларацию [Fe (C 5 Me 5 ) 2 ] 2+ , который образует карбонильный комплекс, [Fe (C 5 Me 5 ) 2 (co)] (SBF 6 ) 2 . [ 34 ] Также известно, что ферроцены подвергаются протонированию в железном центре с HF/ALCL 3 или HF/PF 5, чтобы получить формально гидрид -комплекс Fe (IV), [CP 2 FEH] + [ПФ 6 ] – . [ 35 ] [ 36 ]
Iron(V, VI, VII)
[ редактировать ]В 2020 году Джереми М. Смит и его коллеги сообщили о кристаллографически охарактеризованных комплексах Fe (V) и Fe (VI) бисимидо, основанных на бидентатном BIS (карбене) боратном лиганде. [ 37 ] Благодаря архитектуре поддерживающей лиганда эти виды составляют органометаллические комплексы Fe (V) и Fe (VI).
В 2024 году Карстен Мейер и его коллеги сообщили о кристаллографически охарактеризованном комплексе Fe (VI), [Timmn Мы ) Fe МЫ (≡N) (F)] (PF 6 ) 2 · CH 2 Cl 2 , который несет трис (N-гетероциклический карбен) лиганд (TRIS [(3-мезитил-имидазол-2-илиден метил] амин). Связанные комплексы Fe (V) были кристаллографически охарактеризованы в том же исследовании, в то время как виды Fe (VII), которые разлагаются выше -50 ° C, характеризовались спектроскопией Mössbauer . [ 38 ]
Органические соединения в органическом синтезе и гомогенном катализе
[ редактировать ]В промышленном катализе комплексы железа редко используются в отличие от кобальта и никеля . Из -за низкой стоимости и низкой токсичности его солей железо привлекательно в качестве стехиометрического реагента. Некоторые области расследования включают:
- Гидрирование и восстановление , например, катализатор комплекса Кнолькера .
- Реакции перекрестной связи . Соединения железа, такие как Fe ( ACAC ) 3, широкий диапазон реакций поперечного связки с одним субстратом арилом или алкил- григнар, а другой субстрат-арил, алкенил (винил) или ацилгаргалид катализируют . В соответствующей связке Кумада катализаторы основаны на палладие и никеле .
- Комплексы, полученные из оснований Шиффа, являются активными катализаторами для полимеризации олефина. [ 39 ]
Биохимия
[ редактировать ]В области биоорганометаллической химии виды органоирогов обнаруживаются в активных участках трех ферментов гидрогеназы, а также моноксидрогеназы угарного углерода.
Дальнейшее чтение
[ редактировать ]- Ea Koerner von Gustorf; Ф.-В. Гревелс; И. Фишлер, ред. (1978). Органическая химия железа . Академическая пресса. doi : 10.1016/b978-0-12-417101-5.x5001-x . ISBN 978-0-12-417101-5 .
Ссылки
[ редактировать ]- ^ Синтез органометаллических соединений: практическое руководство Sanshiro Komiya ed. S. Komiya, M. Hurano 1997
- ^ Болм, Карстен (2004). «Катализируемые железом реакции при органическом синтезе». Химические обзоры . 104 (12): 6217–6254. doi : 10.1021/cr040664h . PMID 15584700 .
- ^ Entaler, S.; Junge, K.; Беллер, М. (2008). «Устойчивый металлический катализ с железом: от ржавчины до восходящей звезды?». Angew. Химический Инт. Редакция 47 (18): 3317–3321. doi : 10.1002/anie.200800012 . PMID 18412184 .
- ^ Финке, Ричард Дж.; Соррелл, Томас Н. (1979). «Нуклеофильное ацилирование с дизодий тетракарбонилферрат: метил 7-оксогептаноат и метил 7-оксокортаноат». Органические синтезы . 59 : 102. doi : 10.15227/orgsyn.059.0102 .
- ^ Брюне Дж.Дж. (1990). «Тетракарбонилгидридофираты, MHFE (CO) 4 : Универсальные инструменты в органическом синтезе и катализе». Химический Преподобный 90 (1041–1059): 1041. doi : 10.1021/cr00104a006 .
- ^ Jump up to: а беременный Д. Эндерс; Б. Джанделейт; С. Фон Берг (2002). "(+)-(1R, 2S, 3R) -tetracarbonyl [(1-3η) -1- (фенилсульфонил)-но-2-en-en-1-yl] железо (1+) Тетрафтоороборат". Орг Синтезатор 78 : 189. doi : 10.15227/orgsyn.078.0189 .
- ^ Пирсон, Энтони Дж.; Sun, Huikai (2008). «Циклогексадинерон трикарбонил». Энциклопедия E-Eeros реагентов для органического синтеза . doi : 10.1002/047084289x.rn00791 . ISBN 978-0471936237 .
- ^ Береза, AJ; Chamberlain, KB (1977). «Трикарбонил [(2,3,4,5-η) -2,4-циклогексадиен-1-One] железо и трикарбонил [(1,2,3,4,5-1) -2-метокси-2,4 -Киклогексадиен-1-ил] железо (1+) гексафторофосфат (1-) из анизола ». Органические синтезы . 57 : 107. doi : 10.15227/orgsyn.057.0107 .
- ^ Береза, AJ; Chamberlain, KB (1977). "Алкилирование димедона с трикарбонильным (диеном) комплексом железа: трикарбонил [2-[(2,3,4,5,5-η) -4-метокси-2,4-циклогексадиен-1-ил] -5,5-диметил -1,3-циклогексанедионе] железо ". Орг Синтезатор 57 : 16. doi : 10.15227/orgsyn.057.0016 .
- ^ C. Хугзанд; У. Хубель (1968). «Циклическая полимеризация ацетиленов металлическими карбонильными соединениями». В Wender, я.; Пино, П. (ред.). Органические синтезы через металлические карбонилы Том 1 . Уайли. ISBN 0-471-93367-8 .
- ^ ^ Schlacy, RA Hunting, Inorg. Синтезатор Том 15, 2 ( 1974 ) Два : 10.1002/9780470132463.CH1
- ^ Лавалло Винсент, Груббс Роберт Х (2009). «Карбены как катализаторы для трансформаций органометаллических железных комплексов» . Наука . 326 (5952): 559–562. Bibcode : 2009Sci ... 326..559L . doi : 10.1126/science.1178919 . PMC 2841742 . PMID 19900894 .
- ^ Эллис, JE (2019). «Реакция Chatt: обычные маршруты на гомолептические арены элементов D-блока». Dalton Transactions . 48 (26): 9538–9563. doi : 10.1039/c8dt05029e . PMID 30724934 . S2CID 73436073 .
- ^ Astruc, Didier (2017). «Почему ферроцен такой исключительный?». Европейский журнал неорганической химии . 2017 (1): 6–29. doi : 10.1002/ejic.201600983 . ISSN 1099-0682 .
- ^ Malishwski, Moritz; Сеппельт, Конрад; Саттер, Йорг; Heinemann, Frank W.; Диттрих, Биргер; Мейер, Карстен (2017). «Протонирование ферроцена: низкотемпературное рентгеновское исследование [CP2FEH] (PF6) выявляет лиганд гидридо, связанный с железом». Applied Chemistry International Edition . 56 (43): 13372–13376. Doi : 10.1002/ani.201704854 . ISSN 1521-3773 . PMID 28834022 .
- ^ Каннингем, Аллан Ф. (1997-03-01). «Механизм рота ферроцена: общая обработка электрофильной замещения производных ферроцена». Органометаллики . 16 (6): 1114–1122. doi : 10.1021/om960815+ . ISSN 0276-7333 .
- ^ Петра Степникка "Ферросры: лиганды, материалы и биомолекулы" Дж. Уайли, Хобокен, 2008. ISBN 0-470-03585-4
- ^ Ситцманн, Гельмут; Декабрь, Томас; Каим, Вольфганг; Бауманн, Фрэнк; Стальке, Дитмар; Kärcher, Joerg; Дорманн, Эльмар; Зима, Хьюберт; Вахтер, Кристоф; Kelemen, Marc (1996). «Синтез и характеристика стабильного дикарбонильного (циклопентатенилового) радикала железа [(C5R5) Fe (CO) 2] (R CHME2)» . Applied Chemistry International Edition на английском языке . 35 (23–24): 2872–2875. Doi : 10.1002/ani.199628721 . ISSN 1521-3773 .
- ^ Кит Х. Паннелл; Хемант К. Шарма (2010). "(Циклопентадиенил) дикарбонилметилмелрон ((η 5 -C 5 H 5 ) Fe (CO) 2 Ch 3 , FPME), Алкильный комплекс с семинальным переходом: подвижность метильной группы ». Органометаллические . 29 (21): 4741–4745. DOI : 10.1021/OM1004594 .
- ^ Мэтью Н. Мэтсон; Эдвард Дж. О'Коннор; Пол Хелквист (1998). «Циклопропанация с использованием железосодержащего метиленового реагента: 1,1-дифенилциклопропана» . Органические синтезы ; Собранные объемы , вып. 9, с. 372 .
- ^ Тони К.Т. Чанг; Мирон Розенблум; Нэнси Симмс (1988). «Винилирование enolates с виниловым катионным эквивалентом: транс-3-метил-2-винилциклогексанон». Орг Синтезатор 66 : 95. doi : 10.15227/orgsyn.066.0095 .
- ^ Уотсон, Джеймс Д.; Поле, Лесли Д.; Ball, Graham E. (2022-09-28). "[Fp (ch 4)] +, [η 5 -cpru (co) 2 (ch 4)] + и [η 5 -cpos (co) 2 (ch 4)] +: полный набор металла группы 8 –Methane Complexes » . Журнал Американского химического общества . 144 (38): 17622–17629. doi : 10.1021/jacs.2c07124 . ISSN 0002-7863 .
- ^ Карола Рук-Браун "железные ацильные комплексы" в переходных металлах для органического синтеза. Тол. 1. 2 -е изд., М. Беллер, С. Болм, ред. Wiley-VCH, 2004, Вайнхайм. ISBN 3-527-30613-7 .
- ^ Катлер, А.; Ehnholt, D.; Леннон, П.; Николас, К.; Мартен, Дэвид Ф.; Мадхаварао, м.; Raghu, S.; Розан, А.; Rosenblum, M. (1975-05-01). "Химия дикарбонил .eta.5-циклопентадиенилоронных комплексов. Общие синтезы монозамещенных комплексов .eta.2-Olefin и 1-составных комплексов. олефин) катионы ». Журнал Американского химического общества . 97 (11): 3149–3157. doi : 10.1021/ja00844a038 . ISSN 0002-7863 .
- ^ Ван, Идонг; Чжу, Джин; Дарем, Остин С.; Линдберг, Хейли; Wang, Yi-Ming (2019-12-18). «Функционализация α-C-H π-связей с использованием железных комплексов: каталитическое гидроксиалкилирование алкинов и алкенов». Журнал Американского химического общества . 141 (50): 19594–19599. doi : 10.1021/jacs.9b11716 . ISSN 0002-7863 . PMID 31791121 . S2CID 208611984 .
- ^ Кинг, Р.Б., «Производные органосульфы металлических карбонилов. I. Выделение двух изомерных продуктов в реакции Triiron Dodecacarbonyl с диметиловым дисульфидом», J. Am. Химический Soc., 1962, 84, 2460.
- ^ Сирс, Джеффри Д.; Муньос, Сальвадор Б.; Cuenca, Maria Camila Aguilera; Brennessel, William W.; Нейдиг, Майкл Л. (2019). «Синтез и характеристика стерически обремененного гомолептического тетраалкилорона (III) комплекса феррата» . Многогранник . 158 : 91–96. doi : 10.1016/j.poly.2018.10.041 . PMC 6481957 . PMID 31031511 . и ссылки на них.
- ^ Мако, TL; Байерс, JA (2016). «Последние достижения в области реакций перекрестного соединения, катализируемого железом, и их механистического лечения». Неорганическая химия границы . 3 (6): 766–790. doi : 10.1039/c5qi00295h .
- ^ Огоши, Хисанобу; Сугимото, Хироши; Йошида, Зен-Ичи; Кобаяши, Ханако; Сакай, Хироши; Maeda, Yutaka (1982). «Синтезы и магнитные свойства комплексов арилрон (III) восьэтилпорфиринов» . Журнал органометаллической химии . 234 (2): 185–195. doi : 10.1016/s0022-328x (00) 85854-4 . ISSN 0022-328X .
- ^ Лекса, Дорис; Mispelter, Джоэл; Савиант, Жан Мишель (1981). «Электронно-алкилирование железа в порфириновых комплексах. Электрохимические и спектральные характеристики .sigma.-alkylironporphyrins» . Журнал Американского химического общества . 103 (23): 6806–6812. doi : 10.1021/ja00413a004 . ISSN 0002-7863 .
- ^ Pascal Doppelt (1984). «Молекулярная стереохимия низкоупинового пятикоординационного фенил (мезотетрафенилпорфиринато) железа (III)». Inorg. Химический 23 (24): 4009–4011. doi : 10.1021/ic00192a033 .
- ^ BK Bower и HG Tennent (1972). «Переходной металл Bicyclo [2.2.1] HEPT-1-ILS». J. Am. Химический Соц 94 (7): 2512–2514. doi : 10.1021/ja00762a056 .
- ^ Казитас, Алисия; Рис, Джулиан А.; Годдард, Ричард; Билл, Экхард; Дебейр, Серена; Fürstner, Alois (2017-08-14). «Два исключительных гомолептических железа (IV) тетраалкильных комплексов» . Angewandte Chemie International Edition . 56 (34): 10108–10113. doi : 10.1002/anie.201612299 . PMID 28251752 .
- ^ Malishwski, Moritz; Сеппельт, Конрад; Саттер, Йорг; Мунц, Доминик; Мейер, Карстен (2018). «Комплекс карбонильного комплекса на основе ферроцена (IV)». Applied Chemistry International Edition . 57 (44): 14597–14601. Doi : 10.1002/ani.201809464 . ISSN 1521-3773 . PMID 30176109 . S2CID 52145802 .
- ^ Розенблум, Мирон; Сантер, Джо (1959). «Протонирование ферроцена сильными кислотами 1» . Журнал Американского химического общества . 81 (20): 5517–5518. doi : 10.1021/ja01529a075 . ISSN 0002-7863 .
- ^ Malishwski, Moritz; Сеппельт, Конрад; Саттер, Йорг; Heinemann, Frank W.; Диттрих, Биргер; Мейер, Карстен (2017-10-16). «Протонирование ферроцена: низко -тлемпературное исследование x - лучевая дифракция [CP 2 FEH] (PF 6) выявляет железо -связанный гидридо -лиганд» . Applied Chemistry International Edition . 56 (43): 13372–13376. Doi : 10.1002/ani.201704854 . ISSN 1433-7851 .
- ^ Мартинес, Хорхе Л.; Лутц, Шон А.; Ян, Хао; Се, Джиаз; Телсер, Джошуа; Хоффман, Брайан М.; Карла, Вероника; Розовая, Марен; Losovyj, Yaroslav; Смит, Джереми М. (2020-10-16). «Структурная и спектроскопическая характеристика комплекса Fe (VI) Bis (Imido)» . Наука . 370 (6514): 356–359. doi : 10.1126/science.abd3054 . ISSN 0036-8075 .
- ^ Кейлверт, Мартин; Мао, Вейкин; Малишичевский, Мориц; Jannnuzzi, Sergio av; Breitwiser, Kevin; Heinemann, Frank W.; Scheurer, Andreas; Дебейр, Серена; Мунц, Доминик; Билл, Экхард; Мейер, Карстен (2024-01-30). «Синтез и характеристика комплекса нитридо железа (VI) » Химия природы : 1–7 Doi : 10.1038/ s41557-023-01418-4 ISSN 1755-4 10997499PMC
- ^ Аллан, Лен; Бритва, депутат; White, AJP и Gibson, VC, «Корреляция металлического спинового состояния в альфа-дииминовых железных катализаторах с механизмом полимеризации», Inorg. Chem., 2007, 46, 8963-8970.
