Молекулярная генетика
Эта статья нуждается в дополнительных цитатах для проверки . ( январь 2012 г. ) |
| Часть серии о |
| Генетика |
|---|
 |
Молекулярная генетика — это раздел биологии , который изучает, как различия в структурах или экспрессии молекул ДНК проявляются в виде вариаций среди организмов. Молекулярная генетика часто применяет «исследовательский подход» для определения структуры и/или функции генов в геноме организма с использованием генетического скрининга . [ 1 ] [ 2 ]
Область исследования основана на слиянии нескольких подобластей биологии: классической менделевской наследственности , клеточной биологии , молекулярной биологии , биохимии и биотехнологии . Он объединяет эти дисциплины для изучения таких вещей, как генетическая наследственность, регуляция и экспрессия генов, а также молекулярный механизм, лежащий в основе различных жизненных процессов. [ 1 ]
Ключевой целью молекулярной генетики является выявление и изучение генетических мутаций. Исследователи ищут мутации в гене или вызывают мутации в гене, чтобы связать последовательность гена с определенным фенотипом. [ 3 ] Таким образом, молекулярная генетика является мощной методологией связи мутаций с генетическими состояниями, которая может помочь в поиске методов лечения различных генетических заболеваний.
История
[ редактировать ]Открытие ДНК как основы жизни и прорыв в исследованиях молекулярной генетики стали результатом совместных работ многих ученых. В 1869 году химик Иоганн Фридрих Мишер , исследовавший состав лейкоцитов, обнаружил и выделил из ядра клетки новую молекулу, которую он назвал нуклеином, что в конечном итоге стало первым открытием молекулы ДНК , которая, как позже было установлено, была молекулярная основа жизни. Он определил, что он состоит из водорода, кислорода, азота и фосфора. [ 4 ] Биохимик Альбрехт Козелл идентифицировал нуклеин как нуклеиновую кислоту и дал ему название дезоксирибонуклеиновая кислота (ДНК). Он продолжал развивать это, изолируя основные строительные блоки ДНК и РНК ; состоит из нуклеотидов : аденина, гуанина, тимина, цитозина. и урацил. Его работа над нуклеотидами принесла ему Нобелевскую премию по физиологии. [ 5 ]
В начале 1900-х годов Грегор Мендель , который стал известен как один из отцов генетики , внес большой вклад в область генетики посредством своих различных экспериментов с растениями гороха, где он смог открыть принципы наследования, такие как рецессивные и доминантные признаки. , не зная, из каких генов он состоит. [ 6 ] В середине 19-го века анатом Вальтер Флемминг открыл то, что мы теперь знаем как хромосомы, и процесс разделения, которому они подвергаются посредством митоза. Его работа вместе с Теодором Бовери впервые привела к созданию хромосомной теории наследственности, которая помогла объяснить некоторые закономерности, которые Мендель наблюдал гораздо раньше. [ 7 ]
Для развития молекулярной генетики как дисциплины необходимо было сделать несколько научных открытий. Открытие ДНК как средства передачи генетического кода жизни от одной клетки к другой и между поколениями имело важное значение для идентификации молекулы, ответственной за наследственность . Молекулярная генетика первоначально возникла в результате исследований генетической трансформации бактерий . В 1944 году Эйвери, Маклеод и Маккарти [ 8 ] выделили ДНК из вирулентного штамма S. pneumoniae и, используя только эту ДНК, смогли превратить безвредный штамм в вирулентный. Они назвали поглощение, включение и экспрессию ДНК бактериями «трансформацией». Это открытие позволило предположить, что ДНК является генетическим материалом бактерий. [ 9 ] Бактериальная трансформация часто индуцируется стрессовыми условиями, и функция трансформации, по-видимому, заключается в восстановлении геномных повреждений . [ 9 ]
В 1950 году Эрвин Чаргафф вывел правила, доказывающие, что ДНК является генетическим материалом жизни. Это были: «1) основной состав ДНК различается у разных видов и 2) в природных молекулах ДНК количество аденина (А) равно количеству тимина (Т), а количество гуанина (G) равно количеству на количество цитозина (С)». [ 10 ] Эти правила, известные как правила Чаргаффа, помогли понять молекулярную генетику. [ 10 ] В 1953 году Фрэнсис Крик и Джеймс Уотсон, основываясь на работах Розалинд Франклин и Мориса Уилкинса по рентгеновской кристаллографии, смогли получить трехмерную структуру двойной спирали ДНК. [ 11 ]
Группа фагов представляла собой неформальную сеть биологов, основанную на Максе Дельбрюке , которая внесла значительный вклад в молекулярную генетику и зарождение молекулярной биологии в период примерно с 1945 по 1970 год. [ 12 ] Группа фагов получила свое название от бактериофагов , вирусов, инфицирующих бактерии, которые группа использовала в качестве экспериментальных модельных организмов. Исследования молекулярных генетиков, связанных с этой группой, способствовали пониманию того, как кодируемые генами белки функционируют в репликации ДНК , репарации ДНК и рекомбинации ДНК , а также того, как вирусы собираются из белковых компонентов и компонентов нуклеиновых кислот (молекулярный морфогенез). Кроме того, была выяснена роль терминирующих кодонов цепи. Одно примечательное исследование было проведено Сидни Бреннером и его сотрудниками с использованием «янтарных» мутантов, дефектных по гену, кодирующему основной головной белок бактериофага Т4. [ 13 ] Это исследование продемонстрировало коллинеарность гена с кодируемым им полипептидом, тем самым предоставив убедительные доказательства «гипотезы последовательности», согласно которой аминокислотная последовательность белка определяется нуклеотидной последовательностью гена, определяющего белок.
Выделение Арбером и Линном в 1969 эндонуклеазы рестрикции в E. coli открыло область генной инженерии . [ 14 ] Рестрикционные ферменты использовались для линеаризации ДНК для разделения с помощью электрофореза , а Саузерн-блоттинг позволил идентифицировать определенные сегменты ДНК с помощью зондов гибридизации . [ 15 ] [ 16 ] В 1971 году Берг использовал ферменты рестрикции для создания первой молекулы рекомбинантной ДНК рекомбинантной ДНК и первой плазмиды . [ 17 ] В 1972 году Коэн и Бойер создали первый организм с рекомбинантной ДНК, вставив плазмиды рекомбинантной ДНК в E. coli , что теперь известно как бактериальная трансформация , и проложило путь молекулярному клонированию. [ 18 ] Разработка методов секвенирования ДНК в конце 1970-х годов, сначала Максамом и Гилбертом, а затем Фредериком Сэнгером , имела решающее значение для молекулярно-генетических исследований и позволила ученым начать проводить генетические скрининги, чтобы связать генотипические последовательности с фенотипами. [ 19 ] Полимеразная цепная реакция (ПЦР) с использованием Taq-полимеразы, изобретенная Муллисом в 1985 году, позволила ученым создать миллионы копий определенной последовательности ДНК, которую можно было использовать для трансформации или манипулировать ею с помощью разделения в агарозном геле . [ 20 ] Десять лет спустя был секвенирован первый полный геном ( Hemophilus influenzae было секвенировано геном человека ), а затем в 2001 году в рамках проекта «Геном человека» . [ 21 ] Кульминацией всех этих открытий стала новая область, названная геномикой , которая связывает молекулярную структуру гена с белком или РНК, кодируемым этим сегментом ДНК, и функциональной экспрессией этого белка в организме. [ 22 ] Сегодня, благодаря применению молекулярно-генетических методов, геномика изучается на многих модельных организмах, а данные собираются в компьютерных базах данных, таких как NCBI и Ensembl . Компьютерный анализ и сравнение генов внутри и между разными видами называется биоинформатикой и связывает генетические мутации в эволюционном масштабе. [ 23 ]
Центральная догма
[ редактировать ]На этом изображении показан пример центральной догмы, использующей транскрибируемую, а затем транслируемую цепь ДНК, и показаны важные ферменты, используемые в этих процессах.
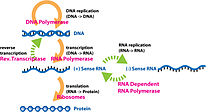
Центральная догма играет ключевую роль в изучении молекулярной генетики. Центральная догма гласит, что ДНК реплицируется, ДНК транскрибируется в РНК, а РНК транслируется в белки. [ 24 ] Наряду с Центральной догмой генетический код используется для понимания того, как РНК транслируется в белки. Репликация ДНК и транскрипция ДНК в мРНК происходит в ядре, тогда как трансляция из РНК в белки происходит в рибосоме . [ 25 ] Генетический код состоит из четырех взаимозаменяемых частей молекул ДНК, называемых «основаниями»: аденина, цитозина, урацила (в РНК; тимина в ДНК) и гуанина и является избыточным, то есть множеством комбинаций этих пар оснований (которые читаются в в трех экземплярах) производят одну и ту же аминокислоту. [ 26 ] Протеомика и геномика — это области биологии, возникшие в результате изучения молекулярной генетики и Центральной догмы. [ 27 ]
Структура ДНК
[ редактировать ]организма Геном состоит из всего набора его ДНК и отвечает за его генетические особенности, функции и развитие. Состав ДНК сам по себе является важным компонентом молекулярной генетики; это основа того, как ДНК способна хранить генетическую информацию, передавать ее и сохранять формат, который можно читать и транслировать. [ 28 ]
ДНК представляет собой двухцепочечную молекулу, каждая цепь которой ориентирована антипараллельно. Нуклеотиды — это строительные блоки ДНК, каждый из которых состоит из молекулы сахара, фосфатной группы и одного из четырех азотистых оснований: аденина, гуанина, цитозина и тимина. Одна цепь ДНК удерживается вместе ковалентными связями, а две антипараллельные цепи удерживаются вместе водородными связями между нуклеотидными основаниями. Аденин связывается с тимином, а цитозин — с гуанином. Именно эти четыре основные последовательности образуют генетический код всей биологической жизни и содержат информацию обо всех белках, которые организм сможет синтезировать. [ 29 ]
Его уникальная структура позволяет ДНК хранить и передавать биологическую информацию из поколения в поколение во время деления клеток . При делении клеток клетки должны иметь возможность копировать свой геном и передавать его дочерним клеткам. Это возможно благодаря двухцепочечной структуре ДНК, поскольку одна цепь комплементарна своей партнерской цепи, и поэтому каждая из этих цепей может выступать в качестве матричной цепи для образования новой комплементарной цепи. Вот почему процесс репликации ДНК известен как полуконсервативный процесс. [ 30 ]
Техники
[ редактировать ]Форвардная генетика
[ редактировать ]Прямая генетика — это метод молекулярной генетики, используемый для идентификации генов или генетических мутаций, которые производят определенный фенотип . При генетическом скрининге случайные мутации генерируются с помощью мутагенов (химических веществ или радиации) или транспозонов , и люди проверяются на определенный фенотип. Часто вторичный анализ в форме селекции может следовать за мутагенезом , когда желаемый фенотип трудно наблюдать, например, в бактериях или клеточных культурах. Клетки можно трансформировать с использованием гена устойчивости к антибиотикам или флуоресцентного репортера, так что мутанты с желаемым фенотипом выбираются из немутантов. [ 31 ]
Мутанты, демонстрирующие интересующий фенотип, изолируют, и можно провести тест на комплементацию, чтобы определить, является ли фенотип результатом более чем одного гена. Затем мутантные гены характеризуются как доминантные (приводящие к усилению функции), рецессивные (демонстрирующие потерю функции) или эпистатические (мутантный ген маскирует фенотип другого гена). Наконец, местоположение и конкретный характер мутации картируются с помощью секвенирования . [ 32 ] Форвардная генетика представляет собой беспристрастный подход и часто приводит ко многим неожиданным открытиям, но может быть дорогостоящим и отнимать много времени. Модельные организмы, такие как нематодный червь Caenorhabditis elegans , плодовая мушка Drosophila melanogaster и рыбка данио Danio rerio, успешно использовались для изучения фенотипов, возникающих в результате генных мутаций. [ 33 ]

Обратная генетика
[ редактировать ]
Обратная генетика — это термин, обозначающий методы молекулярной генетики, используемые для определения фенотипа, возникающего в результате преднамеренной мутации интересующего гена. Фенотип используется для определения функции немутантной версии гена. Мутации могут представлять собой случайные или преднамеренные изменения интересующего гена. Мутации могут представлять собой ошибочную мутацию, вызванную заменой нуклеотида, добавлением или удалением нуклеотида, вызывающим мутацию сдвига рамки считывания , или полным добавлением/удалением гена или сегмента гена. Удаление определенного гена приводит к нокауту гена , при котором ген не экспрессируется, что приводит к потере функции (например, у нокаутных мышей ). Неправильно смысловые мутации могут вызвать полную потерю функции или привести к частичной потере функции, известной как нокдаун. Нокдаун также может быть достигнут с помощью РНК-интерференции (РНКи). [ 35 ] Альтернативно, гены могут быть заменены в геноме организма (также известном как трансген ), чтобы создать нокаут гена и привести к усилению функции хозяина. [ 36 ] Хотя этим методам присуща некоторая предвзятость в отношении решения связать фенотип с определенной функцией, с точки зрения производства они намного быстрее, чем прямая генетика, поскольку интересующий ген уже известен.
Молекулярно-генетические инструменты
[ редактировать ]Молекулярная генетика — это научный подход, который использует основы генетики в качестве инструмента для лучшего понимания молекулярной основы заболеваний и биологических процессов в организме. Ниже приведены некоторые инструменты, которые охотно используются исследователями в этой области.
Микроспутники
[ редактировать ]Микросателлиты или повторы одиночной последовательности (SSRS) представляют собой короткие повторяющиеся сегменты ДНК, состоящие из 6 нуклеотидов в определенном месте генома, которые используются в качестве генетического маркера. Исследователи могут анализировать эти микросателлиты с помощью таких методов, как дактилоскопия ДНК и тестирование на отцовство, поскольку эти повторы уникальны для отдельных людей или семей. a также может использоваться при построении генетических карт и изучении генетического сцепления для определения гена или мутации, ответственных за конкретный признак или заболевание. Микросателлиты также можно применять в популяционной генетике для изучения сравнения между группами. [ 37 ]
Исследования общегеномных ассоциаций
[ редактировать ]Полногеномные исследования ассоциаций (GWAS) — это метод, основанный на однонуклеотидных полиморфизмах ( SNP ) для изучения генетических вариаций в популяциях, которые могут быть связаны с конкретным заболеванием. Проект «Геном человека» картировал весь геном человека и сделал этот подход более доступным и экономически эффективным для реализации исследователями. Для проведения GWAS исследователи используют две группы: одну группу, у которой есть заболевание, которое изучают исследователи, и другую, которая действует как контрольная, у которой нет этого конкретного заболевания. У участников получают образцы ДНК, затем их геном можно получить с помощью лабораторного оборудования и быстро обследовать для сравнения участников и поиска SNP, которые потенциально могут быть связаны с заболеванием. Этот метод позволяет исследователям точно определить гены и интересующие их места в геноме человека, которые они затем могут дополнительно изучить, чтобы определить причину заболевания. [ 38 ]
Кариотипирование
[ редактировать ]Кариотипирование позволяет исследователям анализировать хромосомы во время метафазы митоза, когда они находятся в конденсированном состоянии. Хромосомы окрашивают и визуализируют под микроскопом на предмет наличия хромосомных аномалий. Этот метод можно использовать для выявления врожденных генетических нарушений, таких как синдром Дауна , определения пола эмбрионов и диагностики некоторых видов рака, вызванных хромосомными мутациями, такими как транслокации. [ 39 ]
Современные приложения
[ редактировать ]Генная инженерия
[ редактировать ]Генная инженерия — это новая область науки, и исследователи могут использовать молекулярно-генетические технологии для модификации ДНК организмов и создания генетически модифицированных и усовершенствованных организмов для промышленных, сельскохозяйственных и медицинских целей. Это можно сделать с помощью методов редактирования генома, которые могут включать изменение пар оснований в последовательности ДНК или добавление и удаление определенных участков ДНК. [ 40 ]
Редактирование генов
[ редактировать ]Редактирование генов позволяет ученым изменять/редактировать ДНК организма. Один из способов добиться этого — использовать метод Crispr/Cas9 , который был адаптирован на основе иммунной защиты генома, естественно присутствующей в бактериях. Этот метод основан на белке Cas9, который позволяет ученым разрезать нити ДНК в определенном месте, и использует специальную направляющую последовательность РНК, чтобы гарантировать, что разрез сделан в нужном месте генома. Затем ученые используют пути восстановления ДНК, чтобы вызвать изменения в геноме; этот метод имеет широкое применение для лечения заболеваний. [ 41 ]
Персонализированная медицина
[ редактировать ]Молекулярная генетика имеет большое значение для развития медицины, а понимание молекулярной основы заболеваний открывает возможности для более эффективной диагностики и лечения. Одной из целей этой области является персонализированная медицина человека , где генетика может помочь определить причину и подобрать лечение заболевания, которым он страдает, и потенциально позволить использовать более индивидуализированные подходы к лечению, которые могут быть более эффективными. Например, определенные генетические вариации у людей могут сделать их более восприимчивыми к определенному лекарству, в то время как другие могут иметь более высокий риск побочных реакций на лечение. Таким образом, эта информация позволит исследователям и врачам принимать наиболее обоснованные решения об эффективности лечения пациентов, а не стандартным методом проб и ошибок. [ 42 ]
Судебная генетика
[ редактировать ]Судебная генетика играет важную роль в уголовных расследованиях благодаря использованию различных молекулярно-генетических методов. Одним из распространенных методов является дактилоскопия ДНК, которая осуществляется с использованием комбинации молекулярно-генетических методов, таких как полимеразная цепная реакция (ПЦР) и гель-электрофорез . ПЦР — это метод, который позволяет амплифицировать целевую последовательность ДНК. Это означает, что даже небольшое количество ДНК с места преступления можно извлечь и реплицировать много раз, чтобы получить достаточное количество материала для анализа. Гель-электрофорез позволяет разделить последовательность ДНК по размеру, а полученный образец известен как дактилоскопия ДНК и уникален для каждого человека. Эта комбинация молекулярно-генетических методов позволяет извлекать, амплифицировать, анализировать и сравнивать простую последовательность ДНК с другими и является стандартным методом, используемым в судебной медицине. [ 43 ]
См. также
[ редактировать ]- Комплементация (генетика)
- Повреждение ДНК (естественное)
- Теория старения, связанная с повреждением ДНК
- Эпигенетика
- Картирование генов
- Генетический код
- Генетическая рекомбинация
- Геномный импринтинг
- История генетики
- Гомологичная рекомбинация
- Мутагенез
- Регуляция экспрессии генов
- Хронология истории генетики
- Трансформация (генетика)
Источники и примечания
[ редактировать ]- ^ Перейти обратно: а б Уотерс, Кен (2013), «Молекулярная генетика» , в Залте, Эдвард Н. (редактор), Стэнфордская энциклопедия философии (изд. осени 2013 г.), Лаборатория метафизических исследований, Стэнфордский университет , получено 7 октября 2019 г.
- ^ Альбертс, Брюс (18 ноября 2014 г.). Молекулярная биология клетки (Шестое изд.). Нью-Йорк, штат Нью-Йорк. ISBN 978-0-8153-4432-2 . OCLC 887605755 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Браун, Теренс А. (2002), «Мутация, репарация и рекомбинация» , Геномы. 2-е издание , Вили-Лисс , получено 9 октября 2023 г.
- ^ Ламм, Эхуд; Харман, Орен; Вейгль, Софи Джулиана (июнь 2020 г.). «До Уотсона и Крика в 1953 году в 1869 году появился Фридрих Мишер» . Генетика . 215 (2): 291–296. дои : 10.1534/genetics.120.303195 . ISSN 0016-6731 . ПМЦ 7268995 . ПМИД 32487691 .
- ^ «Нобелевская премия по физиологии и медицине 1910 года» . NobelPrize.org . Проверено 15 октября 2023 г.
- ^ «Грегор Мендель и принципы наследования | Изучайте науку в Scitable» . www.nature.com . Проверено 15 октября 2023 г.
- ^ Павелец, Н. (январь 2001 г.). «Вальтер Флемминг: пионер исследования митоза» . Обзоры природы. Молекулярно-клеточная биология . 2 (1): 72–75. дои : 10.1038/35048077 . ISSN 1471-0072 . ПМИД 11413469 . S2CID 205011982 .
- ^ Эйвери ОТ, Маклауд СМ, Маккарти М. Исследования химической природы вещества, вызывающего трансформацию типов пневмококков: индукция трансформации фракцией дезоксирибонуклеиновой кислоты, выделенной из пневмококка типа III. J Exp Med. 1944 февраля; 79 (2): 137-58. дои : 10.1084/jem.79.2.137 . ПМИД 19871359 ; ПМК 2135445
- ^ Перейти обратно: а б Бернштейн Х., Бернштейн С., Мишод Р.Э. (2018). Пол у микробных возбудителей. Инфекция, генетика и эволюция, том 57, страницы 8–25. дои : 10.1016/j.meegid.2017.10.024
- ^ Перейти обратно: а б Элсон, Дэвид; Чаргафф, Эрвин (май 1954 г.). «Закономерности состава пентозонуклеиновых кислот» . Природа . 173 (4413): 1037–1038. Бибкод : 1954Natur.173.1037E . дои : 10.1038/1731037a0 . ISSN 1476-4687 . ПМИД 13165710 . S2CID 4219775 .
- ^ Уотсон, доктор медицинских наук; Крик, FHC (апрель 1953 г.). «Молекулярная структура нуклеиновых кислот: структура нуклеиновой кислоты дезоксирибозы» . Природа . 171 (4356): 737–738. Бибкод : 1953Natur.171..737W . дои : 10.1038/171737a0 . ISSN 1476-4687 . ПМИД 13054692 . S2CID 4253007 .
- ^ Фаг и истоки молекулярной биологии (2007) Под редакцией Джона Кэрнса, Гюнтера С. Стента и Джеймса Д. Уотсона, Лаборатория количественной биологии Колд-Спринг-Харбор, Колд-Спринг-Харбор, Лонг-Айленд, Нью-Йорк ISBN 978-0-87969-800-3
- ^ Сарабхай А.С., Стреттон А.О., Бреннер С., Болле А. (январь 1964 г.). «Колинеарность гена с полипептидной цепью». Природа. 201 (4914): 13–7. Бибкод:1964Natur.201...13S. два : 10.1038/201013a0 . ПМИД 14085558 . S2CID 10179456
- ^ «В центре внимания ферменты рестрикции | Изучайте науку в Scitable» . www.nature.com . Проверено 7 октября 2019 г.
- ^ Ригетти, Пьер Джорджио (24 июня 2005 г.). «Электрофорез: марш копеек, марш десятицентовиков». Журнал хроматографии А. 1079 (1–2): 24–40. дои : 10.1016/j.chroma.2005.01.018 . ПМИД 16038288 .
- ^ «Саузерн-блоттинг | Учебный центр MyBioSource» . Проверено 11 ноября 2019 г.
- ^ «Профессор Пол Берг | Биографическое резюме» . WhatisBiotechnology.org . Проверено 7 октября 2019 г.
- ^ «Герберт В. Бойер и Стэнли Н. Коэн» . Институт истории науки . 01.06.2016 . Проверено 7 октября 2019 г.
- ^ «Секвенирование ДНК | генетика» . Британская энциклопедия . Проверено 7 октября 2019 г.
- ^ «Изобретение ПЦР» . Биоразмер укуса . 24 октября 2007 г. Проверено 7 октября 2019 г.
- ^ «Хронология: организмы, геномы которых секвенированы» . ваш геном . Проверено 7 октября 2019 г.
- ^ «Что такое геномика?» . EMBL-EBI Поезд онлайн . 9 сентября 2011 г. Проверено 7 октября 2019 г.
- ^ «Что такое биоинформатика? Предлагаемое определение и обзор области». Методы информации в медицине . 40 (2). 2001. doi : 10.1055/s-008-38405 . ISSN 0026-1270 .
- ^ «Центральная догма | Протокол» . www.jove.com . Проверено 4 декабря 2020 г.
- ^ «Транскрипция, трансляция и репликация» . www.atdbio.com . Проверено 4 декабря 2020 г.
- ^ «Генетический код» . Genome.gov . Проверено 4 декабря 2020 г.
- ^ «Краткое руководство по геномике» . Genome.gov . Проверено 4 декабря 2020 г.
- ^ «Дом – Геном – NCBI» . www.ncbi.nlm.nih.gov . Проверено 16 октября 2023 г.
- ^ Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Рафф, Мартин; Робертс, Кейт; Уолтер, Питер (2002), «Структура и функция ДНК» , Молекулярная биология клетки. 4-е издание , Garland Science , получено 16 октября 2023 г.
- ^ «Полуконсервативная репликация ДНК | Изучайте науку в Scitable» . www.nature.com . Проверено 16 октября 2023 г.
- ^ «Отбор против скрининга в направленной эволюции», Направленная эволюция селективных ферментов , John Wiley & Sons, Ltd, 2016, стр. 27–57, doi : 10.1002/9783527655465.ch2 , ISBN 978-3-527-65546-5
- ^ Шнебергер, Корбинян (20 августа 2014 г.). «Использование секвенирования нового поколения для выделения мутантных генов в результате прямого генетического скрининга». Обзоры природы Генетика . 15 (10): 662–676. дои : 10.1038/nrg3745 . hdl : 11858/00-001M-0000-0024-CF80-4 . ISSN 1471-0056 . ПМИД 25139187 . S2CID 1822657 .
- ^ Лоусон, Натан Д.; Вулф, Скот А. (19 июля 2011 г.). «Прямой и обратный генетические подходы к анализу развития позвоночных рыбок данио» . Развивающая клетка . 21 (1): 48–64. дои : 10.1016/j.devcel.2011.06.007 . ISSN 1534-5807 . ПМИД 21763608 .
- ^ Кучер, Лена М. (2014). «Прямой и обратный мутагенез у C. elegans» . Червячная книга : 1–26. дои : 10.1895/wormbook.1.167.1 . ПМК 4078664 . ПМИД 24449699 .
- ^ Харди, Серж; Леганье, Винсент; Аудик, Янн; Пайяр, Люк (октябрь 2010 г.). «Обратная генетика у эукариот» . Биология клетки . 102 (10): 561–580. дои : 10.1042/BC20100038 . ПМК 3017359 . ПМИД 20812916 .
- ^ Дойл, Альфред; МакГарри, Майкл П.; Ли, Нэнси А.; Ли, Джеймс Дж. (апрель 2012 г.). «Создание трансгенных и нокаутных/ноккинных мышиных моделей заболеваний человека» . Трансгенные исследования . 21 (2): 327–349. дои : 10.1007/s11248-011-9537-3 . ISSN 0962-8819 . ПМК 3516403 . ПМИД 21800101 .
- ^ «Микроспутник» . Genome.gov . Проверено 7 декабря 2023 г.
- ^ «Информационный бюллетень по полногеномным исследованиям ассоциаций» . Genome.gov . Проверено 7 декабря 2023 г.
- ^ «Кариотипирование | Изучите науку в Scitable» . www.nature.com . Проверено 7 декабря 2023 г.
- ^ Ховард, Хайди С.; ван Эль, Карла Г.; Форцано, Франческа; Радойкович, Драгица; Риал-Себбаг, Эммануэль; де Верт, Гвидо; Борри, Паскаль; Корнел, Мартина К. (январь 2018 г.). «Одно маленькое изменение для людей, одно гигантское изменение для человечества? Вопросы и моменты, которые следует учитывать, чтобы найти ответственный подход к редактированию генов у людей» . Европейский журнал генетики человека . 26 (1): 1–11. дои : 10.1038/s41431-017-0024-z . ISSN 1018-4813 . ПМК 5839051 . ПМИД 29192152 .
- ^ «Что такое редактирование генома и CRISPR-Cas9?: MedlinePlus Genetics» . medlineplus.gov . Проверено 9 декабря 2023 г.
- ^ Гетц, Лаура Х.; Шорк, Николас Дж. (июнь 2018 г.). «Персонализированная медицина: мотивация, вызовы и прогресс» . Фертильность и бесплодие . 109 (6): 952–963. doi : 10.1016/j.fertnstert.2018.05.006 . ISSN 0015-0282 . ПМК 6366451 . ПМИД 29935653 .
- ^ Ли, Чэнтао (18 июля 2018 г.). «Судебная генетика» . Судебно-медицинские исследования . 3 (2): 103–104. дои : 10.1080/20961790.2018.1489445 . ISSN 2096-1790 . ПМК 6197140 . ПМИД 30483657 .
Дальнейшее чтение
[ редактировать ]- Сайты и базы данных, связанные с генетикой, цитогенетикой и онкологией , в Атласе генетики и цитогенетики в онкологии и гематологии.
- Джереми В. Дейл и Саймон Ф. Парк. 2010. Молекулярная генетика бактерий, 5-е издание. ISBN 978-0-470-74184-9
Внешние ссылки
[ редактировать ] СМИ, связанные с молекулярной генетикой, на Викискладе?
СМИ, связанные с молекулярной генетикой, на Викискладе?