Гематопоэтические стволовые клетки
Эта статья может быть слишком технической для большинства читателей, чтобы понять . ( Август 2015 ) |
| Гематопоэтические стволовые клетки | |
|---|---|
 Обзор нормального человеческого гематопоэза | |
| Подробности | |
| Предшественник | Гемангиобласт |
| Система | Гематопоэтическая система |
| Расположение | Костный мозг |
| Функция | Стволовые клетки , которые вызывают другие клетки крови |
| Идентификаторы | |
| латинский | Cell Haematopoietica Precursor |
| Аббревиатура (ы) | HSC |
| Сетка | D006412 |
| Тур | H2.00.01.0.00006 |
| Анатомические термины микроанатомии | |
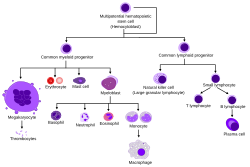
Гематопоэтические стволовые клетки ( HSC ) являются стволовыми клетками [ 1 ] Это приводит к другим клеткам крови . Этот процесс называется haematopoiesis . [ 2 ] У позвоночных первые окончательные HSC возникают из вентральной эндотелиальной стенки эмбриональной аорты в области (средней) аорта-хонад-мезонефрос , посредством процесса, известного как эндотелиально-гематопоэтический переход. [ 3 ] [ 4 ] У взрослых гематопоэзис встречается в красном костном мозге , в ядре большинства костей. Красный костный мозг получен из слоя эмбриона , называемого мезодермой .
Гематопоэз - это процесс, с помощью которого продуцируются все зрелые клетки крови. Он должен сбалансировать огромные потребности в производстве (средний человек производит более 500 миллиардов клеток крови каждый день) с необходимостью регулировать количество каждого типа клетки крови в кровообращении. У позвоночных подавляющее большинство гематопоэза происходит в костном мозге и получено из ограниченного числа гемопоэтических стволовых клеток, которые являются мультипотентными и способными к обширному самообновлению .
Гемопоэтические стволовые клетки вызывают различные типы клеток крови, в линиях, называемых миелоидными и лимфоидными . Миелоидные и лимфоидные линии участвуют в образовании дендритных клеток . Миелоидные клетки включают моноциты , макрофаги , нейтрофилы , базофилы , эозинофилы , эритроциты и мегакариоциты в тромбоциты . Лимфоидные клетки включают Т -клетки , В -клетки , природные клетки -киллеры и врожденные лимфоидные клетки .
Определение гематопоэтических стволовых клеток развилось с тех пор, как они были впервые обнаружены в 1961 году. [ 5 ] Гемопоэтическая ткань содержит клетки с долгосрочными и кратковременными способностями регенерации и преданными мультипотентными , олигопотентными и однопотентными предшественниками. Гемопоэтические стволовые клетки составляют 1: 10000 клеток в миелоидной ткани .
Трансплантаты HSC используются при лечении рака и других нарушений иммунной системы [ 6 ] из -за их регенеративных свойств. [ 7 ]
Структура
[ редактировать ]Они круглые, не приспособленные, с округлым ядром и низким соотношением цитоплазмы к нуклеусу. В форме гематопоэтические стволовые клетки напоминают лимфоциты .
Расположение
[ редактировать ]Самые первые гематопоэтические стволовые клетки во время (мыши и человека) эмбрионального развития обнаружены в области аорта-хонад-мезонефроса , а также вителлин и пупочных артерий. [ 8 ] [ 9 ] [ 10 ] Чуть позже HSC также обнаруживаются в плаценте, желтком мешке, эмбриональной головке и печени плода. [ 3 ] [ 11 ]
Стволовые и клетки -предшественники могут быть взяты из таза, на подвздошном гребне, используя иглу и шприц. [ 12 ] Клетки могут быть удалены как жидкость (чтобы выполнить мазок, чтобы посмотреть на морфологию клеток), или их можно удалить с помощью биопсии ядра (для поддержания архитектуры или взаимосвязи клеток друг к другу и с костью). [ Цитация необходима ]
Подтипы
[ редактировать ]Колония, формирующая единицу, является подтипом HSC. (Этот смысл термина отличается от колоний-формирующих единиц микробов, который является единицей подсчета клеток .) Существуют различные виды колоний HSC колонии:
- Колония -образец - гранулоциты - эритроцит - моноцит - мегакариоцит ( КОЕ -гемм )
- Колония-формирование- лимфоцит ( КОЕ-L )
- Колония-образец- эритроцит ( КОЕ-E )
- Колония-формирование- гранулоциты - макрофаги ( КОЕ-ГМ )
- Колония-формирование- мегакариоцит ( КОЕ-МЕГ )
- Колония-формирующая единица- базофил ( КОЕ-басо )
- Колония-образец- эозинофил ( КОЕ-ЭОС )
Вышеуказанные КОЕ основаны на линии. Другой КОЕ, колония-формирующая единица-Спин (КОЕ-S), был основой образования клональной колоний in vivo , которая зависит от способности инфузированных клеток костного мозга вызывать клоны созревающих гемопоэтических клеток в селезенках облученных мышей через 8-12 дней. Он широко использовался в ранних исследованиях, но в настоящее время считается, что он измеряет более зрелые предшественники или транзитные амплифицирующие клетки, а не стволовые клетки [ Цитация необходима ] .
Изоляция стволовых клеток
[ редактировать ]Поскольку гематопоэтические стволовые клетки не могут быть выделены как чистая популяция, их невозможно идентифицировать их в микроскопе. [ Цитация необходима ] Гемопоэтические стволовые клетки могут быть идентифицированы или выделены с помощью проточной цитометрии, где комбинация нескольких различных маркеров клеточной поверхности (особенно CD34 ) используется для отделения редких гемопоэтических стволовых клеток от окружающих клеток крови. Гемопоэтические стволовые клетки не имеют экспрессии зрелых маркеров клетки крови и, таким образом, называются Lin-. Отсутствие экспрессии маркеров линии используется в сочетании с обнаружением нескольких положительных маркеров клеточной поверхности для изоляции гемопоэтических стволовых клеток. Кроме того, гематопоэтические стволовые клетки характеризуются их небольшим размером и низким окрашиванием жизненно важными красителями, такими как родамин 123 (родамин это ) или Hoechst 33342 (боковая популяция).
Функция
[ редактировать ]
HaeMatopoiesis
[ редактировать ]Гемопоэтические стволовые клетки необходимы для гематопоэза, образования клеток в крови. Гемопоэтические стволовые клетки могут пополнять все типы клеток крови (то есть мультипотентные ) и самообновления. Небольшое количество гемопоэтических стволовых клеток может расширяться, чтобы генерировать очень большое количество дочерних гемопоэтических стволовых клеток. Это явление используется при трансплантации костного мозга , [ 13 ] Когда небольшое количество гематопоэтических стволовых клеток восстанавливает гематопоэтическую систему. Этот процесс указывает на то, что после трансплантации костного мозга должны возникать симметричные клеточные деления на две дочерние гемопоэтические стволовые клетки.
Считается, что самообновление стволовых клеток происходит в нише стволовых клеток в костном мозге, и разумно предположить, что ключевые сигналы, присутствующие в этой нише, будут важны для самообновления. [ 2 ] Существует большой интерес к экологическим и молекулярным требованиям к самообновлению HSC, так как понимание способности HSC пополнять себя в конечном итоге позволит генерировать расширенные популяции HSC in vitro , которые могут использоваться терапевтически.
Покоя
[ редактировать ]Гемопоэтические стволовые клетки, как и все взрослые стволовые клетки , в основном существуют в состоянии покоя или обратимой остановки роста. Измененный метаболизм покоящихся HSC помогает клеткам выжить в течение длительных периодов времени в среде гипоксического костного мозга. [ 14 ] При спровоцированном гибелью клеток или повреждением гематопоэтические стволовые клетки выходят из поколения и снова начинают активно делиться. Переход от покоя к распространению и спине регулируется путем MEK/ERK и путем PI3K/AKT/MTOR . [ 15 ] Дисрегуляция этих переходов может привести к истощению стволовых клеток или постепенной потере активных гемопоэтических стволовых клеток в системе крови. [ 15 ]
Мобильность
[ редактировать ]Гемопоэтические стволовые клетки обладают более высоким потенциалом, чем другие незрелые клетки крови, чтобы пройти барьер костного мозга , и, таким образом, могут перемещаться в крови из костного мозга в одной кости к другой кости. Если они оседают в тимусе , они могут превратиться в Т -клетки . В случае плодов и других экстрамедаллярных гематопоэза . Гемопоэтические стволовые клетки также могут оседать в печени или селезенке и развиваться.
Это позволяет собирать гематопоэтические стволовые клетки непосредственно из крови.
Клиническое значение
[ редактировать ]Пересадка
[ редактировать ]Трансплантация гемопоэтических стволовых клеток (HSCT) представляет собой трансплантацию мультипотентных гемопоэтических стволовых клеток , обычно полученных из костного мозга, периферической крови или пуповинной крови. [ 16 ] [ 17 ] [ 13 ] Он может быть аутологичным (используются собственные стволовые клетки пациента), аллогенные (стволовые клетки поступают от донора) или синген (от идентичного близнеца). [ 16 ] [ 17 ]
Это чаще всего выполняется для пациентов с определенными раками крови костного или мозга , таких как множественная миелома или лейкоз . [ 17 ] В этих случаях иммунная система получателя обычно разрушается радиацией или химиотерапией перед трансплантацией. Инфекция и заболевание трансплантата против хозяина являются основными осложнениями аллогенного HSCT. [ 17 ]
Чтобы собирать стволовые клетки из циркулирующей периферической крови, донорам крови инъецируется цитокином , таким как стимулирующий фактор гранулоцитов (G-CSF), который заставляет клетки покидать костный мозг и циркулировать в кровеносных сосудах. [ 18 ] При эмбриологии млекопитающих первые определяющие гематопоэтические стволовые клетки обнаруживаются в AGM ( аорта-хонад-мезонефрос ), а затем значительно расширяются в печени плода перед колонизацией костного мозга до рождения. [ 11 ]
Трансплантация гемопоэтических стволовых клеток остается опасной процедурой со многими возможными осложнениями; Он зарезервирован для пациентов с опасными для жизни заболеваниями. Поскольку выживаемость после процедуры увеличилась, ее использование расширилось до рака до аутоиммунных заболеваний [ 19 ] [ 20 ] и наследственные скелетные дисплазии ; особенно злокачественный инфантильный остеопетроз [ 21 ] [ 22 ] и мукополисахаридоз . [ 23 ]
Стволовые клетки могут быть использованы для регенерации различных типов тканей. HCT является установленной в качестве терапии для хронической миелоидной лейкозы, острой лимфатической лейкозы, апластической анемии и гемоглобинопатий, в дополнение к острым миелоидным лейкозам и первичным иммунным дефицитом. Регенерация гематопоэтической системы обычно достигается в течение 2–4 недель после Чемо- или облучения терапии и HCT. HSC клинически протестируются на их использование в негематопоэтической регенерации тканей. [ 24 ]
Старение гематопоэтических стволовых клеток
[ редактировать ]Повреждение ДНК
[ редактировать ]Разрывы ДНК накапливаются в долгосрочных гемопоэтических стволовых клетках во время старения. [ 25 ] Это накопление связано с широким ослаблением пути репарации ДНК и ответа, что зависит от покоящегося в HSC. [ 25 ] Не-гомологичный конец соединения (NHEJ)-это путь, который ремонтирует двойные разрывы в ДНК. NHEJ называют «не-гомологичным», потому что концы разрыва непосредственно лигируются без необходимости гомологичного шаблона. Путь NHEJ зависит от нескольких белков, включая лигазу 4 , ДНК -полимеразу MU и NHEJ Фактор 1 (NHEJ1, также известный как Cernunnos или XLF).
ДНК-лигаза 4 (LIG4) играет очень специфическую роль в восстановлении двойных разрывов с помощью NHEJ. Дефицит LIG4 у мыши вызывает прогрессирующую потерю гемопоэтических стволовых клеток во время старения. [ 26 ] Дефицит LIG4 в плюрипотентных стволовых клетках приводит к накоплению двухцепочечных разрывов ДНК и усилению апоптоза. [ 27 ]
У мышей -мутанта MU полимеразы развитие гематопоэтических клеток дефектно в нескольких популяциях клеток периферического и костного мозга с примерно на 40% уменьшением числа клеток костного мозга, которое включает в себя несколько гематопоэтических линий. [ 28 ] Потенциал расширения гематопоэтических клеток -предшественников также снижается. Эти характеристики коррелируют с пониженной способностью восстанавливать двойные разрывы в гематопоэтической ткани.
Дефицит фактора 1 NHEJ у мышей приводит к преждевременному старению гематопоэтических стволовых клеток, как указано несколькими линиями доказательств, включая доказательства того, что долгосрочная репопуляция дефектная и ухудшается с течением времени. [ 29 ] Используя человеческую модель плюрипотентных стволовых клеток дефицита NHEJ1, было показано, что NHEJ1 играет важную роль в содействии выживанию примитивных гематопоэтических предшественников. [ 30 ] Эти клетки с дефицитом NHEJ1 обладают слабым NEJ1-опосредованной восстановительной способностью, которая, по-видимому, неспособна справиться с повреждением ДНК, вызванным физиологическим стрессом, нормальным метаболизмом и ионизирующим радиацией. [ 30 ]
Чувствительность гематопоэтических стволовых клеток к дефициту LIG4, ДНК -полимеразы MU и NHEJ1 предполагает, что NHEJ является ключевой детерминантой способности стволовых клеток поддерживать себя против физиологического стресса во времени. [ 26 ] Rossi et al. [ 31 ] обнаружили, что эндогенное повреждение ДНК накапливается с возрастом даже в гематопоэтических стволовых клетках дикого типа, и предполагает, что начисление повреждения ДНК может быть важным физиологическим механизмом старения стволовых клеток.
Потеря клонального разнообразия
[ редактировать ]Исследование показывает, что клональное разнообразие гематопоэтических стволовых клеток резко уменьшается около 70 лет. Для более быстрорастущих немногих , обоснование новой теории старения , которая может позволить здоровому старению . [ 32 ] [ 33 ] Следует отметить, что сдвиг в клональном разнообразии во время старения ранее сообщалось в 2008 году [ 34 ] для мышиной системы, проведенной лабораторией Криста Мюллера-Сибург в Сан-Диего, штат Калифорния.
Исследовать
[ редактировать ]Поведение в культуре
[ редактировать ]Анализ формирующими ячейки для булыжника (CAFC) с представляет собой эмпирический анализ на основе клеточной культуры. При наличии на слизную культуру слоя стромальной кормушки , [ 35 ] Фракция гематопоэтических стволовых клеток ползут между пробелами (даже если стромальные клетки касаются друг друга) и в конечном итоге оседают между стромальными клетками и субстратом (здесь поверхность блюда) или захватываемые в клеточных процессах между стромальными клетками. Империполез - это феномен in vivo, в котором одна клетка полностью охвачена в другую (например, тимоциты в клетки медсестры тимуса ); С другой стороны, когда in vitro , лимфоидные клетки линии ползут под медсестрами , процесс называется псевдоэмпериполезом . явление более широко известно в поле HSC с помощью терминологии Это сходное клеточной культуры . Это происходит потому, что клетки, которые свободно плавают на вершине стромальных клеток, являются сферическими и, следовательно, рефрактильными. Однако клетки, которые ползут под стромальными клетками, сплющены и, таким образом, не рефрактильны. Механизм псевдоэмпериполеза только недавно выходит на свет. Это может быть опосредовано взаимодействием через CXCR4 (CD184) Рецептор для хемокинов CXC (например, SDF1 ) и α4β1 интегринов . [ 36 ]
Кинетика репопуляции
[ редактировать ]Гемопоэтические стволовые клетки (HSC) не могут быть легко наблюдаются напрямую, и, следовательно, их поведение должно быть выведено косвенно. Клональные исследования, вероятно, являются наиболее близким методом для исследований HSC HSC с одним клетками. Здесь сложные экспериментальные и статистические методы используются, чтобы выяснить, что с высокой вероятностью один HSC содержится в трансплантации, вводимой в смертельно облученного хозяина. Клональное расширение этой стволовой клетки может затем наблюдаться с течением времени, контролируя процентные клетки донорского типа в крови, когда хозяин восстановлен. Полученные временные ряды определяются как кинетика репопуляции HSC.
Кинетика восстановления очень разнородна. Однако, используя символическую динамику , можно показать, что они попадают в ограниченное количество классов. [ 37 ] Чтобы доказать это, несколько сотен экспериментальной кинетики репопуляции из клональной Thy-1 это SCA-1 + линейный − (B220, CD4, CD8, GR-1, MAC-1 и TER-119) [ 38 ] c-kit + HSC были переведены в символические последовательности путем назначения символов «+», «-», «~» всякий раз, когда два последовательных измерения процентных клеток донорского типа имеют положительный, отрицательный или неизменный наклон, соответственно. Используя расстояние в гамме , паттерны репопуляции подвергали кластерному анализу, давая 16 различных групп кинетики. Чтобы закончить эмпирическое доказательство, подход Add-One Laplace был использован для определения того, что вероятность обнаружения кинетики, не содержащейся в этих 16 группах, очень мала. Следующим, этот результат показывает, что гематопоэтическое компартмент стволовых клеток также неоднородна по динамическим критериям.
Первоначально считалось, что все гематопоэтические стволовые клетки были одинаковыми в их способностях к самообновлению и дифференцировке. Эта точка зрения была сначала оспорена открытием 2002 года Группой Мюллера-Сибург в Сан-Диего, который показал, что разные стволовые клетки могут демонстрировать различные паттерны репопуляции, которые являются эпигенетически предопределенными внутренними свойствами клонального типа 1 это SCA-1 + линейный − c-kit + HSC. [ 39 ] [ 40 ] [ 41 ] Результаты этих клональных исследований привели к понятию смещения линии . Используя соотношение Из лимфоидных (L) к миелоидным (M) клеткам в крови в качестве количественного маркера компартмент стволовых клеток может быть разделен на три категории HSC. Сбалансированные (BALA) гематопоэтические стволовые клетки пропаполируют периферическими белыми клетками в том же соотношении миелоидных и лимфоидных клеток, которые наблюдаются у неэманипулированных мышей (в среднем около 15% миелоидных и 85% лимфоидных клеток, или 3 ≤ ρ ≤ 10). Гемопоэтические стволовые клетки с миелоидом приводят к очень мало лимфоцитов, приводящих к соотношениям 0 <ρ <3, в то время как гемопоэтические стволовые клетки с лимфоидом , которые приводят к лимфоидному (Ly-Bi), они приводят к невыражению. Скорее, это три класса HSC, каждый с эпигенетически фиксированной программой дифференциации. Эти исследования также показали, что смещение линии не является стохастически регулируемым или не зависит от различий в влиянии на окружающую среду. My-Bi HSC самообновления дольше, чем сбалансированный или Ly-Bi HSC. Миелоидное смещение возникает в результате снижения чувствительности к лимфопоэтину Интерлейкин 7 (IL 7). [ 40 ]
Впоследствии другие группы подтвердили и выделили оригинальные результаты. [ 42 ] Например, группа карниза подтвердила в 2007 году, что кинетика репопуляции, долгосрочная способность самообновления и My-Bi и Ly-Bi стабильно унаследованные внутренние свойства HSC. [ 43 ] В 2010 году Goodell Group предоставила дополнительную информацию о молекулярной основе смещения линии в боковой популяции (SP) SCA-1 + линейный − c-kit + HSC. [ 44 ] Как показано ранее для передачи сигналов IL-7, было обнаружено, что член семейства трансформирующих факторов роста (TGF-бета) вызывает и ингибирует пролиферацию My-Bi и Ly-Bi HSC, соответственно.
Этимология
[ редактировать ]От греческого хаймато- сочетание формы хаймы «крови» и от латинизированной формы греческого poietikos , способного создавать, творческий, продуктивный », от Poiein ', чтобы сделать, создать». [ 45 ]
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Monga I, Kaur K, Dhanda S (март 2022 г.). «Пересмотр гематопоэза: применение объемной и одноклеточной транскриптомики, рассекающая гетерогенность транскрипции в гематопоэтических стволовых клетках». Брифинги в функциональной геномике . 21 (3): 159–176. doi : 10.1093/bfgp/elac002 . PMID 35265979 .
- ^ Jump up to: а беременный Birbrair A, Frenette PS (апрель 2016 г.). «Нишевая неоднородность в костном мозге» . Анналы нью -йоркской академии наук . 1370 (1): 82–96. BIBCODE : 2016NASA1370 ... 82B . doi : 10.1111/nyas.13016 . PMC 4938003 . PMID 27015419 .
- ^ Jump up to: а беременный Dzierzak E, Bigas A (май 2018). «Развитие крови: зависимость гемопоэтических стволовых клеток и независимость». Клеточная стволовая клетка . 22 (5): 639–651. doi : 10.1016/j.stem.2018.04.015 . HDL : 10230/36965 . PMID 29727679 .
- ^ Ottersbach K (апрель 2019 г.). «Эндотелиальный переход к эндотелиальному делу: обновление процесса изготовления крови» . Биохимическое общество транзакций . 47 (2): 591–601. doi : 10.1042/bst20180320 . PMC 6490701 . PMID 30902922 .
- ^ До JE, McCulloch EA (февраль 1961 г.). «Прямое измерение чувствительности радиации нормальных клеток костного мозга мыши». Радиационные исследования . 14 (2): 213–22. Bibcode : 1961radr ... 14..213t . doi : 10.2307/3570892 . HDL : 1807/2781 . JSTOR 3570892 . PMID 13776896 .
- ^ «5. гемопоэтические стволовые клетки» . Информация о стволовых клетках . Национальные институты здравоохранения, Министерство здравоохранения и социальных служб США. 17 июня 2011 года. Архивировано с оригинала 2015-09-29.
- ^ Мюллер, Альбрехт М.; Хупперц, Саша; Хеншлер, Рейнхард (июль 2016 г.). «Гемопоэтические стволовые клетки в регенеративной медицине: сбивают с пути или на пути?» Полем Трансфузионная медицина и гемотерапия . 43 (4): 247–254. doi : 10.1159/000447748 . ISSN 1660-3796 . PMC 5040947 . PMID 27721700 .
- ^ De Bruijn MF, Speck NA, Peeters MC, Dzierzak E (июнь 2000 г.). «Определенные гематопоэтические стволовые клетки сначала развиваются в основных артериальных областях эмбриона мыши» . Embo Journal . 19 (11): 2465–2474. doi : 10.1093/emboj/19.11.2465 . PMC 212758 . PMID 10835345 .
- ^ Медвинский А., Дзьерзак Е (сентябрь 1996 г.). «Окончательный гематопоэз автономно инициируется регионом AGM» . Клетка . 86 (6): 897–906. doi : 10.1016/s0092-8674 (00) 80165-8 . HDL : 1765/57137 . PMID 8808625 . S2CID 3330712 .
- ^ Ивановс А., Рибтсов С., Уэлч Л., Андерсон Р.А., Тернер М.Л., Медвинский А (ноябрь 2011 г.). «Очень мощные гематопоэтические стволовые клетки человека впервые появляются во внутриэмбриональной области аорта-хонад-мезонефрос» . Журнал экспериментальной медицины . 208 (12): 2417–2427. doi : 10.1084/jem.20111688 . PMC 3256972 . PMID 22042975 .
- ^ Jump up to: а беременный Dzierzak E, Speck NA (февраль 2008 г.). «Линии и наследия: развитие гемопоэтических стволовых клеток млекопитающих» . Природа иммунология . 9 (2): 129–136. doi : 10.1038/ni1560 . PMC 2696344 . PMID 18204427 .
- ^ «Процесс пересадки костного мозга» . Клиника Майо . Получено 18 марта 2015 года .
- ^ Jump up to: а беременный Махла Р.С. (2016). «Применение стволовых клеток в регенеративной медицине и терапии заболевания» . Международный журнал клеточной биологии . 2016 (7): 6940283. DOI : 10.1155/2016/6940283 . PMC 4969512 . PMID 27516776 .
- ^ Шрикант Л., Сунетта М.М., Венкатеш К., Кумар П.С., Чандрасекхар С., Венгамма Б., Сарма П.В. (2015). «Анаэробный гликолиз и экспрессия HIF1α в гематопоэтических стволовых клетках объясняют его природу покоя». Журнал стволовых клеток . 10 (2): 97–106. PMID 27125138 .
- ^ Jump up to: а беременный Baumgartner C, Toifl S, Farlik M, Halbriter F, Scheicher R, Fischer I, et al. (Июнь 2018 г.). «ERK-зависимый механизм обратной связи предотвращает истощение гемопоэтических стволовых клеток» . Клеточная стволовая клетка . 22 (6): 879–892.e6. doi : 10.1016/j.stem.2018.05.003 . PMC 5988582 . PMID 29804890 .
- ^ Jump up to: а беременный Felfly H, Haddad GG (2014). «Гематопоэтические стволовые клетки: потенциальные новые применения для трансляционной медицины». Журнал стволовых клеток . 9 (3): 163–197. PMID 25157450 .
- ^ Jump up to: а беременный в дюймовый Парк Б., Ю К, Ким С (декабрь 2015 г.). «Расширение и генерация гематопоэтических стволовых клеток: способы прорыва» . Исследование крови . 50 (4): 194–203. doi : 10.5045/br.2015.50.4.194 . PMC 4705045 . PMID 26770947 .
- ^ «5. гемопоэтические стволовые клетки - stemcells.nih.gov» . stemcells.nih.gov . Архивировано из оригинала 2021-05-01 . Получено 2018-01-18 .
- ^ Tyndall A, Fassas A, Passweg J, Ruiz de Elvira C, Attal M, Brooks P, et al. (Октябрь 1999). «Аутологичные гематопоэтические трансплантаты стволовых клеток для аутоиммунного заболевания-смертность, связанная с трансплантацией. Аутоиммунные заболевания и лимфома, рабочие партии европейской группы по крови и трансплантации костного мозга, Европейская лига против ревматизма и международный проект стволовых клеток для аутоиммунных заболеваний» . Трансплантация костного мозга . 24 (7): 729–734. doi : 10.1038/sj.bmt.1701987 . PMID 10516675 .
- ^ Burt RK, Loh Y, Pearce W, Beohar N, Barr WG, Craig R, et al. (Февраль 2008 г.). «Клиническое применение стволовых клеток, полученных из крови и костного мозга, для незлокачественных заболеваний» . Джама . 299 (8): 925–936. doi : 10.1001/Jama.299.8.925 . PMID 18314435 .
- ^ El-Sobky Ta, El-Haddad A, Elsobky E, Elsayed SM, Sakr HM (март 2017 г.). «Изменение скелетной рентгенографической патологии в случае злокачественного детского остеопетроза после трансплантации гематопоэтических стволовых клеток» . Египетский журнал радиологии и ядерной медицины . 48 (1): 237–243. doi : 10.1016/j.ejrnm.2016.12.013 .
- ^ Hashemi Taheri AP, Radmard AR, Kooraki S, Behfar M, Pak N, Hamidieh AA, Ghavamzadeh A (сентябрь 2015 г.). «Рентгенологическое разрешение злокачественного младенческого остеопетроза изменений скелета после трансплантации гемопоэтических стволовых клеток». Педиатрическая кровь и рак . 62 (9): 1645–1649. doi : 10.1002/pbc.255524 . PMID 25820806 . S2CID 11287381 .
- ^ Langereis EJ, Den OS MM, Breen C, Jones SA, Knaven OC, Mercer J, et al. (Март 2016 г.). «Прогрессирование дисплазии тазобедренного сустава при мукополисахаридозе тип типа I Shurler после успешной трансплантации гемопоэтических стволовых клеток». Журнал хирургии костей и суставов. Американский том . 98 (5): 386–395. doi : 10.2106/jbjs.o.00601 . PMID 26935461 .
- ^ Мюллер, Альбрехт М.; Хупперц, Саша; Хеншлер, Рейнхард (2016-07-26). «Гемопоэтические стволовые клетки в регенеративной медицине: сбивают с пути или на пути?» Полем Трансфузионная медицина и гемотерапия . 43 (4): 247–254. doi : 10.1159/000447748 . ISSN 1660-3796 . PMC 5040947 . PMID 27721700 .
- ^ Jump up to: а беременный Beerman I, Seita J, Inlay MA, Weissman IL, Rossi DJ (июль 2014 г.). «Огромные гематопоэтические стволовые клетки накапливают повреждение ДНК во время старения, которое восстанавливается при входе в клеточный цикл» . Клеточная стволовая клетка . 15 (1): 37–50. doi : 10.1016/j.stem.2014.04.016 . PMC 4082747 . PMID 24813857 .
- ^ Jump up to: а беременный Nijnik A, Woodbine L, Marchetti C, Dawson S, Lambe T, Liu C, et al. (Июнь 2007 г.). «Репарация ДНК ограничивает гематопоэтические стволовые клетки во время старения». Природа . 447 (7145): 686–690. Bibcode : 2007natur.447..686n . doi : 10.1038/nature05875 . PMID 17554302 . S2CID 4332976 .
- ^ Tilgner K, Neganova I, Moreno-Gimeno I, Al-Aama JY, Burks D, Yung S, et al. (Август 2013). «Человеческая модель IPSC дефицита IPSC лигазы IV выявляет важную роль для восстановления NHEJ-опосредованного DSB при выживании и геномной стабильности индуцированных плюрипотентных стволовых клеток и появляющихся гематопоэтических предшественников» . Гибель клеток и дифференциация . 20 (8): 1089–1100. doi : 10.1038/cdd.2013.44 . PMC 3705601 . PMID 23722522 .
- ^ Лукас Д., Эскодеро Б., Лигос Дж.М., Сеговия Дж.С., Эстрада Дж.С., Террадос Г. и др. (Февраль 2009 г.). «Измененный гематопоэз у мышей, в которых отсутствует ДНК-полимераза MU, обусловлено неэффективным двойным репарацией разрыва» . PLOS Genetics . 5 (2): E1000389. doi : 10.1371/journal.pgen.1000389 . PMC 2638008 . PMID 19229323 .
- ^ Avagyan S, Churchill M, Yamamoto K, Crowe JL, Li C, Lee BJ, et al. (Сентябрь 2014). «Дисфункция гематопоэтических стволовых клеток лежит в основе прогрессирующей лимфоцитопении при дефиците XLF/cernunnos» . Кровь . 124 (10): 1622–1625. doi : 10.1182/blood-2014-05-574863 . PMC 4155271 . PMID 25075129 .
- ^ Jump up to: а беременный Tilgner K, Neganova I, Singhapol C, Saretzki G, Al-Aama JY, Evans J, et al. (Сентябрь 2013 г.). «Краткий отчет: индуцированная человеком плюрипотентные стволовые клетки дефицита Cernunnos выявляет важную роль XLF в выживании примитивных гематопоэтических предшественников» . Стволовые клетки . 31 (9): 2015–2023. doi : 10.1002/Stem.1456 . PMID 23818183 . S2CID 3623309 .
- ^ Rossi DJ, Bryder D, Seita J, Nussenzweig A, Hoejmakers J, Weissman IL (июнь 2007 г.). «Недостатки в восстановлении повреждения ДНК ограничивают функцию гематопоэтических стволовых клеток с возрастом». Природа . 447 (7145): 725–729. Bibcode : 2007natur.447..725r . doi : 10.1038/nature05862 . PMID 17554309 . S2CID 4416445 .
- ^ «Исследования могут показать, почему люди могут внезапно стать слабыми в возрасте 70 лет» . Хранитель . 1 июня 2022 года . Получено 18 июля 2022 года .
- ^ Митчелл, Эмили; Спенсер Чепмен, Майкл; Уильямс, Николас; Доусон, Кевин Дж.; Менде, Николь; Calderbank, Emily F.; Юнг, Хинтул; Митчелл, Томас; Coorens, Тим HH; Спенсер, Дэвид Х.; Мачадо, Хизер; Ли-Шикс, Генри; Дэвис, Меган; Хейлер, Даниэль; Фабре, Маргарет А.; Махбубани, Кришнаа; Абаскаль, Федерико; КАГАН, Алекс; Vassiliou, George S.; Бакстер, Джоанна; Martincorena, Inigo; Страттон, Майкл Р.; Кент, Дэвид Дж.; Чаттерджи, Кришна; Парси, Коурош Саэб; Грин, Энтони Р.; Нангалия, Джиоти; Лауренти, Элиза; Кэмпбелл, Питер Дж. (Июнь 2022 г.). «Клональная динамика гематопоэза на протяжении всей жизни» . Природа . 606 (7913): 343–350. Bibcode : 2022nater.606..343M . doi : 10.1038/s41586-022-04786-y . ISSN 1476-4687 . PMC 9177428 . PMID 35650442 .
- ^ Чо, Ребекка Х; Зибург, Ганс Б; Мюллер-Шиберг, Криста Е. (2008). «Новый механизм старения гематопоэтических стволовых клеток: старение изменяет клональный состав компартмента стволовых клеток, но не отдельных стволовых клеток» . Кровь . 111 (12): 5553–5561. doi : 10.1182/blood-2007-11-123547 . PMC 2424153 . PMID 18413859 .
- ^ Ламас, Сара; Гарсия-Перес, Ева; Meana, Альваро; Ларчер, Фернандо; Дель Рио, Марсела (2015). «Действия и приложения клеток питателя» . Tysue Tarr B Rev. 21 (4): 345–3 doi : 10.1089/ent . PMC 45333020 . PMID 25659081 .
- ^ Burger JA, Spoo A, Dwenger A, Burger M, Behringer D (август 2003 г.). «Рецепторы хемокинов CXCR4 (CD184) и интегрины Alpha4beta1 опосредуют спонтанную миграцию человеческих предшественников CD34+ и острых миелоидных клеток лейкемии под стромальными клетками мозга (псевдоэмпиполис)» . Британский журнал гематологии . 122 (4): 579–89. doi : 10.1046/j.1365-2141.2003.04466.x . PMID 12899713 . S2CID 8764752 .
- ^ Sieburg HB, Müller-Sieburg CE (2004). «Классификация короткой кинетики по форме». В Силико биологии . 4 (2): 209–17. PMID 15107024 .
- ^ Challen, Grant A.; Болес, Натан; Лин, Куан-Инь К.; Гуделл, Маргарет А. (январь 2009 г.). «Мышиная гематопоэтическая идентификация и анализ стволовых клеток» . Цитометрия часть а . 75a (1): 14–24. doi : 10.1002/cyto.a.20674 . PMC 2640229 . PMID 19023891 .
- ^ Müller-Sieburg CE, CHO RH, Thoman M, Adkins B, Sieburg HB (август 2002 г.). «Детерминистическая регуляция самообновления и дифференцировки гематопоэтических стволовых клеток» . Кровь . 100 (4): 1302–9. doi : 10.1182/blood.v100.4.1302.h81602001302_1302_1309 . PMID 12149211 .
- ^ Jump up to: а беременный Muller-Sieburg CE, CHO RH, Karlsson L, Huang JF, Sieburg HB (июнь 2004 г.). «Миелоидные гематопоэтические стволовые клетки обладают обширной способностью к самообновлению, но генерируют уменьшенное лимфоидное потомство с нарушением отзывчивости IL-7» . Кровь . 103 (11): 4111–8. doi : 10.1182/blood-2003-10-3448 . PMID 14976059 .
- ^ Sieburg HB, Cho RH, Dykstra B, Uchida N, Eaves CJ, Muller-Sieburg CE (март 2006 г.). «Гемопоэтическое стволовое отделение состоит из ограниченного числа дискретных подмножеств стволовых клеток» . Кровь . 107 (6): 2311–6. doi : 10.1182/blood-2005-07-2970 . PMC 1456063 . PMID 16291588 .
- ^ Шредер Т (март 2010 г.). «Гемопоэтическая гетерогенность стволовых клеток: подтипы, а не непредсказуемое поведение» . Клеточная стволовая клетка . 6 (3): 203–7. doi : 10.1016/j.stem.2010.02.006 . PMID 20207223 .
- ^ Dykstra B, Kent D, Bowie M, McCaffrey L, Hamilton M, Lyons K, et al. (Август 2007 г.). «Долгосрочное распространение различных программ дифференциации гематопоэтической дифференциации in vivo» . Клеточная стволовая клетка . 1 (2): 218–29. doi : 10.1016/j.stem.2007.05.015 . PMID 18371352 .
- ^ Challen GA, Boles NC, Chambers SM, Goodell MA (март 2010 г.). «Различные гематопоэтические подтипы стволовых клеток дифференциально регулируются TGF-бета1» . Клеточная стволовая клетка . 6 (3): 265–78. doi : 10.1016/j.stem.2010.02.002 . PMC 2837284 . PMID 20207229 .
- ^ Flexner SB, Hauck LC, Eds. (1993). Случайный домик Unabrided Dictionary (2 -е изд.). Нью -Йорк: Рэндом Хаус. п. 890. ISBN 0-679-42917-4 .
