Клатрин
| Повтор тяжелого N-концевого пропеллера клатрина | |||
|---|---|---|---|
 Терминальный домен Клатрина | |||
| Идентификаторы | |||
| Символ | Клатрин_пропель | ||
| Пфам | PF01394 | ||
| Пфам Клан | CL0020 | ||
| ИнтерПро | ИПР022365 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1бпо / СКОПе / СУПФАМ | ||
| |||
| Клатрин, линкер тяжелой цепи | |||
|---|---|---|---|
 Проксимальный повтор тяжелой цепи клатрина (линкер) | |||
| Идентификаторы | |||
| Символ | Клатрин-ссылка | ||
| Пфам | PF09268 | ||
| Пфам Клан | CL0020 | ||
| ИнтерПро | ИПР015348 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1б89 / СКОПе / СУПФАМ | ||
| |||
| CHCR /VPS 7-кратный повтор | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Клатрин_пропель | ||
| Пфам | PF00637 | ||
| Пфам Клан | CL0020 | ||
| ИнтерПро | IPR000547 | ||
| УМНЫЙ | SM00299 | ||
| PROSITE | ПС50236 | ||
| КАТ | 1b89 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1б89 / СКОПе / СУПФАМ | ||
| |||
| Легкая цепь клатрина | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Клатрин_lg_ch | ||
| Пфам | PF01086 | ||
| ИнтерПро | IPR000996 | ||
| PROSITE | PDOC00196 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 3ийв / СКОПе / СУПФАМ | ||
| |||
Клатрин представляет собой белок , который играет важную роль в формировании покрытых оболочкой везикул . Клатрин был впервые выделен Барбарой Пирс в 1976 году. [ 1 ] Он образует форму трискелиона , состоящую из трех тяжелых цепей клатрина и трех легких цепей. Когда трискелии взаимодействуют, они образуют многогранную решетку, окружающую везикулу. Название белка относится к этой решетчатой структуре, происходящей от латинского clathri, что означает «решетка». [ 2 ] Барбара Пирс назвала белок клатрином по предложению Грэма Митчисона , выбрав его из трёх возможных вариантов. [ 3 ] Белки оболочки, такие как клатрин, используются для создания небольших пузырьков для транспортировки молекул внутри клеток. Эндоцитоз . и экзоцитоз везикул позволяют клеткам общаться, переносить питательные вещества, импортировать сигнальные рецепторы, опосредовать иммунный ответ после отбора проб внеклеточного мира и очищать клеточный мусор, оставшийся в результате воспаления тканей Эндоцитарный путь может быть перехвачен вирусами и другими патогенами, чтобы проникнуть в клетку во время инфекции. [ 4 ]
Структура
[ редактировать ]| Легкая цепь клатрина а |
|---|
| Легкая цепь клатрина b |
|---|
| Тяжелая цепь клатрина 1 |
|---|
| Тяжелая цепь клатрина 2 |
|---|
Клатрин-трискелион состоит из трех тяжелых цепей клатрина, взаимодействующих на своих С-концах , каждая тяжелая цепь ~190 кДа имеет прочно связанную с ней легкую цепь ~25 кДа. Три тяжелые цепи обеспечивают структурную основу решетки клатрина, а три легкие цепи, как полагают, регулируют образование и разборку решетки клатрина. Существует две формы легких цепей клатрина, обозначенные a и b. Основная тяжелая цепь клатрина, расположенная у человека на 17-й хромосоме , обнаружена во всех клетках. Второй ген тяжелой цепи клатрина, на хромосоме 22 , экспрессируется в мышцах. [ 5 ]
Тяжелая цепь клатрина часто описывается как нога с субдоменами, представляющими стопу ( N-концевой домен), за которыми следуют домены лодыжки, дистальной части ноги, колена, проксимальной части ноги и домены тримеризации. N-концевой домен состоит из семилопастной структуры β-пропеллера. Остальные домены образуют суперспираль из коротких альфа-спиралей. Первоначально это было определено на основе структуры домена проксимальной ноги, который идентифицировал и состоит из меньшего структурного модуля, называемого повторяющимися мотивами тяжелой цепи клатрина. Легкие цепи связываются преимущественно с проксимальной частью тяжелой цепи с некоторым взаимодействием вблизи домена тримеризации. β-пропеллер у «ножки» клатрина содержит множество сайтов связывания для взаимодействия с другими белками. [ 5 ]
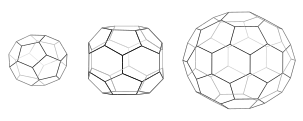
Когда трискелии собираются вместе в растворе, они могут взаимодействовать с достаточной гибкостью, образуя 6-сторонние кольца ( шестиугольники ), образующие плоскую решетку, или 5-сторонние кольца ( пятиугольники ), необходимые для образования изогнутой решетки. Когда множество трискелионов соединяются, они могут образовывать структуру, похожую на корзину. Показанная структура состоит из 36 трискелий, одна из которых показана синим цветом. Другая распространенная сборка — усеченный икосаэдр . Чтобы вместить везикулу, в решетке должно присутствовать ровно 12 пятиугольников.
В клетке клатрин трискелион в цитоплазме связывается с белком-адаптером, который связал мембрану, одновременно присоединяя к мембране одну из своих трех ножек. Клатрин не может напрямую связываться с мембраной или грузом и вместо этого использует для этого адаптерные белки. Этот трискелион будет связываться с другими трискелиями, прикрепленными к мембране, образуя округлую решетку из шестиугольников и пятиугольников, напоминающую панели футбольного мяча, которые втягивают мембрану в бутон. Путем построения различных комбинаций 5- и 6-сторонних колец можно собирать везикулы разных размеров. Самая маленькая клетка клатрина, которую обычно изображают, называемая мини-пальто, имеет 12 пятиугольников и только два шестиугольника. Еще более мелкие клетки с нулевыми шестиугольниками, вероятно, не образуются из нативного белка, поскольку ножки трискелии слишком громоздки. [ 6 ]
Функция
[ редактировать ]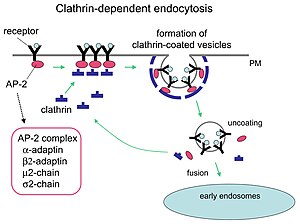
Клатрин играет решающую роль в формировании округлых везикул в цитоплазме для внутриклеточного транспорта. Покрытые клатрином везикулы (CCV) избирательно сортируют груз на клеточной мембране , в транс- сети Гольджи и в эндосомальных компартментах для множества путей мембранного транспорта. После того как везикула попадает в цитоплазму, оболочка быстро разбирается, позволяя клатрину перерабатываться, в то время как везикула транспортируется в различные места.
Молекулы-адаптеры отвечают за самосборку и рекрутирование. Двумя примерами адаптерных белков являются AP180. [ 7 ] и эпсин . [ 8 ] [ 9 ] [ 10 ] AP180 используется при образовании синаптических пузырьков . Он привлекает клатрин к мембранам, а также способствует его полимеризации . Эпсин также привлекает клатрин к мембранам и способствует его полимеризации, а также может способствовать деформации мембраны, и, таким образом, везикулы, покрытые клатрином, могут отпочковываться. В клетке трискелион, плавающий в цитоплазме, связывается с белком-адаптером, поочередно соединяя одну из его ножек с мембраной. Ножка трискелиона связывается с другими, прикрепленными к мембране, образуя многогранную решетку, ножку трискелиона, которая втягивает мембрану в почку. Ножка не связывается непосредственно с мембраной, а связывается с белками-адаптерами, распознающими молекулы на поверхности мембраны.
Клатрин выполняет еще одну функцию, помимо покрытия органелл . В неделящихся клетках образование везикул, покрытых клатрином, происходит непрерывно. , прекращается образование везикул, покрытых клатрином В клетках, подвергающихся митозу . Во время митоза клатрин связывается с веретенообразным аппаратом в комплексе с двумя другими белками: TACC3 и ch-TOG/ CKAP5 . Клатрин способствует съезду хромосом путем стабилизации кинетохорных волокон митотического веретена . Аминоконцевой домен тяжелой цепи клатрина и домен TACC TACC3 образуют поверхность связывания микротрубочек для TACC3/ch-TOG/клатрина для связывания с митотическим веретеном . Стабилизация кинетохорных волокон требует тримерной структуры клатрина для сшивания микротрубочек. [ 11 ] [ 12 ] [ 13 ]
Клатрин-опосредованный эндоцитоз (CME) регулирует многие клеточные физиологические процессы, такие как интернализация факторов роста и рецепторов, проникновение патогенов и синаптическая передача. Считается, что клеточные захватчики используют питательный путь, чтобы получить доступ к механизмам репликации клетки. Определенные сигнальные молекулы открывают путь питательным веществам. [ 1 ] Два химических соединения под названием Pitstop 1 и Pitstop 2, селективные ингибиторы клатрина, могут препятствовать патогенной активности и, таким образом, защищать клетки от инвазии. Эти два соединения избирательно блокируют ассоциацию эндоцитарного лиганда с концевым доменом клатрина in vitro. [ 14 ] Однако специфичность этих соединений в блокировании клатрин-опосредованного эндоцитоза подвергается сомнению. [ 15 ] Однако в более поздних исследованиях было подтверждено, что специфичность Pitstop 2 зависит от клатрина. [ 16 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Пирс Б.М. (апрель 1976 г.). «Клатрин: уникальный белок, связанный с внутриклеточным переносом мембран с помощью везикул, покрытых оболочкой» . Труды Национальной академии наук Соединенных Штатов Америки . 73 (4): 1255–1259. Бибкод : 1976PNAS...73.1255P . дои : 10.1073/pnas.73.4.1255 . ПМК 430241 . ПМИД 1063406 .
- ^ «клатрат, прилагательное» . Мерриам-Вебстер . Проверено 29 ноября 2023 г.
- ^ Пирс Б.М. (сентябрь 1987 г.). «Клатрин и покрытые оболочкой везикулы» . ЭМБО Дж . 6 (9): 2507–12. дои : 10.1002/j.1460-2075.1987.tb02536.x . ПМК 553666 . ПМИД 2890519 .
- ^ «ИнтерПро» . Архивировано из оригинала 16 января 2016 г. Проверено 7 октября 2015 г.
- ^ Перейти обратно: а б Робинсон М.С. (декабрь 2015 г.). «Сорок лет везикул, покрытых клатрином» . Трафик . 16 (12): 1210–38. дои : 10.1111/tra.12335 . ПМИД 26403691 .
- ^ Фотин А., Кирххаузен Т., Григорьев Н., Харрисон С.С., Уолц Т., Ченг Ю. (декабрь 2006 г.). «Определение структуры клатриновых оболочек с субнанометровым разрешением методом одночастичной криоэлектронной микроскопии» . J Структур Биол . 156 (3): 453–60. дои : 10.1016/j.jsb.2006.07.001 . ПМК 2910098 . ПМИД 16908193 .
- ^ МакМахон ХТ. «Клатрин и его взаимодействие с AP180» . МРЦ Лаборатория молекулярной биологии. Архивировано из оригинала 1 мая 2009 г. Проверено 17 апреля 2009 г.
микрофотографии сборки клатрина
- ^ МакМахон ХТ. «Галерея Эпсин 1 ЭМ» . МРЦ Лаборатория молекулярной биологии. Архивировано из оригинала 2 января 2009 г. Проверено 17 апреля 2009 г.
микрофотографии почкования пузырьков
- ^ Форд М.Г., Пирс Б.М. , Хиггинс М.К., Валлис Ю., Оуэн Дж., Гибсон А. и др. (февраль 2001 г.). «Одновременное связывание PtdIns(4,5)P2 и клатрина с помощью AP180 при зарождении клатриновых решеток на мембранах» (PDF) . Наука . 291 (5506): 1051–1055. Бибкод : 2001Sci...291.1051F . CiteSeerX 10.1.1.407.6006 . дои : 10.1126/science.291.5506.1051 . ПМИД 11161218 . Архивировано из оригинала (PDF) 21 ноября 2008 г. Проверено 17 апреля 2009 г.
- ^ Хиггинс М.К., МакМахон Х.Т. (май 2002 г.). «Снимки клатрин-опосредованного эндоцитоза» (PDF) . Тенденции биохимических наук . 27 (5): 257–263. дои : 10.1016/S0968-0004(02)02089-3 . ПМИД 12076538 . Архивировано из оригинала (PDF) 21 ноября 2008 г. Проверено 17 апреля 2009 г.
- ^ Ройл С.Дж., Брайт Н.А., Лагнадо Л. (апрель 2005 г.). «Клатрин необходим для функционирования митотического веретена» . Природа . 434 (7037): 1152–1157. Бибкод : 2005Natur.434.1152R . дои : 10.1038/nature03502 . ПМЦ 3492753 . ПМИД 15858577 .
- ^ Худ Ф.Е., Уильямс С.Дж., Берджесс С.Г., Ричардс М.В., Рот Д., Штраубе А. и др. (август 2013 г.). «Координация соседних доменов опосредует сборку TACC3-ch-TOG-клатрина и связывание митотического веретена» . Журнал клеточной биологии . 202 (3): 463–478. дои : 10.1083/jcb.201211127 . ПМЦ 3734082 . ПМИД 23918938 .
- ^ Причард К.Л., О'Брайен Н.С., Мурсия С.Р., Бейкер-младший, Маккласки А. (18 января 2022 г.). «Роль клатрина и динамина в клатрин-опосредованном эндоцитозе/рециркуляции синаптических пузырьков и последствиях при неврологических заболеваниях» . Границы клеточной нейронауки . 15 : 754110. doi : 10.3389/fncel.2021.754110 . ПМЦ 8805674 . ПМИД 35115907 .
- ^ Роль терминального домена клатрина в регуляции динамики покрытых ямок, выявленная с помощью ингибирования малых молекул | Cell, том 146, выпуск 3, 471–484, 5 августа 2011 г. Аннотация. Архивировано 19 января 2012 г. в Wayback Machine.
- ^ Датта Д., Уильямсон К.Д., Коул Н.Б., Дональдсон Дж.Г. (сентябрь 2012 г.). «Питстоп 2 является мощным ингибитором клатрин-независимого эндоцитоза» . ПЛОС ОДИН . 7 (9): е45799. Бибкод : 2012PLoSO...745799D . дои : 10.1371/journal.pone.0045799 . ПМЦ 3448704 . ПМИД 23029248 .
- ^ Робертсон М.Дж., Хорачек А., Зауэр С., фон Кляйст Л., Бейкер Дж.Р., Штальшмидт В. и др. (ноябрь 2016 г.). «5-Арил-2-(нафта-1-ил)сульфонамидотиазол-4(5H)-оны как ингибиторы клатрина». Органическая и биомолекулярная химия . 14 (47): 11266–11278. дои : 10.1039/C6OB02308H . ПМИД 27853797 .
Дальнейшее чтение
[ редактировать ]- Уэйкхэм Д.Э., Чен С.И., Грин Б., Хван П.К., Бродский Ф.М. (октябрь 2003 г.). «Самосборка клатрина включает скоординированные слабые взаимодействия, благоприятные для клеточной регуляции» . Журнал ЭМБО . 22 (19): 4980–4990. дои : 10.1093/emboj/cdg511 . ПМК 204494 . ПМИД 14517237 .
- Форд М.Г., Миллс И.Г., Питер Б.Дж., Валлис Ю., Прафке Г.Дж., Эванс П.Р. и др. (сентябрь 2002 г.). «Искривление покрытых клатрином ямок, вызванное эпсином». Природа . 419 (6905): 361–366. Бибкод : 2002Natur.419..361F . дои : 10.1038/nature01020 . ПМИД 12353027 . S2CID 4372368 .
- Фотин А., Ченг Ю., Слиз П., Григорьев Н., Харрисон С.С., Кирххаузен Т. и др. (декабрь 2004 г.). «Молекулярная модель полной решетки клатрина по данным электронной криомикроскопии». Природа . 432 (7017): 573–579. Бибкод : 2004Natur.432..573F . дои : 10.1038/nature03079 . ПМИД 15502812 . S2CID 4396282 .
- Мусави С.А., Малерод Л., Берг Т., Кьекен Р. (январь 2004 г.). «Клатринзависимый эндоцитоз» . Биохимический журнал . 377 (Часть 1): 1–16. дои : 10.1042/BJ20031000 . ПМЦ 1223844 . ПМИД 14505490 .
- Смит С.Дж., Григорьев Н., Пирс Б.М. (сентябрь 1998 г.). «Клатриновые покрытия с разрешением 21 А: клеточная сборка, предназначенная для повторного использования нескольких мембранных рецепторов» . Журнал ЭМБО . 17 (17): 4943–4953. дои : 10.1093/emboj/17.17.4943 . ПМК 1170823 . ПМИД 9724631 . (Модель сборки Клатрина)
- Перес-Гомес Дж., Мур I (март 2007 г.). «Эндоцитоз растений: все-таки это клатрин» . Современная биология . 17 (6): 217–219 Р2. Бибкод : 2007CBio...17.R217P . дои : 10.1016/j.cub.2007.01.045 . ПМИД 17371763 . S2CID 17680351 . (Обзор участия клатрина в эндоцитозе растений)
- Ройл С.Дж., Брайт Н.А., Лагнадо Л. (апрель 2005 г.). «Клатрин необходим для функционирования митотического веретена» . Природа . 434 (7037): 1152–1157. Бибкод : 2005Natur.434.1152R . дои : 10.1038/nature03502 . ПМЦ 3492753 . ПМИД 15858577 .
- Худ Ф.Е., Уильямс С.Дж., Берджесс С.Г., Ричардс М.В., Рот Д., Штраубе А. и др. (август 2013 г.). «Координация соседних доменов опосредует сборку TACC3-ch-TOG-клатрина и связывание митотического веретена» . Журнал клеточной биологии . 202 (3): 463–478. дои : 10.1083/jcb.201211127 . ПМЦ 3734082 . ПМИД 23918938 .
- Кнуэль С., Чен С.И., Манало В., Хван П.К., Ота Н., Бродский Ф.М. (декабрь 2006 г.). «Новые места связывания на клатрине и адаптерах регулируют различные аспекты сборки оболочки» . Трафик . 7 (12): 1688–1700. дои : 10.1111/j.1600-0854.2006.00499.x . ПМИД 17052248 . S2CID 19087208 .
- Эделинг М.А., Смит С., Оуэн Д. (январь 2006 г.). «Жизнь клатриновой оболочки: данные о клатриновых и AP-структурах». Обзоры природы. Молекулярно-клеточная биология . 7 (1): 32–44. дои : 10.1038/nrm1786 . ПМИД 16493411 . S2CID 19393938 .
- Датта Д., Уильямсон К.Д., Коул Н.Б., Дональдсон Дж.Г. (сентябрь 2012 г.). «Питстоп 2 является мощным ингибитором клатрин-независимого эндоцитоза» . ПЛОС ОДИН . 7 (9): е45799. Бибкод : 2012PLoSO...745799D . дои : 10.1371/journal.pone.0045799 . ПМЦ 3448704 . ПМИД 23029248 .
Внешние ссылки
[ редактировать ]- MBInfo - Клатрин-опосредованный эндоцитоз
- ресурса Eukaryotic Linear Motif Класс мотива LIG_Clathr_ClatBox_1
- ресурса Eukaryotic Linear Motif Класс мотива LIG_Clathr_ClatBox_2
- Структура клатрина
- Мембранная динамика
- Клатрин Динамикс [ постоянная мертвая ссылка ] Библиотека изображений и видео ASCB