Дикислородный комплекс переходного металла
Дикислородные комплексы — координационные соединения , содержащие О 2 в качестве лиганда . [1] [2] Изучение этих соединений вдохновлено белками-переносчиками кислорода, такими как миоглобин , гемоглобин , гемеритрин и гемоцианин . [3] Некоторые переходные металлы образуют комплексы с O 2 , причем многие из этих комплексов образуются обратимо. [4] Связывание O 2 является первым шагом во многих важных явлениях, таких как клеточное дыхание , коррозия и промышленная химия. Первый синтетический кислородный комплекс был продемонстрирован в 1938 году с комплексом кобальта(II), обратимо связанным с O 2 . [5]
Мононуклеарные комплексы O 2
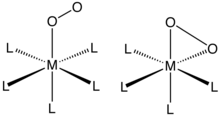
[ редактировать ]O 2 связывается с одним металлическим центром либо «концом» ( η 1 - ) или «бок» ( η 2 -). Связи и структуры этих соединений обычно оценивают с помощью монокристаллической рентгеновской кристаллографии , уделяя особое внимание как общей геометрии, так и расстояниям O–O, что выявляет порядок связи лиганда O 2 .
Комплексы η 1 -О 2 лиганды
[ редактировать ]
O 2 Аддукты , полученные из кобальта (II) и железа комплексов (II) порфирина (и родственных анионных макроциклических лигандов), демонстрируют этот тип связывания. Миоглобин и гемоглобин являются известными примерами, и было описано множество синтетических аналогов, которые ведут себя аналогичным образом. Связывание O 2 обычно описывается как происходящее путем переноса электрона от центра металла(II) с образованием супероксида ( O −
2 ) комплексы металл(III)-центров. Как показали механизмы цитохрома Р450 и альфа-кетоглутаратзависимой гидроксилазы , Fe- η 1 Связь -O 2 способствует образованию оксоцентров Fe(IV). O 2 может связываться с одним металлом биметаллического звена теми же способами, которые обсуждались выше для моноядерных комплексов. Хорошо известным примером является активный центр белка гемеритрина железа , который представляет собой дикарбоксилат , связывающий O 2 в одном Fe-центре. Биядерные комплексы также могут сотрудничать при связывании, хотя первоначальная атака О 2 , вероятно, происходит по одному металлу.
Комплексы η 2 -О 2 лиганды
[ редактировать ]или 2 -связь - наиболее распространенный мотив, наблюдаемый в координационной химии дикислорода. Такие комплексы можно получить обработкой комплексов низковалентных металлов кислородом. Например, комплекс Васки обратимо связывает О 2 (Ph = C 6 H 5 ):
- IrCl(CO)(PPh 3 ) 2 + O 2 ⇌ IrCl(CO)(PPh 3 ) 2 O 2
Преобразование описывается как 2 e − Окислительно-восстановительный процесс: Ir(I) превращается в Ir(III), так же как дикислород превращается в пероксид . Поскольку O 2 имеет триплетное основное состояние, а комплекс Васки является синглетным, реакция протекает медленнее, чем при синглетного кислорода . использовании [7] Магнитные свойства некоторых η 2 Комплексы -О 2 показывают, что лиганд на самом деле является супероксидом, а не пероксидом. [8]
Большинство комплексов η 2 -O 2 образуются с использованием перекиси водорода , а не из O 2 . Хромат ([CrO 4 )] 2− ) можно, например, превратить в тетрапероксид [Cr(O 2 ) 4 ] 2− . Реакция перекиси водорода с водным раствором титана (IV) дает ярко окрашенный пероксикомплекс, который является полезным тестом на титан, а также на перекись водорода. [9]
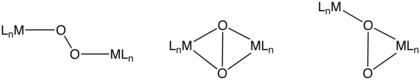
Биядерные комплексы O 2
[ редактировать ]
Эти способы связывания включают μ 2 - η 2 , ч 2 -, м 2 - ч 1 , ч 1 -, и μ 2 - h 1 , ч 2 -. В зависимости от степени переноса электрона с диметаллического звена эти лиганды O 2 снова можно назвать пероксо или супероксо. Гемоцианин представляет собой O 2 -носитель, который использует мостиковый мотив связывания O2. Он имеет пару медных центров. [10]

.
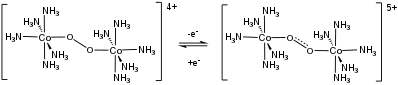
Салкомин , комплекс кобальта(II) сален-лиганда, является первым синтетическим О 2 . переносчиком [12] Сольватированные производные твердого комплекса связывают 0,5 эквивалента О 2 :
- 2 Co(сален) + O 2 → [Co(сален)] 2 O 2
Обратимые реакции переноса электрона наблюдаются в некоторых биядерных комплексах О 2 . [13]
Связь с другими кислородными лигандами и приложениями
[ редактировать ]Дикислородные комплексы являются предшественниками других семейств оксигенных лигандов. Оксосоединения металлов возникают в результате разрыва связи О–О после комплексообразования. Гидропероксокомплексы образуются при восстановлении дикислорода металлами. Восстановление O 2 металлическими катализаторами является ключевой полуреакцией в топливных элементах .
Катализируемые металлами окисления с О 2 протекают через посредство дикислородных комплексов, хотя реальными окислителями часто являются оксопроизводные. Обратимое связывание О 2 металлокомплексами использовалось как средство очистки кислорода из воздуха, однако криогенная перегонка жидкого воздуха доминирующей технологией остается .
Ссылки
[ редактировать ]- ^ Да, Гереон М.; Толман, Уильям Б. (2015). «Глава 5: Комплексы переходных металлов и активация дикислорода». В Кронеке, Питер М.Х.; Соса Торрес, Марта Э. (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие дикислород и другие жевательные газы . Ионы металлов в науках о жизни. Том. 15. Спрингер. стр. 131–204. дои : 10.1007/978-3-319-12415-5_5 . ПМИД 25707468 .
- ^ Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего, Калифорния: Academic Press. ISBN 0-12-352651-5 .
- ^ Липпард, С.Дж.; Берг, Дж. М. (1994). Основы бионеорганической химии . Милл-Вэлли, Калифорния: Университетские научные книги. ISBN 0-935702-73-3 .
- ^ Берри, RE (2004). «Реакционная способность и строение комплексов малых молекул: дикислород». Комплексная координационная химия II . Том. 1. С. 625–629. дои : 10.1016/B0-08-043748-6/01161-0 . ISBN 978-0-08-043748-4 .
- ^ Цумаки, Токуичи (1938). «Соединения вторичного валентного кольца. IV. О некоторых внутрикомплексных солях кобальта оксиальдиминов» [Соединения вторичного валентного кольца. IV. О некоторых внутрикомплексных кобальтовых солях оксиальдимина . Бюллетень Химического общества Японии . 13 (2): 252–260. дои : 10.1246/bcsj.13.252 .
- ^ С. Дж. Липпард, Дж. М. Берг «Принципы биоинорганической химии» Университетские научные книги: Милл-Вэлли, Калифорния; 1994. ISBN 0-935702-73-3 .
- ^ Сельке, М.; Фут, CS (1993). «Реакции металлоорганических комплексов с синглетным кислородом. Фотоокисление комплекса Васьки». Дж. Ам. хим. Соц . 115 (3): 1166–1167. дои : 10.1021/ja00056a061 .
- ^ Иган, Джеймс В.; Хаггерти, Брайан С.; Рейнгольд, Арнольд Л.; Сендлингер, Шон К.; Теопольд, Клаус Х. (1990). «Кристаллическая структура бокового супероксокомплекса отщепления кобальта и водорода реакционноспособным концевым оксолигандом». Журнал Американского химического общества . 112 (6): 2445–2446. дои : 10.1021/ja00162a069 .
- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .
- ^ Элвелл, Кортни Э.; Ганьон, Николь Л.; Нейсен, Бенджамин Д.; Дхар, Дебанджан; Шпет, Эндрю Д.; Да, Гереон М.; Толман, Уильям Б. (2017). «Возвращение к медно-кислородным комплексам: структура, спектроскопия и реакционная способность» . Химические обзоры . 117 (3): 2059–2107. doi : 10.1021/acs.chemrev.6b00636 . ПМЦ 5963733 . ПМИД 28103018 .
- ^ М. Каллигарис; Г. Нарден; Л. Рандаччо; А. Рипамонти (1970). «Структурные аспекты синтетического переносчика кислорода NN'-этиленбис(салицилидениминато)кобальт(II): структура соединения присоединения с кислородсодержащим диметилформамидом». Дж. Хим. Соц. А : 1069. дои : 10.1039/j19700001069 .
- ^ Токуичи Цумаки (1938). «Соединения с малым валентным кольцом. IV. О некоторых внутрикомплексных солях кобальта оксиальдиминов» . Бюллетень Химического общества Японии . 13 (2): 252–260. дои : 10.1246/bcsj.13.252 .
- ^ Шефер, Уильям Палцер (1968). «Структура тетрагидрата дисульфата декааммин-мк-пероксо-дикобальта». Неорганическая химия . 7 (4): 725–731. дои : 10.1021/ic50062a022 .