Эксцизионная репарация нуклеотидов
Эксцизионная репарация нуклеотидов представляет собой механизм репарации ДНК . [2] Повреждение ДНК происходит постоянно из-за химических веществ (например, интеркалирующих агентов ), радиации и других мутагенов . Для восстановления повреждений одноцепочечной ДНК существуют три пути эксцизионного восстановления: эксцизионная репарация нуклеотидов (NER), эксцизионная репарация оснований (BER) и репарация несоответствия ДНК (MMR). Хотя путь BER может распознавать специфические необъемные повреждения ДНК, он может корректировать только поврежденные основания, которые удаляются специфическими гликозилазами . Точно так же путь MMR нацелен только на несовпадающие пары оснований Уотсона-Крика .
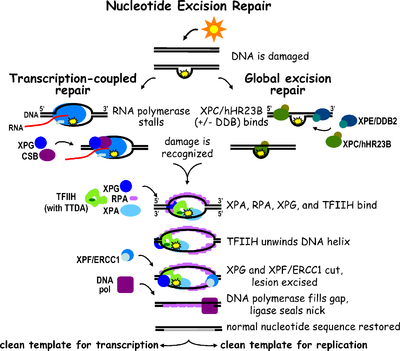
Эксцизионная репарация нуклеотидов (NER) является особенно важным механизмом эксцизии, который устраняет повреждения ДНК, вызванные ультрафиолетовым светом (УФ). Повреждение ДНК УФ-излучением приводит к образованию объемных аддуктов ДНК — эти аддукты в основном представляют собой димеры тимина и 6,4-фотопродукты. Распознавание повреждения приводит к удалению короткого одноцепочечного сегмента ДНК, содержащего повреждение. Неповрежденная одноцепочечная ДНК остается, и ДНК-полимераза использует ее в качестве матрицы для синтеза короткой комплементарной последовательности . Окончательное лигирование для завершения NER и образования двухцепочечной ДНК осуществляется ДНК-лигазой . NER можно разделить на два подпути: глобальный геномный NER (GG-NER или GGR) и связанный с транскрипцией NER (TC-NER или TCR). Эти два подпути различаются тем, как они распознают повреждение ДНК, но используют один и тот же процесс разрезания, восстановления и лигирования повреждения.
О важности NER свидетельствуют тяжелые заболевания человека, возникающие в результате врожденных генетических мутаций белков NER. Пигментная ксеродерма и синдром Кокейна являются двумя примерами заболеваний, связанных с НЭР.
У эукариотов
[ редактировать ]более сложна Эксцизионная репарация нуклеотидов у эукариот , чем у прокариот , которые экспрессируют такие ферменты, как фотолиаза . У людей и других плацентарных животных в НЭР участвуют 9 основных белков. Дефицит определенных белков приводит к заболеванию; Названия белков связаны с заболеванием. XPA , XPB , XPC , XPD, XPE , XPF и XPG происходят из пигментной херодермы , а CSA и CSB представляют собой белки, связанные с синдромом Кокейна. Кроме того, в эксцизионной репарации нуклеотидов участвуют белки ERCC1 , RPA , RAD23A , RAD23B и другие. Более полный список белков, участвующих в NER, можно найти ниже .
Эксцизионную репарацию эукариотических нуклеотидов можно разделить на два подпути: глобальный геномный NER (GG-NER) и транскрипционно-связанный NER (TC-NER). В распознавании повреждений ДНК для каждого подпути участвуют три разных набора белков. После распознавания повреждения три подпути сходятся на этапах двойного разреза, восстановления и лигирования.
Распознавание повреждений
[ редактировать ]Глобальный геномный NER (GG-NER)
[ редактировать ]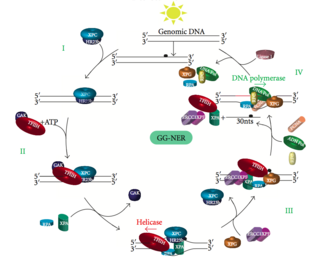
Глобальный геномный NER восстанавливает повреждения как в транскрибируемых, так и в нетранскрибируемых цепях ДНК в активных и неактивных генах по всему геному. Этот процесс не зависит от транскрипции. Этот путь использует несколько белков, «чувствительных к повреждению», включая комплексы связывания ДНК-повреждения (DDB) и комплексы XPC-Rad23B, которые постоянно сканируют геном и распознают искажения спирали: комплекс XPC -Rad23B отвечает за распознавание искажений, а DDB1 и DDB2 ( XPE ) также может распознавать некоторые виды повреждений, вызванных ультрафиолетовым излучением. Кроме того, XPA выполняет функцию распознавания ущерба, которая пока еще плохо определена. После идентификации поврежденного участка последующие репарационные белки затем рекрутируются к поврежденной ДНК, чтобы проверить наличие повреждения ДНК, вырезают поврежденную ДНК, окружающую повреждение, а затем заполняют восстановительный участок.
Заболевания, связанные с GG-NER
[ редактировать ]Мутации в механизме GG-NER ответственны за множественные генетические нарушения, в том числе:
- Пигментная ксеродерма (XP): тяжелая фоточувствительность, высокий уровень заболеваемости раком на участках тела, подверженных воздействию солнца (например, кожа).
Связанная с транскрипцией репарация (TC-NER)
[ редактировать ]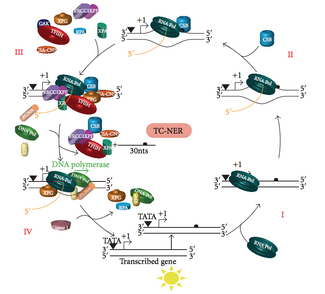
В любой момент времени большая часть генома организма не подвергается транскрипции; существует разница в эффективности NER между транскрипционно молчащими и транскрипционно активными областями генома. При многих типах повреждений NER восстанавливает транскрибируемые цепи транскрипционно активных генов быстрее, чем нетранскрибируемые цепи и транскрипционно молчащую ДНК.
TC-NER и GG-NER различаются только на начальных этапах распознавания повреждений ДНК. Принципиальное различие между TC-NER и GG-NER заключается в том, что TC-NER не требует белков XPC или DDB для распознавания искажений в клетках млекопитающих. Вместо этого TC-NER инициируется, когда РНК-полимераза останавливается при повреждении ДНК: заблокированная РНК-полимераза служит сигналом распознавания повреждения, который заменяет необходимость в свойствах распознавания искажений комплексов XPC-RAD23B и DDB. Белки CS (CSA и CSB) связывают некоторые типы повреждений ДНК вместо XPC-Rad23B.
Возможны и другие механизмы восстановления, но они менее точны и эффективны.
Заболевания, связанные с TC-NER
[ редактировать ]TC-NER инициируется, когда РНК-полимераза останавливается в месте повреждения ДНК, после чего белковые комплексы помогают переместить полимеразу назад. Мутации в механизме TC-NER ответственны за множественные генетические нарушения, в том числе:
- Трихотиодистрофия (ТТД): у некоторых людей светочувствительность, ихтиоз, умственная/физическая отсталость.
- Синдром Коккейна (КС): фотосенсибилизация, умственная отсталость, прогериеподобные признаки, микроцефалия.
Двойной разрез
[ редактировать ]Транскрипционный фактор II H (TFIIH) является ключевым ферментом, участвующим в двойном иссечении. TFIIH и XPG сначала рекрутируются в месте повреждения ДНК (XPG стабилизирует TFIIH). Субъединицы TFIIH XPD и XPB действуют как 5'-3' и 3'-5' хеликазы соответственно — они помогают раскручивать ДНК и создавать соединение между двухцепочечной и одноцепочечной ДНК вокруг транскрипционного пузыря . Помимо стабилизации TFIIH, XPG также обладает эндонуклеазной активностью; он разрезает повреждения ДНК на 3'- стороне, тогда как гетеродимерный белок XPF – ERCC1 разрезает на 5'-стороне. Двойной разрез приводит к удалению оцДНК с одноцепочечным разрывом в 25–30 нуклеотидов. Небольшие, вырезанные, содержащие повреждения ДНК-олигонуклеотиды (sedDNA) первоначально высвобождаются из дуплекса в комплексе с TFIIH, но затем диссоциируют АТФ-зависимым образом и связываются с репликационным белком А (RPA). Ингибирование синтеза ДНК и лигирования, заполняющих пробелы, приводит к накоплению RPA-связанных sedДНК в клетке.
Репликационный белок A (RPA) и XPA — два последних белка, связанных с основным комплексом репарации NER. Эти два белка присутствуют до связывания TFIIH, поскольку они участвуют в проверке повреждения ДНК. Они также могут защищать одноцепочечную ДНК. После проверки делается разрез на 5'-сторонней стороне, и восстановление ДНК начинается перед разрезом на 3'-сторонней стороне. Это помогает уменьшить обнажение одноцепочечной ДНК во время процесса восстановления.
Ремонт и лигирование
[ редактировать ]Фактор репликации C ( RFC ) загружает ядерный антиген пролиферирующих клеток (PCNA) на цепь ДНК. Это позволяет ДНК-полимеразам, участвующим в репарации (δ, ε и/или κ), копировать неповрежденную цепь посредством транслокации. ДНК-лигаза I и эндонуклеаза Flap 1 или комплекс Ligase-III-XRCC1 запечатывают разрывы, завершая NER.
У прокариот: белки Uvr.
[ редактировать ]
Процесс эксцизионной репарации нуклеотидов контролируется у Escherichia coli , эндонуклеазным ферментным комплексом UvrABC который состоит из четырех белков Uvr: UvrA, UvrB, UvrC и ДНК-хеликазы II (иногда называемой в этом комплексе также UvrD). Сначала комплекс UvrA-UvrB сканирует ДНК, при этом субъединица UvrA распознает искажения в спирали, вызванные, например, пиримидиновыми димерами . Когда комплекс распознает такое искажение, субъединица UvrA уходит, и появляется белок UvrC, который связывается с мономером UvrB и, следовательно, образует новый димер UvrBC . UvrB расщепляет фосфодиэфирную связь на 4 нуклеотида ниже повреждения ДНК, а UvrC расщепляет фосфодиэфирную связь на 8 нуклеотидов выше повреждения ДНК и создает вырезанный сегмент из 12 нуклеотидов. Затем появляется ДНК-хеликаза II (иногда называемая UvrD) и удаляет вырезанный сегмент, активно разрывая водородные связи между комплементарными основаниями. Образовавшийся пробел затем заполняется с помощью ДНК-полимеразы I и ДНК-лигазы. Основной процесс удаления очень похож в высших клетках, но эти клетки обычно включают гораздо больше белков – E.coli – простой пример. [5]
TC-NER также существует у бактерий и опосредуется белком TRCF (Mfd) . TRCF представляет собой SF2- АТФазу , которая использует гидролиз АТФ для перемещения по дцДНК выше транскрипционного пузыря и вперед-транслокации РНК-полимеразы, тем самым инициируя диссоциацию тройного элонгационного комплекса РНК-полимеразы. TRCF также задействует механизм эксцизионной репарации нуклеотидов Uvr(A)BC путем прямого физического взаимодействия с субъединицей UvrA.
Рак
[ редактировать ]
Хотя исторические исследования показали противоречивые результаты, генетические вариации или мутации в генах эксцизионной репарации нуклеотидов могут влиять на риск рака , влияя на эффективность восстановления. Однонуклеотидные полиморфизмы (SNP) и несинонимичные кодирующие SNP (nsSNP) присутствуют в человеческой популяции на очень низких уровнях (>1%). [7] Если такие мутации расположены в генах или регуляторных последовательностях NER, они могут отрицательно повлиять на способность репарации ДНК , что приведет к увеличению вероятности развития рака. Хотя функциональное влияние всех полиморфизмов не охарактеризовано, некоторые полиморфизмы в генах репарации ДНК или их регуляторных последовательностях действительно вызывают фенотипические изменения и участвуют в развитии рака. [8] Исследование случаев рака легких выявило умеренную связь между NER-специфическими полиморфизмами SNP и риском рака легких. [9] Результаты показывают, что некоторые наследственные полиморфные вариации генов NER могут приводить к предрасположенности к раку легких и, возможно, к другим раковым состояниям.
Дисфункция НЭР в результате полиморфизма ДНК
[ редактировать ]Двумя важными генами пути NER, для которых полиморфизм продемонстрировал функциональное и фенотипическое влияние, являются гены XPD и XPC . [10] XPD, также известный как ERCC2, помимо других транскрипционных активностей служит для открытия ДНК вокруг места повреждения во время NER. Исследования показали, что полиморфизмы экзона 10 (G>A)(Asp312Asn) и экзона 23 (A>T)(Lys751Gln) связаны с генетической предрасположенностью к нескольким типам рака. [11] [12] Ген XPC отвечает за белок, который распознает ДНК на ранней стадии пути NER. Этот ген может иметь полиморфизмы в интроне 9 и SNP в экзоне 15, которые также коррелируют с риском развития рака. Исследования показали, что двуаллельный полиморфизм вставки/делеции поли (АТ) в интроне 9 XPC связан с повышенным риском развития рака кожи, молочной железы и простаты. [12] [13] [14] особенно в популяциях Северной Индии.
Влияние на прогноз рака
[ редактировать ]Изучение наследственного рака, пигментной ксеродермы, помогло идентифицировать несколько генов, которые кодируют белки пути NER, два из которых — XPC и XPD. XP вызван гомозиготным дефицитом восстановления повреждений ДНК УФ-излучением (GG-NER), что увеличивает риск развития рака кожи у пациентов в 1000 раз. У гетерозиготных пациентов риск рака является спорадическим, но его можно предсказать на основе аналитической оценки полиморфизмов в генах репарации ДНК, связанных с XP, выделенных из лимфоцитов . [15] В исследовании частоты рецидивов колоректального рака II и III стадии высокого риска полиморфизм XPD (ERCC2) 2251A>C значительно коррелировал с ранним рецидивом после химиотерапевтического лечения. [16] Исследования показали, что эффекты полиморфных генов NER аддитивны: с большей частотой вариантов возникает больший риск рака. [15] [16] [17]
Старение
[ редактировать ]У людей и мышей зародышевые мутации в генах, участвующих в NER, вызывают признаки преждевременного старения. Эти гены и соответствующие им белки включают ERCC1 ( ERCC1 ), ERCC2 (XPD), ERCC3 ( XPB ), ERCC4 (XPF), ERCC5 (XPG), ERCC6 (CSB) и ERCC8 (CSA).
с дефицитом репарации ДНК Мутантные мыши ERCC1 демонстрируют признаки ускоренного старения и имеют ограниченную продолжительность жизни. [18] Ускоренное старение мутанта затрагивает многочисленные органы.
Мутации в гене ERCC2 (XPD) могут приводить к различным синдромам: пигментной ксеродермии (XP), трихотиодистрофии (TTD), комбинации XP и TTD (XPTTD) или комбинации XP и синдрома Коккейна (XPCS). [19] И TTD, и CS демонстрируют признаки преждевременного старения. Эти признаки могут включать нейросенсорную глухоту , дегенерацию сетчатки, гипометилирование белого вещества, кальцификацию центральной нервной системы, снижение роста и кахексию (утрату подкожной жировой ткани). [19] [20] Фибробласты XPCS и TTD мутанта ERCC2 (XPD) человека и мыши демонстрируют доказательства дефектного восстановления окислительных повреждений ДНК, которые могут лежать в основе симптомов сегментарного прогероида (преждевременного старения). [21] (см. теорию старения, связанную с повреждением ДНК ).
Мутации в гене ERCC3 (XPB) у людей могут привести к пигментной ксеродермии (XP) или XP в сочетании с синдромом Кокейна (XPCS). [22]
Дефицит ERCC4 (XPF) у людей приводит к различным состояниям, включая ускоренное старение. [23]
У людей мутационные дефекты в гене ERCC5 (XPG) могут вызывать либо склонное к раку состояние пигментной ксеродермы (XP) отдельно, либо в сочетании с тяжелым нарушением развития нервной системы, синдромом Кокейна (CS) или детской летальной церебро-глазно-фациальной болезнью. скелетный синдром. [24] Модель мыши с мутацией ERCC5 (XPG) демонстрирует признаки преждевременного старения, включая кахексию и остеопороз с выраженными дегенеративными фенотипами как в печени, так и в мозге. [24] У этих мутантных мышей развивается мультисистемный дегенеративный фенотип преждевременного старения, который, по-видимому, усиливает связь между повреждением ДНК и старением . [24] (см. теорию старения, связанную с повреждением ДНК ).
Синдром Кокейна (CS) возникает в результате зародышевой линии мутаций любого из двух генов ERCC8 (CSA) или ERCC6 (CSB). Мутации ERCC8 (CSA) обычно приводят к более умеренной форме CS, чем мутации ERCC6 (CSB). [25] Мутации гена CSA составляют около 20% случаев КС. [26] Лица с CSA и CSB характеризуются тяжелым постнатальным ростом и умственной отсталостью, а также ускоренным старением, приводящим к преждевременной смерти в возрасте от 12 до 16 лет. [27]
Снижение NER с возрастом
[ редактировать ]As reviewed by Gorbunova et al., [28] исследования НЭР в различных клетках и тканях у молодых и старых людей часто показывают снижение мощности НЭР с возрастом. Это снижение может быть связано со снижением конститутивных уровней белков, участвующих в пути NER. [29]
NER-ассоциированные гены
[ редактировать ]| Человеческий ген (белок) | Мышиный ортолог | Дрожжевой ортолог | Подземный путь | Функция в НЭР | GeneCards Вход в |
|---|---|---|---|---|---|
| CCNH ( Циклин H ) | Ккнх | CCL1 | Оба | Субъединица киназы-активатора CDK (CAK) | ККНХ |
| CDK7 ( циклинзависимая киназа (CDK) 7) ) | Cdk7 | КИН28 | Оба | субъединица CAK | CDK7 |
| CETN2 (Центрин-2) | Цетн2 | Неизвестный | ГГР | Распознавание повреждений; образует комплекс с XPC | ЦЕТН2 |
| ДДБ1 ( ДДБ1 ) | Ддб1 | Неизвестный | ГГР | Распознавание повреждений; образует комплекс с DDB2 | ДДБ1 |
| ДДБ2 ( ДДБ2 ) | Ддб2/Xpe | Неизвестный | ГГР | Распознавание повреждений; нанимает XPC | ДДБ2 |
| ERCC1 ( ERCC1 ) | Ercc1 | РАД10 | Оба | Поражен разрез на 3-й стороне повреждения; образует комплекс с XPF | ЭРСС1 |
| ERCC2 ( XPD ) | Ercc2 | РАД3 | Оба | АТФазная и геликазная активность; Субъединица транскрипционного фактора II H (TFIIH) | ERCC2 |
| ERCC3 ( XPB ) | Ercc3 | РАД25 | Оба | АТФазная и геликазная активность; Субъединица транскрипционного фактора II H (TFIIH) | ERCC3 |
| ERCC4 ( СПФ ) | Ercc4 | РАД1 | Оба | Поражен разрез на 3-й стороне повреждения; структурно-специфическая эндонуклеаза | ERCC4 |
| ERCC5 ( XPG ) | Ercc5 | РАД2 | Оба | Поражен разрез на 5-футовой стороне повреждения; стабилизирует TFIIH; структурно-специфическая эндонуклеаза | ERCC5 |
| ERCC6 ( ЦСБ ) | Ercc6 | РАД26 | ТЦ-НЕР | фактор элонгации транскрипции; участвует в транскрипционном сопряжении и ремоделировании хроматина | ERCC6 |
| ERCC8 ( CSA ) | Ercc8 | РАД28 | ТЦ-НЕР | убиквитинлигазный комплекс; взаимодействует с CSB и p44 TFIIH | ERCC8 |
| LIG1 ( ДНК-лигаза I ) | Больной1 | CDC9 | Оба | Окончательная перевязка | БОЛЕЗНЬ1 |
| МНАТ1 ( МНАТ1 ) | Мнат1 | ТФБ3 | Оба | Стабилизирует комплекс CAK | МНАТ1 |
| ММС19 ( ММС19 ) | ммс19 | МЕТ18 | Оба | Взаимодействует с субъединицами XPD и XPB хеликаз TFIIH. | ММС19 |
| РАД23А ( РАД23А ) | Рад23а | РАД23 | ГГР | Распознавание повреждений; образует комплекс с XPC | РАД23А |
| РАД23Б ( РАД23Б ) | Рад23б | РАД23 | ГГР | Распознавание повреждений, комплексные формы с XPC | РАД23Б |
| РПА1 ( РПА1 ) | РПА1 | RFA1 | Оба | Подразделение комплекса RFA | РПА1 |
| РПА2 ( РПА2 ) | РПА2 | РФА2 | Оба | Подразделение комплекса RFA | РПА2 |
| TFIIH ( фактор транскрипции II H ) | Gtf2h1 - 3 | Tfb1 SSL1 Tfb4 | Оба | Поражается разрезом, образует комплекс вокруг поражения. | GTF2H1 GTF2H2 GTF2H3 |
| ХАБ2 ( ХАБ2 ) | Хаб2 | СИФ1 | ТЦ-НЕР | Распознавание повреждений; взаимодействует с XPA, CSA и CSB | ХАБ2 |
| XPA ( XPA ) | Xpa | РАД14 | Оба | Распознавание повреждений | XPA |
| ХПК ( ХПК ) | Xpc | RAD4 | ГГР | Распознавание повреждений | XPC |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Фасс Д.О., Купер П.К. (июнь 2006 г.). «Восстановление ДНК: динамические защитники от рака и старения» . ПЛОС Биология . 4 (6): е203. doi : 10.1371/journal.pbio.0040203 . ПМЦ 1475692 . ПМИД 16752948 .

- ^ Кэрролл С.Б.; Весслер С.Р.; Гриффитс AJFL; Левонтин Р.К. (2008). Введение в генетический анализ . Нью-Йорк: WH Freeman and Co., с. 534. ИСБН 978-0-7167-6887-6 .
- ^ Перейти обратно: а б Ле Мэй Н., Эгли Дж.М., Монета F (2010). «Правдивая ложь: двойная жизнь факторов эксцизионной репарации нуклеотидов при транскрипции и репарации ДНК» . Журнал нуклеиновых кислот . 2010 : 1–10. дои : 10.4061/2010/616342 . ПМЦ 2915888 . ПМИД 20725631 .
- ^ Морита Р., Накане С., Шимада А. и др. (2010). «Молекулярные механизмы всей системы репарации ДНК: сравнение бактериальных и эукариотических систем» . Журнал нуклеиновых кислот . 2010 : 1–32. дои : 10.4061/2010/179594 . ПМЦ 2957137 . ПМИД 20981145 .
- ^ Трульо Дж.Дж., Крото Д.Л., Ван Хаутен Б., Кискер С. (февраль 2006 г.). «Эксцизионная репарация прокариотических нуклеотидов: система UvrABC». Химические обзоры . 106 (2): 233–252. дои : 10.1021/cr040471u . ПМИД 16464004 .
- ^ Чжан Ю, Роде Л.Х., Ву Х (июнь 2009 г.). «Участие механизмов вырезания нуклеотидов и восстановления несоответствий в восстановлении двухцепочечных разрывов» . Современная геномика . 10 (4): 250–258. дои : 10.2174/138920209788488544 . ПМК 2709936 . ПМИД 19949546 .
- ^ Квок ПЯ, Гу З (декабрь 1999 г.). «Библиотеки однонуклеотидного полиморфизма: зачем и как мы их создаем?». Молекулярная медицина сегодня . 5 (12): 538–543. дои : 10.1016/S1357-4310(99)01601-9 . ПМИД 10562720 .
- ^ Карахалил Б., Бор В., Уилсон Д. (октябрь 2012 г.). «Влияние полиморфизмов ДНК в ключевых белках эксцизионной репарации оснований ДНК на риск рака» . Человеческая и экспериментальная токсикология . 31 (10): 981–1005. Бибкод : 2012HETox..31..981K . дои : 10.1177/0960327112444476 . ПМЦ 4586256 . ПМИД 23023028 .
- ^ Сакода Л.К., Лумис М.М., Доэрти Дж.А., Джулианто Л., Барнетт М.Дж., Нойхаузер М.Л., Торнквист М.Д., Вайс Н.С., Гудман Г.Е., Чен С. (2012). «Вариации зародышевой линии в генах эксцизионной репарации нуклеотидов и риск рака легких у курильщиков» . Международный журнал молекулярной эпидемиологии и генетики . 3 (1): 1–17. ПМК 3316453 . ПМИД 22493747 .
- ^ Хоу С.М., Фельт С., Анджелини С., Ян К., Нюберг Ф., Ламберт Б., Хемминки К. (апрель 2002 г.). «Аллели варианта XPD связаны с повышенным уровнем аддукта ароматической ДНК и риском рака легких» . Канцерогенез . 23 (4): 599–603. дои : 10.1093/carcin/23.4.599 . ПМИД 11960912 .
- ^ Ван М., Гу Д., Чжан З., Чжоу Дж., Чжан З. (2009). «Полиморфизмы XPD, курение сигарет и риск рака мочевого пузыря: метаанализ». Журнал токсикологии и гигиены окружающей среды, часть A. 72 (11–12): 698–705. Бибкод : 2009JTEHA..72..698W . дои : 10.1080/15287390902841029 . ПМИД 19492231 . S2CID 22991719 .
- ^ Перейти обратно: а б Миттал Р.Д., Мандал РК (январь 2012 г.). «Генетические вариации в генах пути эксцизионной репарации нуклеотидов влияют на восприимчивость к раку простаты и мочевого пузыря у населения Северной Индии» . Индийский журнал генетики человека . 18 (1): 47–55. дои : 10.4103/0971-6866.96648 . ПМЦ 3385179 . ПМИД 22754221 .
- ^ Бланкенбург С., Кениг И.Р., Месснер Р., Ласпе П., Томс К.М., Крюгер У., Хан С.Г., Вестфаль Г., Беркинг К., Волкенандт М., Райх К., Нейман К., Циглер А., Кремер К.Х., Эммерт С. (июнь 2005 г.). «Оценка 3 полиморфизмов гена пигментной ксеродермы группы C и риска меланомы кожи: исследование случай-контроль» . Канцерогенез . 26 (6): 1085–1090. дои : 10.1093/carcin/bgi055 . ПМИД 15731165 .
- ^ Шор Р.Э., Зеленюх-Жакотт А., Карри Д., Моренвейзер Х., Афанасьева Ю., Кениг К.Л., Арслан А.А., Тониоло П., Виргин I (май 2008 г.). «Полиморфизмы генов XPC и ERCC2, курение и риск рака молочной железы» . Международный журнал рака . 122 (9): 2101–2105. дои : 10.1002/ijc.23361 . ПМИД 18196582 . S2CID 9456435 .
- ^ Перейти обратно: а б Цяо Ю., Шпиц М.Р., Го З., Хадеяти М., Гроссман Л., Кремер К.Х., Вэй К. (ноябрь 2002 г.). «Быстрая оценка восстановления поврежденной ультрафиолетом ДНК с помощью модифицированного анализа реактивации клеток-хозяев с использованием репортерного гена люциферазы и корреляции с полиморфизмом генов репарации ДНК в нормальных лимфоцитах человека». Мутационные исследования . 509 (1–2): 165–174. дои : 10.1016/S0027-5107(02)00219-1 . ПМИД 12427537 .
- ^ Перейти обратно: а б Хуан М.Ю., Фан В.И., Ли С.К., Ченг Т.Л., Ван Дж.Ю., Линь С.Р. (2008). «Генетический полиморфизм ERCC2 2251A>C тесно коррелировал с ранним рецидивом у пациентов с колоректальным раком II и III стадии высокого риска: предварительное исследование» . БМК Рак . 8:50 . дои : 10.1186/1471-2407-8-50 . ПМК 2262891 . ПМИД 18267032 .

- ^ Шпитц М.Р., Ву Х, Ван Й, Ван Ле, Шете С., Амос С.И., Го З, Лэй Л., Моренвейзер Х., Вэй Кью (февраль 2001 г.). «Модуляция способности эксцизионного восстановления нуклеотидов полиморфизмами XPD у пациентов с раком легких». Исследования рака . 61 (4): 1354–1357. ПМИД 11245433 .
- ^ Вермей В.П., Долле М.Э., Рейлинг Э., Яарсма Д., Паян-Гомез С., Бомбардьери Ч.Р., Ву Х., Рокс А.Дж., Боттер С.М., ван дер Эрден БК, Юссеф С.А., Койпер Р.В., Нагараджа Б, ван Остром Ч.Т., Брандт Р.М., Барнхорн С., Имхольц С., Пеннингс Дж.Л., де Брюин А., Гиенис А., Потхоф Дж., Вейг Дж., ван Стег Х., Хоймейкерс Дж.Х. (2016). «Ограниченная диета замедляет ускоренное старение и геномный стресс у мышей с дефицитом репарации ДНК» . Природа . 537 (7620): 427–431. Стартовый код : 2016Natur.537..427V . дои : 10.1038/nature19329 . ПМК 5161687 . ПМИД 27556946 .
- ^ Перейти обратно: а б Андрессу Дж. О., Хоймейкерс Дж. Х., Митчелл Дж. Р. (2006). «Нарушения эксцизионной репарации нуклеотидов и баланс между раком и старением» . Клеточный цикл . 5 (24): 2886–8. дои : 10.4161/cc.5.24.3565 . ПМИД 17172862 .
- ^ Фусс Дж.О., Тайнер Дж.А. (2011). «Хеликазы XPB и XPD в TFIIH организуют открытие дуплекса ДНК и проверку повреждений, чтобы координировать восстановление с транскрипцией и клеточным циклом через киназу CAK» . Восстановление ДНК (Амст.) . 10 (7): 697–713. дои : 10.1016/j.dnarep.2011.04.028 . ПМК 3234290 . ПМИД 21571596 .
- ^ Андрессоо Дж.О., Митчелл Дж.Р., де Вит Дж., Хугстратен Д., Волкер М., Туссен В., Спекснейдер Е., Бимс Р.Б., ван Стиг Х., Янс Дж., де Зеув К.И., Ясперс Н.Г., Раамс А., Леманн А.Р., Вермюлен В., Хоймейкерс Дж.Х. , ван дер Хорст GT (2006). «Мышиная модель Xpd для комбинированной пигментной ксеродермии/синдрома Коккейна, демонстрирующая как предрасположенность к раку, так и сегментарную прогерию» . Раковая клетка . 10 (2): 121–32. дои : 10.1016/j.ccr.2006.05.027 . hdl : 10029/5565 . ПМИД 16904611 .
- ^ О К.С., Хан С.Г., Ясперс Н.Г., Раамс А., Уэда Т., Леманн А., Фридманн П.С., Эммерт С., Грачев А., Лахлан К., Лукассан А., Бейкер CC, Кремер К.Х. (2006). «Фенотипическая гетерогенность гена ДНК-хеликазы XPB (ERCC3): пигментная ксеродермия без синдрома Коккейна и с ним» . Хм. Мутат . 27 (11): 1092–103. дои : 10.1002/humu.20392 . ПМИД 16947863 . S2CID 22852219 .
- ^ Грегг С.К., Робинсон А.Р., Нидернхофер Л.Дж. (2011). «Физиологические последствия дефектов эндонуклеазы репарации ДНК ERCC1-XPF» . Восстановление ДНК (Амст.) . 10 (7): 781–91. дои : 10.1016/j.dnarep.2011.04.026 . ПМК 3139823 . ПМИД 21612988 .
- ^ Перейти обратно: а б с Барнхорн С., Уиттенбугор Л.М., Яарсма Д., Вермей В.П., Трезини М., Веймер М., Менони Х., Брандт Р.М., де Ваард М.К., Боттер С.М., Саркер А.Х., Ясперс Н.Г., ван дер Хорст ГТ, Купер ПК, Хоймейкерс Дж.Х., ван дер Плюйм I (2014). «Клеточно-автономные изменения прогероида в условных моделях мышей при дефиците репарации эндонуклеазы XPG» . ПЛОС Генет . 10 (10): e1004686. дои : 10.1371/journal.pgen.1004686 . ПМК 4191938 . ПМИД 25299392 .
- ^ Ияма Т., Уилсон Д.М. (2016). «Элементы, которые регулируют реакцию белков, дефектных при синдроме Кокейна, на повреждение ДНК» . Дж. Мол. Биол . 428 (1): 62–78. дои : 10.1016/j.jmb.2015.11.020 . ПМЦ 4738086 . ПМИД 26616585 .
- ^ Кох С., Гарсия Гонсалес О., Ассфальг Р., Шеллинг А., Шефер П., Шарффеттер-Кочанек К., Ибен С. (2014). «Белок А синдрома Коккейна является фактором транскрипции РНК-полимеразы I и стимулирует биогенез и рост рибосом» . Клеточный цикл . 13 (13): 2029–37. дои : 10.4161/cc.29018 . ПМЦ 4111694 . ПМИД 24781187 .
- ^ Эдифици Д, Шумахер Б (2015). «Нестабильность генома в развитии и старении: результаты эксцизионной репарации нуклеотидов у людей, мышей и червей» . Биомолекулы . 5 (3): 1855–69. дои : 10.3390/biom5031855 . ПМЦ 4598778 . ПМИД 26287260 .
- ^ Горбунова В, Селуанов А, Мао З, Хайн С (2007). «Изменения в репарации ДНК при старении» . Нуклеиновые кислоты Рез . 35 (22): 7466–74. дои : 10.1093/нар/gkm756 . ПМК 2190694 . ПМИД 17913742 .
- ^ Гукасян Д., Гад Ф., Яар М., Эллер М.С., Нехал США, Гилкрест Б.А. (2000). «Механизмы и последствия возрастного снижения способности к репарации ДНК» . ФАСЕБ Дж . 14 (10): 1325–34. дои : 10.1096/fj.14.10.1325 . ПМИД 10877825 .
Дальнейшее чтение
[ редактировать ]- Элленбергер Т., Фридберг Э.К., Уокер Г.С., Вольфрам С., Вуд Р.Дж., Шульц Р. (2006). Репарация ДНК и мутагенез . Вашингтон, округ Колумбия: ASM Press. ISBN 978-1-55581-319-2 .
- Сато М.С., Ханавальт ПК (сентябрь 1996 г.). «TFIIH-опосредованная репарация нуклеотидов и инициация транскрипции мРНК в оптимизированном бесклеточном анализе репарации ДНК и транскрипции РНК» . Исследования нуклеиновых кислот . 24 (18): 3576–3582. дои : 10.1093/нар/24.18.3576 . ПМК 146147 . ПМИД 8836185 . Статья об отношениях между TFIIH и NER
- Фрит П., Квон К., Коин Ф., Ориоль Дж., Дубаэле С., Саллес Б., Эгли Дж.М. (декабрь 2002 г.). «Активаторы транскрипции стимулируют восстановление ДНК» . Мол. Клетка . 10 (6): 1391–1401. дои : 10.1016/S1097-2765(02)00732-3 . ПМИД 12504014 .
- Меллон I (сентябрь 2005 г.). «Репарация, связанная с транскрипцией: сложное дело». Мутат. Рез . 577 (1–2): 155–161. дои : 10.1016/j.mrfmmm.2005.03.016 . ПМИД 15913669 .
Внешние ссылки
[ редактировать ] СМИ, связанные с эксцизионным восстановлением нуклеотидов, на Викискладе?
СМИ, связанные с эксцизионным восстановлением нуклеотидов, на Викискладе?