Гемопоэтические стволовые клетки
Эта статья может быть слишком технической для понимания большинства читателей . ( Август 2015 г. ) |
| Гемопоэтические стволовые клетки | |
|---|---|
 Обзор нормального кроветворения человека | |
| Подробности | |
| Предшественник | Гемангиобласт |
| Система | Система кроветворения |
| Расположение | Костный мозг |
| Функция | Стволовые клетки, дающие начало другим клеткам крови |
| Идентификаторы | |
| латинский | гемопоэтическая клетка-предшественник |
| Акроним(ы) | ВСК |
| МеШ | D006412 |
| ТД | Х2.00.01.0.00006 |
| Анатомические термины микроанатомии | |
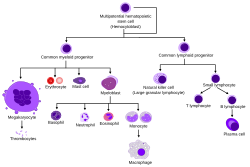
Гематопоэтические стволовые клетки ( ЗСК ) – это стволовые клетки. [1] которые дают начало другим клеткам крови . Этот процесс называется кроветворением . [2] У позвоночных первые дефинитивные ЗКП возникают из вентральной эндотелиальной стенки эмбриональной аорты в (средней стадии беременности) области аорта-гонад-мезонефрос посредством процесса, известного как эндотелиально-кроветворный переход. [3] [4] У взрослых кроветворение происходит в красном костном мозге , в ядре большинства костей. Красный костный мозг происходит из слоя эмбриона , называемого мезодермой .
Гематопоэз – это процесс, в ходе которого образуются все зрелые клетки крови. Он должен сбалансировать огромные производственные потребности (средний человек производит более 500 миллиардов клеток крови каждый день) с необходимостью регулировать количество каждого типа клеток крови в кровообращении. У позвоночных подавляющее большинство гемопоэза происходит в костном мозге и происходит из ограниченного числа гемопоэтических стволовых клеток, которые являются мультипотентными и способны к обширному самообновлению .
Гемопоэтические стволовые клетки дают начало различным типам клеток крови, в линиях, называемых миелоидными и лимфоидными . Миелоидные и лимфоидные линии участвуют в образовании дендритных клеток . Миелоидные клетки включают моноциты , макрофаги , нейтрофилы , базофилы , эозинофилы , эритроциты и мегакариоциты и тромбоциты . Лимфоидные клетки включают Т-клетки , В-клетки , естественные клетки-киллеры и врожденные лимфоидные клетки .
Определение гемопоэтических стволовых клеток развивалось с момента их первого открытия в 1961 году. [5] Гематопоэтическая ткань содержит клетки с долговременной и кратковременной способностью к регенерации, а также детерминированные мультипотентные , олигопотентные и унипотентные предшественники. Гематопоэтические стволовые клетки составляют 1:10 000 клеток миелоидной ткани .
Трансплантаты HSC используются при лечении рака и других нарушений иммунной системы. [6] благодаря их регенеративным свойствам. [7]
Структура
[ редактировать ]Они округлые, неадгезивные, с округлым ядром и низким соотношением цитоплазмы к ядру. По форме гемопоэтические стволовые клетки напоминают лимфоциты .
Расположение
[ редактировать ]Самые первые гемопоэтические стволовые клетки во время эмбрионального развития (мыши и человека) обнаруживаются в области аорты, гонад, мезонефроса , а также в желточных и пупочных артериях. [8] [9] [10] Несколько позже ЗКП обнаруживаются также в плаценте, желточном мешке, головке эмбриона и печени плода. [3] [11]
Стволовые клетки и клетки-предшественники можно взять из таза, в гребне подвздошной кости, с помощью иглы и шприца. [12] Клетки можно удалить в жидком виде (чтобы взять мазок для изучения морфологии клеток) или с помощью пункционной биопсии (чтобы сохранить архитектуру или взаимоотношения клеток друг с другом и с костью). [ нужна ссылка ]
Подтипы
[ редактировать ]Колониеобразующая единица является подтипом ГСК. (Этот смысл термина отличается от колониеобразующих единиц микробов, которые представляют собой единицу подсчета клеток .) Существуют различные виды колониеобразующих единиц ГСК:
- Колониеобразующая единица – гранулоцит - эритроцит - моноцит - мегакариоцит ( КОЕ-ГЕММ )
- Колониеобразующая единица – лимфоцит ( КОЕ-Л )
- Колониеобразующая единица – эритроцит ( КОЕ-Э )
- Колониеобразующая единица гранулоцит – - макрофаг ( КОЕ-ГМ )
- Колониеобразующая единица – мегакариоцит ( КОЕ-Мег )
- Колониеобразующая единица – базофил (КОЕ-Б)
- Колониеобразующая единица – эозинофил ( КОЕ-Эос )
Вышеуказанные КОЕ основаны на происхождении. Другая КОЕ – колониеобразующая единица – селезенка (КОЕ-С) – послужила основой формирования клональных колоний in vivo , которое зависит от способности инфузированных клеток костного мозга давать начало клонам созревающих гемопоэтических клеток в селезенке. облученных мышей через 8-12 дней. Он широко использовался в ранних исследованиях, но теперь считается, что он позволяет измерять более зрелые клетки-предшественники или транзитно-амплифицированные клетки, а не стволовые клетки. [ нужна ссылка ] .
Выделение стволовых клеток
[ редактировать ]Поскольку гемопоэтические стволовые клетки невозможно выделить в виде чистой популяции, их невозможно идентифицировать под микроскопом. [ нужна ссылка ] Гемопоэтические стволовые клетки можно идентифицировать или выделить с помощью проточной цитометрии , при которой комбинация нескольких различных маркеров клеточной поверхности (особенно CD34 ) используется для отделения редких гемопоэтических стволовых клеток от окружающих клеток крови. Гематопоэтические стволовые клетки лишены экспрессии маркеров зрелых клеток крови и поэтому называются Lin-. Отсутствие экспрессии маркеров клонирования используется в сочетании с обнаружением нескольких положительных маркеров клеточной поверхности для выделения гемопоэтических стволовых клеток. Кроме того, гемопоэтические стволовые клетки характеризуются небольшими размерами и слабой окраской жизненно важными красителями, такими как родамин 123 (родамин это ) или Hoechst 33342 (побочная популяция).
Функция
[ редактировать ]
Кроветворение
[ редактировать ]Гемопоэтические стволовые клетки необходимы для кроветворения, образования клеток в крови. Гемопоэтические стволовые клетки могут пополнять все типы клеток крови (т. е. являются мультипотентными ) и самообновляться. Небольшое количество гемопоэтических стволовых клеток может размножаться, образуя очень большое количество дочерних гемопоэтических стволовых клеток. Это явление используется при трансплантации костного мозга . [13] когда небольшое количество гемопоэтических стволовых клеток восстанавливает кроветворную систему. Этот процесс указывает на то, что после трансплантации костного мозга должно произойти симметричное деление клеток на две дочерние гемопоэтические стволовые клетки.
Считается, что самообновление стволовых клеток происходит в нише стволовых клеток в костном мозге, и разумно предположить, что ключевые сигналы, присутствующие в этой нише, будут важны для самообновления. [2] Существует большой интерес к экологическим и молекулярным требованиям для самообновления HSC, поскольку понимание способности HSC к самовосполнению в конечном итоге позволит создавать расширенные популяции HSC in vitro , которые можно будет использовать в терапевтических целях.
Покой
[ редактировать ]Гемопоэтические стволовые клетки, как и все взрослые стволовые клетки , в основном существуют в состоянии покоя или обратимой остановки роста. Измененный метаболизм покоящихся ЗКП помогает клеткам выживать в течение длительных периодов времени в гипоксической среде костного мозга. [14] Когда кроветворные стволовые клетки провоцируются гибелью или повреждением клеток, они выходят из состояния покоя и снова начинают активно делиться. Переход от покоя к размножению и обратно регулируется путем MEK/ERK и путем PI3K/AKT/mTOR . [15] Нарушение регуляции этих переходов может привести к истощению стволовых клеток или постепенной потере активных гемопоэтических стволовых клеток в системе крови. [15]
Мобильность
[ редактировать ]Гемопоэтические стволовые клетки имеют более высокий потенциал, чем другие незрелые клетки крови, для прохождения костномозгового барьера и, таким образом, могут перемещаться в крови из костного мозга из одной кости в другую. Если они оседают в тимусе , они могут развиться в Т-клетки . У плодов и других органов экстрамедуллярного кроветворения . Гемопоэтические стволовые клетки также могут оседать в печени или селезенке и развиваться.
Это позволяет получать гемопоэтические стволовые клетки непосредственно из крови.
Клиническое значение
[ редактировать ]Трансплантация
[ редактировать ]Трансплантация гемопоэтических стволовых клеток (ТГСК) — это трансплантация мультипотентных гемопоэтических стволовых клеток , обычно полученных из костного мозга, периферической крови или пуповинной крови. [16] [17] [13] Они могут быть аутологичными (используются собственные стволовые клетки пациента), аллогенными (стволовые клетки получают от донора) или сингенными (от однояйцевого близнеца). [16] [17]
Чаще всего ее проводят пациентам с некоторыми видами рака крови , или костного мозга такими как множественная миелома или лейкемия . [17] В этих случаях иммунная система реципиента обычно разрушается лучевой или химиотерапией перед трансплантацией. Инфекция и реакция «трансплантат против хозяина» являются основными осложнениями аллогенной ТГСК. [17]
Чтобы собрать стволовые клетки из циркулирующей периферической крови, донорам крови вводят цитокин , такой как гранулоцитарно-колониестимулирующий фактор (G-CSF), который заставляет клетки покидать костный мозг и циркулировать в кровеносных сосудах. [18] В эмбриологии млекопитающих первые окончательные гемопоэтические стволовые клетки обнаруживаются в AGM ( аорта-гонады-мезонефрос ), а затем массово размножаются в печени плода до колонизации костного мозга еще до рождения. [11]
Трансплантация гемопоэтических стволовых клеток остается опасной процедурой со многими возможными осложнениями; он предназначен для пациентов с опасными для жизни заболеваниями. Поскольку выживаемость после процедуры увеличилась, ее использование распространилось не только на рак, но и на аутоиммунные заболевания. [19] [20] и наследственные скелетные дисплазии ; особенно злокачественный детский остеопетроз [21] [22] и мукополисахаридоз . [23]
Стволовые клетки можно использовать для регенерации различных типов тканей. HCT является признанным методом лечения хронического миелолейкоза, острого лимфатического лейкоза, апластической анемии и гемоглобинопатий, а также острого миелолейкоза и первичного иммунодефицита. Регенерация системы кроветворения обычно достигается в течение 2–4 недель после химио- или лучевой терапии и HCT. ЗКП проходят клинические испытания на предмет их использования в регенерации негематопоэтических тканей. [24]
Старение гемопоэтических стволовых клеток
[ редактировать ]повреждение ДНК
[ редактировать ]Разрывы нитей ДНК накапливаются в долгосрочных гемопоэтических стволовых клетках во время старения. [25] Это накопление связано с широким ослаблением путей репарации ДНК и ответа, которое зависит от покоя HSC. [25] Ономологичное соединение концов (NHEJ) — это путь восстановления двухцепочечных разрывов ДНК. NHEJ называют «негомологичным», поскольку концы разрыва лигируются напрямую без необходимости использования гомологичного шаблона. Путь NHEJ зависит от нескольких белков, включая лигазу 4 , ДНК-полимеразу mu и фактор 1 NHEJ (NHEJ1, также известный как Cernunnos или XLF).
ДНК-лигаза 4 (Lig4) играет весьма специфическую роль в восстановлении двухцепочечных разрывов с помощью NHEJ. Дефицит Lig4 у мышей вызывает прогрессирующую потерю гемопоэтических стволовых клеток с возрастом. [26] Дефицит lig4 в плюрипотентных стволовых клетках приводит к накоплению двухцепочечных разрывов ДНК и усилению апоптоза. [27]
У мышей, мутантных по полимеразе, развитие гемопоэтических клеток является дефектным в нескольких популяциях периферических клеток и клеток костного мозга, при этом количество клеток костного мозга снижается примерно на 40%, включая несколько гемопоэтических линий. [28] Потенциал роста гемопоэтических клеток-предшественников также снижается. Эти характеристики коррелируют со сниженной способностью восстанавливать двухцепочечные разрывы кроветворной ткани.
Дефицит фактора 1 NHEJ у мышей приводит к преждевременному старению гемопоэтических стволовых клеток, о чем свидетельствуют несколько доказательств, включая доказательства того, что долгосрочная репопуляция является дефектной и ухудшается с течением времени. [29] Используя модель дефицита NHEJ1, индуцированного плюрипотентными стволовыми клетками человека, было показано, что NHEJ1 играет важную роль в обеспечении выживания примитивных гемопоэтических предшественников. [30] Эти клетки с дефицитом NHEJ1 обладают слабой способностью к восстановлению, опосредованной NHEJ1, которая, по-видимому, неспособна справиться с повреждениями ДНК, вызванными физиологическим стрессом, нормальным метаболизмом и ионизирующей радиацией. [30]
Чувствительность гемопоэтических стволовых клеток к дефициту Lig4, ДНК-полимеразы mu и NHEJ1 позволяет предположить, что NHEJ является ключевым фактором, определяющим способность стволовых клеток противостоять физиологическому стрессу с течением времени. [26] Росси и др. [31] обнаружили, что эндогенные повреждения ДНК накапливаются с возрастом даже в гемопоэтических стволовых клетках дикого типа, и предположили, что накопление повреждений ДНК может быть важным физиологическим механизмом старения стволовых клеток.
Потеря клонального разнообразия
[ редактировать ]Исследование показывает, что клональное разнообразие гемопоэтических стволовых клеток резко сокращается примерно в возрасте 70 лет. немногим быстрорастущим группам населения , обосновывая новую теорию старения , которая может обеспечить здоровое старение . [32] [33] Следует отметить, что об изменении клонального разнообразия во время старения ранее сообщалось в 2008 году. [34] для мышиной системы в лаборатории Кристы Мюллер-Зибург в Сан-Диего, Калифорния.
Исследовать
[ редактировать ]Поведение в культуре
[ редактировать ]Анализ образующих область булыжника (CAFC), клеток , представляет собой эмпирический анализ, основанный на культуре клеток. При посеве на сливную культуру питающего слоя стромы [35] часть гемопоэтических стволовых клеток ползет между промежутками (даже несмотря на то, что стромальные клетки соприкасаются друг с другом) и в конечном итоге оседает между стромальными клетками и субстратом (в данном случае поверхностью чашки) или попадает в клеточные отростки между стромальными клетками. Эмпериполез – это явление in vivo , при котором одна клетка полностью поглощается другой (например, тимоциты превращаются в кормящие клетки тимуса ); с другой стороны, когда in vitro клетки лимфоидного происхождения проникают под клетки, подобные медсестрам , этот процесс называется псевдоэмпериполезом . Это подобное явление более широко известно в области HSC под терминологией клеточной культуры « клетки, образующие область булыжника» (CAFC) , что означает, что области или кластеры клеток выглядят тусклыми, как булыжник , под фазово-контрастной микроскопией по сравнению с другими гемопоэтическими стволовыми клетками. , которые являются преломляющими. Это происходит потому, что клетки, свободно плавающие поверх стромальных клеток, имеют сферическую форму и, следовательно, преломляются. Однако клетки, которые ползут под стромальные клетки, уплощены и, следовательно, не преломляются. Механизм псевдоэмпериполеза стал известен лишь недавно. Это может быть опосредовано взаимодействием через CXCR4 (CD184) — рецептор хемокинов CXC (например, SDF1 ) и α4β1 интегринов . [36]
Кинетика репопуляции
[ редактировать ]Гемопоэтические стволовые клетки (ГСК) нелегко наблюдать напрямую, и, следовательно, об их поведении необходимо судить косвенно. Клональные исследования, вероятно, являются наиболее близким методом исследования HSC на отдельных клетках in vivo. Здесь с помощью сложных экспериментальных и статистических методов установлено, что с высокой вероятностью в трансплантате, введенном летально облученному хозяину, содержится одиночный ЗКП. Клональную экспансию этих стволовых клеток затем можно наблюдать с течением времени, отслеживая процент клеток донорского типа в крови по мере восстановления хозяина. Полученный временной ряд определяется как кинетика репопуляции HSC.
Кинетика восстановления очень неоднородна. Однако, используя символическую динамику , можно показать, что они попадают в ограниченное число классов. [37] Чтобы доказать это, было проведено несколько сотен экспериментальных кинетик репопуляции клонального Thy-1. это СКА-1 + Лин − (Б220, CD4, CD8, Гр-1, Мак-1 и Тер-119) [38] c-комплект + HSC были переведены в символические последовательности путем присвоения символов «+», «-», «~» всякий раз, когда два последовательных измерения процента клеток донорского типа имели положительный, отрицательный или неизмененный наклон соответственно. Используя расстояние Хэмминга , модели репопуляции были подвергнуты кластерному анализу, в результате чего были выделены 16 различных групп кинетики. Чтобы завершить эмпирическое доказательство, был использован подход Лапласа с добавлением единицы , чтобы определить, что вероятность обнаружения кинетики, не содержащейся в этих 16 группах, очень мала. Как следствие, этот результат показывает, что компартмент гемопоэтических стволовых клеток также гетерогенен по динамическим критериям.
Первоначально считалось, что все гемопоэтические стволовые клетки одинаковы по своим способностям к самообновлению и дифференцировке. Эта точка зрения была впервые оспорена открытием в 2002 году группы Мюллера-Зибурга в Сан-Диего, которое проиллюстрировало, что разные стволовые клетки могут демонстрировать различные модели репопуляции, которые являются эпигенетически предопределенными внутренними свойствами клонального Thy-1. это Ска-1 + Лин − c-комплект + ХСК. [39] [40] [41] Результаты этих клональных исследований привели к понятию предвзятости в происхождении . Используя соотношение От лимфоидных (L) до миелоидных (М) клеток в крови в качестве количественного маркера компартмент стволовых клеток можно разделить на три категории ЗКП. Сбалансированные (Bala) гемопоэтические стволовые клетки заселяют периферические лейкоциты в том же соотношении миелоидных и лимфоидных клеток, что и у неманипулированных мышей (в среднем около 15% миелоидных и 85% лимфоидных клеток, или 3 ≤ ρ ≤ 10). Миелоидно-ориентированные (My-bi) гемопоэтические стволовые клетки дают очень мало лимфоцитов, что приводит к соотношениям 0 < ρ < 3, в то время как лимфоидно-ориентированные (Ly-bi) гемопоэтические стволовые клетки генерируют очень мало миелоидных клеток, что приводит к -миелоидное соотношение ρ > 10. Все три типа являются нормальными типами ЗКП и не представляют собой стадии дифференцировки. Скорее, это три класса HSC, каждый из которых имеет эпигенетически закрепленную программу дифференцировки. Эти исследования также показали, что предвзятость в отношении происхождения не регулируется стохастически и не зависит от различий во влиянии окружающей среды. My-bi HSC самообновляется дольше, чем сбалансированный или Ly-bi HSC. Миелоидное смещение возникает в результате снижения чувствительности к лимфопоэтину. интерлейкин 7 (IL-7). [40]
Впоследствии другие группы подтвердили и подчеркнули первоначальные выводы. [42] Например, группа Ивса подтвердила в 2007 году, что кинетика репопуляции, способность к долговременному самообновлению, а также My-bi и Ly-bi стабильно наследуются внутренние свойства HSC. [43] В 2010 году группа Гуделла предоставила дополнительную информацию о молекулярной основе систематической ошибки в боковой популяции (SP) SCA-1. + Лин − c-комплект + ХСК. [44] Как ранее было показано для передачи сигналов IL-7, было обнаружено, что член семейства трансформирующих факторов роста (TGF-бета) индуцирует и ингибирует пролиферацию My-bi и Ly-bi HSC соответственно.
Этимология
[ редактировать ]От греческого haimato- , комбинированной формы haima «кровь», и от латинизированной формы греческого poietikos «способный творить, творить, продуктивно», от poiein «творить, творить». [45]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Монга I, Каур К., Дханда С. (март 2022 г.). «Возвращаясь к гемопоэзу: применение объемной и одноклеточной транскриптомики, анализирующей транскрипционную гетерогенность в гемопоэтических стволовых клетках». Брифинги по функциональной геномике . 21 (3): 159–176. дои : 10.1093/bfgp/elac002 . ПМИД 35265979 .
- ^ Перейти обратно: а б Бирбрайр А., Френетт П.С. (апрель 2016 г.). «Неоднородность ниш в костном мозге» . Анналы Нью-Йоркской академии наук . 1370 (1): 82–96. Бибкод : 2016NYASA1370...82B . дои : 10.1111/nyas.13016 . ПМЦ 4938003 . ПМИД 27015419 .
- ^ Перейти обратно: а б Дзержак Э., Бигас А (май 2018 г.). «Развитие крови: зависимость и независимость гемопоэтических стволовых клеток». Клеточная стволовая клетка . 22 (5): 639–651. дои : 10.1016/j.stem.2018.04.015 . hdl : 10230/36965 . ПМИД 29727679 .
- ^ Оттерсбах К. (апрель 2019 г.). «Переход от эндотелия к кроветворению: обновленная информация о процессе кроветворения» . Труды Биохимического общества . 47 (2): 591–601. дои : 10.1042/BST20180320 . ПМК 6490701 . ПМИД 30902922 .
- ^ Тилль Дж. Э., Маккаллок Э. А. (февраль 1961 г.). «Прямое измерение радиационной чувствительности нормальных клеток костного мозга мыши». Радиационные исследования . 14 (2): 213–22. Бибкод : 1961РадР...14..213Т . дои : 10.2307/3570892 . hdl : 1807/2781 . JSTOR 3570892 . ПМИД 13776896 .
- ^ «5. Гематопоэтические стволовые клетки» . Информация о стволовых клетках . Национальные институты здравоохранения, Министерство здравоохранения и социальных служб США. 17 июня 2011 г. Архивировано из оригинала 29 сентября 2015 г.
- ^ Мюллер, Альбрехт М.; Хупперц, Саша; Хеншлер, Рейнхард (июль 2016 г.). «Гематопоэтические стволовые клетки в регенеративной медицине: сбились с пути или на пути?» . Трансфузиология и гемотерапия . 43 (4): 247–254. дои : 10.1159/000447748 . ISSN 1660-3796 . ПМК 5040947 . ПМИД 27721700 .
- ^ де Брёйн М.Ф., Спек Н.А., Петерс М.К., Дзерзак Э. (июнь 2000 г.). «Окончательные гемопоэтические стволовые клетки сначала развиваются в основных артериальных областях эмбриона мыши» . Журнал ЭМБО . 19 (11): 2465–2474. дои : 10.1093/emboj/19.11.2465 . ПМК 212758 . ПМИД 10835345 .
- ^ Медвинский А, Дзержак Э (сентябрь 1996 г.). «Окончательный гемопоэз автономно инициируется регионом AGM» . Клетка . 86 (6): 897–906. дои : 10.1016/s0092-8674(00)80165-8 . hdl : 1765/57137 . ПМИД 8808625 . S2CID 3330712 .
- ^ Иванов А., Рыбцов С., Уэлч Л., Андерсон Р.А., Тернер М.Л., Медвинский А. (ноябрь 2011 г.). «Высокоэффективные гемопоэтические стволовые клетки человека впервые появляются во внутриэмбриональной области аорты, гонад и мезонефроса» . Журнал экспериментальной медицины . 208 (12): 2417–2427. дои : 10.1084/jem.20111688 . ПМК 3256972 . ПМИД 22042975 .
- ^ Перейти обратно: а б Дзержак Э., Спек Н.А. (февраль 2008 г.). «О происхождении и наследии: развитие гемопоэтических стволовых клеток млекопитающих» . Природная иммунология . 9 (2): 129–136. дои : 10.1038/ni1560 . ПМК 2696344 . ПМИД 18204427 .
- ^ «Процесс трансплантации костного мозга» . Клиника Мэйо . Проверено 18 марта 2015 г.
- ^ Перейти обратно: а б Махла РС (2016). «Применение стволовых клеток в регенеративной медицине и терапии заболеваний» . Международный журнал клеточной биологии . 2016 (7): 6940283. doi : 10.1155/2016/6940283 . ПМЦ 4969512 . ПМИД 27516776 .
- ^ Шрикант Л., Сунита М.М., Венкатеш К., Кумар П.С., Чандрасекхар С., Венгамма Б., Сарма П.В. (2015). «Анаэробный гликолиз и экспрессия HIF1α в гемопоэтических стволовых клетках объясняют его природу покоя». Журнал стволовых клеток . 10 (2): 97–106. ПМИД 27125138 .
- ^ Перейти обратно: а б Баумгартнер С., Тойфл С., Фарлик М., Халбриттер Ф., Шайхер Р., Фишер И. и др. (июнь 2018 г.). «Зависимый от ERK механизм обратной связи предотвращает истощение гемопоэтических стволовых клеток» . Клеточная стволовая клетка . 22 (6): 879–892.e6. дои : 10.1016/j.stem.2018.05.003 . ПМЦ 5988582 . ПМИД 29804890 .
- ^ Перейти обратно: а б Фелфли Х., Хаддад Г.Г. (2014). «Гематопоэтические стволовые клетки: новые потенциальные применения в трансляционной медицине». Журнал стволовых клеток . 9 (3): 163–197. ПМИД 25157450 .
- ^ Перейти обратно: а б с д Пак Би, Ю К.Х., Ким Си (декабрь 2015 г.). «Экспансия и генерация гемопоэтических стволовых клеток: пути к прорыву» . Исследование крови . 50 (4): 194–203. дои : 10.5045/br.2015.50.4.194 . ПМК 4705045 . ПМИД 26770947 .
- ^ «5. Гематопоэтические стволовые клетки – Stemcells.nih.gov» . Stemcells.nih.gov . Архивировано из оригинала 1 мая 2021 г. Проверено 18 января 2018 г.
- ^ Тиндалл А., Фассас А., Пассвег Дж., Руис де Эльвира С., Аттал М., Брукс П. и др. (октябрь 1999 г.). «Аутологичные трансплантации гемопоэтических стволовых клеток при аутоиммунных заболеваниях - осуществимость и смертность, связанная с трансплантацией. Рабочие группы по аутоиммунным заболеваниям и лимфоме Европейской группы по трансплантации крови и костного мозга, Европейской лиги против ревматизма и Международного проекта стволовых клеток при аутоиммунных заболеваниях» . Трансплантация костного мозга . 24 (7): 729–734. дои : 10.1038/sj.bmt.1701987 . ПМИД 10516675 .
- ^ Берт Р.К., Ло Й., Пирс В., Беохар Н., Барр В.Г., Крейг Р. и др. (февраль 2008 г.). «Клиническое применение стволовых клеток крови и костного мозга при доброкачественных заболеваниях» . ДЖАМА . 299 (8): 925–936. дои : 10.1001/jama.299.8.925 . ПМИД 18314435 .
- ^ Эль-Собки Т.А., Эль-Хаддад А., Эльсобки Э., Эльсаед С.М., Сакр Х.М. (март 2017 г.). «Реверс рентгенологической патологии скелета при злокачественном детском остеопетрозе после трансплантации гемопоэтических стволовых клеток» . Египетский журнал радиологии и ядерной медицины . 48 (1): 237–243. дои : 10.1016/j.ejrnm.2016.12.013 .
- ^ Хашеми Тахери А.П., Радмард А.Р., Кураки С., Бехфар М., Пак Н., Хамиди А.А., Гавамзаде А. (сентябрь 2015 г.). «Рентгенологическое разрешение злокачественных изменений скелета при детском остеопетрозе после трансплантации гемопоэтических стволовых клеток». Детская кровь и рак . 62 (9): 1645–1649. дои : 10.1002/pbc.25524 . ПМИД 25820806 . S2CID 11287381 .
- ^ Лангерайс Э.Дж., ден Ос М.М., Брин С., Джонс С.А., Кнавен О.К., Мерсер Дж. и др. (март 2016 г.). «Прогрессирование дисплазии тазобедренного сустава при мукополисахаридозе I типа после успешной трансплантации гемопоэтических стволовых клеток». Журнал костной и суставной хирургии. Американский том . 98 (5): 386–395. дои : 10.2106/JBJS.O.00601 . ПМИД 26935461 .
- ^ Мюллер, Альбрехт М.; Хупперц, Саша; Хеншлер, Рейнхард (26 июля 2016 г.). «Гематопоэтические стволовые клетки в регенеративной медицине: сбились с пути или на пути?» . Трансфузиология и гемотерапия . 43 (4): 247–254. дои : 10.1159/000447748 . ISSN 1660-3796 . ПМК 5040947 . ПМИД 27721700 .
- ^ Перейти обратно: а б Бирман I, Сейта Дж, Инлей М.А., Вайсман И.Л., Росси DJ (июль 2014 г.). «Покоящиеся гемопоэтические стволовые клетки накапливают повреждения ДНК во время старения, которые восстанавливаются при входе в клеточный цикл» . Клеточная стволовая клетка . 15 (1): 37–50. дои : 10.1016/j.stem.2014.04.016 . ПМЦ 4082747 . ПМИД 24813857 .
- ^ Перейти обратно: а б Нижник А., Вудбайн Л., Маркетти С., Доусон С., Ламбе Т., Лю С. и др. (июнь 2007 г.). «Репарация ДНК ограничивает гемопоэтические стволовые клетки во время старения». Природа . 447 (7145): 686–690. Бибкод : 2007Natur.447..686N . дои : 10.1038/nature05875 . ПМИД 17554302 . S2CID 4332976 .
- ^ Тилгнер К., Неганова И., Морено-Гимено И., Аль-Аама Дж. Я., Беркс Д., Юнг С. и др. (август 2013 г.). «Модель iPSC человека с дефицитом лигазы IV показывает важную роль NHEJ-опосредованной репарации DSB в выживании и геномной стабильности индуцированных плюрипотентных стволовых клеток и появляющихся гемопоэтических предшественников» . Смерть клеток и дифференцировка . 20 (8): 1089–1100. дои : 10.1038/cdd.2013.44 . ПМК 3705601 . ПМИД 23722522 .
- ^ Лукас Д., Эскудеро Б., Лигос Х.М., Сеговия Х.К., Эстрада Х.К., Террадос Дж. и др. (февраль 2009 г.). «Измененный гемопоэз у мышей, лишенных ДНК-полимеразы мю, обусловлен неэффективной репарацией двухцепочечных разрывов» . ПЛОС Генетика . 5 (2): e1000389. дои : 10.1371/journal.pgen.1000389 . ПМК 2638008 . ПМИД 19229323 .
- ^ Авагян С., Черчилль М., Ямамото К., Кроу Дж.Л., Ли С., Ли Б.Дж. и др. (сентябрь 2014 г.). «Дисфункция гемопоэтических стволовых клеток лежит в основе прогрессирующей лимфоцитопении при дефиците XLF/Cernunnos» . Кровь . 124 (10): 1622–1625. doi : 10.1182/blood-2014-05-574863 . ПМЦ 4155271 . ПМИД 25075129 .
- ^ Перейти обратно: а б Тилгнер К., Неганова И., Сингапол С., Сарецки Г., Аль-Аама Дж. Я., Эванс Дж. и др. (сентябрь 2013 г.). «Краткий отчет: модель дефицита цернунноса, индуцированная человеком, показывает важную роль XLF в выживании примитивных гемопоэтических предшественников» . Стволовые клетки . 31 (9): 2015–2023. дои : 10.1002/stem.1456 . ПМИД 23818183 . S2CID 3623309 .
- ^ Росси DJ, Брайдер Д., Сейта Дж., Нуссенцвейг А., Хоймейкерс Дж., Вайсман И.Л. (июнь 2007 г.). «Недостаток восстановления повреждений ДНК ограничивает функцию гемопоэтических стволовых клеток с возрастом». Природа . 447 (7145): 725–729. Бибкод : 2007Natur.447..725R . дои : 10.1038/nature05862 . ПМИД 17554309 . S2CID 4416445 .
- ^ «Исследования могут раскрыть, почему люди в возрасте 70 лет могут внезапно стать слабыми» . Хранитель . 1 июня 2022 г. Проверено 18 июля 2022 г.
- ^ Митчелл, Эмили; Спенсер Чепмен, Майкл; Уильямс, Николас; Доусон, Кевин Дж.; Менде, Николь; Колдербанк, Эмили Ф.; Юнг, Хюнчуль; Митчелл, Томас; Куренс, Тим Х.Х.; Спенсер, Дэвид Х.; Мачадо, Хизер; Ли-Сикс, Генри; Дэвис, Меган; Хейлер, Дэниел; Фабр, Маргарет А.; Махбубани, Кришна; Абаскаль, Федерико; Кейган, Алекс; Василиу, Джордж С.; Бакстер, Джоанна; Мартинкорена, Иниго; Страттон, Майкл Р.; Кент, Дэвид Г.; Чаттерджи, Кришна; Парси, Курош Саеб; Грин, Энтони Р.; Нангалия, Джиоти; Лауренти, Элиза; Кэмпбелл, Питер Дж. (июнь 2022 г.). «Клональная динамика кроветворения на протяжении всей жизни человека» . Природа . 606 (7913): 343–350. Бибкод : 2022Natur.606..343M . дои : 10.1038/s41586-022-04786-y . ISSN 1476-4687 . ПМЦ 9177428 . ПМИД 35650442 .
- ^ Чо, Ребекка Х; Зибург, Ганс Б; Мюллер-Зибург, Криста Э (2008). «Новый механизм старения гемопоэтических стволовых клеток: старение меняет клональный состав компартмента стволовых клеток, но не отдельных стволовых клеток» . Кровь . 111 (12): 5553–5561. дои : 10.1182/blood-2007-11-123547 . ПМК 2424153 . ПМИД 18413859 .
- ^ Ллэймс, Сара; Гарсиа-Перес, Ева; Меана, Альваро; Ларчер, Фернандо; дель Рио, Марсела (2015). «Действия и приложения ячеек питающего слоя» . Tissue Eng Часть B Ред . 21 (4): 345–353. дои : 10.1089/ten.teb.2014.0547 . ПМК 4533020 . ПМИД 25659081 .
- ^ Burger JA, Spoo A, Dwenger A, Burger M, Behringer D (август 2003 г.). «Хемокиновые рецепторы CXCR4 (CD184) и интегрины альфа4бета1 опосредуют спонтанную миграцию предшественников CD34+ человека и клеток острого миелоидного лейкоза под стромальные клетки костного мозга (псевдоэмпериполез)» . Британский журнал гематологии . 122 (4): 579–89. дои : 10.1046/j.1365-2141.2003.04466.x . ПМИД 12899713 . S2CID 8764752 .
- ^ Зибург Х.Б., Мюллер-Зибург CE (2004). «Классификация коротких кинетик по форме». В кремниевой биологии . 4 (2): 209–17. ПМИД 15107024 .
- ^ Челлен, Грант А.; Боулс, Натан; Линь, Куан-Инь К.; Гуделл, Маргарет А. (январь 2009 г.). «Идентификация и анализ гемопоэтических стволовых клеток мыши» . Цитометрия Часть А. 75А (1): 14–24. doi : 10.1002/cyto.a.20674 . ПМК 2640229 . ПМИД 19023891 .
- ^ Мюллер-Зибург CE, Чо Р.Х., Томан М., Адкинс Б., Зибург Х.Б. (август 2002 г.). «Детерминистическая регуляция самообновления и дифференцировки гемопоэтических стволовых клеток» . Кровь . 100 (4): 1302–9. doi : 10.1182/blood.V100.4.1302.h81602001302_1302_1309 . ПМИД 12149211 .
- ^ Перейти обратно: а б Мюллер-Зибург CE, Чо Р.Х., Карлссон Л., Хуанг Дж.Ф., Зибург Х.Б. (июнь 2004 г.). «Миелоидно-ориентированные гемопоэтические стволовые клетки обладают обширной способностью к самообновлению, но генерируют уменьшенное лимфоидное потомство с нарушенной чувствительностью к IL-7» . Кровь . 103 (11): 4111–8. дои : 10.1182/кровь-2003-10-3448 . ПМИД 14976059 .
- ^ Сибург Х.Б., Чо Р.Х., Дикстра Б., Учида Н., Ивс К.Дж., Мюллер-Зибург CE (март 2006 г.). «Гематопоэтический стволовой компартмент состоит из ограниченного числа отдельных подмножеств стволовых клеток» . Кровь . 107 (6): 2311–6. дои : 10.1182/кровь-2005-07-2970 . ПМК 1456063 . ПМИД 16291588 .
- ^ Шредер Т. (март 2010 г.). «Неоднородность гемопоэтических стволовых клеток: подтипы, а не непредсказуемое поведение» . Клеточная стволовая клетка . 6 (3): 203–7. дои : 10.1016/j.stem.2010.02.006 . ПМИД 20207223 .
- ^ Дайкстра Б., Кент Д., Боуи М., Маккаффри Л., Гамильтон М., Лайонс К. и др. (август 2007 г.). «Долгосрочное распространение различных программ гемопоэтической дифференциации in vivo» . Клеточная стволовая клетка . 1 (2): 218–29. дои : 10.1016/j.stem.2007.05.015 . ПМИД 18371352 .
- ^ Челлен Г.А., Боулс, Северная Каролина, Чемберс С.М., Гуделл М.А. (март 2010 г.). «Отличные подтипы гемопоэтических стволовых клеток по-разному регулируются TGF-бета1» . Клеточная стволовая клетка . 6 (3): 265–78. дои : 10.1016/j.stem.2010.02.002 . ПМЦ 2837284 . ПМИД 20207229 .
- ^ Флекснер С.Б., Хаук Л.С., ред. (1993). Полный словарь Random House (2-е изд.). Нью-Йорк: Рэндом Хаус. п. 890. ИСБН 0-679-42917-4 .
