Альфавирус
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
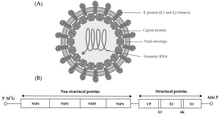
Альфавирусы — род РНК-вирусов , единственный род семейства Togaviridae . Альфавирусы относятся к группе IV Балтиморской классификации вирусов с с геномом с одноцепочечной РНК положительным смыслом . Существует 32 альфавируса, которые заражают различных позвоночных, таких как люди, грызуны, рыбы, птицы и более крупные млекопитающие, такие как лошади, а также беспозвоночные . Альфавирусы, которые могут инфицировать как позвоночных, так и членистоногих, называются альфавирусами с двойным хозяином, в то время как альфавирусы, специфичные для насекомых, такие как вирус Эйлат и вирус Яда-яда, ограничиваются своим компетентным переносчиком из членистоногих. [1] Передача между видами и особями происходит в основном через комаров, что делает альфавирусы частью коллекции арбовирусов , или вирусов, передающихся членистоногими . Частицы альфавируса имеют оболочку, имеют диаметр 70 нм, имеют тенденцию быть сферическими (хотя и слегка плеоморфными ) и имеют изометрический нуклеокапсид размером 40 нм . [2]
Геном
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( Май 2023 г. ) |
| Альфа_E1_гликоп | |||
|---|---|---|---|
 Кристаллическая структура гомотримера слитого гликопротеина Е1 вируса Леса Семлики | |||
| Идентификаторы | |||
| Символ | Альфа_E1_гликоп | ||
| Пфам | PF01589 | ||
| ИнтерПро | ИПР002548 | ||
| СКОП2 | 1рер / СКОПе / СУПФАМ | ||
| TCDB | 1.Г | ||
| Суперсемейство OPM | 109 | ||
| белок OPM | 1рер | ||
| |||
| Альфа_E2_гликоп | |||
|---|---|---|---|
 Картирование гликопротеина E2 альфавирусов | |||
| Идентификаторы | |||
| Символ | Альфа_E2_гликоп | ||
| Пфам | PF00943 | ||
| ИнтерПро | IPR000936 | ||
| TCDB | 1.Г | ||
| Суперсемейство OPM | 109 | ||
| белок OPM | 2тис | ||
| |||
| Альфа_E3_гликоп | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Альфа_E3_гликоп | ||
| Пфам | PF01563 | ||
| ИнтерПро | ИПР002533 | ||
| TCDB | 1.Г | ||
| Суперсемейство OPM | 109 | ||
| |||
Альфавирусы представляют собой небольшие сферические вирусы с оболочкой, геном которых состоит из одной цепи РНК с положительным смыслом. Общая длина генома колеблется от 11 000 до 12 000 нуклеотидов и имеет 5'-кэп и 3'- поли-А-хвост . Четыре гена неструктурных белков кодируются в 5'-двух третях генома, тогда как три структурных белка транслируются с субгеномной мРНК, коллинеарной с 3'-одной третью генома.
существуют две открытые рамки считывания В геноме (ОРС): неструктурная и структурная. Первый неструктурен и кодирует белки (nsP1–nsP4), необходимые для транскрипции и репликации вирусной РНК. Второй кодирует три структурных белка: основной нуклеокапсида белок C и белки оболочки P62 и E1, которые соединяются в гетеродимер . , закрепленные на вирусной мембране, Поверхностные гликопротеины отвечают за распознавание рецепторов и проникновение в клетки- мишени посредством слияния мембран .
Структурные белки
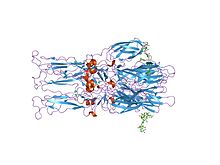
[ редактировать ]Протеолитическое созревание P62 в E2 и E3 вызывает изменение поверхности вируса. Вместе E1, E2, а иногда и E3, гликопротеиновые E1/E2 «шипы» образуют димер или тример E1/E2/E3, где E2 простирается от центра к вершинам, E1 заполняет пространство между вершинами, а E3, если он присутствует, то находится на дистальном конце шипа. [3] При воздействии на вирус кислотной среды эндосомы E1 диссоциирует от E2 с образованием гомотримера E1 , который необходим на этапе слияния, чтобы свести вместе клеточные и вирусные мембраны . Альфавирусный гликопротеин E1 представляет собой вирусный слитый белок класса II, который структурно класса I, отличается от слитых белков обнаруженных в вирусе гриппа и ВИЧ. Структура структурными вируса леса Семлики обнаружила структуру, аналогичную структуре флавивирусного гликопротеина Е, с тремя доменами в том же расположении первичной последовательности . [4] Гликопротеин Е2 взаимодействует с нуклеокапсидом через свой цитоплазматический домен, а его эктодомен отвечает за связывание клеточного рецептора . Большинство альфавирусов теряют периферический белок Е3, но у вирусов Семлики он остается связанным с вирусной поверхностью.
Неструктурные белки
[ редактировать ]Четыре неструктурных белка (nsP1–4), которые образуются в виде одного полипротеина, составляют механизм репликации вируса. [5] Процессинг полипротеина происходит строго регулируемым образом, при этом расщепление в месте соединения P2/3 влияет на использование матрицы РНК во время репликации генома. Это место расположено у подножия узкой расщелины и труднодоступно. Перед расщеплением nsP3 создает кольцевую структуру, окружающую nsP2. Эти два белка имеют обширный интерфейс.
Мутации в nsP2, которые приводят к образованию нецитопатических вирусов или кластера чувствительных к температуре фенотипов в области интерфейса P2/P3. Мутации P3, противоположные расположению нецитопатических мутаций nsP2, предотвращают эффективное расщепление P2/3. Это, в свою очередь, влияет на инфекционность РНК, изменяя уровни продукции вирусной РНК.
Вирусология
[ редактировать ]Вирус имеет диаметр 60–70 нанометров . Он имеет оболочку, сферическую форму и имеет геном РНК с положительной цепью размером ~ 12 тысяч оснований. Геном кодирует два полипротеина. Первый полипротеин состоит из четырех неструктурных единиц: в порядке от N-конца к С-концу — nsP1, nsP2, nsP3 и nsP4. Второй представляет собой структурный полипротеин, состоящий из пяти единиц экспрессии: от N-конца до С-конца — капсида, Е3, Е2, 6К и Е1. Субгеномная РНК с положительной цепью - 26S РНК - реплицируется из промежуточной РНК с отрицательной цепью. Это служит матрицей для синтеза вирусных структурных белков. Большинство альфавирусов имеют консервативные домены, участвующие в регуляции синтеза вирусной РНК.
Нуклеокапсид диаметром 40 нанометров содержит 240 копий капсидного белка и имеет икосаэдрическую симметрию Т = 4. Вирусные гликопротеины E1 и E2 встроены в липидный бислой. Отдельные молекулы E1 и E2 объединяются с образованием гетеродимеров. Гетеродимеры E1–E2 образуют контакты один к одному между белком E2 и мономерами нуклеокапсида. Белки Е1 и Е2 обеспечивают контакт между вирусом и клеткой-хозяином.
Было идентифицировано несколько рецепторов. К ним относятся прогибин , фосфатидилсерин , гликозаминогликаны и β-субъединица АТФ-синтазы (необходима ссылка).
Репликация происходит внутри цитоплазмы, особенно в областях, называемых «сферулами», отделенных от остальных инвагинациями плазматической мембраны. Каждый комплекс занимает одну такую область внутренним диаметром около 50 нм. [6]
Вирионы созревают путем отпочкования через плазматическую мембрану, где ассимилируются поверхностные гликопротеины Е2 и Е1, кодируемые вирусом. Эти два гликопротеина являются мишенями многочисленных серологических реакций и тестов, включая нейтрализацию и ингибирование гемагглютинации. Альфавирусы проявляют различную степень антигенной перекрестной реактивности в этих реакциях, что составляет основу семи антигенных комплексов, 32 видов и множества подтипов и разновидностей. Белок Е2 является местом расположения большинства нейтрализующих эпитопов, тогда как белок Е1 содержит более консервативные перекрестно-реактивные эпитопы.
Эволюция
[ редактировать ]Изучение этого таксона позволяет предположить, что эта группа вирусов имела морское происхождение — в частности, Южный океан — и что впоследствии они распространились как в Старый, так и в Новый Свет. [7]
В этом роде есть три подгруппы: подгруппа вирусов леса Семлики (вирусы леса Семлики, вирусы О'ньонг-нён и Росс-Ривер); подгруппа вируса восточного лошадиного энцефалита (вирусы восточного лошадиного энцефалита и венесуэльского лошадиного энцефалита) и подгруппа вируса Синдбис. [8] Вирус Синдбис, географически ограниченный Старым Светом, более тесно связан с подгруппой восточного лошадиного энцефалита, которая относится к вирусам Нового Света, чем с подгруппой вирусов леса Семлики, которая также встречается в Старом Свете.
Таксономия
[ редактировать ]К роду отнесены следующие виды: [9]
- Вирус ауры
- Вирус Бармах Форест
- Обновления вирусов
- Вирус Каингуа
- Вирус Кабассу
- Вирус Чикунгунья
- Вирус восточного лошадиного энцефалита
- Эйлатский вирус
- Вирус Эверглейдс
- Вирус Форт-Моргана
- Вирусный сок
- Вирус Хайлендс J
- Вирус Мадариага
- Вирус Майаро
- Вирус Мидделбурга
- Вирус Моссо-дас-Педрас
- Сексуальный вирус
- Вирус Ндуму
- Вирус О'Нённи
- Вирус Пиксуна
- Вирус Рио-Негру
- Вирус Росс-Ривер
- Вирус болезни поджелудочной железы лосося
- Вирус леса Семлики
- Вирус Синдби
- Вирус южного морского слона
- Тонировать вирус
- Вирус Трокара
- вирус
- Вирус венесуэльского лошадиного энцефалита
- Вирус западного лошадиного энцефалита
- Вирусное программное обеспечение
Семь комплексов:
- Вирусный комплекс Бармах Форест
- Комплекс восточного лошадиного энцефалита
- Вирус восточного лошадиного энцефалита (семь антигенных типов)
- Вирусный комплекс Мидделбурга
- Вирусный комплекс Ндуму
- Вирусный комплекс Леса Семлики
- Обновления вирусов
- Вирус Чикунгунья
- Вирусный сок
- Вирус Майаро
- Подтип: вирус Уна
- Вирус О'Нённи
- Подтип: вирус Игбо-Ора
- Вирус Росс-Ривер
- Подтип: вирус Сагияма
- Вирус леса Семлики
- Подтип: Вирус Me Tri
- Комплекс венесуэльского лошадиного энцефалита.
- Вирус Кабассу
- Вирус Эверглейдс
- Вирус Моссо-дас-Педрас
- Сексуальный вирус
- Вирус Парамана
- Вирус Пиксуна
- Рио-Негру Вирус
- Вирус Трокара
- Подтип: Вирус Bijou Bridge.
- Вирус венесуэльского лошадиного энцефалита
- Комплекс западного лошадиного энцефалита
- Вирус ауры
- Вирус Бабанки
- Вирус Кызылагач
- Вирус Синдби
- Вирус Окельбо
- Вирусное программное обеспечение
- Рекомбинанты в этом комплексе
- Вирус Багги-Крик
- Вирус Форт-Моргана
- Вирус Хайлендс J
- Вирус западного лошадиного энцефалита
- Неклассифицированный
- Эйлатский вирус
- мвинилунга Альфавирус
- Альфавирус лососевых
- Вирус южного морского слона
- Тонировать вирус
- Вирус Каингуа [10]
Примечания
[ редактировать ]Вирус леса Бармах родственен вирусу леса Семлики. Вирус Мидделбург, хотя и классифицируется как отдельный комплекс, может принадлежать к группе вирусов Леса Семлики.
Кажется вероятным, что этот род развился в Старом Свете из растительного вируса, передающегося насекомыми. [11]
Вирус Синдбис, возможно, возник в Южной Америке. [12] Вирусы лошадиного энцефалита и вирус Синдбис родственны.
Вирусы Старого Света и Нового Света, по-видимому, разошлись между 2000 и 3000 лет назад. [13] Расхождение между вирусом венесуэльского лошадиного энцефалита и вирусом восточного лошадиного, по-видимому, произошло примерно 1400 лет назад. [14]
Клада, заражающая рыб, по-видимому, является базальной по отношению к другим видам.
Вирус южного морского слона, по-видимому, связан с кладой Синбис.
Патогенез и иммунный ответ
[ редактировать ]| Вирус | Человеческие болезни | Резервуар позвоночных | Распределение |
|---|---|---|---|
| Вирус Бармах Форест |
| Люди | Австралия |
| Вирус Чикунгунья | Сыпь, артрит | Приматы, люди | Африка, Латинская Америка, Индия , Юго-Восточная Азия |
| Вирус восточного лошадиного энцефалита | Энцефалит | Птицы | Америка |
| Вирус Майаро | Сыпь, артрит | Приматы, люди | Южная Америка |
| Вирус О'Нённи | Сыпь, артрит | Приматы , Люди | Африка |
| Вирус Росс-Ривер | Сыпь, артрит | Млекопитающие, люди | Австралия, южная часть Тихого океана |
| Вирус леса Семлики | Сыпь, артрит | Птицы | Африка |
| Вирус Синдби | Сыпь, артрит | Птицы | Европа , Африка , Австралия |
| Тонировать вирус | Энцефалит | Люди | Южная Америка |
| вирус | Сыпь, артрит | Приматы, люди | Южная Америка |
| Вирус венесуэльского лошадиного энцефалита | Энцефалит | Грызуны , лошади | Америка |
| Вирус западного лошадиного энцефалита | Энцефалит | Птицы, млекопитающие | Северная Америка |
По всему миру распространено множество альфавирусов, способных вызывать заболевания человека. инфекционный артрит , энцефалит , сыпь и лихорадка Наиболее часто наблюдаемыми симптомами являются . Более крупные млекопитающие, такие как люди и лошади, обычно являются тупиковыми хозяевами или играют незначительную роль в передаче вируса; однако в случае венесуэльского лошадиного энцефалита вирус в основном амплифицируется у лошадей. В большинстве остальных случаев вирус сохраняется в природе у комаров, грызунов и птиц.
Наземные альфавирусные инфекции распространяются насекомыми-переносчиками, такими как комары. После укуса человека инфицированным комаром вирус может попасть в кровоток, вызывая виремию . Альфавирус также может проникнуть в ЦНС , где он может расти и размножаться внутри нейронов. Это может привести к энцефалиту , который может привести к летальному исходу.
Когда человек заражается этим конкретным вирусом, его иммунная система может играть роль в уничтожении вирусных частиц. Альфавирусы способны вызывать выработку интерферонов . Антитела и Т-клетки также участвуют. Нейтрализующие антитела также играют важную роль в предотвращении дальнейшего заражения и распространения.
Диагностика, профилактика и контроль
[ редактировать ]Диагностика основывается на клинических образцах, из которых вирус можно легко выделить и идентифицировать. В настоящее время вакцины против альфавируса не существует. Предпочтительными профилактическими мерами являются борьба с переносчиками инфекции с помощью репеллентов, защитной одежды, уничтожение мест размножения и опрыскивание. [ нужна ссылка ]
Исследовать
[ редактировать ]Альфавирусы представляют интерес для исследователей генной терапии , в частности вирус Росс-Ривер, вирус Синдбис , вирус леса Семлики и вирус венесуэльского лошадиного энцефалита - все они использовались для разработки вирусных векторов для доставки генов. Особый интерес представляют химерные вирусы, которые могут образовываться с альфавирусными оболочками и ретровирусными капсидами. Такие химеры называются псевдотипированными вирусами. Псевдотипы альфавирусной оболочки ретровирусов или лентивирусов способны интегрировать гены, которые они несут, в обширный диапазон потенциальных клеток-хозяев, которые распознаются и инфицируются белками альфавирусной оболочки E2 и E1. Стабильная интеграция вирусных генов опосредована ретровирусными внутренностями этих векторов. Существуют ограничения на использование альфавирусов в области генной терапии из-за отсутствия у них таргетной направленности, однако за счет введения вариабельных доменов антител в неконсервативную петлю в структуре Е2 были нацелены конкретные популяции клеток. Более того, использование целых альфавирусов для генной терапии имеет ограниченную эффективность как потому, что несколько внутренних альфавирусных белков участвуют в индукции апоптоза при инфекции, так и потому, что альфавирусный капсид опосредует лишь временное введение мРНК в клетки-хозяева. Ни одно из этих ограничений не распространяется на псевдотипы альфавирусной оболочки ретровирусов или лентивирусов. Однако экспрессия оболочек вируса Синдбис может приводить к апоптозу, а их введение в клетки-хозяева при инфицировании псевдотипированными ретровирусами оболочки вируса Синдбис также может приводить к гибели клеток. Токсичность вирусных оболочек Синдбис может быть причиной очень низких титров продукции, реализуемых упаковывающими клетками, сконструированными для производства псевдотипов Синдбис. Другая отрасль исследований альфавирусов связана с вакцинацией. Альфавирусы могут быть созданы для создания репликонные векторы, которые эффективно индуцируют гуморальный и Т-клеточный иммунные ответы. Поэтому их можно использовать для вакцинации против вирусных, бактериальных, простейших и опухолевых антигенов.
История
[ редактировать ]Первоначально семейство Togaviridae включало в себя так называемые флавивирусы , входящие в род Alphavirus . Флавивирусы были выделены в собственное семейство, когда благодаря развитию секвенирования были отмечены достаточные различия с альфавирусами. [15] Вирус краснухи ранее был включен в семейство Togaviridae в отдельный род Rubivirus , но теперь отнесен к отдельному семейству Matonaviridae . [16] Альфавирусы теперь являются единственным родом в этом семействе.
- 1930 – вирус западного лошадиного энцефалита (первый когда-либо выделенный альфавирус). В США впервые выделен
- 1933 – вирус восточного лошадиного энцефалита . В США впервые выделен
- 1938 г. — венесуэльский лошадиный энцефалит . выделен
- западного лошадиного энцефалита эпидемия 1941 г. – в США наблюдается . От него страдают 300 000 лошадей и 3336 человек.
- 1941 г. - Норман Грегг замечает большое количество детей с катарактой после вспышки краснухи. Этот и другие дефекты затем классифицируются как синдром врожденной краснухи .
- 1942 — Вирус леса Семлики выделен в Булияме, округ Бвамба, Уганда .
- 1952 — Вирус Синдбис выделен в медицинском районе Синдбис, в 40 милях (64 км) к северу от Каира, Египет .
- 1959 — вирус Росс-Ривер выделен из комаров Aedes vigilax (теперь известный как Ochlerotatus vigilax ). [17] которые оказались в ловушке на реке Росс в Австралии.
- вирус Росс-Ривер, вызывающий эпидемический полиартрит (в основном встречающийся в Австралии). 1963 г. - Доэрти и его коллеги выделили [18]
- 1971 – Последняя эпидемия венесуэльского лошадиного энцефалита отмечена у лошадей на юге Техаса . [19]
- 1986 – вирус Бармах Форест вызывает заболевание человека в Австралии. Установлено, что [20]
- 2001 — Ученые разгадали кристаллическую структуру гликопротеиновой оболочки вируса леса Семлики .
- 2005–2006 гг. – Крупная эпидемия вируса чикунгунья на острове Реюньон и прилегающих островах в Индийском океане. [21]
- 2006 г. - крупная эпидемия вируса чикунгунья в Индии, зарегистрировано более 1,5 миллиона случаев. [22]
См. также
[ редактировать ]Источники
[ редактировать ]- «Арбовирусы» . Вирусология-онлайн .
- «Источники ICTV» . ICTV . Архивировано из оригинала 12 февраля 2006 года.
- Смерду, К.; Лильестрем, П. (2000). «Альфавирусные векторы: от производства белка до генной терапии» . Генная терапия и регулирование . 1 (1): 33–63. дои : 10.1163/156855800744520 . ISSN 1568-5586 .
- Райнер Д.О., Дрыга С.А., Камруд К.И. (2002). «Альфавирусные векторы и вакцинация». Обзоры по медицинской вирусологии . 12 (5): 279–96. дои : 10.1002/rmv.360 . ПМИД 12211042 . S2CID 21432844 .
- Рема, Селин; Эренгрубер, Маркус У.; Гранжирар, Дени (2005). «Альфавирусная цитотоксичность и ее влияние на развитие векторов». Экспериментальная физиология . 90 (1): 45–52. doi : 10.1113/expphysicalol.2004.028142 . ПМИД 15542620 .
- Шмальджон, Алан Л.; Макклейн, Дэвид (1996). «54. Альфавирусы (Togaviridae) и флавивирусы (Flaviviridae)» . В Бароне, Сэмюэле (ред.). Медицинская микробиология (4-е изд.). Медицинский филиал Техасского университета в Галвестоне. ISBN 0-9631172-1-1 . ПМИД 21413253 . НБК7633.
Ссылки
[ редактировать ]- ^ Эльрефаи А.М., Абдельнаби Р., Росалес Росас А.Л., Ван Л., Басу С., Деланг Л. (31 августа 2020 г.). «Понимание механизмов, лежащих в основе ограничения хозяином вирусов, специфичных для насекомых» . Вирусы . 12 (9): 964. дои : 10.3390/v12090964 . ПМЦ 7552076 . ПМИД 32878245 .
- ^ Чен Р., Мукхопадьяй С., Меритс А., Боллинг Б., Насар Ф., Коффи Л.Л. и др. (июнь 2018 г.). «Профиль таксономии вируса ICTV: Togaviridae» . Журнал общей вирусологии . 99 (6): 761–2. дои : 10.1099/jgv.0.001072 . ПМИД 29745869 .
- ^ Веньен-Брайан С., Фуллер С.Д. (февраль 1994 г.). «Организация шиповчатого комплекса вируса леса Семлики». Дж. Мол. Биол . 236 (2): 572–83. дои : 10.1006/jmbi.1994.1166 . ПМИД 8107141 .
- ^ Лескар Дж., Руссель А., Вен М.В., Наваза Дж., Фуллер С.Д., Венглер Дж., Венглер Дж., Рей Ф.А. (апрель 2001 г.). «Слитая гликопротеиновая оболочка вируса леса Семлики: икосаэдрическая сборка, подготовленная к фузогенной активации при эндосомальном pH» . Клетка . 105 (1): 137–48. дои : 10.1016/S0092-8674(01)00303-8 . ПМИД 11301009 . S2CID 16535677 .
- ^ Шин Г., Йост С.А., Миллер М.Т., Элрод Э.Дж., Гракуи А., Маркотриджано Дж. (2012). «Структурные и функциональные данные об обработке и патогенезе полипротеинов альфавирусов» . Proc Natl Acad Sci США . 109 (41): 16534–9. Бибкод : 2012PNAS..10916534S . дои : 10.1073/pnas.1210418109 . ПМЦ 3478664 . ПМИД 23010928 .
- ^ Спуул, П; Балистрери, Дж; Хеллстрем, К; Голубцов А.В.; Йокитало, Э; Ахола, Т. (май 2011 г.). «Сборка репликационных комплексов альфавируса из РНК и белковых компонентов в новой системе трансрепликации в клетках млекопитающих» . Журнал вирусологии . 85 (10): 4739–51. дои : 10.1128/JVI.00085-11 . ПМК 3126202 . ПМИД 21389137 .
- ^ Форрестер Н.Л., Паласиос Г., Теш Р.Б., Савджи Н., Гузман Х., Шерман М., Уивер С.К., Липкин В.И. (декабрь 2011 г.). «Филогения рода Alphavirus в масштабе генома предполагает морское происхождение» . Дж Вирол . 86 (5): 2729–38. дои : 10.1128/JVI.05591-11 . ПМК 3302268 . ПМИД 22190718 .
- ^ Левинсон Р.С., Штраус Дж.Х., Штраус Э.Г. (1990). «Полная последовательность геномной РНК вируса О'Нён-Нён и ее использование в построении филогенетических деревьев альфавирусов». Вирусология . 175 (1): 110–123. дои : 10.1016/0042-6822(90)90191-с . ПМИД 2155505 .
- ^ «Таксономия вирусов: выпуск 2020 г.» . Международный комитет по таксономии вирусов (ICTV). Март 2021 года . Проверено 15 мая 2021 г.
- ^ Ча М.К., Сузукава А.А., Греф Т., Пианчини Л.Д., да Силва А.М., Фаоро Х. и др. (2019). «Идентификация нового альфавируса, связанного с комплексами энцефалита, циркулирующими на юге Бразилии» . Новые микробы и инфекции . 8 (1): 920–933. дои : 10.1080/22221751.2019.1632152 . ПМК 6598490 . ПМИД 31237479 .
- ^ Пауэрс А.М., Брот А.К., Ширако Ю., Штраус Э.Г., Канг В., Штраусс Дж.Х., Уивер С.К. (ноябрь 2001 г.). «Эволюционные взаимоотношения и систематика альфавирусов» . Дж. Вирол . 75 (21): 10118–31. doi : 10.1128/JVI.75.21.10118-10131.2001 . ПМК 114586 . ПМИД 11581380 .
- ^ Лундстрем Дж.О., Пфеффер М. (ноябрь 2010 г.). «Филогеографическая структура и история эволюции вируса Синдбис». Векторные зоонозные дис . 10 (9): 889–907. дои : 10.1089/vbz.2009.0069 . ПМИД 20420530 .
- ^ Уивер С.К., Хагенбо А., Беллью Л.А., Нетесов С.В., Волчков В.Е., Чанг Г.Дж., Кларк Д.К., Гуссе Л., Скотт Т.В., Трент Д.В. (ноябрь 1993 г.). «Сравнение нуклеотидных последовательностей вирусов восточного и западного лошадиного энцефаломиелита с последовательностями других альфавирусов и родственных РНК-вирусов». Вирусология . 197 (1): 375–90. дои : 10.1006/виро.1993.1599 . ПМИД 8105605 .
- ^ Уивер С.К., Рико-Хессе Р., Скотт Т.В. (1992). «Генетическое разнообразие и медленные темпы эволюции альфавирусов Нового Света». Курс. Вершина. Микробиол. Иммунол . Актуальные темы микробиологии и иммунологии. 176 : 99–117. дои : 10.1007/978-3-642-77011-1_7 . ISBN 978-3-642-77013-5 . ПМИД 1318187 .
- ^ «Тогавирусиды» . Стэнфорд.edu.
- ^ «Список таксономии ICTV» . Проверено 5 мая 2020 г.
- ^ «Аедес Вигилакс» . Программа наблюдения и мониторинга переносчиков арбовирусов штата Новый Южный Уэльс . Программа наблюдения за арбовирусами и комаров Нового Южного Уэльса. Архивировано из оригинала 19 марта 2018 года . Проверено 5 июня 2010 г.
Обратите внимание, что до 2000 года Ochlerotatus vigilax был известен как Aedes vigilax.
- ^ Доэрти Р.Л., Карли Дж.Г., Бест Дж.К. (май 1972 г.). «Выделение вируса Росс-Ривер от человека». Медицинский журнал Австралии . 1 (21): 1083–4. дои : 10.5694/j.1326-5377.1972.tb116646.x . ПМИД 5040017 . S2CID 13048176 .
- ^ Калишер CH (январь 1994 г.). «Медицински важные арбовирусы США и Канады» . Обзоры клинической микробиологии . 7 (1): 89–116. дои : 10.1128/CMR.7.1.89 . ПМК 358307 . ПМИД 8118792 .
- ^ Боутон Ч.Р., Хоукс Р.А., Наим Х.М. (февраль 1988 г.). «Болезнь, вызванная вирусом, похожим на лес Барма, в Новом Южном Уэльсе». Медицинский журнал Австралии . 148 (3): 146–7. дои : 10.5694/j.1326-5377.1988.tb112780.x . ПМИД 2828896 . S2CID 30837260 .
- ^ Цесаркин К., Хиггс С., МакГи С.Э., Де Ламбаллери X, Чаррел Р.Н., Ванландингем Д.Л. (2006). «Инфекционные клоны вируса Чикунгунья (изолят Ла Реюньон) для исследований компетентности переносчиков». Трансмиссивные и зоонозные болезни . 6 (4): 325–37. дои : 10.1089/vbz.2006.6.325 . ПМИД 17187566 .
- ^ Лахария С., Прадхан С.К. (декабрь 2006 г.). «Появление вируса чикунгунья на Индийском субконтиненте через 32 года: обзор». Журнал трансмиссивных болезней . 43 (4): 151–60. ПМИД 17175699 .