Тетрафторид циркония
 | |
| Имена | |
|---|---|
| ИЮПАК имена Фторид циркония(IV) Тетрафторид циркония | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.107 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ЗрФ 4 | |
| Молярная масса | 167.21 g/mol |
| Появление | белый кристаллический порошок |
| Плотность | 4,43 г/см 3 (20 °С) |
| Температура плавления | 910 ° C (1670 ° F; 1180 К) |
| 1,32 г/100 мл (20 °С) 1,388 г/100 мл (25 °С) | |
| Структура | |
| Моноклиника , мС60 | |
| С12/с1, №15 | |
| Опасности | |
| точка возгорания | Невоспламеняющийся |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 98 мг/кг (перорально, мышь) 98 мг/кг (перорально, крыса) [1] |
| Родственные соединения | |
Другие анионы | Хлорид циркония(IV) Бромид циркония(IV) Йодид циркония(IV) |
Другие катионы | Фторид титана(IV) Фторид гафния(IV) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фторид циркония (IV) описывает членов семейства неорганических соединений с формулой ( Zr F 4 (H 2 O) x . Все они представляют собой бесцветные диамагнитные твердые вещества. Безводный фторид циркония (IV) »является компонентом ZBLAN фторидного стекла . [2]
Структура
[ редактировать ]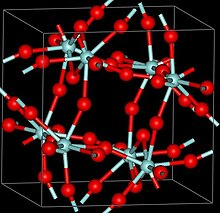
трех кристаллических фазах ZrF 4 Сообщалось о : α ( моноклинная ), β ( тетрагональная , символ Пирсона tP40, пространственная группа P42/m, № 84) и γ (структура неизвестна). β- и γ-фазы нестабильны и необратимо переходят в α-фазу при 400 °С. [3]
Фторид циркония(IV) образует несколько гидратов. Тригидрат имеет структуру (μ-F) 2 [ZrF 3 (H 20 ) 3 ] 2 . [4]
Препарат и реакции
[ редактировать ]Фторид циркония можно получить несколькими способами. Диоксид циркония реагирует с фтористым водородом и плавиковой кислотой с образованием безводных и моногидратов:
- ZrO 2 + 4 HF → ZrF 4 + 2 H 2 O
Реакция металлического Zr при высоких температурах реагирует также с HF:
- Zr + 4 HF → ZrF 4 + 2 H 2
Диоксид циркония реагирует при 200 °C с твердым бифторидом аммония с образованием соли гептафторцирконата, которую можно превратить в тетрафторид при 500 °C:
- 2ZrO 2 + 7 (NH 4 )HF 2 → 2 (NH 4 ) 3 ZrF 7 + 4 H 2 O + NH 3
- (NH 4 ) 3 ZrF 7 → ZrF 4 + 3 HF + 3 NH 3
При добавлении плавиковой кислоты к растворам нитрата циркония выделяется твердый моногидрат. Гидраты тетрафторида циркония можно обезвоживать нагреванием в токе фтористого водорода.
Фторид циркония можно очистить дистилляцией или сублимацией . [2]
Фторид циркония образует двойные соли с другими фторидами . Наиболее известным является гексафторциронат калия, образующийся при сплавлении фторида калия и тетрафторида циркония: [5]
- ZrF 4 + 2 КФ → К 2 ZrF 6
Приложения
[ редактировать ]Основное и, возможно, единственное коммерческое применение фторида циркония — это предшественник стекол ZBLAN. [2]
смесь фторида натрия, фторида циркония и тетрафторида урана использовалась В качестве теплоносителя в эксперименте с авиационным реактором (53-41-6 мол.%) . смесь фторида лития , фторида бериллия , фторида циркония и тетрафторида урана-233 использовалась В эксперименте с реактором на расплавленной соли . ( Уран-233 используется в реакторах ториевого топливного цикла .) [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ «Соединения циркония (как Zr)» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б с Нильсен, Ральф (2000). «Цирконий и соединения циркония». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a28_543 . ISBN 3527306730 .
- ^ Пол Л. Браун; Федерико Дж. Момпеан; Джейн Перроне; Мириам Ильмассен (2005). Химическая термодинамика циркония . Профессиональное издательство Персидского залива. п. 144. ИСБН 0-444-51803-7 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 965. ИСБН 978-0-08-037941-8 .
- ^ Мешри, Даял Т. (2000), «Соединения фтора неорганические, титан», Энциклопедия химической технологии Кирка-Отмера , Нью-Йорк: Джон Уайли, номер документа : 10.1002/0471238961.2009200113051908.a01 , ISBN 9780471238966
- ORNL/TM-2006/12 Оценка потенциальных теплоносителей на основе расплавленных солей для усовершенствованного высокотемпературного реактора (AHTR), март 2006 г. (по состоянию на 18 сентября 2008 г.)