Эукариотический перевод
Эукариотическая трансляция - это биологический процесс, с помощью которого мессенджера транслируется РНК в белки у эукариот . Он состоит из четырех этапов: инициация, удлинение, прекращение и повторение.
Инициация
[ редактировать ]
Инициирование трансляции - это процесс, с помощью которого рибосома и связанные с ней факторы связываются с мРНК и собираются в начальном кодоне. Этот процесс определяется как либо CAP-зависимый, в котором рибосома изначально связывается в 5-дюймовой колпачке, а затем перемещается к стоп-кодону или как независимый от CAP, где рибосома изначально не связывает 5-'крышку.
CAP-зависимое начало
[ редактировать ]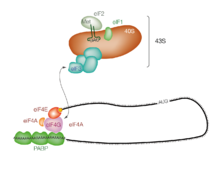
Инициирование трансляции обычно включает взаимодействие определенных ключевых белков, факторы инициации , со специальной меткой, связанной с 5'-конец молекулы мРНК, 5 'CAP , а также с 5' UTR . Эти белки связывают небольшую (40 -е) рибосомную субъединицу и удерживают мРНК на месте. [ 1 ]
EIF3 связан с рибосомальной субъединицей 40 -х годов и играет роль в предотвращении преждевременной субъединицы от преждевременного связывания. EIF3 также взаимодействует с комплексом EIF4F , который состоит из трех других факторов инициации: EIF4A , EIF4E и EIF4G . EIF4G - это белок каркасов, который напрямую ассоциируется как с EIF3, так и с двумя другими компонентами. EIF4E -это кеп-связывающий белок. Связывание CAP с помощью EIF4E часто считается ограничивающей скоростью стадией CAP-зависимой инициации, а концентрация EIF4E является регуляторной связью трансляционного контроля. Некоторые вирусы расщепляют часть eIF4G, которая связывает eIF4E, таким образом предотвращая перевод, зависимый от CAP, чтобы захватить хост-механизм в пользу вирусных (независимых) сообщений. EIF4A является АТФ-зависимой РНК-геликазой, которая помогает рибосоме, разрешая определенные вторичные структуры, образующиеся вдоль транскрипта мРНК. [ 2 ] Поли (A) -связывающий белок (PABP) также ассоциируется с комплексом EIF4F через eIF4G и связывает поли-а-хвост большинства эукариотических молекул мРНК. Этот белок участвует в том, чтобы играть роль в циркулялизации мРНК во время трансляции. [ 3 ]
Этот предварительный комплекс 43S (43S PIC), сопровождаемый белковыми факторами, движется вдоль цепи мРНК в направлении его 3'-конца, в процессе, известном как «сканирование», чтобы достичь стартового кодона (обычно август). У эукариот и археи , аминокислот кодируемая стартовым кодоном, является метионином . Met-заряженная инициатор тРНК (Met-Trna I Из ) доставляется на P-сайт небольшой рибосомной субъединицы с помощью эукариотического фактора инициации 2 (EIF2) . Он гидролизует GTP и сигнализирует о диссоциации нескольких факторов из небольшой рибосомальной субъединицы, в конечном итоге приводит к ассоциации большой субъединицы (или субъединицы 60 -х годов ). Полная рибосома ( 80 -е годы ) затем начинает удлинение перевода.
Регуляция синтеза белка частично влияет фосфорилирование EIF2 (через α-субъединицу), которая является частью EIF2-GTP-MET-TRNA I Из тройной комплекс (EIF2-TC). Когда большое количество EIF2 фосфорилируется, синтез белка ингибируется. Это происходит при аминокислотном голодке или после вирусной инфекции. Однако небольшая часть этого фактора инициации естественным образом фосфорилируется. Другим регулятором является 4EBP , который связывается с коэффициентом инициации eIF4E и ингибирует его взаимодействия с EIF4G , что предотвращает зависимое от CAP инициацию. Чтобы противостоять влиянию 4EBP, факторов роста фосфорилирует 4EBP, снижая его сродство к EIF4E и разрешает синтез белка. [ Цитация необходима ]
В то время как синтез белка глобально регулируется путем модуляции экспрессии ключевых факторов инициации, а также количества рибосом, отдельные мРНК могут иметь разные скорости трансляции из -за наличия элементов регуляторной последовательности. Было показано, что это важно в различных условиях, включая дрожжевой мейоз и этиленовый ответ у растений. Кроме того, недавняя работа в дрожжах и людях предполагает, что эволюционная дивергенция в цис-регуляторных последовательностях может влиять на регуляцию трансляции. [ 4 ] Кроме того, РНК -геликазы , такие как DHX29 и DED1/DDX3, могут участвовать в процессе инициации трансляции, особенно для мРНК со структурированными 5'UTR. [ 5 ]
CAP-независимое начало
[ редактировать ]Наиболее изученный пример инициации трансляции, независимого от CAP, у эукариот использует внутренний сайт входа в рибосому (IRES). В отличие от CAP-зависимого трансляции, независимый от CAP трансляция не требует 5-дюймовой крышки для инициирования сканирования с 5-дюймового конца мРНК до начального кодона. Рибосома может локализоваться в начальном месте путем прямого связывания, факторов инициации и/или ITAF (IRES Trans-Cacting Factors), обходящих необходимость сканирования всего 5 'UTR . Этот метод трансляции важен в условиях, которые требуют трансляции специфических мРНК во время клеточного стресса, когда общая трансляция снижается. Примеры включают факторы, реагирующие на апоптоз и вызванные стрессом ответы. [ 6 ]
Удлинение
[ редактировать ]
Удлинение зависит от факторов эукариотической удлинения . В конце стадии инициации мРНК расположена так, чтобы следующий кодон мог быть переведен на стадии удлинения синтеза белка. Инициатор тРНК занимает P-сайт P в рибосоме , а сайт A готов получить аминоацил-тРНК. Во время удлинения цепи каждая дополнительная аминокислота добавляется в зарождающуюся полипептидную цепь в трехступенчатом микроцикле. Шаги в этом микроцикле заключаются в (1) позиционировании правильной аминоацил-тРНК в сайте рибосомы, который вносится в этот сайт с помощью EEF1, (2) образуя пептидную связь и (3) смещение мРНК одним кодоном относительно рибосомы с помощью EEF2. конец мРНК В отличие от бактерий, в которых инициирование трансляции происходит, как только синтезируется 5 -дюймовый и цитоплазма ). Предшественники эукариотической мРНК должны обрабатывать в ядре (например, утилизация, полиаденилирование , сплайсинг) в рибосомах до того, как они будут экспортированы в цитоплазму для трансляции. На трансляция также может быть затронута рибосомальная пауза , которая может вызвать эндонуклеолитическую атаку тРНК, процесс, называемый распадом мРНК. Рибосомальная пауза также помогает совместному трансляционному складыванию зарождающегося полипептида на рибосоме и задерживает трансляцию белка, пока он кодирует тРНК. Это может вызвать рибосомальное рамение. [ 7 ]
Завершение
[ редактировать ]Прекращение удлинения зависит от эукариотических факторов высвобождения . Процесс аналогичен процессу бактериального прекращения , но в отличие от бактериального прекращения, существует универсальный фактор высвобождения , ERF1, который распознает все три стоп -кодоны. После прекращения рибосома разобрана, а завершенный полипептид высвобождается. ERF3-это рибосома-зависимая GTPase, которая помогает ERF1 высвободить завершенный полипептид. Человеческий геном кодирует несколько генов, чьи мРНК останавливают кодон, на удивление протекают: в этих генах прекращение трансляции неэффективно из -за особых оснований РНК в непосредственной близости от стоп -кодона. Утечка в этих генах приводит к трансляционному чтению до 10% от стоп -кодонов этих генов. Некоторые из этих генов кодируют функциональные белковые домены в их разгибании чтения, чтобы могут возникнуть новые изоформы белка . Этот процесс был назван «Функциональным трансляционным чтением». [ 8 ]
Регулирование и модификация перевода
[ редактировать ]Перевод является одним из ключевых потребителей энергии в клетках, следовательно, он строго регулируется. Многочисленные механизмы развили, которые контролировали и регулируют трансляцию у эукариот , а также прокариоты . Регуляция трансляции может влиять на глобальную скорость синтеза белка, которая тесно связана с метаболическим и пролиферативным состоянием клетки. Чтобы углубиться в этот сложный процесс, ученые обычно используют технику, известную как профилирование рибосом. [ 9 ] Этот метод позволяет исследователям сделать снимок трансфера, показывая, какие части мРНК переводятся в белки рибосомами в определенное время. Профилирование рибосом дает ценную информацию о динамике трансляции, выявляя сложное взаимодействие между последовательности генов, структурой мРНК и регуляцией трансляции. Расширяя эту концепцию, более поздняя разработка-профилирование рибосом с одной ячейкой, метод, который позволяет нам изучать процесс трансляции при разрешении отдельных клеток. [ 10 ] Профилирование одноклеточных рибосом может пролить свет на гетерогенную природу клеток, что приводит к более нюансированному пониманию того, как регуляция трансляции может влиять на поведение клеток, метаболическое состояние и отзывчивость к различным стимулам или условиям.
Аминокислотная замена
[ редактировать ]В некоторых клетках некоторые аминокислоты могут быть истощены и, таким образом, влияют на эффективность трансляции. Например, активированные Т-клетки секретируют интерферон-γ , который запускает нехватку внутриклеточного триптофана, активизируя фермент индоаминовой 2,3-диоксигеназы 1 (IDO1). Удивительно, но, несмотря на истощение триптофана , синтез белка в рамке продолжается через триптофанские кодоны . Это достигается за счет включения фенилаланина вместо триптофана. Полученные пептиды называются w> f "заместителями". Такие заместители W> F в изобилии в определенных типах рака и были связаны с повышенной экспрессией IDO1. Функционально, w> f заместители могут нарушать активность белка . [ 11 ]
Смотрите также
[ редактировать ]- 40 -е годы
- 60 -е годы
- 80 -е годы
- Эукариотический коэффициент инициации
- Эукариотические факторы удлинения
- Эукариотические факторы высвобождения
Ссылки
[ редактировать ]- ^ Malys N, McCarthy JE (март 2011 г.). «Инициирование перевода: вариации в механизме можно ожидать» . Клеточные и молекулярные науки о жизни . 68 (6): 991–1003. doi : 10.1007/s00018-010-0588-z . PMC 11115079 . PMID 21076851 . S2CID 31720000 .
- ^ Hellen Cu, Sarnow P (июль 2001 г.). «Внутренние сайты ввода рибосом в эукариотических молекулах мРНК» . Гены и развитие . 15 (13): 1593–612. doi : 10.1101/gad.891101 . PMID 11445534 .
- ^ Wells SE, Hillner PE, Vale Rd, Sachs AB (июль 1998 г.). «Циркулялизация мРНК с помощью эукариотических факторов инициации трансляции» . Молекулярная клетка . 2 (1): 135–40. doi : 10.1016/s1097-2765 (00) 80122-7 . PMID 9702200 .
- ^ Cenik C, Cenik ES, Byeon GW, Grubert F, Candille SI, Spacek D, Alcallakh B, Tilgner H, Araya CL, Tang H, Ricci E, Snyder MP (ноябрь 2015 г.). «Интегративный анализ уровней РНК, трансляции и белка выявляет различные регуляторные изменения среди людей» . Исследование генома . 25 (11): 1610–21. doi : 10.1101/gr.193342.115 . PMC 4617958 . PMID 26297486 .
- ^ Fireva VP, Comrace CU, PV TV (декабрь 2008 г.). «Инициирование трансляции на мРНК млекопитающих со структурированными 5'UTR требует белка DEXH-бокса DHX29» . Смеситель 135 (7): 1237–50. doi : 10.1016/j.cell . PMC 2948571 . PMID 19109895 .
- ^ Лопес-Ластра М., Ривас А., Бараря М.И. (2005). «Синтез белка у эукариот: растущая биологическая значимость инициации трансляции, независимой от CAP» . Биологические исследования . 38 (2–3): 121–46. doi : 10.4067/s0716-97602005000200003 . PMID 16238092 .
- ^ Бьюкен -младший, Стэнсфилд I (сентябрь 2007 г.). «Остановка клеточной линии производства: ответы на рибосомальную паузу во время перевода» . Биология клетки . 99 (9): 475–87. doi : 10.1042/bc20070037 . PMID 17696878 .
- ^ Schueren F, Thoms S (август 2016 г.). «Функциональное трансляционное чтение: перспектива биологии системной биологии» . PLOS Genetics . 12 (8): E1006196. doi : 10.1371/journal.pgen.1006196 . PMC 4973966 . PMID 27490485 .
- ^ Инголия Н.Т., Гаммагхами С., Ньюман -младший, Вайсман Дж.С. (апрель 2009 г.). «Анализ по всему геному in vivo трансляции с разрешением нуклеотидов с использованием профилирования рибосом» . Наука . 324 (5924): 218–23. Bibcode : 2009sci ... 324..218i . doi : 10.1126/science.1168978 . PMC 2746483 . PMID 19213877 .
- ^ Озадам Х, Тонн Т, Хан С.М., Сегура А., Хоскинс И., Рао С; и др. (2023). «Одноклеточная количественная оценка занятости рибосом в раннем развитии мыши» . Природа . 618 (7967): 1057–1064. doi : 10.1038/s41586-023-06228-9 . PMC 10307641 . PMID 37344592 .
{{cite journal}}: Cs1 maint: несколько имен: список авторов ( ссылка ) - ^ Патаскар, Абхихет; Шампанское, Жюльен; Нагель, Ремко; Кенски, Джулиана; Лаос, Маарджа; Михаук, Джастин; Пак, Хуэй Сонг; Bleijerveld, Onno B.; Мортенте, Келли; Наварро, Жасмин Черногория; БЛОМАЕРТ, Наоми (2022-03-24). «Истощение триптофана приводит к заместителям триптофана к фенилаланинам» . Природа . 603 (7902): 721–727. doi : 10.1038/s41586-022-04499-2 . ISSN 0028-0836 . PMC 8942854 . PMID 35264796 .