Phycodnaviridae
| Phycodnaviridae | |
|---|---|
| Классификация вирусов | |
| (не вмешательство): | Вирус |
| Область : | Varidnaviria |
| Королевство: | Bamfordvirae |
| Филум: | Нуклеоцитовирикота |
| Сорт: | Мегавирицеты |
| Заказ: | Водоросль |
| Семья: | Phycodnaviridae |
| Роды | |
Phycodnaviridae -это семейство крупных (100–560 т.п.н.) двухцепочечных ДНК-вирусов , которые заражают морские или пресноводные эукариотические водоросли . Вирусы в этом семействе имеют аналогичную морфологию с икосаэдрическим капсидом (многогранник с 20 гранями). По состоянию на 2014 год в этом семействе было 33 вида, разделенных между 6 родами. [ 1 ] [ 2 ] Это семейство принадлежит супергруппам крупных вирусов, известных как нуклеоцитоплазматические вирусы крупных ДНК . В 2014 году были опубликованы доказательства, свидетельствующие о том, что конкретные штаммы Phycodviridae могут заразить людей, а не только виды водорослей, как это было ранее. [ 3 ] Большинство родов в этом семействе попадают в клетку -хозяина путем эндоцитоза клеточного рецептора и реплицируются в ядре. Phycodnaviridae играют важные экологические роли, регулируя рост и продуктивность своих хозяев водорослей. Виды водорослей, такие как гетерозигма Акашиво и род Chrysochromulina могут образовывать плотные цветы, которые могут нанести ущерб рыболовству, что приводит к потерям в аквакультурной промышленности. [ 4 ] Гетерозигма акасиво (HAV) был предложен для использования в качестве микробного агента для предотвращения рецидива токсичных красных приливов, продуцируемых этими видами водорослей. [ 5 ] Phycodnaviridae вызывают гибель и лизис пресноводных и морских водорослей, освобождая органический углерод, азот и фосфор в воду, обеспечивая питательные вещества для микробной петли. [ 6 ]
Таксономия
[ редактировать ]Группа: двухцепочечная ДНК
Таксономия этого семейства первоначально основывалась на диапазоне хозяев: хлорвирусы заражают зеленые водоросли, похожие на хлорэллу, из пресноводных вод; Принимая во внимание, что члены остальных пяти родов заражают морские микроводоросли и некоторые виды коричневых макроволок. Впоследствии это было подтверждено анализом их ДНК-полимераз B-семейства B, которые указывали на то, что члены Phycodnaviridae более тесно связаны друг с другом по сравнению с другими вирусами ДНК с двойными больными, образуя монофилетическую группу. [ 7 ] [ 8 ] [ 9 ] Фикоднавирусы содержат шесть родов: кокколитовирус , хлорвирус , феовирус , прасиновирус , придмнеовирус и рафидовирус . Роды можно отличить друг от друга, например, различия в жизненном цикле и содержании генов. [ 8 ]
Структура
[ редактировать ]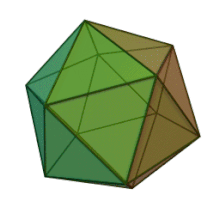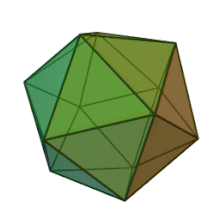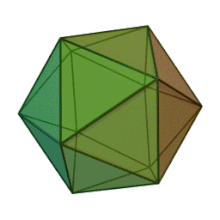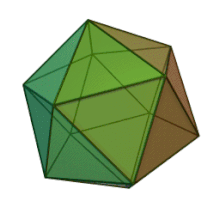
Все шесть родов в семействе Phycodnaviridae имеют сходную структуру вириона и морфологию. Это большие вирионы, которые могут варьироваться от 100 до 220 нм в диаметре. Они имеют двухцепочечный геном ДНК и белковое ядро, окруженное липидным бислой, и икосаэдрическим капсидом. [ 10 ] Капсид имеет 2, 3 и 5 -кратную ось симметрии с 20 равенными треугольными лицами, составляющими белковые субъединицы. У всех известных членов Phycodnaviridae капсид состоит из упорядоченных субструктур с 20 трисамметронами и 12 пентасимметронами, состоящими из тримерных капсомеров в форме пончиков, где каждый капсомер состоит из трех мономеров основного капсидного белка. Если все тримерические капсомеры идентичны по структуре, вирион капсид содержит 5040 копий основного капсидного белка в общей сложности с триангуляционным числом 169. При пятикратных вершин существует 12 пентамеров-каппомеров состоит из различных белков. Белок (ы), который можно найти ниже осевого канала каждого пентамера, может быть ответственным за переваривание клеточной стенки хозяина во время вирусной инфекции. Вид вируса Phaeocystis puchetii из рода Prymnesiovirus имеет самую большую капсидную структуру в семействе Phycodviridae . [ 11 ]
Липидная бислоя мембрана у фикоднавирусов не совсем понятна и не исследована. Некоторые исследования показали, что мембрана происходит из эндоплазматической ретикулумы, а также может быть непосредственно получена из клеточной мембраны хозяина во время вирусной сборки. Хотя члены семейства Phycodnaviridae очень разнообразны, они имеют очень консервативные гены, связанные с морфологией или структурой вириона. [ Цитация необходима ] Несмотря на сходство капсидной структуры фикоднавирусов, недавние эксперименты выявили морфологические различия среди членов в этом семействе. Эмилиана Хакслий Вирус 86 (EHV-86), штамм кокколитовируса, отличается от его аналогов вируса водорослей тем, что его капсид охвачен липидной мембраной. [ 12 ] Кроме того, недавние эксперименты по реконструкции 3D показали, что вирус хлореллы PBCV-1 имеет цилиндрический всплеск длиной 250A, простирающийся от одной из его вершин. EHV-86 также может обладать резкой или хвостовой структурой. [ 13 ]
Геном
[ редактировать ]Фикоднавирусы известны своими большими двухцепочечными геномами ДНК в диапазоне от 100 КБ до более чем 550 КБ с содержанием 40% до 50% GC. [ 8 ] В настоящее время для нескольких членов семейства Phycodnaviridae доступны полные последовательности генома (включая шесть хлорвирусов, два фейвируса, несколько празиновирусов и кокколитовирус), а также есть некоторые частичные последовательности, доступные для другого кокколитовируса. [ 14 ] [ 15 ] [ 16 ] [ 17 ]
Геномные структуры фикоднавирусов имеют значительные различия. Хлоровирус PBCV-1 имеет линейный геном 330 т.п.н. с неподходящим двухцепочечной ДНК, который ковалентно закрыт терминами шпильки. Точно так же фейвирус ESV-1 имеет линейный двухцепочечный геном ДНК с инвертированными повторами, которые имеют почти идеальную гомологию. Эти перевернутые повторения могут способствовать эффективной циркулязации генома, и в течение определенного периода времени подозревается, что ESV-1 имеет круговой геном. [ 15 ] Предполагается, что кокколитовирус EHV-86 имеет как линейные, так и круглые геномы на разных фазах во время упаковки ДНК. Амплификация ПЦР выявляет случайные свесы A/T, обнаружение ДНК -лигаз и эндонуклеазы, намекающие на то, что линейный геном может быть упакован и круглый во время репликации ДНК. [ 16 ] [ 18 ] Фикоднавирусы имеют компактные геномы для эффективности репликации с приблизительно одним геном на 900-1000 п.н. последовательностей генома. [ 16 ] Фейвирус ESV-1 является исключением с 231 кодирующим геном белка, что означает, что он имеет один ген на приблизительно 1450 п.н. Несмотря на компактные геномы, обычно обнаруживаемые в вирусах, геномы Phycodnaviridae имеют повторяющиеся области, обычно вблизи терминальных целей и некоторые тандемные повторения, расположенные по всему геному. Предполагается, что эти повторяющиеся последовательности могут играть роль в рекомбинации генов, которая позволяет вирусу обмениваться генетической информацией с другими вирусами или клеткой -хозяином. [ 19 ]
Филогения
[ редактировать ]![Эволюционная история была выведена с использованием метода максимального правдоподобия на основе модели на основе матрицы JTT [1]. Дерево консенсуса начальной загрузки, выведенное из 100 повторов, принимается для представления эволюционной истории проанализированного таксонов. Ветви, соответствующие разделам, воспроизводимые менее чем в 50% репликациях начальной загрузки, обрушиваются. Процент повторяющихся деревьев, в которых связанные таксоны сгруппировались вместе в тесте начальной загрузки (100 повторностей), показаны размером красного узла на каждом Брахе. Первоначальное дерево (ы) для эвристического поиска были получены автоматически путем применения алгоритмов соседства и бионжа к матрице парных расстояний, оцененных с использованием модели JTT, а затем выбрать топологию с превосходным значением правдоподобия логарифма. Анализ включал 26 аминокислотных последовательностей. В окончательном наборе данных было в общей сложности 2599 позиций. Эволюционный анализ проводился в MEGA7.](http://upload.wikimedia.org/wikipedia/commons/thumb/4/48/Molecular_Phylogenetic_analysis_of_NCLDV_members_by_Maximum_Likelihood_method.png/274px-Molecular_Phylogenetic_analysis_of_NCLDV_members_by_Maximum_Likelihood_method.png)
Вирусы, принадлежащие к Phycodnaviridae двумцепочечным геномам ДНК , с размерами нескольких 100 кбит, которые вместе с другими мегавиралами (EG Iridoviridae , Pandoraviridae и Mimiviridae ) называются нуклеоцитоплазматическими вирусами крупных ДНК . Из -за их больших размеров генома и различных белков, которые кодируются, вирусы Phycodnaviridae бросают вызов традиционным концепциям, что вирусы являются небольшими и простыми «организмами на краю жизни». Филогенетический анализ основных генов на основе конкатенации генов, [ 21 ] индивидуальные филогения ДНК -полимеразы, [ 22 ] и основной капсидный белок, [ 23 ] Укажите тесные эволюционные отношения между членами Phycodnaviridae , а также между Phycodnaviridae и другими семействами нуклеоцитоплазматических вирусов крупных ДНК.
Жизненный цикл
[ редактировать ]| Род | Детали хоста | Ткань тропизм | Детали записи | Выпустить детали | Сайт репликации | Сайт сборки | Передача инфекции |
|---|---|---|---|---|---|---|---|
| Рафидовирус [ 24 ] | Водоросль | Никто | Эндоцитоз клеточного рецептора | Лизис | Ядро | Цитоплазма | Пассивная диффузия |
| Кокколитовирус | Водоросль | Никто | Эндоцитоз клеточного рецептора | Подаящее начало | Ядро | Цитоплазма | Пассивная диффузия |
| Феовирус | Водоросль | Никто | Эндоцитоз клеточного рецептора | Лизис | Ядро | Цитоплазма | Пассивная диффузия |
| Хлоровирус | Водоросль | Никто | Эндоцитоз клеточного рецептора | Лизис | Ядро | Цитоплазма | Неизвестный |
| Примнеовирус | Водоросль | Никто | Эндоцитоз клеточного рецептора | Лизис | Ядро | Цитоплазма | Пассивная диффузия |
| Празиновирус | Водоросль | Никто | Эндоцитоз клеточного рецептора | Лизис и подаяние | Ядро | Цитоплазма | Пассивная диффузия |
Рафидовирус
[ редактировать ]В рафидовирусе (вероятно, что раскололся рафидовирус ), существует только один вид, гетерозигма акасиво (HAV), который заражает одноклеточную водоросли, гетерозигма Акашиво . H. Akashiwo является членом класса Raphidophyceae , цветущего вида, и широко распространен в умеренных и неритовых водах. [ 21 ] Несколько других типов вирусов, заражающих H. akashiwo, были изолированы и не должны путать с HAV, такими как H. akashiwo РНК -вирус (Harnav). [ 25 ] и H. akashiwo ядерный вирус включения (Haniv). [ 26 ] [ 4 ] Поскольку HAV был первым изолирован и охарактеризован в 1997 году, [ 4 ] Информация о жизненном цикле ограничена.
HAV специально заражает H. akashiwo и не заражает другие испытанные морские виды фитопланктона . [ 4 ] Механизмы, определяющие специфичность вируса хоста, не совсем понятны. Tomaru et al. (2008) [ 4 ] предположить, что специфичность вируса-хоста может быть вызвана уникальным взаимодействием между вирусным лигандом и рецептором хозяина. В исследовании Nagaski et al. Вирусные частицы были обнаружены внутри цитоплазмы хозяина через 24 часа после заражения. Латентный период или лизогенный цикл был оценен в 30–33 ч со средним размером взрыва (количество вирусов, полученных после лизиса) 770 на клетку. Частицы вируса были обнаружены в подповерхностной области и в вироплазмы области [ 5 ]
Кокколитовирус
[ редактировать ]
В 2009 году Mackinder et al. выяснил механизм входа родов кокколитовирус . [ 12 ] Используя конфокальную и электронную микроскопию , исследователи продемонстрировали, что вирусный штамм EHV-86 использует уникальный механизм инфекции, который отличается от других вирусов водорослей и демонстрирует большее сходство с стратегиями входа и выхода, наблюдаемых в животных, похожих на нуклеоцитоплазматические двойные двойные, страстные ДНК. Вирусы (нуклеоцитоплазматические крупные ДНК -вирусы). EHV-86 отличается от своих коллег из водорослей тем, что его капсид охвачен липидной мембраной. EHV-86 входит в клетки путем эндоцитоза (процесс, посредством которого пищевые или жидкие частицы попадают в клетку пузырьком) или прямого слияния (вирусная оболочка сливается с мембраной хозяина). Вход EHV-86 с помощью эндоцитоза приводит к дополнительному мембранному слою, окружающему капсид-инкапсулированный геном. Независимо от механизма входа, капсид входит в цитоплазму нетронутой. После входа в клетку вирусная капсида разбирается и ДНК высвобождается в цитоплазму хозяина или непосредственно в ядро. EHV-86 уникален для других фикоднавирусов, поскольку он кодирует шесть субъединиц РНК-полимеразы. Ни PBCV-1, ни ESV-1, например, кодируют компоненты РНК-полимеразы. [ 8 ] Гены вирусной РНК -полимеразы не транскрибируются не менее чем через 2 часа после заражения (PI). При 3–4 PI вирионы собираются в цитоплазме с помощью АТФазы (белок упаковки ДНК) и транспортируются в плазматическую мембрану, где они высвобождаются от хозяина с помощью начинающего механизма. В этом начинающем механизме EHV-86 получает внешнюю мембрану от мембраны хозяина. [ 12 ] Размер взрыва варьируется от 400 до 1000 частиц на ячейку. [ 8 ]
Кластер сфинголипидов генов был идентифицирован в EHV -86. Исследователи обнаружили, что производство вирусных сфинголипидов, продуцируемых во время литической стадии, участвует в запрограммированной гибели клеток в популяциях кокколитофора. Была обнаружена высокая корреляция между выработкой гликосфинголипидов (GSL) и каспазной активностью во время литической стадии в инфицированных клетках. Каспазы представляют собой семейство протеазы, участвующие в запрограммированной гибели клеток. Исследователи также обнаружили, что для инициации критической концентрации GSL (> 0,06 мг/мл) необходима для инициирования лизиса клеток. Таким образом, авторы предполагают, что производство GSL для критической концентрации может быть частью механизма синхронизации литического цикла. Авторы также предполагают, что эти биомолекулы могут быть способны индуцировать запрограммированную гибель клеток в других незатронутых клетках, тем самым служив в качестве сигнала прекращения цветущего водоросля. [ 27 ]
Феовирус
[ редактировать ]Кокколитовирусы и фейвирусы были описаны как имеющие противоположные жизненные стратегии. Кокколитовирус обладает стратегией острой жизненной стратегии, характеризующейся высокими показателями воспроизводства и мутаций и большей зависимостью от плотных популяций хозяина для передачи. Фейовирусы обладают стратегией постоянной жизненной стратегии, в которой инфекция может вызвать или не вызывать заболевания, а геном передается от родителя к потомству. [ 28 ]
Феовирусы заражают эктокарпал -коричневые водоросли, которые представляют собой порядок нитевидных коричневых водорослей. Одним из наиболее изученных фейвирусов является вирус эктокарпуса силикулозуса , чаще всего известный как ESV-1. [ 28 ] Вирус ESV-1 заражает только одноклеточные гаметы или споры E. siliculosus . Вегетативные клетки невосприимчивы к инфекции, поскольку они защищены жесткой клеточной стенкой. [ 29 ] После инфекции одна копия вирусной ДНК включена в геном хозяина. Затем воспроизводится вирусный геном ESV-1, а вирионы собираются в спорангии или гаметангии инфицированных растений. [ 30 ] Впоследствии вирусы высвобождаются посредством лизиса репродуктивных клеток, стимулируемых изменениями в условиях окружающей среды, такими как повышение температуры. [ 31 ] У здоровых растений экологические стимулы синхронизируют высвобождение гаметов и зооспоров в окружающую воду. [ 31 ] Затем частицы свободного вируса могут повторно зарабатывать свободные гаметы или споры здоровых растений. Инфицированные гаметы или споры подвергаются митозу, образуя инфицированные растения, а все клетки растения потомства содержат вирусную ДНК. Однако вирусные частицы продуцируются только в репродуктивных клетках водорослей, в то время как вирусы остаются скрытыми в вегетативных клетках. У инфицированных спорофитов клетки подвергаются мейозу и продуцируют гаплоидные споры. Геном ESV передается в мендель, где половина потомства содержит вирусную ДНК. Часто водоросли из инфицированных споров неотличимы от водорослей, полученных из здоровых споров, но частично или полностью неспособны к размножению. [ 29 ] [ 30 ]
Хлоровирус
[ редактировать ]Хлоровирусы являются единственными вирусами, характеризующимися до сих пор, которые заражают пресноводные водоросли. [ 32 ] Хозяевах хлорвирусов представляют собой зоохлорллы, которые представляют собой эндосимбиотические зеленые водоросли, обычно связанные с хозяевами Paramecium bursaria , Coeleterate Hydra viridis или глиозооанской акантоцистской турфои . [ 33 ] в ресничной байсарии Например , водоросли живет в клетках хозяина, обеспечивая питательные вещества с помощью фотосинтеза. Жизнь внутри клеток ресничной системы обеспечивает защиту водорослей и способ транспортировки. Зоохлорллы устойчивы к инфекции в их симбиотическом состоянии. Когда взаимосвязь между водорослями и хозяином нарушается, например, путем выпаса с целобочин, инфекция хлорвирусами разрешена. [ 34 ]
Жизненный цикл хлорвируса, заражающего Paramecium bursaria , известный как PBCV-1, был подробно изучен [ Цитация необходима ] Полем Криоэлектронная микроскопия и 3D реконструкция вирусного капсида показывают, что существует длинная структура «всплеска», которая сначала контактирует со клеточной стенкой и, вероятно, служит для прокола клеточной стенки хозяина. Вирус PBCV-1 специфичен для его хозяина, а распознавание опосредовано взаимодействием поверхностных вирусных белков с углеводами поверхности водорослей. После прикрепления вируса к клеточной стенке хозяина гликолитические ферменты, связанные с капсидом, разрушают клеточную стенку. Вирусная мембрана, вероятно, сливается с мембраной хозяина, позволяя вирусной ДНК входить в цитоплазму, оставляя пустой капсид снаружи. Поскольку PBCV-1 не имеет гена РНК-полимеразы, вирус должен использовать механизм клеток-хозяина для получения вирусной РНК. Таким образом, вирусная ДНК быстро перемещается в ядро, где ранняя транскрипция инициируется через 5–10 минут после заражения. В течение нескольких минут после инфекции происходит хромосомная деградация хозяина, ингибируя транскрипцию хозяина. Через 20 минут после заражения большая часть мРНК в инфицированных клетках представляют собой вирусные мРНК. Белки, переведенные с ранней стадии транскрипции, участвуют в инициировании репликации вирусной ДНК, происходящей через 60–90 минут после заражения. Вторая фаза белков транслируется в цитоплазме, а сборка вирусных капсидов начинается примерно через 2–3 часа после инфекции. Зрелые вирионы образуются с добавлением вновь реплицированной вирусной ДНК из ядра хозяина, вероятно, облегченного вирусом, кодируемой ДНК -упаковкой АТФазы. Примерно через 5–6 часов после инфекции PBCV-1 цитоплазма заполняется вирионами, и лизис происходит через 6–8 часов после выпуска инфекции, выпуская примерно 1000 частиц на клетку. [ 32 ] [ 35 ]
Примнеовирус
[ редактировать ]Род Prymnesiovirus в настоящее время содержит только один вид, известный как вирус Chrysochromulina brevifilum pw1 (CBV-PW1). CBV-PW1 заражает два вида морского фитопланктона, Chrysochromulina brevifilum и C. strobilus , принадлежащих к роду Chrysochromulina . [ 36 ] [ 37 ] Согласно базе данных водорослей, в настоящее время в роде насчитывается 63 названия морских и пресноводных видов, из которых 48 признаны таксономически приемлемыми именами. [ 38 ] Chrysochromulina является особенно важным родом, поскольку он может содержать более 50% фотосинтетических нанопланктонных клеток в океане. [ 36 ]
Мало что известно о жизненном цикле вируса, заражающего эти плактонные планктонные виды, хрисохромулину Brevifilum и C. strobilus . Саттл и Чан (1995) были первыми, кто изолировал вирусы, которые заражают приоритеты или гаптофиты. В этом исследовании ультратонкие срезы вирусов в чирсохромулине Brevifilum были подготовлены и просмотрены с использованием просвечивающей электронной микроскопии. [ 36 ] Электронные микрофотографии на ранней стадии инфекции позволяют предположить, что репликация вируса происходит в цитоплазме в вироплазме . Вироплазма - это локализованная область в цитоплазме или вокруг ядра клетки, которое служит «фабрикой репликации вируса». Вироплазма содержит такие компоненты, как генетический материал вируса, белки -хозяев и рибосомы, необходимые для репликации. Виросомы часто окружают мембрану; Было обнаружено, что мембрана, окружающая виросому, содержащуюся в инфицированных клетках в исследовании, состоят из фибриллярной матрицы. [ 36 ] Вирионы высвобождаются из инфицированных клеток после нарушения органеллов и лизиса клеточной мембраны хозяина. Саттл и Чан (1995) посчитали более 320 вирусов в ультрафийном срезе инфекционной клетки. [ 36 ] Оценки размеров взрыва варьируются от 320 до 600 вирусов на клетку. [ 39 ]
Празиновирус
[ редактировать ]Члены рода Prasinovirus заражают мелкие одноклеточные зеленые водоросли в порядке Mamiellales , обычно встречающихся в прибрежных морских водах. [ 40 ] Видом рода прасиновирус является вирус Pusilla MicroMonas SP1 (MPV-SP1), [ 41 ] который был выделен из образца воды, собранного от Сан -Диего. [ 42 ] Prasinovirus mpv-sp1 заражает микромонас pusilla , которая является доминирующей фотосинтетическим морским пикуикариотом. [ 43 ] и который заражает MicroMonas pusilla (Utex 991, Plymouth 27). Общие хозяева празиновирусов включают членов из рода Ostreococcus и Micromonas . Три потенциальных вида Ostreococcus были идентифицированы и различаются в зависимости от их легких требований. [ 44 ] Один из наиболее широко изученных празиновирусов, штамма OTV5, чей геном полностью секвенирует инфекции Ostreococcus tauri , самые маленькие свободноживущие эукариоты в настоящее время известны. [ 45 ]
Празиновирусы используют стратегию нуклео-цитоплазматической репликации, где вирионы прилипают к поверхности клеток-хозяина, с последующей инъекцией ДНК в цитоплазму хозяина. [ 45 ] Исследователи обнаружили, что «пустые» вирусы OTV5 или вирусы с только капсидом, прикрепленным к мембране хозяина, редко наблюдались на любой стадии инфекции, что позволяет предположить, что вирионы отделяются от мембраны хозяина после инъекции их ДНК. Авторы также обнаружили, что высокая доля вирусов не прикреплялась к клеткам после инокуляции и предполагает, что прикрепление вируса может быть ограничивающей стадией в инфекции. Вирусная ДНК затем реплицируется внутри ядра механизмом клетки -хозяина. Частицы вируса собираются в цитоплазме, обычно занимая пространство возле внутренней поверхности ядра. Из -за чрезвычайно небольшого размера клеток водорослей средний размер взрыва составлял 25 частиц вируса на клетку. [ 45 ]
Вирусная продукция без лизиса клеток недавно наблюдалась в клетках О. Таури . Thomas et al. (2011) обнаружили, что в устойчивых клетках -хозяевах вирусный геном был воспроизведен, а вирусы высвобождались с помощью начинающего механизма. [ 46 ] Этот низкий уровень высвобождения вируса посредством почкования позволяет продолжить продолжительность выживаемости хозяина и потомства вируса, что приводит к стабильному сосуществованию. [ 47 ]
Кодированные белки
[ редактировать ]Эктокарпус вирус силикулозуса (ESV-1), принадлежащий к роду фейвируса и вирус хлореллы Paramecium bursaria (PBCV-1), принадлежащий к роду хлорвируса , представляют собой два хорошо изученных вируса, чьи геномы были обнаружены кодируют многие белки. Эти белки функционируют в стабильности вируса, синтезе ДНК, транскрипции и других важных взаимодействиях с хозяином. [ Цитация необходима ]
Ферменты для гликозилирования
[ редактировать ]PBCV-1 имеет 54 кДа гликозилированный основной капсидный белок, который составляет около 40% от общего вирусного белка. [ 12 ] В отличие от большинства вирусных структурных белков, которые гликозилированы в аппарате эндоплазматического ретикулума (ER) и Гольджи кодируемыми хозяином гликозилтрансферазами , [ 48 ] PBCV-1 гликозилирует его основной капсидный белок независимо, кодируя большинство ферментов, необходимых для построения сложных олигосахаридов, которые затем прикрепляются к основному капсидному белке PBCV-1 для образования гликопротеина. Следовательно, гликозилирование основного капсидного белка PBCV-1 происходит независимо от аппарата ER и Гольджи в клетках-хозяевах. [ 49 ]
Белки ионных каналов
[ редактировать ]Первый известный вирусный белок, который функционирует как ионный ионный канал калия, был обнаружен в PBCV-1. [ 50 ] Белок (называемый KCV) состоит из 94 аминокислот и кодируется из небольшой открытой рамки считывания ( ORF ) (ORF A250R) в PBCV-1, которая может производить калий-селективные и чувствительные к напряжению проводимость в Xenopus ооцитах . [ 50 ] Предполагаемый белок PBCV-1 имеет короткий цитоплазматический N-конец (12 аминокислот), содержащий один консенсус-сайт протеинкиназы C, и имеет 2 трансмембранных домена. Различные аминокислотные последовательности и отсутствие COOH-концевого цитоплазматического хвоста делают белок KCV отличным от других калиевых каналов. [ 50 ] [ 29 ]
ESV-1 кодирует 124 кодон ORF, который имеет значительное сходство аминокислот с PBCV-1 KCV (41% аминокислотная идентичность). [ 29 ] Тем не менее, белок ESV-1 имеет более длинный N-конце (35 аминокислот), содержащий два консенсусных сайта протеинкиназы C, и имеет три трансмембранных домена. [ 29 ] Неизвестно, может ли белок ESV-1 образовывать функциональный канал в гетерологичных клетках. Геном ESV-1 также кодирует несколько белков с гидрофобными аминокислотными областями, которые напоминают спиральные трансмембранные домены. Среди этих белков входной домен предполагаемой гибридной хи-киназы 186 и ORF 188 напоминает белки ионного канала. [ 45 ]
ДНК-репликационные белки
[ редактировать ]Как ESV-1, так и PBCV-1 кодируют ДНК-полимеразу , которая принадлежит к семейству ДНК-полимеразы-Δ, и все они содержат корректурующий домен экзонуклеазы 3'-5 '. [ 51 ] Кроме того, как PBCV-1, так и ESV-1 кодируют белок фактора процессивности скользящих зажимов (PCNA), который взаимодействует с белками, участвующими в репликации ДНК, а также белкам, участвующими в репарации ДНК и постепоплицирующей обработке (например, ДНК метилазы и ДНК транспозазы). [ 52 ]
Коэффициент гетеропентамерной репликации C (RFC) является комплексом, который отвечает за АТФ-зависимую нагрузку PCNA на ДНК; [ 53 ] [ 54 ] ESV-1 кодирует пять белков, которые могут образовывать комплекс RFC. PBCV-1 кодирует один белок, который напоминает обнаруженный в комплексе Archae RFC. [ 45 ] PBCV-1 также кодирует другие белки, участвующие в репликации ДНК, включая АТФ-зависимую ДНК-лигазу , [ 55 ] типа II ДНК -топоизомераза и РНКаза H. [ 29 ] Хотя и ESV-1, так и PBCV-1 обладают генами для основных элементов системы эукариотической репликации, ни один из них не имеет полных репликативных генов, поскольку у всех них не хватает генов для примазы. [ 12 ] [ 29 ]
Транскрипционные белки
[ редактировать ]Ни ESV-1, ни PBCV-1 кодируют полную РНК-полимеразу , но они продуцируют несколько транскрипционных факторных белков, чтобы помочь системе транскрипции хозяина. [ Цитация необходима ]
ESV-1 кодирует два небольших полипептида (ORF 193 и ORF 196) для регуляции транскрипции; Белки напоминают α/β/α -домен субъединицы TFIID -18. [ 45 ] Комплекс TFIID необходим для транскрипции эукариот, поскольку он связывается с коробкой TATA в ядра промотора гена, чтобы инициировать сборку РНК -полимеразы. Кроме того, полипептиды напоминают набор, BTB/POZ (то есть широкий комплекс, трамвайт и Bric-A-Brac/Poxvirus и цинковый палец) (ORF 40), а домены BAF60B (ORF 129) также кодируются ESV-1 в Регулировать ремоделирование хроматина и репрессию транскрипции. [ 45 ] [ 12 ] [ 56 ]
Четыре транскрипционных факторных белка были обнаружены в PBSV-1, включая TFIIB (A107L), TFIID (A552R), TFIIS (A125L) и фактор транскрипции типа VLTF-2 (A482R). [ 29 ] Кроме того, PBCV-1 также кодирует два фермента, участвующие в формировании структуры CAP мРНК, РНК-трихосфатазы [ 57 ] и мРНК Гунилилтрансфераза . [ 58 ] Ферменты PBCV-1 более тесно связаны с дрожжевыми ферментами, чем с многофункциональными ферментами RNA-покрытия Poxvirus в соответствии с его размером, аминокислотной последовательности и биохимическими свойствами. [ 59 ] [ 58 ] PBCV-1 также кодирует RNASE III , которая участвует в обработке мРНК вируса. [ 29 ]
Нуклеотидные метаболизм белки
[ редактировать ]Чтобы поставлять дезоксинуклеотиды для выработки вируса в низкопролиферирующих клетках -хозяевах, крупные ДНК -вирусы обладают генами для кодирования сами ферментов синтеза дезоксинуклеотидов. [ 29 ] Тринадцать нуклеотидных метаболических ферментов были обнаружены в PBCV-1, два из которых включают DUTP -пирофосфатазу и DCMP- деаминазу , которая может продуцировать дамп (то есть субстрат для тимидилат-синтетазы). [ 60 ] Для сравнения, ESV-1 кодирует только АТФазу (ORF 26), а также обе субъединицы рибонуклеотидредуктазы (ORF 128 и 180), что является ключевым ферментом в синтезе дезоксинуклеотида. [ 45 ]
Другие ферменты
[ редактировать ]Другие ферменты, такие как метилтрансферазы , эндонуклеазы ДНК-ограничения и интегразу , также были обнаружены в PBCV-1. [ 12 ] [ 29 ] PBCV-1 также кодирует 187-аминокислотный белок, который напоминает SOD Cu-Zn со всеми консервативными аминокислотными остатками для связывания меди и цинка, которые могут разложить быстро Полем [ 61 ]
Экологические последствия
[ редактировать ]Рафидовирус
[ редактировать ]
Гетерозигма Акашиво образует плотные, вредные цветы в умеренных и субарктических водах, встречающихся на плотности до 5 × 10 6 клетки/мл. [ 62 ] Эти цветы водорослей могут быть чрезвычайно вредны для водной жизни, вызывая смертность у дикой и культивируемой рыбы, такой как лосось, желтый хвост и морской лещ. [ 5 ] Серьезность и продолжительность этих цветов варьируются от года, и ущерб аквакультуре H.Akashiwo увеличивается. В 1989 году ядовитый цветение водорослей у побережья Новой Зеландии привело к потере семнадцати миллионов новозеландских долларов на лосось Чинук. В 1995 и 1997 годах в японских прибрежных водах в заливе Кагосимо, 1090 миллионов и 327 миллионов иен были убиты соответственно. [ 5 ]
вирус HAV, заражение H. akashiwo, Было показано, что является фактором прекращения цветения. Suttle et al. (1990) предположили, что вирусная инфекция водорослей может играть роль в регуляции плотности населения сообществ фитопланктона, тем самым играя значительную роль в своей динамике в океанах. [ 63 ] Более ранние исследования, такие как исследование Nagasaki et al. (1993), исследовали динамику между Hav и H. akashiwo . Образцы водорослей были получены на средних или окончательных этапах красного прилива в заливе Хиросима , Япония. Используя просвечивающую электронную микроскопию , Nagaski et al. идентифицировал вирус HAV в ядерной области и вокруг ядерных клеток H. akashiwo . [ 63 ] Дополнительная поддержка роли вируса HAV в прекращении цветения была предоставлена исследованием, проведенным Nagaski et al. (1994). Нагаски и соавт. (1994) обнаружили, что доля вируссодержащих клеток быстро увеличивается перед прекращением красного прилива; Никаких вируссодержащих клетки не было обнаружено за три дня до прекращения прилива красного цвета, а образец, собранной в последний день, выявил высокую частоту (11,5%) вируссодержащих клеток. [ 64 ]
Дальнейшие исследования Tarutani et al. (2000) также обнаружили связь между снижением плотности клеток H. akashiwo с увеличением численности HAV. Исследователи обнаружили, что HAV не только играет в важной роли в контроле биомассы, но и влияет на клональный состав или характеристики клеток H. akashiwo . Исследователи обнаружили, что большинство изолятов после прекращения цветения были устойчивы к клональным изолятам HAV, в то время как во время резистентных клеток для образования цветов были незначительным компонентом. Авторы предполагают, что вирусная инфекция во время периода прекращения цветения влияет на свойства доминирующих клеток в H. akashiwo . популяциях [ 65 ] Селективное давление, оказываемое вирусами на более поздней стадии инфекции, может способствовать генетическому разнообразию, позволяя популяции H. akashiwo процветать после прекращения цветения. [ Цитация необходима ]
Как уже упоминалось, цветы H. akashiwo наносят ущерб популяциям рыб в умеренных и субарктических водах и продолжают представлять серьезные угрозы для аквакультуры. Нагасаки и соавт. (1999) изучили характеристики роста HAV и предположили, что HAV можно использовать в качестве микробного агента против H. akashiwo Red Tides. Преимущества использования HAV заключается в том, что он специально заражает H. akashiwo, даже когда присутствуют другие микроорганизмы. Кроме того, он имеет высокие темпы роста и может быть получен по низкой цене. Использование HAV в качестве микробного агента является многообещающим решением для устранения красных приливов для защиты рыболовства и морской жизни, но, как пришли к выводу авторов, влияние различных клонов HAV на популяции H. akashiwo следует изучить более подробно, прежде чем вирус будет использован для широкомасштабные приложения. [ 5 ]
Кокколитовирус
[ редактировать ]
Coccolithovirus Э. (EHV) заражает кокколитофор Эмилиана Хакслии ( Хакслии ). Кокколитофоры представляют собой морские хаптофиты , которые окружены микроскопическими пластинками, изготовленными из карбоната кальция . [ 66 ] Они живут в верхних слоях мировых океанов и представляют собой третью наиболее распространенную группу фитопланктона, содержащая около 300 видов. [ 67 ] E. Huxleyi признан наиболее заметным и экологически важным из кокколитофоров. E. Huxleyi имеет глобальное распространение от тропиков в субарктические воды и иногда образует плотные цветы, которые могут охватывать 100 000 квадратных километров. [ 67 ] Эти триллионы продуманных кокколитофоров, затем умирают и погружаются в дно океанов, способствуют образованию отложений, и являются крупнейшими производителями кальцита в океанах. [ 66 ] Таким образом, кокколиты играют значительную роль в глобальной фиксации углерода и углеродном цикле, а также на велосипеде серы. [ 67 ] Со временем кокколитофоры сформировали геологические особенности нашей планеты. Например, белые скалы Дувра образуются из белого мела или карбоната кальция, продуцируемых кокколитофорами в течение миллионов лет. [ Цитация необходима ]
Кокколитофор цветы, как правило, не вредны для морской жизни в океане. По мере того, как эти организмы процветают в условиях с питательными веществами, кокколитофоры предлагают источник питания для мелкой рыбы и зоопланктона . [ 66 ] E. huxylei вирусы ( EHV Было показано, что ) связаны с прекращением этих цветов. Стадия прекращения цветов обозначена изменением цвета в воде. Когда большое количество кокколитов (карбонатная оболочка, окружающая E. huxylei ), отбрасываются из клеток E. huxylei от гибели клеток или лизиса, вода становится белой или бирюзовой. В областях плотного прекращения цветения белый цвет отражает и можно увидеть на спутниковых снимках. [ 67 ] Wilson et al. (2002) использовали аналитическую проточную цитометрию для измерения численности вирусов в разных местах в области цветения и вокруг него. Исследователи обнаружили, что концентрации вирусов были выше внутри «области высокой отражательной способности», что позволяет предположить, что лизис, вызванный вирусом клеток E. huxleyi, приводил к отряду кокколита. [ 68 ] Другие исследования Martinez et al. (2007) и Bratbak et al. (1993) обнаружили более высокие концентрации вирусов EHV, когда цветение E. huxleyi снизилось, что указывает на то, что литическая вирусная инфекция была основной причиной прекращения цветения. [ 69 ] [ 70 ] Таким образом, вирусы EHV играют важную роль в регуляции выработки биомассы в морской среде и экологической преемственности. Таким образом, эта регуляция популяций кокколитофора вирусами EHV оказывает значительное влияние на биогеохимические циклы , особенно углеродный цикл . [ Цитация необходима ]
Феовирус
[ редактировать ]
Один из лучших фейвирусов, ESV-1, заражает маленькие нитчатые коричневые водоросли E. Силикулозус , который имеет космополитическое распределение (обнаружено в большинстве мировых океанов). [ 29 ] Эктокарпалы , которые являются наиболее экономически важной тесно связаны с коричневой группой водорослей, Laminariales группой коричневых водорослей, имеющих широкий спектр применений в косметике и пищевой промышленности. [ 71 ]
Muller et al. (1990) были одним из первых, кто изучил причины дефектов гаметангия у E. siliculosus, происходящего из Новой Зеландии. Исследователи идентифицировали репродуктивные клетки E. siliculosus, заполненные гексагональными частицами, которые затем высвобождались в культуральную среду, когда клетки лопались. После высвобождения этих частиц спорофиты были заражены, показанные патологическими симптомами, что позволяет предположить, что частицы являются вирусами. [ 72 ] Такие исследования позволили оценке инфекционного потенциала вирусов E. siliculosus . Используя ПЦР -амплификацию фрагмента вирусного гена, Muller et al. (2005) контролировали уровни инфекции патогенов в образцах эктокарпа с острова Гран Канария, Северной Атлантики и южной части Чили. Исследователи обнаружили высокий уровень распространенности патогена; 40–100% образцов ectocarpus содержали вирусную ДНК. [ 73 ] Аналогичные оценки были даны Sengco et al. (1996), который подсчитал, что по меньшей мере 50% растений эктокарпуса в мире содержат вирусную ДНК. [ 74 ] Эта высокая частота вирусной инфекции среди глобально распределенных растений эктокарпуса имеет экологические последствия. Вирусная инфекция ESV-1 у E. siliculosus растений, как уже упоминалось, ограничивает репродуктивный успех инфицированных растений. Таким образом, вирус ESV-1 играет ключевую роль в регуляции популяций E. siliculosus , оказывая дальнейшее влияние на динамику локальной экосистемы. [ Цитация необходима ]
Хлоровирус
[ редактировать ]
Члены рода хлоровирус встречаются в пресноводных источниках по всему миру и заражают зоохлорллы зеленых водорослей. Отсутствует информация о роли хлорвирусов в пресной экологии. [ 75 ] Несмотря на это, хлорвирусы обнаруживаются в местных водах в 1–100 единицах, образующих бляшки (PFU)/мл, и были получены измерения до 100 000 ПФУ/мл нативной воды. [ 8 ] Главная бляшка-это количество частиц, способных образовывать видимые структуры в клеточной культуре, известные как бляшки. [ Цитация необходима ] В результате сезона варьируются количество хлорвирусов, причем самые высокие численности происходят весной. [ 8 ] Хлоровирусы, такие как PBCV-1, играют роль в регулировании популяций хозяина Zoochlorella. Как упоминалось ранее, инфекция Zoochlorella происходит только тогда, когда симбиотическая связь с его хозяином нарушена. Инфекция водорослей на этой стадии независимости хозяина/водорослей предотвратит восстановление взаимосвязи хозяина и водорослей, что снижает выживаемость эндосимбиотических хозяев зоохлорллов, таких как Paramecium bursaria. Таким образом, хлорвирусы играют в важной роли в пресноводных экосистемах , не только регулируя популяции своего хозяина, Zoochlorellae, но и регулируя, в некоторой степени популяции хозяев Zoochlorellae также. Хлоровирусы и вирусы в целом вызывают смерть и лизис их хозяев, высвобождая растворенный органический углерод, азот и фосфор в воду. Эти питательные вещества могут затем быть взяты бактериями, что способствует микробному петлю. Освобождение растворенных органических материалов обеспечивает рост бактерий, а бактерии являются важным источником пищи для организмов на более высоких трофических уровнях. Следовательно, хлорвирусы оказывают значительное влияние на потоки углерода и питательных веществ, влияя на динамику пресноводной экосистемы. [ 6 ]
Примнеовирус
[ редактировать ]Prymnesiovirus, CBV-PW1, как упомянуто, заражает род водорослей Chyrsochromulina . Chyrsochromulina , обнаруженная в глобальных свежих и морских водах, иногда образует плотные цветы, которые могут производить вредные токсины, оказывая негативное влияние на рыболовство. [ 36 ] Особенно токсичный вид, называемый C. polylepis, нанес огромный ущерб коммерческому рыболовству в Скандинавии. В 1988 году это цветение привело к потере 500 тонн рыбы в клетке на сумму 5 миллионов США. [ 76 ] Учитывая, что Chyrsochromulina является широко распространенным видом и имеет значительное экологическое значение, вирусная инфекция и лизис членов рода, вероятно, окажут значительное влияние на биогеохимические циклы, такие как рециркуляция питательных веществ в водных средах. Саттл и Чан предполагают, что наличие вирусов должно оказывать сильное регуляторное влияние на популяции чирсохромулины , что предотвращает образование цветения или обеспечивая прекращение цветения, объясняя, почему постоянные цветы являются необычным явлением в природе. [ 36 ]
Празиновирус
[ редактировать ]Обычно изучаемый прасиновирус, OTV5, как уже упоминалось, заражает наименьшее в настоящее время известное в настоящее время Eukaryote, Ostreococcus tauri . О. Таури имеет диаметр около 0,8 микрометра и находится в рамках пикозиза (0,2–2 микрометров). Пикоукариоты, такие как Ostreococcus tauri, широко распространены и вносят значительный вклад в микробную биомассу и общую первичную продуктивность. В олиготрофической среде морское пикофитопланктон составляет до 90% автотрофной биомассы и, следовательно, является важным источником пищи для нанопланктонных и фаготрофных протистов. [ 77 ] По мере того, как пикоукариоты служат основой для морских микробных пищевых сетей, они присутствуют на выживании более высоких трофических уровней. Ostreococcus Tauri имеет быстрые темпы роста, и у побережья Лонг -Айленда и Калифорнии наблюдались плотные цветы. [ 77 ] Было обнаружено, что образцы, собранные в Лонг-Айлендском заливе, содержат много вирусных частиц, что является вероятной причиной снижения цветения. [ 78 ] Несмотря на большие численности пикуекариот, эти одноклеточные организмы превосходят вирусы примерно на десять до одного. [ 79 ] Вирусы, такие как OTV5, играют важную роль в регуляции популяций фитопланктона, и посредством лизиса клеток способствуют рециркуляции питательных веществ в направлении других микроорганизмов, иначе известных как вирусный шунт . [ 80 ]
Как уже упоминалось, прасиновирус MPV-SP1 заражает MicroMonas Pusilla , которая является основным компонентом пикофитопланктона мировых океанов. М. Пусилла живет от тропических до полярных морских экосистем. [ 81 ] Cottrell & Suttle (1995) обнаружили, что 2–10% популяции M. pusilla в прибрежной среде были лизированы в день, в среднем 4,4%. [ 43 ] Более высокие оценки были даны Evans et al. (2003), которые предполагают, что вирусы M. pusilla могут лизировать до 25% популяции микромонов в день. [ 82 ] Это говорит о том, что вирусы ответственны за умеренное количество смертности в популяциях M. pusilla . [ 43 ] В более широком масштабе вирусная инфекция M. pusilla отвечает за переработку питательных веществ и энергии в водных пищевых сетях, что еще не определено количественно. [ Цитация необходима ]
Патология
[ редактировать ]До недавнего времени фикоднавирусы, как полагают, заражали исключительно виды водорослей. Недавно ДНК-гомологичный по отношению к хлорвирусу вирус 1 (ATCV-1) акантоцистис-турфоцистис был выделен из поверхностей слизистой оболочки носоглотки человека. Присутствие ATCV-1 в микробиоме человека было связано с снижением эффективности когнитивных оценок. Инокуляция ATCV-1 у экспериментальных животных была связана со снижением производительности в памяти и сенсорно-моторном стробировании, а также с измененной экспрессией генов в гиппокампе, связанной с синаптической пластичностью , обучением, формированием памяти и вирусным иммунным ответом. [ 3 ]
Ссылки
[ редактировать ]- ^ «Вирусная зона» . Расширение . Получено 15 июня 2015 года .
- ^ Jump up to: а беременный ICTV. «Таксономия вируса: выпуск 2014 года» . Получено 15 июня 2015 года .
- ^ Jump up to: а беременный Йолкен, RH; и др. (2014). «Хлоровирус ATCV-1 является частью вируса ротоглотки человека и связан с изменениями в когнитивных функциях у людей и мышей» . Proc Natl Acad Sci USA . 111 (45): 16106–16111. Bibcode : 2014pnas..11116106Y . doi : 10.1073/pnas.1418895111 . PMC 4234575 . PMID 25349393 .
- ^ Jump up to: а беременный в дюймовый и Томару, Юджи; Ширай, Йоко; Нагасаки, Кейзо (1 августа 2008 г.). «Экология, физиология и генетика фикоднавируса, заражающего ядовитую расцветую, образующую расцвету, гетерозигма Акашиво ». Наука о рыболовстве . 74 (4): 701–711. Bibcode : 2008fissc..74..701t . doi : 10.1111/j.1444-2906.2008.01580.x . S2CID 23152411 .
- ^ Jump up to: а беременный в дюймовый и Нагасаки, Кейзо; Тарутани, Кенджи; Ямагучи, Минео (1 марта 1999 г.). «Характеристики роста вируса гетерозигмы акасиво и его возможное использование в качестве микробиологического агента для контроля красного прилива» . Прикладная и экологическая микробиология . 65 (3): 898–902. Bibcode : 1999apenm..65..898n . doi : 10.1128/aem.65.3.898-902.1999 . PMC 91120 . PMID 10049839 .
- ^ Jump up to: а беременный Сиги, Дэвид (27 сентября 2005 г.). Пресноводная микробиология: биоразнообразие и динамическое взаимодействие микроорганизмов в водной среде . Джон Уайли и сыновья. ISBN 9780470026472 .
- ^ Аноним (2012) Таксономия вируса: IXTH Отчет Международного комитета по таксономии вирусов. Амстердам: академическая пресса, с. 261.
- ^ Jump up to: а беременный в дюймовый и фон глин Дуниган, Дэвид Д.; Фицджеральд, Лиза А.; Ван Эттен, Джеймс Л. (2006). «Фикоднавирусы: взгляд на генетическое разнообразие» . Исследование вируса . 117 (1): 119–132. doi : 10.1016/j.virusres.2006.01.024 . PMID 16516998 . S2CID 11532538 .
- ^ Чен, Фэн; Саттл, Кертис А. (1996). «Эволюционные отношения между большими двухцепочечными ДНК-вирусами, которые заражают микроводоросли и другие организмы, как выведенные из генов ДНК-полимеразы» . Вирусология . 219 (1): 170–178. doi : 10.1006/viro.1996.0234 . PMID 8623526 .
- ^ Бейкер, Тимоти С.; Ян, Сяодон; Олсон, Норман Х.; Эттен, Джеймс Л. Ван; Бергоин, Макс; Россманн, Майкл Дж. (2000). «Цитата природы» . Природа структурная биология . 7 (2): 101–103. doi : 10.1038/72360 . PMC 4167659 . PMID 10655609 .
- ^ Ян, х.; Chipman, PR; Castberg, T.; Bratbak, G.; Бейкер, Т.С. (2005). «Морской вирус водорослей PPV01 имеет икосаэдрическую капсид с квазимметрией T = 219» . Журнал вирусологии . 79 (14): 9236–9243. doi : 10.1128/jvi.79.14.9236-9243.2005 . PMC 1168743 . PMID 15994818 .
- ^ Jump up to: а беременный в дюймовый и фон глин Макиндер, Люк С.М.; Достойная, Шарлотта А.; Бигги, Гайя; Холл, Мэтью; Райан, Кит П.; Варсани, Арвинд; Харпер, Гленн М.; Уилсон, Уильям Х.; Браунли, Колин (1 января 2009 г.). «Одноклеточный вирус водоросли, вирус Emiliania Huxleyi 86, эксплуатирует стратегию инфекции, похожей на животные» . Журнал общей вирусологии . 90 (9): 2306–2316. doi : 10.1099/vir.0.011635-0 . PMID 19474246 .
- ^ Вирусы, Международный комитет по таксономии; Кинг, Эндрю М. К. (2012). "Phycodnaviridae". Таксономия вируса . С. 249–262. doi : 10.1016/b978-0-12-384684-6.00024-0 . ISBN 9780123846846 .
- ^ Ли, Ю; Лу, Чжицан; Солнце, Лянгу; ROPP, Сьюзен; Кутиш, Джеральд Ф.; Рок, Даниэль Л.; Ван Эттен, Джеймс Л. (1997). «Любое из 74 т.п.н. ДНК, расположенное на правом конце генома вируса хлореллы 330 т.п.н. Вирусология 237 (2): 360–3 Doi : 10.1006/ viro.1997.8 PMID 9356347
- ^ Jump up to: а беременный Деларук, Николас; Мюллер, Дитер Герхард; Боту, Гордана; Пол, Томас; Ножи, Рольф; Боланд, Вильгельм (2001). «Полная последовательность ДНК вируса эктокарпа вируса силикулозового вируса ESV-1» . Вирусология . 287 (1): 112–132. doi : 10.1006/viro.2001.1028 . PMID 11504547 .
- ^ Jump up to: а беременный в Wilson, WH; Шредер, округ Колумбия; Аллен, MJ; Холден, MT; Parkhill, J.; Баррелл, BG; Churcher, C.; Хэмлин, Н.; Mungall, K.; Norbertczak, H.; Перепела, Массачусетс; Цена, C.; Раббинович, E.; Уокер, Д.; Craigon, M.; Рой, Д.; Газал, П. (2005). «Полная последовательность генома и профиль транскрипции литической фазы кокколитовируса». Наука . 309 (5737): 1090–1092. Bibcode : 2005sci ... 309.1090W . doi : 10.1126/science.1113109 . PMID 16099989 . S2CID 6710771 .
- ^ Финке, Ян; Уингет, Даниэль; Чан, Эми; Саттл, Кертис (2017). «Изменение генетического репертуара вирусов, инфицирующих микромоны, отражает горизонтальный перенос генов и связывается с их распределением окружающей среды» . Вирусы . 9 (5): 116. doi : 10.3390/v9050116 . PMC 5454428 . PMID 28534829 .
- ^ Аллен, MJ; Шредер, округ Колумбия; Wilson, WH (1 марта 2006 г.). «Предварительная характеристика повторных семейств в геноме EHV-86, гигантского вируса водорослей, который заражает морскую микроводолету Эмилиани Хакслии ». Архив вирусологии . 151 (3): 525–535. doi : 10.1007/s00705-005-0647-1 . PMID 16195784 . S2CID 10421212 .
- ^ Аллен, Майкл Дж.; Шредер, Деклан С.; Донкин, Эндрю; Crawfurd, Katharine J.; Уилсон, Уильям Х. (2006). «Сравнение генома двух кокколитовирусов» . Virology Journal . 3 : 15. DOI : 10.1186/1743-422X-3-15 . PMC 1440845 . PMID 16553948 .
- ^ Кумар, Судхир; Стехер, Глен; Тамура, Коичиро (2016). «MEGA7: анализ молекулярной эволюционной генетики Версия 7.0 для больших наборов данных» . Молекулярная биология и эволюция . 33 (7): 1870–1874. doi : 10.1093/molbev/msw054 . PMC 8210823 . PMID 27004904 .
- ^ Jump up to: а беременный Маруяма, Фумито; Ueki, Shoko (2016). «Эволюция и филогения крупных ДНК -вирусов, Mimiviridae и Phycodviridae, включая вновь охарактеризованный гетерозигма акасиво» . Границы в микробиологии . 7 : 1942. doi : 10.3389/fmicb.2016.01942 . PMC 5127864 . PMID 27965659 .
- ^ Фишер, мг; Аллен, MJ; Wilson, WH; Саттл, Калифорния (2010). «Гигантский вирус с замечательным дополнением генов заражает морской зоопланктон» . Труды Национальной академии наук . 107 (45): 19508–19513. BIBCODE : 2010PNAS..10719508F . doi : 10.1073/pnas.1007615107 . PMC 2984142 . PMID 20974979 .
- ^ Yau, S.; Лауро, FM; Demaere, MZ; Браун, MV; Thomas, T.; Raftery, MJ; Andrews-Pfannkoch, C.; Льюис, М.; Хоффман, JM; Гибсон, JA; Cavicchioli, R. (2011). «Контроль вируфага динамики вирус-вируса хозяев Антарктики» . Труды Национальной академии наук . 108 (15): 6163–6168. Bibcode : 2011pnas..108.6163y . doi : 10.1073/pnas.1018221108 . PMC 3076838 . PMID 21444812 .
- ^ Халл, Роджер (2014). «Растительные вирусы и их классификация». Вирусология растений . С. 15–68. doi : 10.1016/b978-0-12-384871-0.00002-9 . ISBN 9780123848710 .
- ^ Тай, Вера; Лоуренс, Дженис Э; Ланг, Эндрю С; Чан, Эми М; Калли, Александр I; Саттл, Кертис А (2003). «Характеристика Harnav, одноцепочечного РНК-вируса, вызывающего лизис гетерозигмы Akashiwo (raphidophyceae)». Журнал Phycology . 39 (2): 343–352. doi : 10.1046/j.1529-8817.2003.01162.x . S2CID 86464306 .
- ^ Лоуренс, Дженис Э; Чан, Эми М; Саттл, Кертис А (2001). «Новый вирус (HANIV) вызывает лизис токсической цветущей образующейся водоросли гетерозигмы Akashiwo (Raphidophyceae)». Журнал Phycology . 37 (2): 216–222. Bibcode : 2001jpcgy..37..216l . doi : 10.1046/j.1529-8817.2001.037002216.x . S2CID 86563435 .
- ^ Варди, А.; Ван Муй, Бас; Фредрикс, HF ; Попендорф, KJ; Оссолински, JE; Haramaty, L.; Бидл, KD (2009). «Вирусные гликосфинголипиды вызывают литическую инфекцию и гибель клеток в морском фитопланктоне». Наука . 326 (5954): 861–865. Bibcode : 2009Sci ... 326..861V . doi : 10.1126/science.1177322 . PMID 19892986 . S2CID 40102053 .
- ^ Jump up to: а беременный Стивенс, Ким; Вейнберг, Карен; Беллас, Кристофер; Браун, Соня; Браунли, Колин; Браун, Мюррей Т.; Schroeder, Declan C. (2014). «Новая эволюционная стратегия, выявленная в феовирусах» . Plos один . 9 (1): E86040. Bibcode : 2014ploso ... 986040S . doi : 10.1371/journal.pone.0086040 . PMC 3897601 . PMID 24465858 .
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л Кляйн, М.; Ланка, ул.; Ножи, R.; Мюллер, DG (10 января 1995 г.). «Перекрытие белка вируса силикулозуса эктокарпа » . Вирусология . 206 (1): 520–526. doi : 10.1016/s0042-6822 (95) 80068-9 . PMID 7831806 .
- ^ Jump up to: а беременный Charrier, Bénédicte; Coelho, Susana M.; Залог, aude; Тонон, Тьерри; Мишель, Гурван; Потин, Филипп; Клорег, Бернард; Бойен, Кэтрин; Петерс, Акира Ф.; Чок, Дж. Марк (2007). «Развитие и физиология коричневой водоросли эктокарпус Силикулозус: две столетия исследований» (PDF) . Новый фитолог . 177 (2): 319–332. Doi : 10.1111/j.1469-8137.2007.02304.x . PMID 18181960 . S2CID 43432914 .
- ^ Jump up to: а беременный Мюллер, Д.Г. (1991). «Морский вириопланктон, продуцируемый инфицированным силикулозом эктокарпуса (Phaeophyceae)» . Серия прогресса в морской экологии . 76 : 101–102. Bibcode : 1991meps ... 76..101M . doi : 10.3354/meps076101 .
- ^ Jump up to: а беременный Сиги, Дэвид (27 сентября 2005 г.). Пресноводная микробиология: биоразнообразие и динамическое взаимодействие микроорганизмов в водной среде . Джон Уайли и сыновья. ISBN 9780470026472 .
- ^ Эттен, Джеймс Л. Ван; Дуниган, Дэвид Д. (18 августа 2016 г.). «Гигантские хлорвирусы: пять простых вопросов» . PLO -патогены . 12 (8): E1005751. doi : 10.1371/journal.ppat.1005751 . PMC 4990331 . PMID 27536965 .
- ^ Делонг, Джон П.; Аль-Амили, Зейна; Дункан, Гарри; Ван Эттен, Джеймс Л.; Дуниган, Дэвид Д. (2016). «Хищники катализируют увеличение хлорвирусов путем питания на симбиотических хозяевах Zoochlorellae» . Труды Национальной академии наук . 113 (48): 13780–13784. BIBCODE : 2016PNAS..11313780D . doi : 10.1073/pnas.1613843113 . PMC 5137705 . PMID 27821770 .
- ^ Ван Эттен, Джеймс Л.; Дуниган, Дэвид Д. (2012). «Хлоровирусы: не ваш повседневный вирус растений» . Тенденции в науке о растениях . 17 (1): 1–8. doi : 10.1016/j.tlants.2011.10.005 . PMC 3259250 . PMID 22100667 .
- ^ Jump up to: а беременный в дюймовый и фон глин Саттл, Калифорния; Чан, А.М. (1995). «Вирусы, заражающие морской придмнеофит Chrysochromulina spp.: Изоляция, предварительная характеристика и естественное изобилие» . Серия прогресса в морской экологии . 118 : 275–282. Bibcode : 1995meps..118..275s . doi : 10.3354/meps118275 .
- ^ Саттл, Кертис А.; Чан, Эми М. (2002). «Примнеовирус». Спрингер индекс вирусов . С. 741–743. doi : 10.1007/3-540-31042-8_128 . ISBN 978-3-540-67167-1 .
- ^ "Chrysochromulina Lackey, 1939 :: Algaebase" . www.algaebase.org . Получено 28 февраля 2017 года .
- ^ Кинг, Эндрю Мк (1 января 2012 г.). Таксономия вируса: классификация и номенклатура вирусов: девятый отчет Международного комитета по таксономии вирусов . Elsevier. ISBN 9780123846846 .
- ^ Клерисси, Камилла; Desdevises, Ив; Гримсли, Найджел (2012). «Празиновирусы морской зеленой водоросли Ostreococcus tauri в основном специфичны для видов» . Журнал вирусологии . 86 (8): 4611–4619. doi : 10.1128/jvi.07221-11 . PMC 3318615 . PMID 22318150 .
- ^ «История таксономии ICTV: вирус Pusilla MicroMonas SP1» . ICTV. 8 марта 1998 года . Получено 25 июня 2017 года .
- ^ Коттрелл, MT; Саттл, Калифорния (1991). «Широко распространенное явление и клональные вариации вирусов, которые вызывают лизис космополитического, эукариотического морского фитопланктерного микромонаса Pusilla» . Серия прогресса в морской экологии . 78 : 1–9. Bibcode : 1991meps ... 78 .... 1c . doi : 10.3354/meps078001 .
- ^ Jump up to: а беременный в Коттрелл, Мэтью Т.; Саттл, Кертис А. (1995). «Динамика литического вируса, заражая фотосинтетические морские пикофлагеллятные микромонас pusilla» . Лимнология и океанография . 40 (4): 730–739. Bibcode : 1995limoc..40..730c . doi : 10.4319/lo.1995.40.4.0730 .
- ^ «Домашний ostreococcus lucimarinus » . genome.jgi.doe.gov . Получено 28 февраля 2017 года .
- ^ Jump up to: а беременный в дюймовый и фон глин час Derelle, Evelyne; Ferraz, Conchita; Эсконде, Мари-Линия; Эйхени, Софи; Кук, Ричард; Пигано, Гвенэль; Desdevises, Ив; Беллек, Лаур; Моро, Херве (28 мая 2008 г.). «Жизненный цикл и геном OTV5, большой ДНК-вирус пелагического морского одноклеточного зеленого водоросля Ostreococcus tauri » . Plos один . 3 (5): E2250. Bibcode : 2008ploso ... 3.2250d . doi : 10.1371/journal.pone.0002250 . PMC 2386258 . PMID 18509524 .
- ^ Томас, Розенн; Гримсли, Найджел; Эсконде, Мари-Линия; Субирана, Люси; Derelle, Evelyne; Моро, Херве (2011). «Приобретение и поддержание устойчивости вирусам в популяциях эукариотических фитопланктонов». Экологическая микробиология . 13 (6): 1412–1420. BIBCODE : 2011ENVMI..13.1412T . doi : 10.1111/j.1462-2920.2011.02441.x . PMID 21392198 .
- ^ Sime-Ngando, Tã Lesphore (2014). «Экологические бактериофаги: вирусы микробов в водных экосистемах» . Границы в микробиологии . 5 : 355. DOI : 10.3389/fmicb.2014.00355 . PMC 4109441 . PMID 25104950 .
- ^ Sigvard Olofsson, John-erik s. Ганс (1998). «Гликозилирование клеток -хозяина вирусных гликопротеинов - поле битвы за защиту хозяина и устойчивость к вирусам». Скандинавский журнал инфекционных заболеваний . 30 (5): 435–440. doi : 10.1080/00365549850161386 . PMID 10066039 .
- ^ Markine-Goriaynoff, N.; Gillet, L.; Ван Эттен, JL; Коррес, Х.; Верма, Н.; Vanderplasschen, A. (2004). «Гликозилтрансферазы, кодируемые вирусами» . Журнал общей вирусологии . 85 (10): 2741–2754. doi : 10.1099/vir.0.80320-0 . PMID 15448335 .
- ^ Jump up to: а беременный в Plugge, B.; Gazzarrini, S.; Нельсон, М.; Cerana, R.; Ван Эттен, JL; Derst, C.; Difrancesco, D.; Морони, а.; Thiel, G. (2000). «Белок калия-канала, кодируемый вирусом хлореллы PBCV-1» . Наука . 287 (5458): 1641–1644. Bibcode : 2000sci ... 287.1641p . doi : 10.1126/science.287.5458.1641 . PMID 10698737 . S2CID 17411728 .
- ^ Хубшер, Ульрих; Нашеуер, Хайнц-Петер; Syväoja, Juhani E. (2000). «Эукариотические ДНК -полимеразы, растущая семья». Тенденции в биохимических науках . 25 (3): 143–147. Doi : 10.1016/s0968-0004 (99) 01523-6 . PMID 10694886 .
- ^ Warbrick, E. (2000). «Загадка многих партнеров PCNA». Биологии . 22 (11): 997–1006. doi : 10.1002/1521-1878 (200011) 22:11 <997 :: AID-bies6> 3.0.co; 2-# . PMID 11056476 . S2CID 196597356 .
- ^ Эллисон, Виола; Стиллман, Брюс (2001). «Открытие зажима» . Клетка . 106 (6): 655–660. doi : 10.1016/s0092-8674 (01) 00498-6 . PMID 11572772 . S2CID 17575635 .
- ^ Мосси, Ромина; Хабшер, Ульрих (1998). «Зажим зажимами и зажимами . Европейский журнал биохимии . 254 (2): 209–216. doi : 10.1046/j.1432-1327.1998.2540209.x . PMID 9660172 .
- ^ Хо, ck; Ван Эттен, JL; Шуман С. (1997). «Характеристика АТФ-зависимой ДНК-лигазы, кодируемой вирусом хлореллы PBCV-1» . Журнал вирусологии . 71 (3): 1931–7. doi : 10.1128/JVI.71.3.1931-1937.1997 . PMC 191272 . PMID 9032324 .
- ^ Deweindt, C.; Альбагли, О.; Бернардин, Ф.; Dhordain, P.; Quief, S.; Lantoine, D.; Kerckaert, JP; Leprince, D. (1995). «Онкоген LAZ3/BCL6 кодирует специфический для последовательности ингибитор транскрипции: новая функция для домена BTB/POZ в качестве автономного подавляющего домена» . Рост и дифференциация клеток . 6 (12): 1495–503. PMID 9019154 .
- ^ Хо, ck; Gong, C.; Шуман С. (2001). «РНК -трихосфатаза компонент мРНК с аппаратом с вирусом 1 вируса Paramecium bursaria chlorella 1» . Журнал вирусологии . 75 (4): 1744–1750. doi : 10.1128/JVI.75.4.1744-1750.2001 . PMC 114083 . PMID 11160672 .
- ^ Jump up to: а беременный Хо, ck; Ван Эттен, JL; Шуман С. (1996). «Экспрессия и характеристика фермента РНК, кодируемого вирусом хлореллы, PBCV-1» . Журнал вирусологии . 70 (10): 6658–64. doi : 10.1128/JVI.70.10.6658-6664.1996 . PMC 190707 . PMID 8794301 .
- ^ Шуман С. (2001). «Структура, механизм и эволюция аппарата мРНК». Прогресс в исследованиях нуклеиновых кислот и молекулярной биологии . 66 : 1–40. doi : 10.1016/s0079-6603 (00) 66025-7 . ISBN 9780125400664 Полем PMID 11051760 .
- ^ Ван Эттен, Джеймс Л.; Meints, Russel H. (1999). «Гигантские вирусы, заражающие водоросли» . Ежегодный обзор микробиологии . 53 : 447–494. doi : 10.1146/annurev.micro.53.1.447 . PMID 10547698 . S2CID 7346326 .
- ^ Кан, М.; Дункан, Джорджия; Кушински, C.; Oyler, G.; Zheng, J.; Беккер, DF; Ван Эттен, JL (2014). «Хлоровирус PBCV-1 кодирует активную медную супероксиддисмутазу» . Журнал вирусологии . 88 (21): 12541–12550. doi : 10.1128/jvi.02031-14 . PMC 4248938 . PMID 25142578 .
- ^ Лоуренс, Дженис Э.; Brussaard, Corina Pd; Саттл, Кертис А. (1 марта 2017 г.). «Вирус-специфические реакции гетерозигмы акасиво на инфекцию» . Прикладная и экологическая микробиология . 72 (12): 7829–7834. Bibcode : 2006apenm..72.7829l . doi : 10.1128/aem.01207-06 . PMC 1694243 . PMID 17041155 .
- ^ Jump up to: а беременный Нагасаки, К.; Ando, M.; Imai, я.; Itakura, S.; Ишида, y. «Вирусные частицы в гетерогме Akashiwo (Rephidophyceae): возможный механизм распада красного прилива» Морская биология 119 (2): 307–312. Bibcode : 1994marbi.119..307n Doi : 10.1007/ bf00349570 S2CID 85350528
- ^ Нагасаки, Кейзо; Андо, Масаши; Итакура, Сигеру; Имаи, Ичиро; Ишида, Юзабуро (1994). «Вирусная смертность на последней стадии гетерозигмы акасиво (raphidophyceae) красного прилива». Журнал Plankton Research . 16 (11): 1595-1599. Doi : 10.1093 / plankt / 16.11.1595 .
- ^ Tarutani, K.; Нагасаки, К.; Ямагучи М. (2000). «Вирусное воздействие на полное изобилие и клональный состав вредной цветущей формирующей фитопланктоны гетерозигмы Акашиво» . Прикладная и экологическая микробиология . 66 (11): 4916–4920. Bibcode : 2000apenm..66.4916t . doi : 10.1128/aem.66.11.4916-4920.2000 . PMC 92399 . PMID 11055943 .
- ^ Jump up to: а беременный в Джон, Вейер (26 апреля 1999 г.). «Что такое кокколитофор? Информационный бюллетень: представленные статьи» . EarthObservatory.nasa.gov . Получено 3 марта 2017 года .
- ^ Jump up to: а беременный в дюймовый «Дом - Эмилия Хакслии» . genome.jgi.doe.gov . Получено 3 марта 2017 года .
- ^ Уилсон, Уильям Х.; Тарран, Глен А.; Шредер, Деклан; Кокс, Майкл; Оке, Джоан; Малин, Джиллиан (2002). «Выделение вирусов, ответственных за кончину цветущего Эмилиани Хакслии в английском канале» (PDF) . Журнал Морской биологической ассоциации Великобритании . 82 (3): 369–377. Bibcode : 2002jmbuk..82..369W . doi : 10.1017/s002531540200560x . S2CID 85219045 .
- ^ Мартинес, JM; Шредер, округ Колумбия; Ларсен, А.; Bratbak, G.; Wilson, WH (2007). «Молекулярная динамика Эмилиании Хакслии и пропущенных вирусов во время двух отдельных исследований мезокосма» . Прикладная и экологическая микробиология . 73 (2): 554–562. Bibcode : 2007apenm..73..554m . doi : 10.1128/aem.00864-06 . PMC 1796978 . PMID 17098923 .
- ^ Bratbak, G.; Egge, JK; Худл, М. (1993). «Вирусная смертность морской водоросли Emiliania Huxleyi (Haptophyceae) и прекращение цветов водорослей» . Серия прогресса в морской экологии . 93 : 39–48. Bibcode : 1993meps ... 93 ... 39b . doi : 10.3354/meps093039 .
- ^ «Эктокарпус Силикулозус генетический и геномный организм для коричневых водорослей» . Франсуа Джейкоб Институт биологии. 21 июня 2018 года.
- ^ Мюллер, DG; Kawai, H.; Stache, B.; Ланка С. (1990). «Вирусная инфекция в морской коричневой водоросли ectocarpus silicolusus (phaephyceae)» Botanica Acta 103 (1): 72–8 Doi : 10.1111/j.1438-8677.1990.tb00129.x .
- ^ Мюллер, DG; Westemeier, R.; Моралес, Дж.; Рейна, Г. Гарсия; Поля, E.; Корреа, JA; Rometscha, E. (2000). «Массовая распространенность вирусной ДНК в эктокарпусе (phaeophyceae, ectocarpalees) из двух мест обитания в Северной Атлантике и южной части Тихого океана». Марина Ботаника . 43 (2). Doi : 10.1515/бот . HDL : 10553/73463 . S2CID 84166193 .
- ^ Sengco, MR; Bräutigam, M.; Капп, М.; Мюллер, DG (1 февраля 1996 г.). «Обнаружение вирусной ДНК в EtoCarpus siliculus и E. fascicultus (Phaeophyceae) из различных географических областей» Европейский журнал филологии 31 (1): 73–7 Bibcode : 1996ejphy..31 ... 73s Doi : 10.1080/ 0967026960065121
- ^ Дуниган, Дэвид Д.; Cerny, Ronald L.; Бауман, Эндрю Т.; Роуч, Джаред С.; Лейн, Лесли С.; Agarkova, Irina v.; Вулсер, Курт; Yanai-Balser, Giane M.; Гурн, Джеймс Р.; Vitek, Jason C.; Кроншнабель, Бернард Дж.; Жанниард, Адриен; Блан, Гийом; Аптон, Крис; Дункан, Гарри А.; МакКлюнг, О. Уильям; MA, Fangrui; Ван Эттен, Джеймс Л. (2012). «Paramecium Bursaria Chlorella Virus 1 Протеом выявляет новые архитектурные и регуляторные особенности гигантского вируса» . Журнал вирусологии . 86 (16): 8821–8834. doi : 10.1128/jvi.00907-12 . PMC 3421733 . PMID 22696644 .
- ^ «Токсичное цветение водорослей в скандинавских водах, май - июнь 1988 | Океанография» . Океанография . 2 (1): 9–14. 1989. DOI : 10.5670/Oceanog.1989.24 . Получено 1 марта 2017 года .
- ^ Jump up to: а беременный Derelle, E.; Ferraz, C.; Rombauts, S.; Rouze, P.; Worden, AZ; Robbens, S.; Partensky, F.; Degroeve, S.; Echeynie, S.; Кук, Р.; Saeys, Y.; Wuyts, J.; Джаббари, К.; Боулер, C.; Panaud, O.; Piegu, B.; Мяч, SG; Ral, J.-P.; Бууг, Ф.-Ю.; Пигано, Г.; De Baets, B.; Пикард, А.; Delseny, M.; Demaille, J.; Van de Peer, y.; Моро, Х. (2006). «Анализ генома самого маленького свободноживущего эукариот-ostreococcus tauri представляет множество уникальных особенностей» . Труды Национальной академии наук . 103 (31): 11647–11652. Bibcode : 2006pnas..10311647d . doi : 10.1073/pnas.0604795103 . PMC 1544224 . PMID 16868079 .
- ^ О'Келли, Чарльз Дж.; Sieracki, Michael E.; Три, Эдвард С.; Хобсон, Илана С. (2003). «Переходное цветение Ostreococcus (Chlorophyta, Prasinophyceae) в заливе Вест -Нек, Лонг -Айленд, Нью -Йорк». Журнал Phycology . 39 (5): 850–854. Bibcode : 2003jpcgy..39..850o . doi : 10.1046/j.1529-8817.2003.02201.x . S2CID 84541779 .
- ^ Яу, Шери; Хемон, Клэр; Derelle, Evelyne; Моро, Херве; Пигано, Гвенэль; Гримсли, Найджел (2016). «Вирусная хромосома иммунитета в морском пибикоукариоте, Ostreococcus tauri» . PLO -патогены . 12 (10): E1005965. doi : 10.1371/journal.ppat.1005965 . PMC 5082852 . PMID 27788272 .
- ^ Вейц, Джошуа С.; Вильгейлм, Стивен В. (1 июля 2013 г.). «Океан вирусов» . Ученый .
- ^ Worden, AZ; Lee, J.-H.; Макет, т.; Rouze, P.; Симмонс, MP; Aerts, Al; Аллен, Ае; Cuvelier, ML; Derelle, E.; Эверетт, MV; Фулрон, E.; Grimwood, J.; Gundlach, H.; Henrissat, B.; Наполи, C.; Макдональд, С.М.; Паркер, MS; Rombauts, S.; Salamov, A.; Von Dassow, P.; Барсук, JH; Коутиньо, премьер -министр; Demir, E.; Дубчак, я.; Gentemann, C.; Eikrem, W.; Gready, Je; Джон, U.; Lanier, W.; и др. (2009). «Зеленая эволюция и динамическая адаптация, выявленные геномами морских пикоукариот микромонас» . Наука . 324 (5924): 268–272. Bibcode : 2009Sci ... 324..268W . doi : 10.1126/science.1167222 . PMID 19359590 . S2CID 206516961 .
- ^ Эванс, C.; Archer, SD; Жакет, S.; Wilson, WH (2003). «Прямые оценки вклада вирусного лизиса и выпаса микрозурзоланктона в снижение популяции MicroMonas spp.» . Водная микробная экология . 30 : 207–219. doi : 10.3354/ame030207 .
Дальнейшее чтение
[ редактировать ]- Ван Эттен, Джеймс Л. (2003). «Необычный образ жизни гигантских вирусов хлореллы» . Ежегодный обзор генетики . 37 : 153–195. doi : 10.1146/annurev.genet.37.110801.143915 . PMID 14616059 .
- Ван Эттен, Джеймс Л.; Meints, Russel H. (1999). «Гигантские вирусы, заражающие водоросли» . Ежегодный обзор микробиологии . 53 : 447–494. doi : 10.1146/annurev.micro.53.1.447 . PMID 10547698 . S2CID 7346326 .
- Iyer, Lakshminarayan M.; Balaji, S.; Кунин, Юджин В.; Aravind, L. (2006). «Эволюционная геномика нуклео-цитоплазматических вирусов крупных ДНК» . Исследование вируса . 117 (1): 156–184. doi : 10.1016/j.virusres.2006.01.009 . PMID 16494962 .
- Rault, D.; Audic, Stéphane; Роберт, Кэтрин; Абергель, Шанталь; Ренесто, Патриция; Огата, Хироюки; Ла Скола, Бернард; Сюзан, Мари; Клавери, Жан-Мишель (2004). «Последовательность генома 1,2 мегабазы мимивируса». Наука . 306 (5700): 1344–1350. Bibcode : 2004sci ... 306.1344r . Doi : 10.1126/science.1101485 . PMID 15486256 . S2CID 84298461 .
- Домашняя страница World of Chlorella Viruses