Список фенилтропанов
Эта статья может потребовать очистки Википедии для соответствия стандартам качества . Конкретная проблема заключается в том, что в таблицах нечикопедиаки в таблицах: составные цифры, специфичные для определенных ссылок (например, «7e»). ( Май 2019 ) |
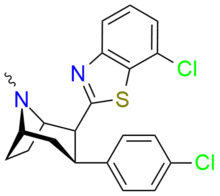
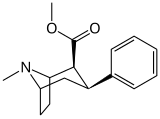
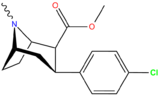
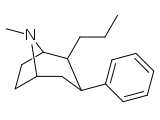
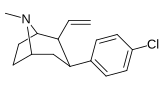
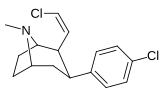
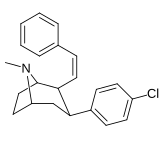
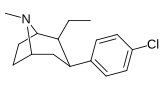
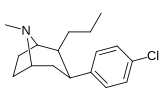
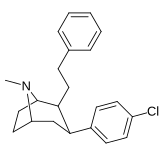
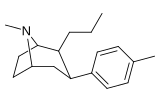
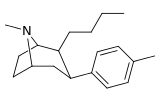
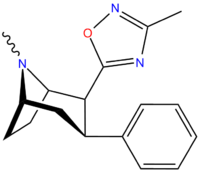
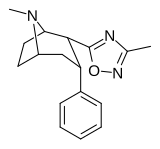
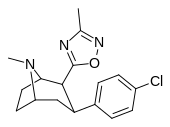
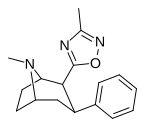
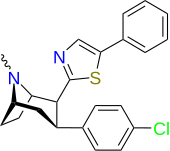
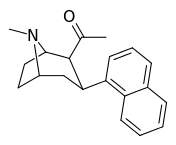
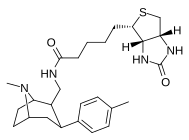
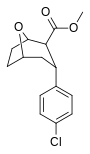
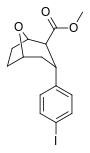
Фенилтропаны ( PT ) представляют собой семейство химических соединений, первоначально полученных из структурной модификации кокаина . Основная особенность, дифференцирующая фенилтропаны от кокаина, заключается в том, что им не хватает функциональности эфира в 3-позиции, заканчивающейся в бензоле ; и, таким образом, фенил прикреплен прямо к тропана скелету без дальнейшей проставки (следовательно, название « фенил кокаина бензоилокси » -тропейн), которое предоставляется . Первоначальная цель которого заключалась в том, чтобы вытащить кардиотоксичность , присущую локальной анестезийной «оцепляющей» способности кокаина (поскольку метилированный эфир бензоата необходим для блокировки кокаина на натриевых каналах , которые вызывают местную анестезию), сохраняя функцию стимулятора . [ А ] Эти соединения представляют множество различных направлений исследований терапевтических применений, особенно в лечении наркомании. Использование варьируется в зависимости от их взаимосвязи конструкции и структуры-активности, начиная от лечения зависимости кокаина до понимания системы вознаграждения дофамина в человеческом мозге до лечения Альцгеймера и Паркинсона болезней . (С 2008 года существуют постоянные дополнения к списку и перечислениям множества типов химических веществ, которые попадают в категорию этого профиля вещества. [ 2 ] ) Определенные фенилтропаны могут даже использоваться в качестве помощи в прекращении курения ( CF RTI-29). Многие из соединений были впервые выяснены в опубликованном материале Институтом исследовательского треугольника и, таким образом, названы «RTI» серийными номерами (в данном случае длинная форма либо Rti-Coc- n , для «кокаина», или аналогового аналога, либо В частности, rti-4229 -n последующих чисел, приведенных ниже в этой статье) [ B ] Точно так же ряд других названы в честь фармацевтических препаратов стерлингового винтропа («выиграть» серийные номеры) и Университет Уэйк Форест («WF» серийные номеры). Следующее включает в себя многие из класса лекарств фенилтропана, которые были произведены и изучены.

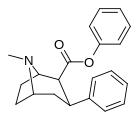
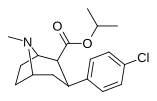
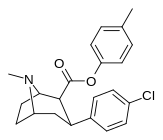
2-карбоксиметиловые эфиры (фенилметиловые экгонины )
[ редактировать ]




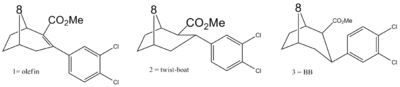
Подобно кокаину, фенилтропаны считаются «типичными» или «классическими» (то есть «кокаиноподобными») лигандами насоса, поскольку они стабилизируют «открытую» конформацию на дофаминовом переносе; Несмотря на чрезвычайное сходство с фенилтропанами, бенцтропин и другие в том же духе не считаются «кокаинообразными» и вместо этого считаются нетипичными ингибиторами, поскольку они стабилизируют то, что считается более внутренним (замкнутым, закрытым) конформационным состоянием. [ 5 ]
Учитывая различия между ПТС и кокаином: разница в длине бензоилокси и фенильной связи, контрастирующей между кокаином и фенилтропанами, обеспечивает более короткое расстояние между центроидом ароматического бензола и азотом моста тропана в последних ПТ. Это расстояние находится в масштабе 5,6 Å для фенилтропанов и 7,7 Å для кокаина или аналогов с бензоилокси нетронутым. [ C ] Способ, которым это устанавливает фенилтропаны в карман связывания в мате, постулируется как одно возможное объяснение для учета PTS повышенной профиль поведенческой стимуляции по сравнению с кокаином. [ D ]
Пустые пространства в таблицах для пропущенных данных используют « Нет данных », " ? ", " - " или " - " взаимозаменяемо.
Структура 
|
Короткое имя т.е. тривиальный iupac (несистематическое) Имя ( # Сингха ) |
R ( пара -подстановка) бензола |
И [ 3 H] выиграть 35428 IC 50 нм ( K I NM) |
5HT [ 3 H] пароксетин IC 50 нм ( K I NM) |
NE [ 3 H] нисоксетин IC 50 нм ( K I NM) |
селективность 5-HTT/DAT |
селективность Не / это |
|---|---|---|---|---|---|---|---|
| кокаин (бензоилокситропан) |
ЧАС | 102 ± 12 241 ± 18 ɑ |
1045 ± 89 112 ± 2 беременный |
3298 ± 293 160 ± 15 в |
10.2 0.5 дюймовый |
32.3 0.7 и | |
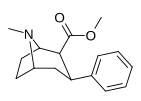 |
( Пара -гидроген) фенилтропан Win 35.065-2 (β-CPT [ E ] ) Тропарил 11A |
ЧАС | 23 ± 5.0 49.8 ± 2.2 ɑ |
1962 ± 61 173 ± 13 беременный |
920 ± 73 37.2 ± 5.2 в |
85.3 3.5 дюймовый |
40.0 0.7 и |
 |
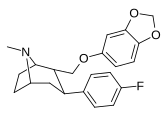
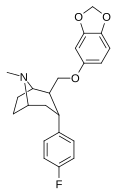
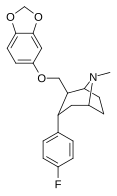
Пара -флорофенилтроп Выиграйте 35 428 (B-CFT [ f ] ) 11b |
Фон | 14 (15.7 ± 1.4) 22.9 ± 0.4 ɑ |
156 (810 ± 59) 100 ± 13 беременный |
85 (835 ± 45) 38.6 ± 9.9 в |
51.6 4.4 дюймовый |
53.2 1.7 и |
 |
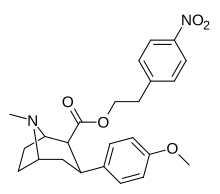
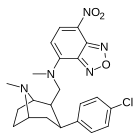
Пара -нитрофенилтроп 11K |
№ 2 | 10.1 ± 0.10 | ? | ? | ? | ? |
 |
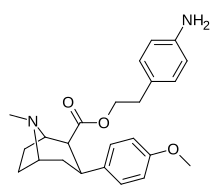
Пара -аминофенилтроп RTI-29 [ 6 ] 11 |
NH 2 | 9.8 24.8 ± 1.3 глин |
5110 | 151 | 521.4 | 15.4 |
 |
Пара -Чорофенилтроп RTI-31 11C |
Калькуляция | 1.12 ± 0.06 3.68 ± 0.09 ɑ |
44.5 ± 1.3 5.00 ± 0.05 беременный |
37 ± 2.1 5.86 ± 0.67 в |
39.7 1.3 дюймовый |
33.0 1.7 и |
 |
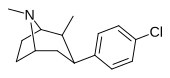
Пара -метилфенилтропан RTI-32 Толпане 11f |
Мне | 1.71 ± 0.30 7.02 ± 0.30 ɑ |
240 ± 27 19.38 ± 0.65 беременный |
60 ± 0.53 и 8.42 ± 1.53 в |
140 2.8 дюймовый |
35.1 1.2 и |
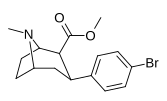 |
Пара -бромофенилтроп RTI-51 Бромопан 11d |
Бренд | 1.81 (1.69) ± 0.30 | 10.6 ± 0.24 | 37.4 ± 5.2 | 5.8 | 20.7 |
 |
Пара -одофенилтропан RTI-55 (β-CIT) слегка 11E |
я | 1.26 ± 0.04 1.96 ± 0.09 ɑ |
4.21 ± 0.3 1.74 ± 0.23 беременный |
36 ± 2.7 7.51 ± 0.82 в |
3.3 0.9 дюймовый |
28.6 3.8 и |
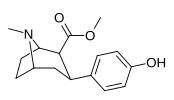 |
Пара -гидроксифенилтропан 11ч |
ОЙ | 12.1 ± 0.86 | — | — | — | — |
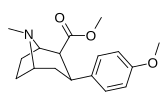 |
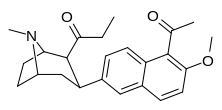
Пара -метоксифенилтропан 11 |
OCH 3 | 8.14 ± 1.3 | — | — | — | — |
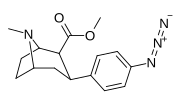 |
Пара -азидофенилтропан 11L |
N 3 | 2.12 ± 0.13 | — | — | — | — |
 |
Пара -трифторметилфенилтропан 11m |
Ср . 3 | 13.1 ± 2.2 | — | — | — | — |
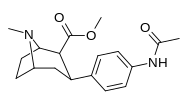 |
Пара -ацетиламинофенилтропан 11N |
Нхкоч 3 | 64.2 ± 2.6 | — | — | — | — |
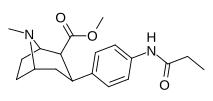 |
Пара -пропиониламинофенилтропан 11o |
NHCOC 2 H 5 | 121 ± 2.7 | — | — | — | — |
 |
Пара -этоксикарбониламинофенилтропан 11 с |
NHCO 2 C 3 H5 | 316 ± 48 | — | — | — | — |
 |
Пара -триметилстанилфенилтропан 11q |
Sn (Ch 3 ) 3 | 144 ± 37 | — | — | — | — |
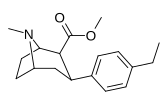 |
Пара -этилфенилтропан RTI-83 11G |
И | 55 ± 2.1 | 28.4 ± 3.8 (2.58 ± 3.5) |
4030 (3910) ± 381 (2360 ± 230) |
0.5 | 73.3 |
 |
para - n -пропилфенилтропан RTI-282 я 11r |
N -c 3 H 7 | 68.5 ± 7.1 | 70.4 ± 4.1 | 3920 ± 130 | 1.0 | 57.2 |
 |
Пара -изопропилфенилтропан 11 с |
Ch (Ch 3 ) 2 | 597 ± 52 | 191 ± 9.5 | 75000 ± 5820 | 0.3 | 126 |
 |
Пара -винилфенилтропан RTI-359 11t |
CH-CH 2 | 1.24 ± 0.2 | 9.5 ± 0.8 | 78 ± 4.1 | 7.7 | 62.9 |
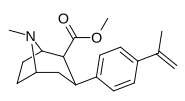 |
Пара -метилэтенилфенилтропан RTI-283 Дж 11U |
C (= CH 2 ) CH 3 | 14.4 ± 0.3 | 3.13 ± 0.16 | 1330 ± 333 | 0.2 | 92.4 |
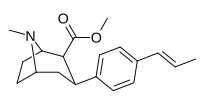 |
Пара - транспропенилфенилтропан RTI-296 я 11 В |
Trans -Ch = CHCH 3 | 5.29 ± 0.53 | 11.4 ± 0.28 | 1590 ± 93 | 2.1 | 300 |
 |
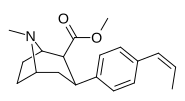
Пара -Аллилфенилтропан 11x |
CH 2 CH = CH 2 | 32.8 ± 3.1 | 28.4 ± 2.4 | 2480 ± 229 | 0.9 | 75.6 |
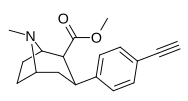 |
Пара -Эфинилфенилтропан RTI-360 11y |
C≡CH | 1.2 ± 0.1 | 4.4 ± 0.4 | 83.2 ± 2.8 | 3.7 | 69.3 |
 |
para -propynylphenyltropane RTI-281 я 11z |
C≡CCH 3 | 2.37 ± 0.2 | 15.7 ± 1.5 | 820 ± 46 | 6.6 | 346 |
 |
пара - цис -пропенилфенилтропан RTI-304 11 Вт |
cis -Ch = chch 3 | 15 ± 1.2 | 7.1 ± 0.71 | 2,800 k ± 300 | 0.5 | 186.6 k |
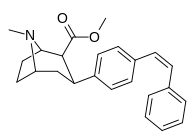 |
пара -( z ) -фенилэтенилфенилтропановый | CIS -CH = CHPH | 11.7 ± 1.12 | — | — | — | — |
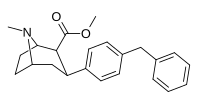 |
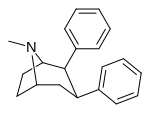
Пара -бензилфенилтропан | -H 2 -ph | 526 ± 65 | 7,240 ± 390 (658 ± 35) |
6670 ± 377 (606 ± 277) |
13.7 | 12.6 |
 |
Пара -фенилэенилфенилтропан | Ch 2 ║ -C-ph |
474 ± 133 | 2,710 ± 800 (246 ± 73) |
7,060 ± 1,760 (4,260 ± 1,060) |
5.7 | 14.8 |
 |
Пара -фенилэтилфенилтропан л | -(Ch 2 ) 2 -ph | 5.14 ± 0.63 | 234 ± 26 (21.3 ± 2.4) |
10.8 ± 0.3 (6.50 ± 0.20) |
45.5 | 2.1 |
 |
пара -( e ) -фенилэтенилфенилтропан л RTI-436 |
Trans –CH = CHPH | 3.09 ± 0.75 | 335 ± 150 (30.5 ± 13.6) |
1960 ± 383 (1180 ± 231) |
108.4 | 634.3 |
 |
Пара -фенилпропилфенилтропан л | -(Ch 2 ) 3 -ph | 351 ± 52 | 1,243 ± 381 (113 ± 35) |
14,200 ± 1,800 (8,500 ± 1,100) |
3.5 | 40.4 |
 |
Пара -фенилпропенилфенилтропан л | -C = CH -Ch 2 -ph | 15.8 ± 1.31 | 781 ± 258 (71 ± 24) |
1,250 ± 100 (759 ± 60) |
49.4 | 79.1 |
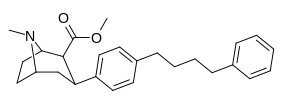 |
Пара -фенилбутилфенилтропан л | -(Ch 2 ) 4 -ph | 228 ± 21 | 4,824 ± 170 (439 ± 16) |
2,310 ± 293 (1,390 ± 177) |
21.1 | 10.1 |
 |
Пара -фенилэтинилфенилтропан л RTI-298 [ 7 ] |
–T -ph | 3.7 ± 0.16 | 46.8 ± 5.8 (4.3 ± 0.53) |
347 ± 25 (209 ± 15) |
12.6 | 93.7 |
 |
Пара -фенилпропионилфенилтропан л [ 8 ] | –C≡C-CH 2 PH | 1.82 ± 0.42 | 13.1 ± 1.7 (1.19 ± 0.42) |
27.4 ± 2.6 (16.5 ± 1.6) |
7.1 | 15 |
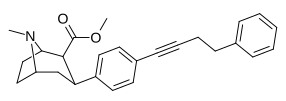 |
Пара -фенилбутинилфенилтропан л RTI-430 |
-Cспеют (c 2 ) 2 ph | 6.28 ± 1.25 | 2180 ± 345 (198 ± 31) |
1470 ± 109 (885 ± 66) |
347.1 | 234 |
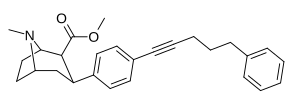 |
Пара -фенилпиннилфенилтропан л | –C≡C- (ch 2 ) 3 -ph | 300 ± 37 | 1,340 ± 232 (122 ± 21) |
4,450 ± 637 (2,680 ± 384) |
4.46 | 14.8 |
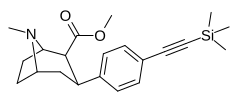 |
Para -trimethylsilylethyynylphenyltropane [ 3 ] | — | — | — | — | — | — |
 |
Para -HydroxyPropyNylphenyltropane [ 3 ] | — | — | — | — | — | — |
 |
Пара -гидроксигексинилфенилтропан л | –C≡C- (Ch 2 ) 4 OH | 57 ± 4 | 828 ± 29 (75 ± 2.6) |
9,500 ± 812 (5,720 ± 489) |
14.5 | 166.6 |
 |
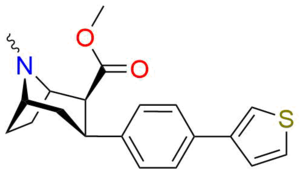
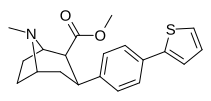
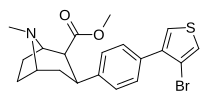
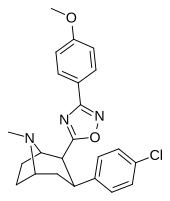
Пара- (тиофен-3-ил) фенилтропан Тамагнан [ 4 ] |
П - Тиофен | 12 | 0.017 | 189 | 0.001416 | 15.7 |
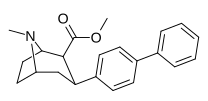 |
Пара -бифенилтропан 11AA |
PH | 10.3 ± 2.6 фон 29.4 ± 3.8 ɑ 15.6 ± 0.6 |
95.8 ± 36 (8.7 ± 3.3) |
1,480 ± 269 (892 ± 162) |
6.1 | 94.8 |
 |
3β-2-нафтилтропан RTI-318 11bb |
3β-2- нафтил | 0.51 ± 0.03 3.32 ± 0.08 фон 3.53 ± 0.09 ɑ |
0.80 ± 0.06 (0.07 ± 0.1) |
21.1 ± 1.0 (12.7 ± 0.60) |
1.5 | 41.3 |
 |
Пара -биметоксифенилтропан 15 |
Och 2 och 3 час | — | — | — | — | — |
|
|
|
(4'-монозамещенные 2,3-тиофеновые фенил) -тропаны
[ редактировать ]| Составная структура | Буквенно -цифровой код (имя) |
Пара -подставление | N8 | ЖЕСТКИЙ | ЧТО | СЕТЬ | Селективность SERT против этого |
Селективность SERT против сети |
|---|---|---|---|---|---|---|---|---|
| 1 (кокаин) |
(-)-Кокаин | Ch 3 | 1050 | 89 | 3320 | 0.08 | 3.2 | |
| 2 (β-cit), (слегкаэтопан) |
Йод | Ch 3 | 0.46 ± 0.06 | 0.96 ± 0.15 | 2.80 ± 0.40 | 2.1 | 6.1 | |
| ( R , s -циталопрам) | — | — | 1.60 | 16,540 | 6,190 | 10,338 | 3,869 | |
 |
4а | 2-тиофен | Ch 3 | 0.15 ± 0.015 | 52 ± 12.8 | 158 ± 12 | 346 | 1,053 |
 |
4B (Тамагнан) |
3-тиофен | Ch 3 | 0.017 ± 0.004 | 12.1 ± 3 | 189 ± 82 | 710 | 11,118 |
 |
4C | 2- (5-Br) -Thiophene | Ch 3 | 0.38 ± 0.008 | 6.43 ± 0.9 | 324 ± 19 | 17 | 853 |
 |
4d | 2- (5-CL) -Thiophene | Ch 3 | 0.64 ± 0.04 | 4.42 ± 1.64 | 311 ± 25 | 6.9 | 486 |
 |
4E. | 2- (5-I) -Thiophene | Ch 3 | 4.56 ± 0.84 | 22.1 ± 3.2 | 1,137 ± 123 | 4.9 | 249 |
 |
4F | 2- (5-NH 2 ) -Thiophene | Ch 3 | 64.7 ± 3.7 | > 10000 | > 30 000 | > 155 | > 464 |
 |
4G | 2- (4,5-нет 2 ) -Thiophene | Ch 3 | 5,000 | > 30 000 | > 10000 | > 6,0 | > 2.0 |
 |
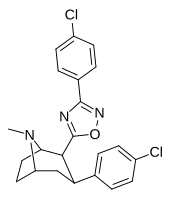
4 часа | 3- (4-Br) -Thiophene | Ch 3 | 4.02 ± 0.34 | 183 ± 69 | > 10000 | 46 | > 2488 |
 |
5A | 2-тиофен | ЧАС | 0.11 ± 0.006 | 12.2 ± 0.9 | 75.3 ± 9.6 | 111 | 685 |
 |
5b | 3-тиофен | ЧАС | 0.23 ± 0.02 | 6.4 ± 0.27 | 39 ± 0.8 | 28 | 170 |
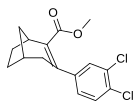
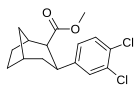
(3 ', 4'-диспущенные фенил) -тропаны
[ редактировать ]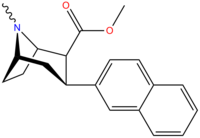

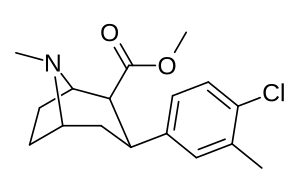
| Сложный (+ Имя С. Сингха) |
Х (4'- до ) |
И (3'- мета ) |
2 позиции | конфигурация | 8 | И | 5-HT | NE |
|---|---|---|---|---|---|---|---|---|
| RTI-318 11bb |
β-нафтил | Co 2 я | Б.Б. | NME | 0.5 | 0.81 | 20 | |
| Дихлорпан (RTI-111 ɑ ) [ 10 ] 17с |
Калькуляция | Калькуляция | Co 2 я | Б.Б. | NME | 0.79 | 3.13 | 18.0 |
| Rti-88 [перепроверка] 17e |
NH 2 | я | Co 2 я | Б.Б. | NME | 1.35 | 1329 в | 320 в |
| RTI-97 17d |
NH 2 | Бренд | Co 2 я | Б.Б. | NME | 3.91 | 181 | 282 |
| RTI-112 беременный 17b |
Калькуляция | Мне | Co 2 я | Б.Б. | NME | 0.82 | 10.5 | 36.2 |
| RTI-96 17а |
Фон | Мне | Co 2 я | Б.Б. | NME | 2.95 | 76 | 520 |
| RTI-295 | И | я | Co 2 я | Б.Б. | NME | 21.3 | 2.96 | 1349 |
| RTI-353 (EINT) | И | я | Co 2 я | Б.Б. | Нын -н.э. | 331 | 0.69 | 148 |
| RTI-279 | Мне | я | Co 2 я | Б.Б. | Нын -н.э. | 5.98 | 1.06 | 74.3 |
| RTI-280 | Мне | я | Co 2 я | Б.Б. | NME | 3.12 | 6.81 | 484 |
| Мельцер [ 11 ] | катехол | Co 2 я | Б.Б. | NME | > 100 | ? | ? | |
| Мельцер [ 11 ] | Ок | Ок | Co 2 я | Б.Б. | NME | ? | ? | ? |
- ɑ как · hcl (соль)
- беременный как · hcl · 2 H 2 O (соль)
- в Сингх дает обратное значение по отношению к IE 1329 для Net & 320 для 5-HT
Сложный 
|
Короткое имя (С. Сингх) |
Ведущий 2 | Ведущий 1 | И | 5HT | NE | Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|---|
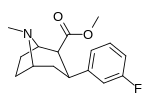 |
Мета -флорофенилтроп 16A |
Фон | ЧАС | 23 ± 7.8 | - | - | - | - |
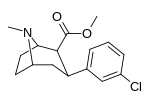 |
Мета -хлорофенилтропан 16b |
Калькуляция | ЧАС | 10.6 ± 1.8 | - | - | - | - |
 |
Метабромофенилтропан 16с |
Бренд | ЧАС | 7.93 ± 0.08 ɑ | - | - | - | - |
 |
Мета -одофенилтропан 16d |
я | ЧАС | 26.1 ± 1.7 | - | - | - | - |
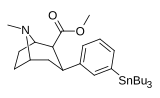 |
Мета -трибулстанилфенилтропан 16e |
SNBU 3 | ЧАС | 1100 ± 170 | - | - | - | - |
 |
Мета -Эфинилфенилтропан [ 3 ] | C≡CH | ЧАС | - | - | - | - | - |
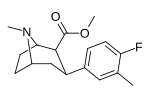 |
мета -метил -пара -флорофенилтропан RTI-96 17а |
Ch 3 | Фон | 2.95 ± 0.58 | - | - | - | - |
 |
мета -метил -пара RTI-112 в 17b |
Ch 3 | Калькуляция | 0.81 ± 0.05 | 10.5 ± 0.05 | 36.2 ± 1.0 | 13.0 | 44.7 |
 |
Мета - пара -дихлорфенилтропан RTI-111 беременный [ 10 ] Дихлорпан 17с |
Калькуляция | Калькуляция | 0.79 ± 0.08 беременный | 3.13 ± 0.36 беременный | 18.0 ± 0.8 17.96 ± 0.85 ' b' d |
4.0 беременный | 22.8 беременный |
 |
Мета -бром -аминофенилтропан RTI-97 17d |
Бренд | NH 2 | 3.91 ± 0.59 | 181 | 282 | 46.2 | 72.1 |
 |
Мета -йодо -пара -аминофенилтропан RTI-88 17e |
я | NH 2 | 1.35 ± 0.11 | 120 ± 4 | 1329 ± 124 | 88.9 | 984 |
 |
Мета -одо -пара -азидофенилтропан 17f |
я | N 3 | 4.93 ± 0.32 | - | - | - | - |
- ɑ IC 50, определяемый в циномолгозной обезьяне хвостат-путамен
- беременный как · hcl (соль)
- в как · hcl · 2 H 2 O (соль)
- дюймовый NEС
Структура 
|
Сложный | Ведущий | Х | не | Ингибирование [ 3 H] выиграть 35 428 @ ЧТО IC 50 (нм) |
Ингибирование [ 3 H] пароксетин @ 5-HTT K I (NM) |
Ингибирование [ 3 H] нисоксетин @ СЕТЬ K I (NM) |
Не / это (коэффициент поглощения) |
NET/5-HTT (коэффициент поглощения) |
|---|---|---|---|---|---|---|---|---|---|
| Кокаин | Des-thio/сульфинил/сульфонил ЧАС |
ЧАС | Десметил 0 |
89.1 | 95 | 1990 | 22 | 21 | |
| Пара -метоксифенилтропан Сингх: 11i |
Des-thio/сульфинил/сульфонил OCH 3 |
ЧАС | 0 | 6.5 ± 1.3 | 4.3 ± 0.5 | 1110 ± 64 | 171 | 258 | |
 |
7A | Ch 3 | ЧАС | 0 | 9 ± 3 | 0.7 ± 0.2 | 220 ± 10 | 24 | 314 |
 |
7b | C 2 H 5 | ЧАС | 0 | 232 ± 34 | 4.5 ± 0.5 | 1170 ± 300 | 5 | 260 |
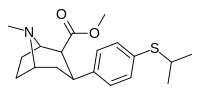 |
7C | Ch (Ch 3 ) 2 | ЧАС | 0 | 16 ± 2 | 23 ± 2 | 129 ± 2 | 8 | 7 |
 |
7d | Ср . 3 | ЧАС | 0 | 200 ± 70 | 8 ± 2 | 1900 ± 300 | 10 | 238 |
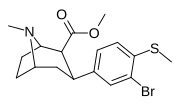 |
7e. | Ch 3 | Бренд | 0 | 10.1 ± 1 | 0.6 ± 0.2 | 121 ± 12 | 12 | 202 |
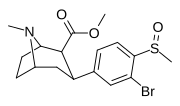 |
7f | Ch 3 | Бренд | 1 | 76 ± 18 | 3.2 ± 0.4 | 690 ± 80 | 9 | 216 |
 |
7G | Ch 3 | ЧАС | 1 | 91 ± 16 | 4.3 ± 0.6 | 515 ± 60 | 6 | 120 |
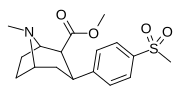 |
7 часов | Ch 3 | ЧАС | 2 | > 10000 | 208 ± 45 | > 10000 | 1 | 48 |
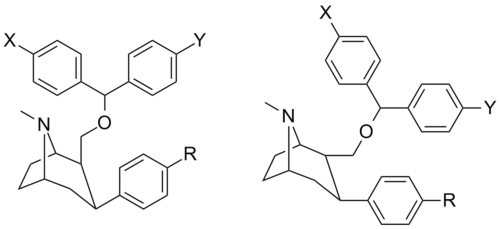
(2 ′, 4'-распределенные фенил) -тропаны
[ редактировать ]Составная структура 
|
Тривиальный iupac (несистематическое) Имя |
Ведущий 2 орто |
Ведущий 1 к |
И | 5HT | NE | Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|---|
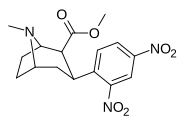 |
Орто , пара -динитрофенилтропан [ 13 ] | № 2 | № 2 | - | - | - | - | - |
(3 ', 4 ′, 5'-тризамещенные пара -метоксифенил) -тропаны
[ редактировать ]Структура 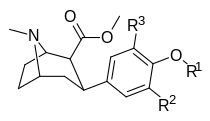
|
Короткое имя (Все соединения протестированы как соли HCL) |
Ведущий 2 3 ′-( мета ) |
Ведущий 3 5 ′- (ди- мета ) |
ИЛИ 1 4 ′-( до ) |
ЧТО IC 50 [ 3 H] (соединение #) 12 |
5-HTT K я [ 3 H] пароксетин |
СЕТЬ K я [ 3 H] нисоксетин |
Селективность Не / это Соотношение K I /IC 50 |
Селективность NET/5-HTT Соотношение K i / k i |
|---|---|---|---|---|---|---|---|---|---|
| Кокаин | - | - | - | 89.1 | 95 | 1990 | 22 | 21 | |
| 6 RTI-112 |
- | - | - | 0.82 ± 0.05 | 0.95 ± 0.04 | 21.8 ± 0.6 | 27 | 23 | |
 |
7A 11 |
ЧАС | ЧАС | Ch 3 | 6.5 ± 1.3 | 4.3 ± 0.5 | 1110 ± 64 | 171 | 258 |
 |
7b | ЧАС | ЧАС | C 2 H 5 | 92 ± 8 | 1.7 ± 0.4 | 1690 ± 50 | 18 | 994 |
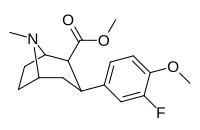 |
7C | Фон | ЧАС | Ch 3 | 16 ± 1 | 4.8 ± 0.5 | 270 ± 50 | 17 | 56 |
 |
7d | Бренд | ЧАС | Ch 3 | 47 ± 15 | 3.1 ± 0.1 | 160 ± 20 | 3 | 52 |
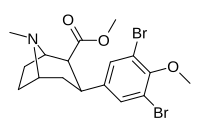 |
7f | Бренд | Бренд | Ch 3 | 92 ± 22 | 2.9 ± 0.1 | 4100 ± 400 ɑ | 45 | 1413 |
 |
7e. | я | ЧАС | Ch 3 | 170 ± 60 | 3.5 ± 0.4 | 180 ± 20 | 1 | 51 |
 |
7G | я | я | Ch 3 | 1300 ± 200 | 7.5 ± 0.8 | 180 ± 20 | 4 | 667 |
ɑ N = 2
(2 ′, 4 ′, 5'-трисабститный фенил) -тропаны
[ редактировать ]| Структура | Короткое имя | Ведущий 1 2 ′-( орто ) |
Ведущий 2 4 ′-( до ) |
Ведущий 3 5 ′-( мета ) |
ЧТО | 5-HTT | СЕТЬ | Селективность Не / это Соотношение |
Селективность NET/5-HTT Соотношение |
|---|---|---|---|---|---|---|---|---|---|
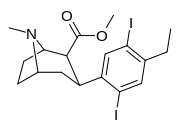 |
пара -этил -орто, мета -дииодофенилтропан [ 3 ] | йод | этил | йод | - | - | - | - | - |
Модифицировано 2-угреволочная (замененная/заменить)
[ редактировать ]Общие 2-кратные модификации
[ редактировать ]2β-подключение P -метокси-фенилтропанов
[ редактировать ]Структура 
|
Короткое имя (Все соединения протестированы как соли HCL) |
CO 2 R (2β-замещенная) (Соединение 9 равно 2β = r ) |
ЧТО IC 50 [ 3 H] (соединение #) 12 |
5-HTT K я [ 3 H] пароксетин |
СЕТЬ K я [ 3 H] нисоксетин |
Селективность Не / это Соотношение K I /IC 50 |
Селективность NET/5-HTT Соотношение K i / k i |
|---|---|---|---|---|---|---|---|
 |
7A 11 |
Ch 3 | 6.5 ± 1.3 | 4.3 ± 0.5 | 1110 ± 64 | 171 | 258 |
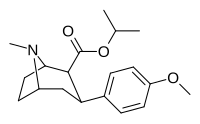 |
8а | (C 3 ) 2 Ch | 14 ± 3 | 135 ± 35 | 2010 ± 200 | 144 | 15 |
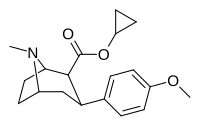 |
8B | Циклопропан | 6.0 ± 2 | 29 ± 3 | 1230 ± 140 | 205 | 42 |
 |
8C | Циклобутан | 13 ± 3 | 100 ± 8 | > 3000 | 231 | 30 |
 |
8d | O 2 n ... 1,4-ксилен ... (Ch 2 ) 2 | 42 ± 8 | 2.9 ± 0.2 | 330 ± 20 | 8 | 114 |
 |
8e. | H 2 n ... 1,4-ксилен ... (Ch 2 ) 2 | 7.0 ± 2 | 8.3 ± 0.4 | 2200 ± 300 ɑ | 314 | 265 |
 |
8f | CH 3 CONH ... 1,4-ксилен ... (Ch 2 ) 2 | 6.0 ± 1 | 5.5 ± 0.5 | 1460 ± 30 | 243 | 265 |
 |
8G | H 2 N ... 2-Бром-1,4-диметилбензол ... (Ch 2 ) 2 | 3.3 ± 1.4 | 4.1 ± 0.6 | 1850 ± 90 | 561 | 451 |
 |
8 часов | H 2 N ... 1,3-дибром-2,5-диметилбензол ... (Ch 2 ) 2 | 15 ± 6 | 2.0 ± 0.4 | 2710 ± 250 ɑ | 181 | 1360 |
 |
8i | H 2 n ... 2-oido-1,4-диметилбензол ... (Ch 2 ) 2 | 2.5 ± 0.7 | 3.5 ± 1 | 2040 ± 300 ɑ | 816 | 583 |
 |
8J | H 2 n ... 1,3-диайоо-2,5-диметилбензол ... (Ch 2 ) 2 | 102 ± 15 | 1.0 ± 0.1 | 2600 ± 200 ɑ | 25 | 2600 |
 |
9 | 3- (4-метилфенил) -1,2-оксазол | 18 ± 6 | 860 ± 170 | > 3000 | 167 | 3 |
ɑ N = 2
2β-карбокси с боковой цепочкой ( P -Chloro/iodo/Methyl) фенилтропаны
[ редактировать ]Сложный 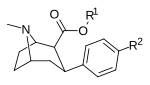
|
Короткое имя (С. Сингх) |
Ведущий | Х | IC 50 (нм) ЧТО [ 3 H] выиграть 35428 |
IC 50 (нм) 5-HTT [ 3 H] пароксетин |
IC 50 (нм) СЕТЬ [ 3 H] нисоксетин |
Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|---|
 |
23а | Ch (Ch 3 ) 2 | ЧАС | 85.1 ± 2.5 | 23121 ± 3976 | 32047 ± 1491 | 272 | 376 |
 |
23B | C 6 H 5 | ЧАС | 76.7 ± 3.6 | 106149 ± 7256 | 19262 ± 593 | 1384 | 251 |
 |
24а | Ch (Ch 3 ) 2 | Калькуляция | 1.4 ± 0.13 6.04 ± 0.31 ɑ |
1400 ± 7 128 ± 15 беременный |
778 ± 21 250 ± 0.9 в |
1000 21.2 дюймовый |
556 41.4 и |
 |
24B | Циклопропил | Калькуляция | 0.96 ± 0.10 | 168 ± 1.8 | 235 ± 8.39 | 175 | 245 |
 |
24C | C 6 H 5 | Калькуляция | 1.99 ± 0.05 5.25 ± 0.76 ɑ |
2340 ± 27 390 ± 34 беременный |
2960 ± 220 242 ± 30 в |
1176 74.3 дюймовый |
1.3 41.6 и |
 |
24d | C 6 H 4 -4 -I | Калькуляция | 32.6 ± 3.9 | 1227 ± 176 | 967.6 ± 26.3 | 37.6 | 29.7 |
 |
24 -й | C 6 H 4 -3 -CH 3 | Калькуляция | 9.37 ± 0.52 | 2153 ± 143 | 2744 ± 140 | 230 | 293 |
 |
24f | C 6 H 4 -4 -CH 3 | Калькуляция | 27.4 ± 1.5 | 1203 ± 42 | 1277 ± 118 | 43.9 | 46.6 |
 |
24G | C 6 H 4 -2 -CH 3 | Калькуляция | 3.91 ± 0.23 | 3772 ± 384 | 4783 ± 387 | 965 | 1223 |
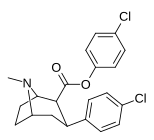 |
24 часа | C 6 H 4 -4 -Cl | Калькуляция | 55 ± 2.3 | 16914 ± 1056 | 4883 ± 288 | 307 | 88.8 |
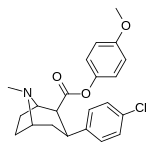 |
24 | C 6 H 4 -4 -Och 3 | Калькуляция | 71 ± 5.6 | 19689 ± 1843 | 1522 ± 94 | 277 | 21.4 |
 |
24J | (Ch 2 ) 2 C 6 H 4 -4 -нет 2 | Калькуляция | 2.71 ± 0.13 | - | - | - | - |
 |
24K | (CH) 2 C 6 H 4 -4 -NH 2 | Калькуляция | 2.16 ± 0.25 | - | - | - | - |
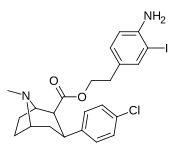 |
24L | (Ch 2 ) 2 C 6 H 3 -3-I-4-NH 2 | Калькуляция | 2.51 ± 0.25 | - | - | - | - |
 |
24 м | (Ch 2 ) 2 C 6 H 3 -E-4-N 3 | Калькуляция | 14.5 ± 0.94 | - | - | - | - |
 |
24n | (Ch 2 ) 2 C 6 H 4 -N3 -4 | Калькуляция | 6.17 ± 0.57 | - | - | - | - |
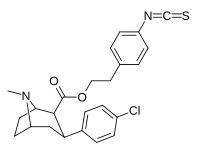 |
24. | (Ch 2 ) 2 C 6 H 4 -4 -NCS | Калькуляция | 5.3 ± 0.6 | - | - | - | - |
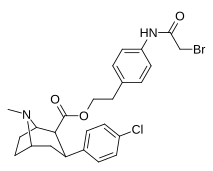 |
24 с | (Ch 2 ) 2 C 6 H 4 -4 -NHCOCH 2 BR | Калькуляция | 1.73 ± 0.06 | - | - | - | - |
 |
25а | Ch (Ch 3 ) 2 | я | 0.43 ± 0.05 2.79 ± 0.13 ɑ |
66.8 ± 6.53 12.5 ± 1.0 беременный |
285 ± 7.6 41.2 ± 3.0 в |
155 4.5 дюймовый |
663 14.8 и |
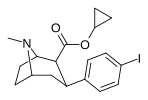 |
25b | Циклопропил | я | 0.61 ± 0.08 | 15.5 ± 0.72 | 102 ± 11 | 25.4 | 167 |
 |
25с | C 6 H 5 | я | 1.51 ± 0.34 6.85 ± 0.93 ɑ |
184 ± 22 51.6 ± 6.2 беременный |
3791 ± 149 32.7 ± 4.4 в |
122 7.5 дюймовый |
2510 4.8 и |
 |
26а | Ch (Ch 3 ) 2 | Ch 3 | 6.45 ± 0.85 15.3 ± 2.08 ɑ |
6090 ± 488 917 ± 54 беременный |
1926 ± 38 73.4 ± 11.6 в |
944 59.9 дюймовый |
299 4.8 и |
 |
26b | Ch (C 2 H 5 ) 2 | Ch 3 | 19.1 ± 1 | 4499 ± 557 | 3444 ± 44 | 235 | 180 |
 |
26с | Циклопропил | Ch 3 | 17.8 ± 0.76 | 485 ± 21 | 2628 ± 252 | 27.2 | 148 |
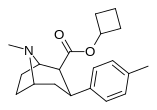 |
26д | циклобутил | Ch 3 | 3.74 ± 0.52 | 2019 ± 133 | 4738 ± 322 | 540 | 1267 |
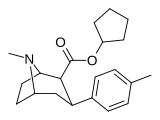 |
26E | Циклопентил | Ch 3 | 1.68 ± 0.14 | 1066 ± 109 | 644 ± 28 | 634 | 383 |
 |
26f | C 6 H 5 | Ch 3 | 3.27 ± 0.06 9.13 ± 0.79 ɑ |
24500 ± 1526 1537 ± 101 беременный |
5830 ± 370 277 ± 23 в |
7492 168 дюймовый |
1783 30.3 и |
 |
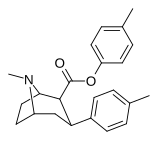
26 г | C 6 H 4 -3 -CH 3 | Ch 3 | 8.19 ± 0.90 | 5237 ± 453 | 2136 ± 208 | 639 | 261 |
 |
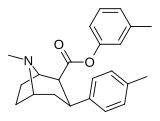
26h | C 6 H 4 -4 -CH 3 | Ch 3 | 81.2 ± 16 | 15954 ± 614 | 4096 ± 121 | 196 | 50.4 |
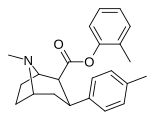 |
26 | C 6 H 4 -2 -CH 3 | Ch 3 | 23.2 ± 0.97 | 11040 ± 504 | 25695 ± 1394 | 476 | 1107 |
 |
26J | C 6 H 4 -4 -Cl | Ch 3 | 117 ± 7.9 | 42761 ± 2399 | 9519 ± 864 | 365 | 81.3 |
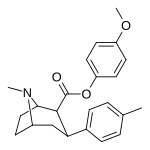 |
26K | C 6 H 4 -4 -Och 3 | Ch 3 | 95.6 ± 8.8 | 82316 ± 7852 | 3151 ± 282 | 861 | 33.0 |
- ɑ Ценность KI для перемещения [ 3 H] DA поглощение.
- беременный Ценность KI для перемещения [ 3 H] 5-HT поглощение.
- в Ценность KI для перемещения [ 3 H] не входы.
- дюймовый [ 3 H] 5-HT поглощение [ 3 H] Коэффициент поглощения DA.
- и [ 3 H] не дает этого [ 3 H] Коэффициент поглощения DA.
Карбоксиарил
[ редактировать ]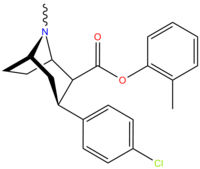


| Сложный | Х | 2 позиции | конфигурация | 8 | И | 5-HT | NE |
|---|---|---|---|---|---|---|---|
| RTI-122 | я | -Co 2 ph | Б.Б. | NME | 1.50 | 184 | 3,791 |
| RTI-113 | Калькуляция | -Co 2 ph | Б.Б. | NME | 1.98 | 2,336 | 2,955 |
| RTI-277 | № 2 | -Co 2 ph | Б.Б. | NME | 5.94 | 2,910 | 5,695 |
| RTI-120 [перепроверка] | Мне | -Co 2 ph | Б.Б. | NME | 3.26 | 24,471 | 5,833 |
| RTI-116 | Калькуляция | -Co 2 ( P -c 6 H 4 I) | Б.Б. | NME | 33 | 1,227 | 968 |
| RTI-203 | Калькуляция | CO 2 ( M -C 6 H 4 ME) | Б.Б. | NME | 9.37 | 2153 | 2744 |
| RTI-204 | Калькуляция | -Co 2 ( o -c 6 H 4 me) | Б.Б. | NME | 3.91 | 3,772 | 4,783 |
| RTI-205 | Мне | -Co 2 ( m -c 6 H 4 me) | Б.Б. | NME | 8.19 | 5,237 | 2,137 |
| RTI-206 | Калькуляция | -Co 2 ( p -c 6 H 4 me) | Б.Б. | NME | 27.4 | 1,203 | 1,278 |
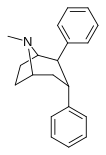
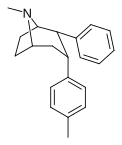
2-фенил-3-фенилтропаны
[ редактировать ]| Составная структура | Короткое имя (С. Сингх) |
Стереохимия | Х ( к ) |
ЧТО [ 3 H] выиграть 35428 IC 50 (нм) |
ЧТО [ 3 H] Мазиндол К я (нм) |
5-HTT [ 3 H] пароксетин IC 50 (нм) |
[ 3 H] DA поглощение K I (NM) | [ 3 H] 5-HT поглощение K I (NM) | Селективность [ 3 H] 5-HT/[ 3 Рука |
|---|---|---|---|---|---|---|---|---|---|
| Кокаин | (2b, 3b) | (ЧАС) | 89 ± 4.8 | 281 | 1050 ± 89 | 423 | 155 | 0.4 | |
 |
67а | 2b, 3b | ЧАС | 12.6 ± 1.8 | 14.9 | 21000 ± 3320 | 28.9 | 1100 | 38.1 |
 |
67b | 2B, 3A | ЧАС | - | 13.8 | - | 11.7 | 753 | 64.3 |
 |
67с | 2а, 3а | ЧАС | 690 ± 37 | - | 41300 ± 5300 | - | - | - |
 |
68 | 2B, 3A | Фон | - | 6.00 | - | 4.58 | 122 | 26.6 |
 |
69а | 2b, 3b | Ch 3 | 1.96 ± 0.08 | 2.58 | 11000 ± 83 | 2.87 | 73.8 | 25.7 |
 |
69b | 2B, 3A | Ch 3 | - | 2.87 | - | 4.16 | 287 | 69.0 |
 |
69с | 2а, 3а | Ch 3 | 429 ± 59 | - | 15800 ± 3740 | - | - | - |
Карбоксиалкил
[ редактировать ]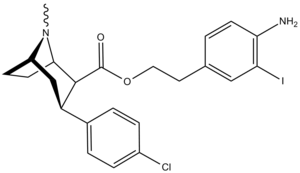
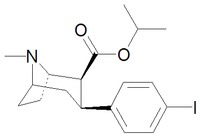
| Код | Х | 2 позиции | конфигурация | 8 | И | 5-HT | NE |
|---|---|---|---|---|---|---|---|
| RTI-77 | Калькуляция | CH 2 100 2 (3-йодо- p -анилино) | Б.Б. | NME | 2.51 | — | 2247 |
| RTI-121 IPCIT | я | -Co 2 pr я | Б.Б. | NME | 0.43 | 66.8 | 285 |
| RTI-153 | я | -Co 2 pr я | Б.Б. | Нын -н.э. | 1.06 | 3.59 | 132 |
| RTI-191 | я | -Co 2 pr цикл | Б.Б. | NME | 0.61 | 15.5 | 102 |
| RTI-114 | Калькуляция | -Co 2 pr я | Б.Б. | NME | 1.40 | 1,404 | 778 |
| RTI-278 | № 2 | -Co 2 pr я | Б.Б. | NME | 8.14 | 2,147 | 4,095 |
| RTI-190 | Калькуляция | -Co 2 pr цикл | Б.Б. | NME | 0.96 | 168 | 235 |
| RTI-193 | Мне | -Co 2 pr цикл | Б.Б. | NME | 1.68 | 1,066 | 644 |
| RTI-117 | Мне | -Co 2 pr я | Б.Б. | NME | 6.45 | 6,090 | 1,926 |
| RTI-150 | Мне | -Co 2 bu цикл | Б.Б. | NME | 3.74 | 2,020 | 4,738 |
| RTI-127 | Мне | -Co 2 c (h) et 2 | Б.Б. | NME | 19 | 4500 | 3444 |
| RTI-338 | этил | -Co 2 c 2 ph | Б.Б. | NME | 1104 | 7.41 | 3366 |
Использование циклопропильного эфира, по -видимому, обеспечивает лучшее удержание мата , чем выбор изопропильного эфира.
Использование цикл BU привел к большей селективности DAT, чем цикл PR Гомолог.
2-алкильные эфиры и эфиры
[ редактировать ]Эфиры (2-алкил)
[ редактировать ]| Структура | Короткое имя (С. Сингх) |
2β = r | K I (NM) ЧТО [ 3 H] выиграть 35428 |
IC 50 (нм) [ 3 H] DA поглощение |
Селективность поглощение/привязка |
|---|---|---|---|---|---|
 |
59а | Ch = chco 2 ch 3 | 22 ± 2 | 123 ± 65 | 5.6 |
 |
59b | Ch 2 ch 2 co 2 ch 3 | 23 ± 2 | 166 ± 68 | 7.2 |
 |
59с | (Ch 2 ) 2 K = CHCO 2 K 3 | 20 ± 2 | 203 ± 77 | 10.1 |
 |
59d | (Ch 22 ) 4 CO 2 Ch 3 | 30 ± 2 | 130 ± 7 | 4.3 |
 |
59e | CH = CHCH 2 OH | 26 ± 3 | 159 ± 43 | 6.1 |
 |
59f | Ch 2 Ch 2 CH 2 OH | 11 ± 1 | 64 ± 32 | 5.8 |
 |
59 г | CH 2 Ch 2 COC 6 H 5 | 28 ± 2 | 47 ± 15 | 1.7 |
Эфиры (2-алкил)
[ редактировать ]Смотрите гомологи N -Десметил пароксетина
| Молекулярная структура | Короткое имя (С. Сингх) |
Стереохимия | ЧТО [ 3 H] выиграть 35428 IC 50 (нм) |
5-HTT [ 3 H] пароксетин IC 50 (нм) |
СЕТЬ [ 3 H] нисоксетин IC 50 (нм) |
Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|
| Пароксетин | 623 ± 25 | 0.28 ± 0.02 | 535 ± 15 | 0.0004 | 0.8 | ||
 |
R -60a | 2b, 3b | 308 ± 20 | 294 ± 18 | 5300 ± 450 | 0.9 | 17.2 |
 |
R -60b | 2а, 3b | 172 ± 8.8 | 52.9 ± 3.6 | 26600 ± 1200 | 0.3 | 155 |
 |
R -60c | 2B, 3A | 3.01 ± 0.2 | 42.2 ± 16 | 123 ± 9.5 | 14.1 | 40.9 |
 |
S -60d | 2b, 3b | 1050 ± 45 | 88.1 ± 2.8 | 27600 ± 1100 | 0.08 | 26.3 |
 |
S -60e | 2а, 3b | 1500 ± 74 | 447 ± 47 | 2916 ± 1950 | 0.3 | 1.9 |
 |
S -60f | 2B, 3A | 298 ± 17 | 178 ± 13 | 12400 ± 720 | 0.6 | 41.6 |
Карбоксамиды
[ редактировать ]
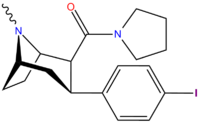

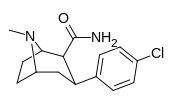
Структура  |
Код ( С. Сингх # ) |
Х | 2 позиции | конфигурация | 8 | И [ 3 H] выиграть 35428 (IC 50 нм) |
NE [ 3 H] нисоксетин |
5-HT [ 3 H] пароксетин (IC 50 нм) |
Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|---|---|---|
 |
RTI-106 27b |
Калькуляция | Con (h) меня | Б.Б. | NME | 12.4 ± 1.17 | 1584 ± 62 | 1313 ± 46 | 106 | 128 |
 |
RTI-118 27а |
Калькуляция | Конх 2 | Б.Б. | NME | 11.5 ± 1.6 | 4270 ± 359 | 1621 ± 110 | 141 | 371 |
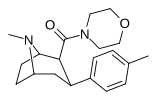 |
RTI-222 29d |
Мне | морфолинил | Б.Б. | NME | 11.7 ± 0.87 | 23601 ± 1156 | > 100 тыс | > 8547 | 2017 |
 |
RTI-129 27E |
Калькуляция | Conme 2 | Б.Б. | NME | 1.38 ± 0.1 | 942 ± 48 | 1079 ± 102 | 792 | 683 |
 |
RTI-146 27d |
Калькуляция | Conhch 2 Oh | Б.Б. | NME | 2.05 ± 0.23 | 144 ± 3 | 97.8 ± 10 | 47.7 | 70.2 |
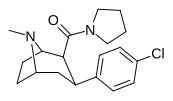 |
RTI-147 27i |
Калькуляция | С (ch 2 ) 4 | Б.Б. | NME | 1.38 ± 0.03 | 3,950 ± 72 | 12400 ± 1207 | 8985 | 2862 |
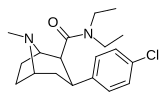 |
RTI-156 | Калькуляция | С (ch 2 ) 5 | Б.Б. | NME | 6.61 | 5832 | 3468 | ||
 |
RTI-170 | Калькуляция | Ребенок (H) 2 Ch | Б.Б. | NME | 16.5 | 1839 | 4827 | ||
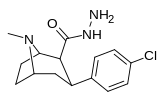 |
RTI-172 | Калькуляция | Ребенок (H) NH 2 | Б.Б. | NME | 44.1 | 3914 | 3815 | ||
 |
RTI-174 | Калькуляция | Раковина | Б.Б. | NME | 158 | > 43к | > 125K | ||
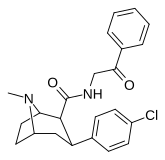 |
RTI-182 | Калькуляция | Conhch 2 Coph | Б.Б. | NME | 7.79 | 1722 | 827 | ||
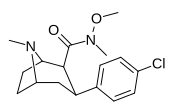 |
RTI-183 ✲ 27 г. |
Калькуляция | С (OME) ME | Б.Б. | NME | 0.85 ± 0.06 | 549 ± 18.5 | 724 ± 94 | 852 | 646 |
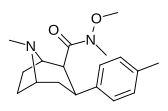 |
RTI-186 29с |
Мне | С (OME) ME | Б.Б. | NME | 2.55 ± 0.43 | 422 ± 26 | 3402 ± 353 | 1334 | 165 |
 |
RTI-198 27 часов |
Калькуляция | С (ch 2 ) 3 | Б.Б. | NME | 6.57 ± 0.67 | 990 ± 4.8 | 814 ± 57 | 124 | 151 |
 |
RTI-196 27c. |
Калькуляция | Конхом | Б.Б. | NME | 10.7 ± 1.25 | 9907 ± 632 | 43700 ± 1960 | 4084 | 926 |
 |
RTI-201 | Калькуляция | Cohnhcoph | Б.Б. | NME | 91.8 | > 20K | > 48K | ||
 |
RTI-208 27J |
Калькуляция | Конус (Ch 2 ) 3 | Б.Б. | NME | 1.47 ± 0.13 | 1083 ± 76 | 2470 ± 56 | 1680 | 737 |
 |
RTI-214 27L |
Калькуляция | Con (-ch 2 ch 2 -) 2 o | Б.Б. | NME | 2.90 ± 0.3 | 8545 ± 206 | 88769 ± 1855 | 30610 | 2946 |
 |
RTI-215 27f |
Калькуляция | Конет 2 | Б.Б. | NME | 5.48 ± 0.19 | 5532 ± 299 | 9433 ± 770 | 1721 | 1009 |
 |
RTI-217 | Калькуляция | Conh ( M -C 6 H 4 OH) | Б.Б. | NME | 4.78 | > 30k | > 16K | ||
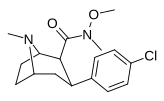 |
RTI-218 ✲ | Калькуляция | С (мне) Оме | Б.Б. | NME | 1.19 | 520 | 1911 | ||
 |
RTI-226 27 м |
Калькуляция | Конмеф | Б.Б. | NME | 45.5 ± 3 | 2202 ± 495 | 23610 ± 2128 | 519 | 48.4 |
 |
RTI-227 | я | Конус (Ch 2 ) 3 | Б.Б. | NME | 0.75 | 446 | 230 | ||
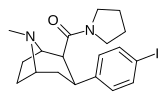 |
RTI-229 [ 16 ] 28а |
я | С (ch 2 ) 4 | Б.Б. | NME | 0.37 ± 0.04 | 991 ± 21 | 1728 ± 39 | 4670 | 2678 |
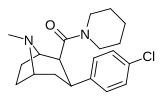 |
27K | 6.95 ± 1.21 | 1752 ± 202 | 3470 ± 226 | 499 | 252 | ||||
 |
28B | 1.08 ± 0.15 | 103 ± 6.2 | 73.9 ± 8.1 | 68.4 | 95.4 | ||||
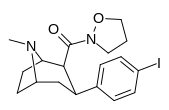 |
28с | 0.75 ± 0.02 | 357 ± 42 | 130 ± 15.8 | 173 | 476 | ||||
 |
29а | 41.8 ± 2.45 | 4398 ± 271 | 6371 ± 374 | 152 | 105 | ||||
 |
29b | 24.7 ± 1.93 | 6222 ± 729 | 33928 ± 2192 | 1374 | 252 |
✲rti-183 и RTI-218 предлагают возможную копию-ошибку, считая, что разница в «con (ome) me» и «con (me)» между метил и метокси, как то же самое.
| Сложный | Короткое имя (С. Сингх) |
Ведущий | Х | IC 50 (нм) ЧТО [ 3 H] выиграть 35428 |
IC 50 (нм) 5-HTT [ 3 H] пароксетин |
IC 50 (нм) СЕТЬ [ 3 H] нисоксетин |
Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|---|

| ||||||||
| 29а | NH 2 | Ch 3 | 41.8 ± 2.45 | 6371 ± 374 | 4398 ± 271 | 152 | 105 | |
| 29b | N (Ch 2 Ch 3 ) 2 | Ch 3 | 24.7 ± 1.93 | 33928 ± 2192 | 6222 ± 729 | 1374 | 252 | |
| 29с RTI-186 |
N (и 3 ) Ch 3 | Ch 3 | 2.55 ± 0.43 | 3402 ± 353 | 422 ± 26 | 1334 | 165 | |
| 29d RTI-222 |
4-морфолина | Ch 3 | 11.7 ± 0.87 | > 100000 | 23601 ± 1156 | > 8547 | 2017 |
Карбоксамидные димеры фенилтропанов
[ редактировать ]
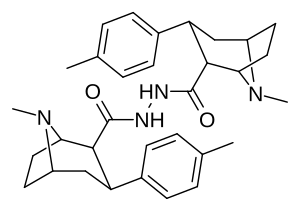
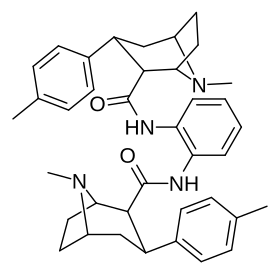
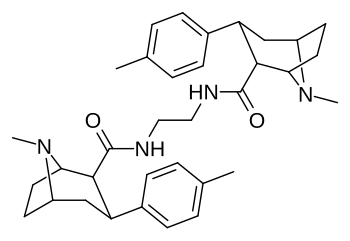

Димеры фенилтропанов, подключенные в двойной форме с использованием местного C2, как изменяемое в направлении в отличие ( конструкции карбоксамида активно откладывая про-лекарства in vivo . [ 3 ]
Гетероциклы
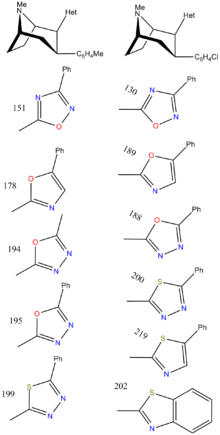
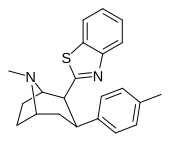
[ редактировать ]Эти гетероциклы иногда называют « биоизостерическим эквивалентом» более простых сложных эфиров, из которых они получены. Потенциальным недостатком оставления ββ-stester непрореагированным является то, что в дополнение к гидролизующему, он также может эпимеризировать. [ 17 ] к энергетически более благоприятной транс -конфигурации. Это может случиться с кокаином.

(Составной модель 34 )
Некоторые из оксадиазолов содержат одинаковое число и типы гетероатомов, в то время как их соответствующие потенции связывания отображают разницу 8 × -15 ×. Открытие, которое не будет объяснено их сродством, возникающим из -за водородных связей.
Чтобы изучить возможность электростатических взаимодействий, использование молекулярных электростатических потенциалов (MEP) использовалось с модельным соединением 34 (замена фенилтропанового фрагмента метильной группой). Сосредоточив внимание на окрестностях атомов @ позиций A-C, минимума электростатического потенциала вблизи атома положения A (Δ V min (a)), рассчитанного с полуэмпирическими ( AM1 ) расчета квантовой механики (наложение гетероциклических и фенильных колец Выясните наименьшее в стерическом и конформационном расхождении) обнаружили корреляцию между аффинностью @ dat и Δ v min (a): при этом значения для последнего для 32c = 0, 32g = -4, 32h = -50 & 32i = -63 ккал/моль.
В отличие от этой тенденции, понимается, что все более отрицательный Δ V MIN коррелирует с увеличением прочности в водородной связи, которая является противоположной тенденцией для вышесказанного; Это указывает на то, что 2β-подключения (по крайней мере, для гетероциклического класса) преобладают электростатическими факторами для связывания в модели предполагаемой водородной связи для этого заместителя кокаин-подобного связывающего лиганда. [ G ]
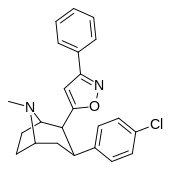
3-замещенная-асоксазол-5-ил
[ редактировать ]| Код (SS #) |
Х | Ведущий | И | NE | 5HT |
|---|---|---|---|---|---|
| RTI-165 | Калькуляция | 3-метилизоксазол-5-ил | 0.59 | 181 | 572 |
| RTI-171 | Мне | 3-метилизоксазол-5-ил | 0.93 | 254 | 3818 |
| RTI-180 | я | 3-метилизоксазол-5-ил | 0.73 | 67.9 | 36.4 |
| Rti-177 β-cppit 32G |
Калькуляция | 3-фенилизоксазол-5-ил | 1.28 ± 0.18 | 504 ± 29 | 2420 ± 136 |
| RTI-176 | Мне | 3-фенилизоксазол-5-ил | 1.58 | 398 | 5110 |
| RTI-181 | я | 3-фенилизоксазол-5-ил | 2.57 | 868 | 100 |
| RTI-184 | ЧАС | метил | 43.3 | — | 6208 |
| RTI-185 | ЧАС | PH | 285 | — | > 12K |
| RTI-334 | Калькуляция | 3-этилизоксазол-5-ил | 0.50 | 120 | 3086 |
| RTI-335 | Калькуляция | изопропил | 1.19 | 954 | 2318 |
| RTI-336 | Калькуляция | 3- (4-метилфенил) изоксазол-5-ил | 4.09 | 1714 | 5741 |
| RTI-337 | Калькуляция | 3-T-бутил-азоксазол-5-ил | 7.31 | 6321 | 37K |
| RTI-345 | Калькуляция | P -Clorophenyl | 6.42 | 5290 | > 76K |
| RTI-346 | Калькуляция | П -анизил | 1.57 | 762 | 5880 |
| RTI-347 | Калькуляция | P -fluorophenyl | 1.86 | 918 | 7257 |
| RTI-354 | Мне | 3-этилизоксазол-5-ил | 1.62 | 299 | 6400 |
| RTI-366 | Мне | R = изопропил | 4.5 | 2523 (1550) | 42,900 (3900) |
| RTI-371 | Мне | P -Clorophenyl | 8.74 | > 100 тыс. (60 200) | > 100 тыс. (9090) |
| RTI-386 | Мне | П -анизил | 3.93 | 756 (450) | 4027 (380) |
| RTI-387 | Мне | P -fluorophenyl | 6.45 | 917 (546) | > 100K (9400) |
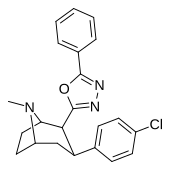
3-замещенные-1,2,4-оксадиазол
[ редактировать ]
| Структура | Код ( # Сингха ) |
Х | Ведущий | Что (IC 50 нм ) смещение [h 3 ] Выиграть 35428 |
Net (IC 50 нм ) [ЧАС 3 ] Нисоксетин |
5-HT (IC 50 нм ) [ЧАС 3 ] пароксетин |
Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|---|
 |
αα αα-87 | ЧАС | 3-метил-1,2,4-оксадиазол | 204 | 36K | 30 тыс | ||
 |
Βα RTI-119 | ЧАС | 3-метил-1,2,4-оксадиазол | 167 | 7K | 41K | ||
 |
αβ αT-124 | ЧАС | 3-метил-1,2,4-оксадиазол | 1028 | 71K | 33к | ||
 |
RTI-125 (32a) |
Калькуляция | 3-метил-1,2,4-оксадиазол | 4.05 ± 0.57 | 363 ± 36 | 2584 ± 800 | 637 | 89.6 |
 |
ββ RTI-126 [ 18 ] (31) |
ЧАС | 3-метил-1,2,4-оксадиазол | 100 ± 6 | 7876 ± 551 | 3824 ± 420 | 38.3 | 788 |
 |
RTI-130 (32c) |
Калькуляция | 3-фенил-1,2,4-оксадиазол | 1.62 ± 0.02 | 245 ± 13 | 195 ± 5 | 120 | 151 |
 |
RTI-141 (32d) |
Калькуляция | 3- ( p -Anisyl) -1,2,4-оксадиазол | 1.81 ± 0.19 | 835 ± 8 | 337 ± 40 | 186 | 461 |
 |
RTI-143 (32e) |
Калькуляция | 3- ( P -Chlorophenyl) -1,2,4-оксадиазол | 4.06 ± 0.22 | 40270 ± 180 (4069) |
404 ± 56 | 99.5 | 9919 |
 |
RTI-144 (32f) |
Калькуляция | 3- ( P -Bromophenyl) -1,2,4-оксадиазол | 3.44 ± 0.36 | 1825 ± 170 | 106 ± 10 | 30.8 | 532 |
 |
β RTI-151 (33) |
Мне | 3-фенил-1,2,4-оксадиазол | 2.33 ± 0.26 | 60 ± 2 | 1074 ± 130 | 459 | 25.7 |
 |
α RTI-152 | Мне | 3-фенил-1,2,4-оксадиазол | 494 | — | 1995 | ||
 |
RTI-154 (32b) |
Калькуляция | 3-изопропил-1,2,4-оксадиазол | 6.00 ± 0.55 | 135 ± 13 | 3460 ± 250 | 577 | 22.5 |
 |
RTI-155 | Калькуляция | 3-циклопропил-1,2,4-оксадиазол | 3.41 | 177 | 4362 |
↑ выше: 2D скелетное изображение .
↓ Ниже: 3D -труба модель .

| Структура | Код | Х | 2 группа | Что (IC 50 нм ) смещение [h 3 ] Выиграть 35428 |
Net (IC 50 нм ) смещение [h 3 ] Нисоксетин |
5-HT (IC 50 нм ) смещение [h 3 ] пароксетин |
Селективность 5-HTT/DAT |
Селективность Не / это |
|---|---|---|---|---|---|---|---|---|
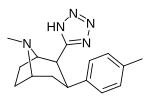 |
RTI-157 | Мне | тетразол | 1557 | > 37K | > 43к | ||
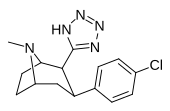 |
RTI-163 | Калькуляция | тетразол | 911 | — | 5456 | ||
 |
RTI-178 | Мне | 5-фенилоксазол-2-ил | 35.4 | 677 | 1699 | ||
 |
RTI-188 | Калькуляция | 5-фенил-1,3,4-оксадиазол-2-ил | 12.6 | 930 | 3304 | ||
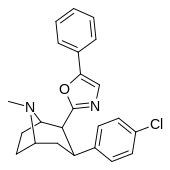 |
RTI-189 ( 32i ) |
Калькуляция | 5-фенилоксазол-2-ил | 19.7 ± 1.98 | 496 ± 42 | 1120 ± 107 | 56.8 | 25.5 |
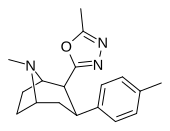 |
RTI-194 | Мне | 5-метил-1,3,4-оксадиазол-2-ил | 4.45 | 253 | 4885 | ||
 |
RTI-195 | Мне | 5-фенил-1,3,4-оксадиазол-2-ил | 47.5 | 1310 | > 22 000 | ||
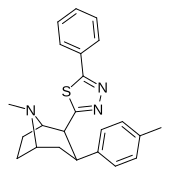 |
RTI-199 | Мне | 5-фенил-1,3,4-тиадиазол-2-ил | 35.9 | > 24 000 | > 51 000 | ||
 |
RTI-200 | Калькуляция | 5-фенил-1,3,4-тиадиазол-2-ил | 15.3 | 4142 | > 18 000 | ||
 |
RTI-202 | Калькуляция | Бензотиазол-2-ил | 1.37 | 403 | 1119 | ||
 |
RTI-219 | Калькуляция | 5-фенилтиазол-2-ил | 5.71 | 8516 | 10,342 | ||
| RTI-262 | Калькуляция | 188.2 ± 5.01 | 595.25 ± 5738 | 5207 ± 488 | 316 | 28 | ||
 |
RTI-370 | Мне | 3- ( P- CRESYL) Изоксазол-5-ил | 8.74 | 6980 | > 100 тыс | ||
 |
RTI-371 | Калькуляция | 3- ( P -Hlorophenyl) Изоксазол-5-ил | 13 | > 100 тыс | > 100 тыс | ||
 |
RTI-436 | Мне | -CH = CHPH [ 20 ] | 3.09 | 1960 (1181) | 335 (31) | ||
 |
RTI-470 | Калькуляция | o -cl-benzothiazol-2-ил | 0.094 | 1590 (994) | 1080 (98) | ||
 |
RTI-451 | Мне | Бензотиазол-2-ил | 1.53 | 476 (287) | 7120 (647) | ||
 |
32G | 1.28 ± 0.18 | 504 ± 29 | 2420 ± 136 | 1891 | 394 | ||
 |
32H | 12.6 ± 10.3 | 929 ± 88 | 330 ± 196 | 262 | 73.7 |

Nb Однако есть некоторые альтернативные способы создания кольца тетразола; Сх. синтеза препаратов сартана Схемы . BU 3 SNN 3 является более мягким выбором реагента, чем азид водорода ( CF Irbesartan ).
Ацил (C2-propanoyl)
[ редактировать ]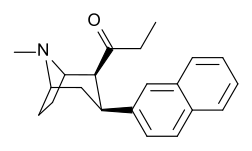
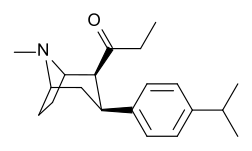
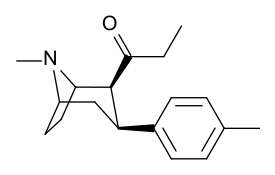
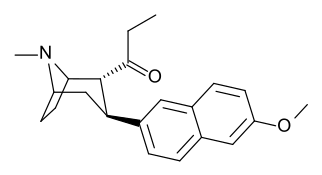

ср. Тамангнановая серия фенилтропанов для примеров с проставкой метиленовой единицы разбивает индол.
| # ( # ) |
Х | И | 2 позиции | конфигурация | 8 | И | 5-HT | NE |
|---|---|---|---|---|---|---|---|---|
| WF-23 ( 39n ) |
β-нафтил | C (O) и | Б.Б. | NME | 0.115 | 0.394 | Нет данных | |
| WF-31 PIT | -Пр я | ЧАС | C.O.Et | Б.Б. | NME | 615 | 54.5 | Нет данных |
| WF-11 ✲ Птт ( 39e ) |
Мне | ЧАС | -C.O.Et | Б.Б. | NME | 8.2 | 131 | Нет данных |
| WF-25 ( 39а ) |
ЧАС | ЧАС | -C.O.Et | Б.Б. | NME | 48.3 | 1005 | Нет данных |
| WF-33 | 6-Meobn | C (O) и | а, б | NME | 0.13 | 2.24 | Нет данных | |
| ✲ Соединение WF-11 было показано, что при постоянном воздействии выявила биологический ответ, противоположный понижению экспрессии гена гена тирозина тирозина-гидроксилазы (вместо активизации, как было отмечено, имеет место для хронического введения кокаина) | ||||||||
| Структура | С. Сингх буквенно -цифровой назначение (имя) |
R 1 | R 2 | ЧТО
[ 125 I] RTI-55 IC 50 ( NM ) |
5-HTT
[ 3 H] пароксетин K I ( NM ) |
Селективность
5-HTT/DAT |
|---|---|---|---|---|---|---|
| кокаин | 173 ± 19 | — | — | |||
| Тропарил 11A (Win 35065-2) |
98.8 ± 12.2 | — | — | |||
 |
WF-25 39а |
C 2 H 5 | C 6 H 5 | 48.3 ± 2.8 | 1005 ± 112 | 20.8 |
 |
39b | Ch 3 | C 6 H 5 | 114 ± 22 | 1364 ± 616 | 12.0 |
 |
39с | C 2 H 5 | C 6 H 4 -4 -F | 15.3 ± 2.8 | 630 ± 67 | 41.2 |
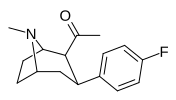 |
39d | Ch 3 | C 6 H 4 -4 -F | 70.8 ± 13 | 857 ± 187 | 12.1 |
 |
WF-11 39e |
C 2 H 5 | C 6 H 4 -4 -CH 3 | 8.2 ± 1.6 | 131 ± 1 | 16.0 |
| (+)-39e | C 2 H 5 | C 6 H 4 -4 -CH 3 | 4.21 ± 0.05 | 74 ± 12 | 17.6 | |
| (-)-39e | C 2 H 5 | C 6 H 4 -4 -CH 3 | 1337 ± 122 | > 10000 | — | |
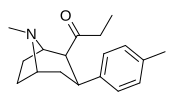
 |
39f | Ch 3 | C 6 H 4 -4 -CH 3 | 9.8 ± 0.5 | 122 ± 22 | 12.4 |
 |
39 г | Ch 3 | C 6 H 4 -4 -C 2 H 5 | 152 ± 24 | 78.2 ± 22 | 0.5 |
 |
39 ч | C 2 H 5 | C 6 H 4 -4 -CH (Ch 3 ) 2 | 436 ± 41 | 35.8 ± 4.4 | 0.08 |
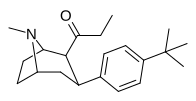 |
39i | C 2 H 5 | C 6 H 4 -4 -C (Ch 3 ) 3 | 2120 ± 630 | 1771 ± 474 | 0.8 |
 |
39J | C 2 H 5 | C 6 H 4 -4 -C 6 H 5 | 2.29 ± 1.08 | 4.31 ± 0.01 | 1.9 |
 |
39K | C 2 H 5 | C 6 H 4 -2 -CH 3 | 1287 ± 322 | 710000 | > 7,8 |
 |
39L | C 2 H 5 | 1-нафтил | 5.43 ± 1.27 | 20.9 ± 2.9 | 3.8 |
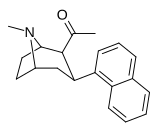 |
39 м | Ch 3 | 1-нафтил | 10.1 ± 2.2 | 25.6 ± 5.1 | 2.5 |
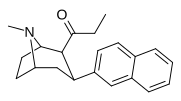 |
WF-23 39н |
C 2 H 5 | 2-нафтил | 0.115 ± 0.021 | 0.394 ± 0.074 | 3.5 |
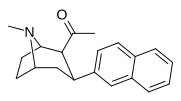 |
39o | Ch 3 | 2-нафтил | 0.28 ± 0.11 | 1.06 ± 0.36 | 3.8 |
 |
39 с | C 2 H 5 | C 6 H 4 -4 -CH (C 2 H 5 ) 2 | 270 ± 38 | 540 ± 51 | 2.0 |
 |
39q | C 2 H 5 | C 6 H 4 -4 -C 6 H 11 | 320 ± 55 | 97 ± 12 | 0.30 |
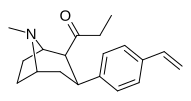 |
39r | C 2 H 5 | C 6 H 4 -4 -CH = CH 2 | 0.90 ± 0.34 | 3.2 ± 1.3 | 3.5 |
 |
39 с | C 2 H 5 | C 6 H 4 -4 -C (= CH 2 ) CH 3 | 7.2 ± 2.1 | 0.82 ± 0.38 | 0.1 |
2β-ацил-3β-нафтил заменен
[ редактировать ]| Структура | Короткое назначение (Числовой код, Дэвис UB ) С. Сингх |
Ведущий | ЧТО [ 125 H] RTI-55 ɑ IC 50 нм |
ЖЕСТКИЙ [ 3 H] пароксетин беременный K I NM |
СЕТЬ [ 3 H] нисоксетин в K I NM |
Коэффициент потенции SERT/это |
Коэффициент потенции SERT/NET |
|---|---|---|---|---|---|---|---|
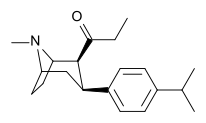
 |
WF-11 (6) |
4'-Me | 8.2 ± 1.6 | 131 ± 10 | 65 ± 9.2 | 0.06 | 0.5 |
 |
WF-31 (7) |
4′- я Премьер -министр | 436 ± 41 | 36 ± 4 | > 10000 | 12 | > 250 |
 |
WF-23 (8) |
2-нафталин | 0.12 ± 0.02 | 0.39 ± 0.07 | 2.9 ± 0.5 | 0.3 | 7 |
 |
2β-ацил-3β-1-нафталин (9а) |
4'-H | 5.3 ± 1.3 | 21 ± 2.9 | 49 ± 10 | 0.3 | 18 |
 |
(9b) | 4'-Me | 25.1 ± 0.5 | 8.99 ± 1.70 | 163 ± 36 | 3 | 18 |
 |
(9c) | 4 что -то | 75.1 ± 11.9 | 175 ± 25 | 4769 ± 688 | 0.7 | 27 |
 |
(9d) | 4′- я Премьер -министр | 225 ± 36 | 136 ± 64 | > 10000 | 2 | > 73,5 |
 |
(10a) | 6'-и | 0.15 ± 0.04 | 0.38 ± 0.19 | 27.7 ± 9.6 | 0.4 | 74 |
 |
(10b) | 6′- я Премьер -министр | 0.39 ± 0.04 | 1.97 ± 0.33 | Нет данных | 0.2 | — |
 |
(10C и ) | 6'-OME | 0.13 ± 0.04 | 2.24 ± 0.34 | Нет данных | 0.05 | — |
 |
(10d) | 5'-ET, 6'-OM | 30.8 ± 6.6 | 7.55 ± 1.57 | 3362 ± 148 | 4.1 | 445 |
 |
(10th) | 5'-c (me) = ch 2 , 6'-ome | 45.0 ± 3.7 | 88.0 ± 13.3 | 2334 ± 378 | 0.5 | 26.5 |
 |
(10f) | 6'-I | 0.35 ± 0.07 | 0.37 ± 0.02 | Нет данных | 1.0 | — |
 |
(10G) | 7'-I | 0.45 ± 0.05 | 0.47 ± 0.02 | Нет данных | 0.5 дюймовый | — |
 |
(10H) | 5'-нет 2 , 6'-OME | 148 ± 50 | 15 ± 1.6 | Нет данных | 10 | — |
 |
(10i) | 5'-I, 6'-OM | 1.31 ± 0.33 | 2.27 ± 0.31 | 781 ± 181 | 0.6 | 344 |
 |
(10J) | 5'-AS, 6'-OM | 12.6 ± 3.8 | 15.8 ± 1.65 | 498 ± 24 | 0.8 | 32 |
 |
(11а) | 2β-coch 3 , 1-naphthyl | 10 ± 2.2 | 26 ± 5.1 | 165 ± 40 | 0.4 | 6.3 |
 |
(11b) | 2α-coch 3 , 1-naphthyl | 97 ± 21 | 217 ± 55 | Нет данных | 0.45 | — |
 |
(11c) | 2α-coch 2 ch 3 , 2-нафтил | 2.51 ± 0.82 | 16.4 ± 2.0 | 68.0 ± 10.8 | 0.15 | 4.1 |
 |
(11d) | 2β-coch 3 , 2-нафтил | 1.27 ± 0.15 | 1.06 ± 0.36 | 4.9 ± 1.2 | 1.2 | 4.6 |
 |
(11e) | 2β-Red (D 3 ) 2 , 2-нафтил | 0.25 ± 0.08 | 2.08 ± 0.80 | 37.6 ± 10.5 | 0.12 | 18.1 |
 |
(11f) 79а |
2β-coch 2 CH 3 , 2-нафтил, N 8-деметил | 0.03 ± 0.01 | 0.23 ± 0.07 | 2.05 ± 0.9 | 0.13 | 8.9 |
|
|
Снижение эфира
[ редактировать ]ПРИМЕЧАНИЕ. P -fluorophenyl слабее других. не является перокси , это метилборинат RTI- 145 .

| Код | Х | 2 позиции | конфигурация | 8 | И | 5-HT | NE |
|---|---|---|---|---|---|---|---|
| RTI-100 | Фон | -Ч 2 О | Б.Б. | NME | 47 | 4741 | Нет данных |
| RTI-101 | я | -Ч 2 О | Б.Б. | NME | 2.2 | 26 | Нет данных |
| RTI-99 | Бренд | -Ч 2 О | Б.Б. | NME | 1.49 | 51 | Нет данных |
| RTI-93 | Калькуляция | -Ч 2 О | Б.Б. | NME | 1.53 | 204 | 43.8 |
| RTI-105 | Калькуляция | -CH 2 OAC | Б.Б. | NME | 1.60 | 143 | 127 |
| RTI-123 | Калькуляция | -Ч 2 obz | Б.Б. | NME | 1.78 | 3.53 | 393 |
| RTI-145 | Калькуляция | -Ч 2 OCO 2 я | Б.Б. | NME | 9.60 | 2.93 | 1.48 |
2-алкан/алкен
[ редактировать ]а K I Значение для смещения Win 35428.
беременный IC 50 Значение.
Необратимые ковалентные ( ср. Ионовые) С2 -лиганды
[ редактировать ]
Необратимый ( фенилизотиоцианат ) связывающий лиганд ( Мурти, В.; Мартин, TJ; Ким, с.; Дэвис, HML; Childers, SR (2008). «Характеристика in vivo нового фенилизотиоцианатного аналога тропана при моноаминовых транспортерах в мозге крысы». Журнал фармакологии и экспериментальной терапии . 326 (2): 587–595. doi : 10.1124/jpet.108.1388442 . PMID 18492949 . S2CID 5996473 . ) [ 23 ] RTI-76 : [ 24 ] 4'-азотиоцианатофенил (1R, 2S, 3S, 5S) -3- (4-хлорфенил) -8-метил-8-азабицикло [3.2.1] октана-2-карбоксилат . Также известен как: 3β- (P-хлорфенил) тропано-2β-карбоновая кислота P-изотиоцианатофенилметиловый эфир .
C2 ацил, фенилизотиоцианат N8
[ редактировать ]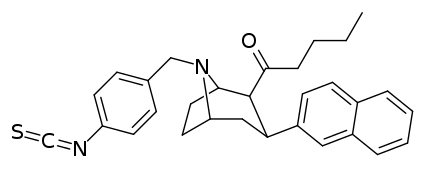
HD-205 (Murthy et al., 2007) [ 25 ]
Обратите внимание на контраст с местоположениями фенилизотиоцианата ковалентного сайта связывания по сравнению с тем, что на P-изококе , аналоге нефенилтропанового кокаина.
На основе бензтропина (гетерозамещенные C2-позиции) фенилтропаны
[ редактировать ]| Структура | Сложный | Ведущий | Х | И | [ 3 H] выиграть 35 428 @ ЧТО K I (NM) |
[ 3 H] циталопрам @ ЖЕСТКИЙ K I (NM) |
[ 3 H] нисоксетин @ СЕТЬ K I (NM) |
[ 3 H] Пирензепин @ M 1 K I (NM) |
|---|---|---|---|---|---|---|---|---|
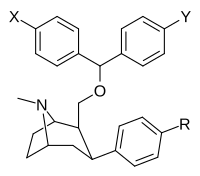
| ||||||||
| 9а | Ch 3 | ЧАС | ЧАС | 34 ± 2 | 121 ± 19 | 684 ± 100 | 10,600 ± 1,100 | |
| 9B | Фон | ЧАС | ЧАС | 49 ± 12 | — | — | — | |
| 9C | Калькуляция | ЧАС | ЧАС | 52 ± 2.1 | 147 ± 8 | 1,190 ± 72 | 11,000 ± 1,290 | |
| 9d | Ch 3 | Калькуляция | ЧАС | 80 ± 9 | 443 ± 60 | 4,400 ± 238 | 31,600 ± 4,300 | |
| 9e. | Фон | Калькуляция | ЧАС | 112 ± 11 | — | — | — | |
| 9f | Калькуляция | Калькуляция | ЧАС | 76 ± 7 | 462 ± 36 | 2,056 ± 236 | 39,900 ± 5,050 | |
| 9G | Ch 3 | Фон | Фон | 62 ± 7 | 233 ± 24 | 1,830 ± 177 | 15,500 ± 1,400 | |
| 9 часов | Фон | Фон | Фон | 63 ± 13 | — | — | — | |
| 9 | Калькуляция | Фон | Фон | 99 ± 18 | 245 ± 16 | 2,890 ± 222 | 16,300 ± 1,300 | |
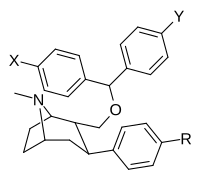
| ||||||||
| 10а | Ch 3 | ЧАС | ЧАС | 455 ± 36 | 530 ± 72 | 2,609 ± 195 | 12,600 ± 1,790 | |
| 10C | Калькуляция | ЧАС | ЧАС | 478 ± 72 | 408 ± 16 | 3,998 ± 256 | 11,500 ± 1,720 | |
| 10d | Ch 3 | Калькуляция | ЧАС | 937 ± 84 | 1,001 ± 109 | 22,500 ± 2,821 | 18,200 ± 2,600 | |
| 10f | Калькуляция | Калькуляция | ЧАС | 553 ± 106 | 1,293 ± 40 | 5,600 ± 183 | 9,600 ± 600 | |
| 10 г | Ch 3 | Фон | Фон | 690 ± 76 | 786 ± 67 | 16,000 ± 637 | 9,700 ± 900 | |
| 10 | Калькуляция | Фон | Фон | 250 ± 40 | 724 ± 100 | 52,300 ± 13,600 | 9,930 ± 1,090 | |
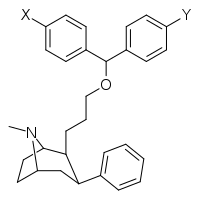
| ||||||||
| 12A | ЧАС | ЧАС | ЧАС | 139 ± 15 | 61 ± 9 | 207 ± 30 | 7,970 ± 631 | |
| 12B | ЧАС | Калькуляция | ЧАС | 261 ± 19 | 45 ± 3 | — | 24,600 ± 2,930 | |
| 12с | ЧАС | Фон | Фон | 60 ± 7 | — | — | — |
Серия F & B (боковые цепи биотина и т. Д.)
[ редактировать ]Один патент претендует на серию соединений с биотинами , связанными с боковыми ходами, представляют собой пестициды . [ 18 ]
| Изображения фенилтропанов биотина C2, нажмите на |
|---|
| Структура | Код | для -x | C2-Тропановое положение | конфигурация | И | NE | 5-HT |
|---|---|---|---|---|---|---|---|
 |
— | ЧАС | F1 | Б.Б. | — | — | — |
 |
RTI-224 | Мне | F1 в | Б.Б. | 4.49 | — | 155.6 |
 |
RTI-233 | Мне | F2 | Б.Б. | 4.38 | 516 | 73.6 |
 |
RTI-235 | Мне | F3 дюймовый | Б.Б. | 1.75 | 402 | 72.4 |
 |
— | — | F3 | Б.Б. | — | — | — |
 |
RTI-236 | Мне | B1 дюймовый | Б.Б. | 1.63 | 86.8 | 138 |
 |
RTI-237 | Мне | B2 дюймовый | Б.Б. | 7.27 | 258 | 363 |
 |
RTI-244 | Мне | B3 дюймовый | Б.Б. | 15.6 | 1809 | 33.7 |
 |
RTI-245 | Калькуляция | F4 в | Б.Б. | 77.3 | — | — |
| RTI-246 | Мне | F4 в | Б.Б. | 50.3 | 3000 | — | |
 |
— | — | F5 | Б.Б. | — | — | — |
 |
RTI-248 | Калькуляция | F6 в | Б.Б. | 9.73 | 4674 | 6.96 |
 |
RTI-249 | Калькуляция | F1 в | Б.Б. | 8.32 | 5023 | 81.6 |
| RTI-266 | Мне | F2 | Б.Б. | 4.80 | 836 | 842 | |
| RTI-267 | Мне | F7 неправильно | Б.Б. | 2.52 | 324 | 455 | |
 |
RTI-268 | Мне | F7 ПРАВО | Б.Б. | 3.89 | 1014 | 382 |
 |
RTI-269 | Мне | F8 | Б.Б. | 5.55 | 788 | 986 |
Miscellany ( то есть misc./miscellary) c2-substituents
[ редактировать ]


| Структура | Код | Х | 2 позиции | конфигурация | 8 | И | 5-HT | NE |
|---|---|---|---|---|---|---|---|---|
 |
RTI-102 | я | CO 2 H. | Б.Б. | NME | 474 | 1928 | 43,400 |
 |
RTI-103 | Бренд | CO 2 H. | Б.Б. | NME | 278 | 3070 | 17,400 |
 |
RTI-104 | Фон | CO 2 H. | Б.Б. | NME | 2744 | > 100 тыс | > 100 тыс |
 |
RTI-108 | Калькуляция | -Ч 2 кл | Б.Б. | NME | 2.64 | 98 | 129.8 |
 |
RTI-241 | Мне | -Ch 2 co 2 я | Б.Б. | NME | 1.02 | 619 | 124 |
 |
RTI-139 | Калькуляция | -H 3 | Б.Б. | NME | 1.67 | 85 | 57 |
 |
RTI-161 | Калькуляция | -C≡N | Б.Б. | NME | 13.1 | 1887 | 2516 |
 |
RTI-230 | Калькуляция | H 3 C - C = CH 2 | Б.Б. | NME | 1.28 | 57 | 141 |
 |
RTI-240 | Калькуляция | -Чм 2 | Б.Б. | NME | 1.38 | 38.4 | 84.5 |
 |
RTI-145 | Калькуляция | -Ч 2 OCO 2 я | Б.Б. | NME | 9.60 | 2,932 | 1,478 |
 |
RTI-158 | Мне | -C≡N | Б.Б. | NME | 57 | 5095 | 1624 |
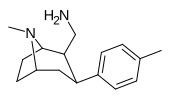 |
RTI-131 | Мне | -Ch 2 NH 2 | Б.Б. | NME | 10.5 | 855 | 120 |
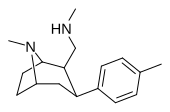 |
RTI-164 | Мне | -Ч 2 нхме | Б.Б. | NME | 13.6 | 2246 | 280 |
 |
RTI-132 | Мне | -Ч 2 нм 2 | Б.Б. | NME | 3.48 | 206 | 137 |
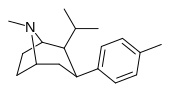 |
RTI-239 | Мне | -Чм 2 | Б.Б. | NME | 0.61 | 114 | 35.6 |
 |
RTI-338 | И | -Co 2 ch 2 ph | Б.Б. | NME | 1104 | 7.41 | 3366 |
 |
RTI-348 | ЧАС | -Ф | Б.Б. | NME | 28.2 | > 34 000 | 2670 |
C2-укушеченный/декарбоксил (неэкгонин без 2-позиционного замены Tropanes)
[ редактировать ]Арилтропен
[ редактировать ]WO 2004113297 , Peters, Dan; Olsen, Gunnar M. & Nielsen, Elsebet Oestergaard et al., «Производные аза-ринг и их использование в качестве моноаминовых нейротрансмиттеров-ингибиторов повторного обновления», опубликованные 2004-12-29, назначенные для нейропроизводства как исследование как
| Тестовое соединение | Da-uptake IC 50 (мкм) | UCTA IC 50 (мкм) | 5-HT-APTAKE IC 50 (мкм) |
|---|---|---|---|
| (+)-3- (4-хлорфенил) -8-H-aza-bicyclo [3.2.1] Oct-2-ene | 0.26 | 0.028 | 0.010 |
| (+)-3-набтален-2-ил-8-азабицикло [3.2.1] окт-2-ene | 0.058 | 0.013 | 0.00034 |
| (-)-8-метил-3- (нафтален-2-ил) -8-азабицило [3.2.1] окт-2-ene | 0.034 | 0.018 | 0.00023 |
| Тестовое соединение | Поглощение DA IC 50 (мкм) | NE uptake IC 50 (μM) | 5-HT поглощение IC 50 (мкм) |
|---|---|---|---|
| (±) -3- (3,4-дихлорфенил) -8-метил-8-азабицикло [3.2.1] окт-2-ene | 0.079 | 0.026 | 0.0047 |
| Тестовое соединение | Поглощение DA IC 50 (мкм) | NE uptake IC 50 (μM) | 5-HT поглощение IC 50 (мкм) |
|---|---|---|---|
| (±) -3- (4-цианофенил) -8-метил-8-азабицикло [3.2.1] окт-2-ene | 18 | 4.9 | 0.047 |
| (±) -3- (4-нитрофенил) -8-метил-8-азабицикло [3.2.1] окт-2-ene | 1.5 | 0.5 | 0.016 |
| (±) -3- (4-трифторметоксифенил) -8-метил-8-азабицикло [3.2.1] Октябрь-2-ene | 22.00 | 8.00 | 0.0036 |
Энантиоселективные нестандартные конфигурации (не 2β-, 3β-)
[ редактировать ]β, α стереохимия
[ редактировать ]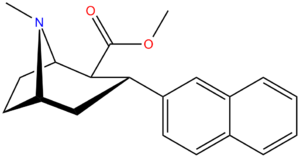

Структура 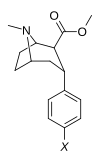 |
Сложный (RTI #) (С. Сингх #) |
Х | 2 группа | конфигурация | 8 | Что IC 50 ( нм ) [ 3 H] выиграть 35428 |
5-HTT IC 50 ( нм ) [ 3 H] пароксетин |
Net IC 50 ( NM ) [ 3 H] нисоксетин |
селективность 5-HTT/DAT |
селективность Не / это |
|---|---|---|---|---|---|---|---|---|---|---|
 |
RTI-140 20А |
ЧАС | Co 2 я | б, а | NME | 101 ± 16 | 5,701 ± 721 | 2,076 ± 285 | 56.4 | 20.6 |
 |
RTI-352 ɑ 20д |
я | Co 2 я | б, а | NME | 2.86 ± 0.16 | 64.9 ± 1.97 | 52.4 ± 4.9 | 22.8 | 18.4 |
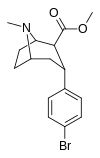 |
RTI-549 | Бренд | Co 2 я | б, а | NME | — | — | — | — | — |
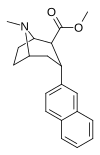 |
RTI-319 беременный | 3α-2-нафтил | Co 2 я | б, а | NME | 1.1 ± 0.09 | 11.4 ± 1.3 | 70.2 ± 6.28 | — | — |
 |
RTI-286 в 20B |
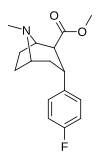
Фон | Co 2 я | б, а | NME | 21 ± 0.57 | 5062 ± 485 | 1231 ± 91 | 241 | 58.6 |
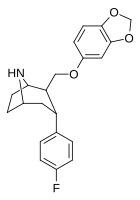 |
RTI-274 дюймовый | Фон | CH 2 O (3 ', 4'-MD-фенил) | б, а | Нын -н.э. | 3.96 | 5.62 | 14.4 | — | — |
 |
RTI-287 | И | Co 2 я | б, а | NME | 327 | 1687 | 17,819 | — | — |
 |
20с | Калькуляция | Co 2 я | б, а | NME | 2.4 ± 0.2 | 998 ± 120 | 60.1 ± 2.4 | 416 | 25.0 |
 |
20E | Мне | Co 2 я | б, а | NME | 10.2 ± 0.08 | 4250 ± 422 | 275 ± 24 | 417 | 27.0 |
 |
Мгновенный | Co 2 я | б, а | NME | — | — | — | — | — |
α, β стереохимия
[ редактировать ]
| Сложный | От (мкм) | Мед (мг/кг) | Доза (мг/кг) | Активность | Активность |
|---|---|---|---|---|---|
| (2R, 3S) -2- (4-хлорфеноксиметил) -8-метил-3- (3-хлорфенил) -8-азабицикло [3.2.1] октатан | 0.39 | <1 | 50 | 0 | 0 |
| (2R, 3S) -2- (карбоксиметил) -8-метил-3- (2-нафтил) -8-азабицикло [3.2.1] октатан | 0.1 | 1 | 25 | 0 | 0 |
| (2R, 3S) -2- (карбоксиметил) -8-метил-3- (3,4-дихлорфенил) -8-азабицикло [3.2.1] октатан | 0.016 | 0.25 | 50 | + | +++ |


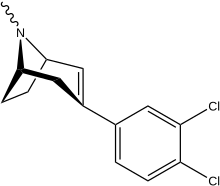
Ди-хлор; Para - & meta - в тандеме (α, β -настроенные фенилтропаны)
[ редактировать ]| Сложный | Х | 2 группа | конфигурация | 8 | И | 5-HT | NE |
|---|---|---|---|---|---|---|---|
| Брасофенсин | CL 2 | метил альдоксим | а, б | NME | — | — | — |
| Тесофенсин | CL 2 | этоксиметил | а, б | NME | 65 | 11 | 1.7 |
| NS-2359 (GSK-372,475) | CL 2 | Метоксиметил | а, б | Нын -н.э. | — | — | — |
соли из фумариновой кислоты (α, β -настроенные фенилтропаны)
[ редактировать ]WO 2004072075 , Peters, Dan; Nielsen, Elsebet oestergaard & Olsen, Gunnar M. et al., «Новый 8-аза-бицикло [3.2.1] октановые производные и их использование в качестве моноаминового нейротрансмиттера повторного обновления», опубликованные 2004-08-26, назначенный нейросомазу. КАК
| Тестовое соединение | Поглощение DA IC 50 (мкм) | NE uptake IC 50 (μM) | 5-HT поглощение IC 50 (мкм) |
|---|---|---|---|
| (2R, 3S) -2- (2,3-дихлорфеноксиметил) -8-метил-3- (3-хлорфенил) -8-азабицикло [3.2.1] Октан-фумарная кислота соль | 0.062 | 0.035 | 0.00072 |
| (2R, 3S) -2- (нафталенооксиметан) -8-метил-3- (3-хлорфенил) -8-азабицикло [3.2.1] октановая фумариновая кислота соль | 0.062 | 0.15 | 0.0063 |
| (2R, 3S) -2- (2,3-дихлорфеноксиметил) -8-H-3- (3-хлорфенил) -8-азабицикло [3.2.1] октановая фумариновая кислота соль | 0.10 | 0.048 | 0.0062 |
| (2R, 3S) -2- (нафтхлилоксиметан) -8-H-3- (3-хлорфенил) -8-азабицикло [3.2.1] октановая фумариновая кислота соль | 0.088 | 0.051 | 0.013 |
Арен эквивалентные изменения
[ редактировать ]или 6 -3β- (переходные металлы в комплексообразовании фенил) Тропаны
[ редактировать ]
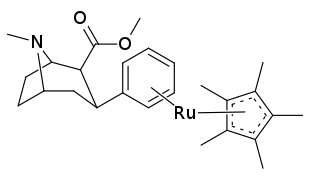
21b может быть приготовлен из ферроценов и перргената реакцией двойного переноса лиганда (DLT). [ 28 ]
В отличие от металлических комплексных баллов, созданных с намерением сделать полезные радиолиганды , были произведены 21a и 21b, видящие как их η 6 - Скоординированный фрагмент резко изменил электронный характер и реактивность бензольного кольца, а также такое изменение, добавляющее асимметричный молекулярный объем к планарному кольцевому кольцевой единице молекулы. [ 1 ] ( ср. Модель Dewar -Chatt -Duncanson ). Кроме того, плоское размер переходного металла, сложенного арен, становится делокализованным ( см. Bloom и Wheeler. [ 29 ] ).
21a был вдвое сильнее, чем кокаин, так и тропарил при смещении β-CFT, а также демонстрировали высокие и низкие значения K I так же, как и эти два соединения. Принимая во внимание, что его ингибирование поглощения DA показало его как сравнительно равноправное по отношению к кокаину и тропарилу. 21b , напротив, имел в сотню разкрата снижение связывания сайта с высокой аффинностью по сравнению с кокаином и потенции на 10 × меньше для ингибирования поглощения DA. Занимая их в качестве настоящих примеров, связанных с полезными эффективными применениями для биоорганометаллической химии .

Предполагается, что расхождение в связывании для двух хелатов металла бензола связано с электростатическими различиями, а не их соответствующей разностью размера. Сплошные углы конуса, измеренные стерическим параметром ( то есть θ ), составляет θ = 131 ° для Cr (co) 3 , тогда как Cp*ru составлял θ = 187 ° или только на 30% больше. Три карбонильная часть считается эквивалентным лиганду циклопента диенила (CP). [ 1 ]

| Структура | Сложный # (С. Сингх) Систематическое название |
K I ( NM ) ɑ | IC 50 ( нм ) | селективность привязка/поглощение |
|---|---|---|---|---|
 |
21а в | 17 ± 15 беременный 224 ± 83 |
418 | 24.6 |
 |
21b дюймовый | 2280 ± 183 | 3890 | 1.7 |
| Кокаин | 32 ± 5 388 ±221 |
405 | 12.6 | |
| Тропарил (11а) | 33 ± 17 314 ± 222 |
373 | 11.3 | |
- ɑ Данные привязки соответствуют модели с двумя сайтами лучше, чем модель с одной площадкой
- беременный Значение K I для модели с одной площадкой составило 124 ± 10 нм
- в : [ IUPAC 6 -(2β-карбометокси-3β-фенил) Тропан] Трикарбонилхромий
- дюймовый : [ IUPAC 5 -(пентаметилциклопентадиенил)]-[ η 6 -(2β-карбометокси-3β-фенил) Тропан] Рутении- (II) трифлат
3- (2-тиофен) и 3- (2-фуран)
[ редактировать ]
| Code | Compound | DA (μM) | NE (μM) | 5-HT (μM) |
|---|---|---|---|---|
| 1 | (2R,3S)-2-(2,3-Dichlorophenoxymethyl)-8-methyl-3-(2-thienyl)-8-aza-bicyclo[3.2.1]octanefumaric acid salt | 0.30 | 0.0019 | 0.00052 |
| 2 | (2R,3S)-2-(1-Naphthyloxymethyl)-8-methyl-3-(2-thienyl)-8-aza-bicyclo-[3.2.1]octane fumaric acid salt | 0.36 | 0.0036 | 0.00042 |
| 3 | (2R,3S)-2-(2,3-Dichlorophenoxymethyl)-8-methyl-3-(2-furanyl)-8-aza-bicyclo-[3.2.1]octane fumaric acid salt | 0.31 | 0.00090 | 0.00036 |
| 4 | (2R,3S)-2-(1-Naphthyloxymethyl)-8-methyl-3-(2-furanyl)-8-aza-bicyclo-[3.2.1]octane fumaric acid salt | 0.92 | 0.0030 | 0.00053 |
| 5 | (2R,3S)-2-(2,3-Dichlorophenoxymethyl)-8-H-3-(2-thienyl)-8-aza-bicyclo[3.2.1]octane fumaric acid salt | 0.074 | 0.0018 | 0.00074 |
| 6 | (2R,3S)-2-(1-Naphthyloxymethyl)-8-H-3-(2-thienyl)-8-aza-bicyclo[3.2.1]octane fumaric acid salt | 0.19 | 0.0016 | 0.00054 |
Thiophenyltropanes
[edit]Diaryl
[edit] |
 |
6/7-tropane position substituted
[edit]2β-carbomethoxy 6/7 substituted
[edit]| Structure | Compound # (S. Singh) |
Substitution | DAT (IC50 nM) displacement of [H3]WIN 35428 |
5-HTT (IC50 nM) [H3]Citalopram |
Selectivity 5-HTT/DAT |
|---|---|---|---|---|---|
| Cocaine | H | 65 ± 12 | - | - | |
 |
103a | 3β,2β, 7-OMe 3′,4′-Cl2 |
86 ± 4.7 | 884 ± 100 | 10.3 |
 |
103b | 3β,2β, 7-OH 3′,4′-Cl2 |
1.42 ± 0.03 | 28.6 ± 7.8 | 20.1 |
 |
103c | 3α,2β, 7-OH 3′,4′-Cl2 |
1.19 ± 0.16 | 1390 ± 56 | 1168 |
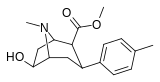 |
104a | 3β,2β, 6-OH 4′-Me |
215ɑ | - | - |
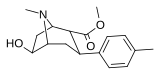 |
104b | 3β,2α, 6-OH 4′-Me |
15310ɑ | - | - |
 |
104c | 3α,2β, 6-OH 4′-Me |
930ɑ | - | - |
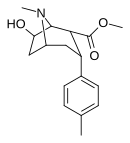 |
104d | 3α,2α, 6-OH 4′-Me |
7860ɑ | - | - |
- ɑIC50 value for displacement of [H3]mazindol. IC50 for cocaine 288 nM for displacement of [H3]mazindol
3-butyl 6/7 substituted
[edit]| Structure | Compound # (S. Singh) |
Substituent | Ki nM displacement of [H3]mazindol binding |
Ki nM [H3]DA uptake |
Selectivity uptake/binding |
|---|---|---|---|---|---|
| Cocaine | H | 270 ± 0.03 | 400 ± 20 | 1.5 | |
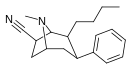 |
121a | 7β-CN | 2020 ± 10 | 710 ± 40 | 0.3 |
 |
121b | 6β-CN | 3040 ± 480 | 6030 ± 880 | 2.0 |
 |
121c | 7β-SO2Ph | 4010 ± 310 | 8280 ± 1340 | 2.1 |
 |
121d | 6β-SO2Ph | 4450 ± 430 | 8270 ± 690 | 1.8 |
 |
121e | 7α-OH | 830 ± 40 | 780 ± 60 | 0.9 |
 |
121f | H | 100 ± 10 | 61 ± 10 | 0.6 |
 |
121g | 7β-CN | 24000 ± 3420 | 32100 ± 8540 | 1.3 |
 |
121h | 6β-CN | 11300 ± 1540 | 26600 ± 3330 | 2.3 |
 |
121i | 7β-SO2Ph | 7690 ± 2770 | 7050 ± 450 | 0.9 |
 |
121j | 6β-SO2Ph | 4190 ± 700 | 8590 ± 1360 | 2.0 |
 |
121k | 7α-SO2Ph | 3420 ± 1100 | - | - |
 |
121l | 7β-SO2Ph, 7α-F | 840 ± 260 | 2520 ± 290 | 3.0 |
 |
121m | 7α-F | 200 ± 10 | 680 ± 10 | 3.4 |
 |
121n | 7β-F | 500 ± 10 | 550 ± 140 | 1.1 |
intermediate 6- & 7-position synthesis modified phenyltropanes
[edit]| Structure | Compound # (S. Singh) |
Substituent W | Substituent X | Substituent Y | Substituent Z |
|---|---|---|---|---|---|
 |
(±)-122a | CN | H | H | H |
 |
(±)-122b | H | H | CH | H |
 |
(±)-122c | H | CH | H | H |
 |
(±)-122d | H | H | H | CH |
 |
(±)-122e | SO2Ph | H | H | H |
 |
(±)-122f | H | H | SO2Ph | H |
 |
(±)-122g | H | SO2Ph | H | H |
 |
(±)-122h | SO2Ph | F | H | H |
 |
(±)-122i | F | SO2Ph | H | H |
 |
(±)-122j | H | H | SO2Ph | F |
8-tropane (bridgehead) position modified
[edit]Nortropanes (N-demethylated)
[edit]
NS2359 (GSK-372,475)
It is well established that electrostatic potential around the para position tends to improve MAT binding. This is believed to also be the case for the meta position, although it is less studied. N-demethylation dramatically potentiates NET and SERT affinity, but the effects of this on DAT binding are insignificant.[33] Of course, this is not always the case. For an interesting exception to this trend, see the Taxil document. There is ample evidence suggesting that N-demethylation of alkaloids occurs naturally in vivo via a biological enzyme. The fact that hydrolysis of the ester leads to inactive metabolites means that this is still the main mode of deactivation for analogues that have an easily metabolised 2-ester substituent. The attached table provides good illustration of the effect of this chemical transformation on MAT binding affinities. N.B. In the case of both nocaine and pethidine, N-demethyl compounds are more toxic and have a decreased seizure threshold.[34]
| Code (S.S. #) |
X para (unless position otherwise given inline) |
DA | 5HT | NE |
|---|---|---|---|---|
| RTI-142 75b |
F | 4.39 | 68.6 | 18.8 |
| RTI-98 75d Norɑ-RTI-55 |
I | 0.69 | 0.36 | 11.0 |
| RTI-110 75c |
Cl | 0.62 | 4.13 | 5.45 |
| RTI-173 75f |
Et | 49.9 | 8.13 | 122 |
| RTI-279 Norɑ-RTI-280 |
para-Me meta-I |
5.98 ± 0.48 | 1.06 ± 0.10 | 74.3 ± 3.8 |
| RTI-305 Norɑ-RTI-360/11y |
Ethynyl | 1.24 ± 0.11 | 1.59 ± 0.2 | 21.8 ± 1.0 |
| RTI-307 Norɑ-RTI-281/11z |
Propynyl | 6.11 ± 0.67 | 3.16 ± 0.33 | 115.6 ± 5.1 |
| RTI-309 Norɑ-11t |
Vinyl | 1.73 ± 0.05 | 2.25 ± 0.17 | 14.9 ± 1.18 |
| RTI-330 Norɑ-11s |
Isopropyl | 310.2 ± 21 | 15.1 ± 0.97 | — |
| RTI-353 | para-Et meta-I |
330.54 ± 17.12 | 0.69 ± 0.07 | 148.4 ± 9.15 |
ɑThe N-demethylated variant of (i.e. compound code-name after dash)
| N-Me compound code# → N-demethylated derivative compound code # |
para-X | [3H]Paroxetine | [3H]WIN 35,428 | [3H]Nisoxetine |
|---|---|---|---|---|
| 11 g→75f | Ethyl | 28.4 → 8.13 | 55 → 49.9 | 4,029 → 122 |
| 11t→75i | Vinyl | 9.5 → 2.25 | 1.24 → 1.73 | 78 → 14.9 |
| 11y→75n | Ethynyl | 4.4 → 1.59 | 1.2 → 1.24 | 83.2 → 21.8 |
| 11r→75 g | 1-Propyl | 70.4 → 26 | 68.5 → 212 | 3,920 → 532 |
| 11v→75k | trans-propenyl | 11.4 → 1.3 | 5.29 → 28.6 | 1,590 → 54 |
| 11w→75l | cis-propenyl | 7.09 → 1.15 | 15 → 31.6 | 2,800 → 147 |
| 11x→75 m | Allyl | 28.4 → 6.2 | 32.8 → 56.5 | 2,480 → 89.7 |
| 11z→75o | 1-Propynyl | 15.7 → 3.16 | 2.37 → 6.11 | 820 → 116 |
| 11s→75h | i-Propyl | 191 → 15.1 | 597 → 310 | 75,000 → ? |
| 11u→75j | 2-Propenyl | 3.13 → 0.6 | 14.4 → 23 | 1,330? → 144 |
| Isomer | 4′ | 3′ | NE | DA | 5HT |
|---|---|---|---|---|---|
| β,β | Me | H | 60 → 7.2 | 1.7 → 0.84 | 240 → 135 |
| β,β | F | H | 835 → 18.8 | 15.7 → 4.4 | 760 → 68.6 |
| β,β | Cl | H | 37 → 5.45 | 1.12 → 0.62 | 45 → 4.13 |
| β,α | Me | H | 270 → 9 | 10.2 → 33.6 | 4250 → 500 |
| β,α | F | H | 1200 → 9.8 | 21 → 32.6 | 5060 → 92.4 |
| β,α | Cl | H | 60 → 5.41 | 2.4 → 3.1 | 998 → 53.3 |
| β,α | F | Me | 148 → 4.23 | 13.7 → 9.38 | 1161 → 69.8 |
| β,α | Me | F | 44.7 → 0.86 | 7.38 → 9 | 1150 → 97.4 |
"Interest in NET selective drugs continues as evidenced by the development of atomoxetine, manifaxine, and reboxetine as new NET selective compounds for treating ADHD and other CNS disorders such as depression" (FIC, et al. 2005).[35]
| Structure | Short Name (S. Singh) |
Para-X | DAT [3H]WIN 35428 IC50 (nM) |
5-HTT [3H]Paroxetine IC50 (nM) |
NET [3H]Nisoxetine IC50 (nM) |
Selectivity 5-HTT/DAT |
Selectivity NET/DAT |
|---|---|---|---|---|---|---|---|
| Norcocaine | H | 206 ± 29 | 127 ± 13 | 139 ± 9 | 0.6 | 0.7 | |
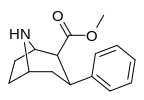 |
75a | H | 30.8 ± 2.3 | 156 ± 8 | 84.5 ± 7.5 | 5.1 | 2.7 |
 |
75b | F | 4.39 ± 0.20 | 68.6 ± 2.0 | 18.8 ± 0.7 | 15.6 | 4.3 |
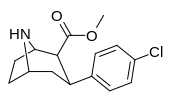 |
75c | Cl | 0.62 ± 0.09 | 4.13 ± 0.62 | 5.45 ± 0.21 | 6.7 | 8.8 |
 |
75d | I | 0.69 ± 0.2 | 0.36 ± 0.05 | 7.54 ± 3.19 | 0.5 | 10.9 |
 |
75e | para-I & 2β-CO2CH(CH3)2 |
1.06 ± 0.12 | 3.59 ± 0.27 | 132 ± 5 | 3.4 | 124 |
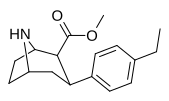 |
75f | C2H5 | 49.9 ± 7.3 | 8.13 ± 0.30 | 122 ± 12 | 0.2 | 2.4 |
 |
75g | n-C3H7 | 212 ± 17 | 26 ± 1.3 | 532 ± 8.1 | 0.1 | 2.5 |
 |
75h | CH(CH3)2 | 310 ± 21 | 15.1 ± 0.97 | - | 0.05 | - |
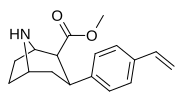 |
75i | CH=CH2 | 1.73 ± 0.05 | 2.25 ± 0.17 | 14.9 ± 1.18 | 1.3 | 8.6 |
 |
75j | C-CH3 ║ CH2 |
23 ± 0.9 | 0.6 ± 0.06 | 144 ± 12 | 0.03 | 6.3 |
 |
75k | trans-CH=CHCH3 | 28.6 ± 3.1 | 1.3 ± 0.1 | 54 ± 16 | 0.04 | 1.9 |
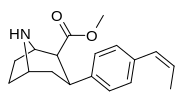 |
75l | cis-CH=CHCH3 | 31.6 ± 2.2 | 1.15 ± 0.1 | 147 ± 4.3 | 0.04 | 4.6 |
 |
75m | CH2CH=CH2 | 56.5 ± 56 | 6.2 ± 0.3 | 89.7 ± 9.6 | 0.1 | 1.6 |
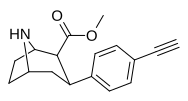 |
75n | CH≡CH | 1.24 ± 0.11 | 1.59 ± 0.2 | 21.8 ± 1.0 | 1.3 | 17.6 |
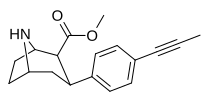 |
75o | CH≡CCH3 | 6.11 ± 0.67 | 3.16 ± 0.33 | 116 ± 5.1 | 0.5 | 19.0 |
 |
75pɑ | 3,4-Cl2 | 0.66 ± 0.24 | 1.4b | - | 2.1 | - |
ɑThese values determined in Cynomolgus monkey caudate-putamen bThe radioligand used for 5-HTT was [3H]citalopram
| Compound Structure | Short Name (S. Singh) |
DAT [125I]RTI-55 IC50 (nM) |
5-HTT [3H]Paroxetine Ki (nM) |
NET [3H]Nisoxetine Ki (nM) |
Selectivity 5-HTT/DAT |
Selectivity NET/DAT |
|---|---|---|---|---|---|---|
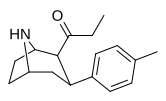
 |
79a | 0.07 ± 0.01 | 0.22 ± 0.16 | 2.0 ± 0.09 | 3.1 | 28.6 |
 |
79b | 4.7 ± 0.58 | 19 ± 1.4 | 5.5 ± 2.0 | 4.0 | 1.2 |
 |
79c | 380 ± 110 | 5.3 ± 1.0 | 3400 ± 270 | 0.01 | 8.9 |
 |
79d | 190 ± 17 | 150 ± 50 | 5100 ± 220 | 0.8 | 26.8 |
 |
79e | 490 ± 120 | 85 ± 16 | 4300 ± 1100 | 0.1 | 8.8 |
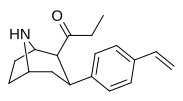 |
79f | 1.5 ± 1.1 | 0.32 ± 0.06 | 10.9 ± 1.5 | 0.2 | 7.3 |
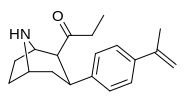 |
79g | 16 ± 4.9 | 0.11 ± 0.02 | 94 ± 18 | 0.07 | 5.9 |
Paroxetine homologues
[edit]See the N-methyl paroxetine homologues cf. di-aryl phenyltropanes for another SSRI approximated hybrid: the fluoxetine based homologue of the phenyltropane class.
| Compound Structure | Short Name (S. Singh) |
Stereochemistry | DAT [3H]WIN 35428 IC50 (nM) |
5-HTT [3H]Paroxetine IC50 (nM) |
NET [3H]Nisoxetine IC50 (nM) |
Selectivity 5-HTT/DAT |
Selectivity NET/DAT |
|---|---|---|---|---|---|---|---|
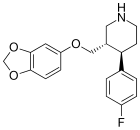 |
Paroxetine | - | 623 ± 25 | 0.28 ± 0.02 | 535 ± 15 | 0.0004 | 0.8 |
 |
R-81a | 2β,3β | 835 ± 90 | 480 ± 21 | 37400 ± 1400 | 0.6 | 44.8 |
 |
R-81b | 2α,3β | 142 ± 13 | 90 ± 3.4 | 2500 ± 250 | 0.6 | 17.6 |
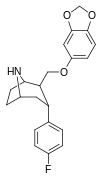 |
R-81c | 2β,3α | 3.86 ± 0.2 | 5.62 ± 0.2 | 14.4 ± 1.3 | 1.4 | 3.7 |
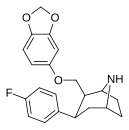 |
S-81d | 2β,3β | 1210 ± 33 | 424 ± 15 | 17300 ± 1800 | 0.3 | 14.3 |
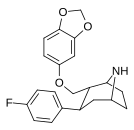 |
S-81e | 2α,3β | 27.6 ± 2.4 | 55.8 ± 5.73 | 1690 ± 150 | 2.0 | 61.2 |
 |
S-81f | 2β,3α | 407 ± 33 | 19 ± 1.8 | 1990 ± 176 | 0.05 | 4.9 |
N-replaced (S,O,C)
[edit]The eight position nitrogen has been found to not be an exclusively necessary functional anchor for binding at the MAT for phenyltropanes and related compounds. Sulfurs, oxygens, and even the removal of any heteroatom, leaving only the carbon skeleton of the structure at the bridged position, still show distinct affinity for the monoamine transporter cocaine-target site and continue to form an ionic bond with a measurable degree of reasonable efficacy.
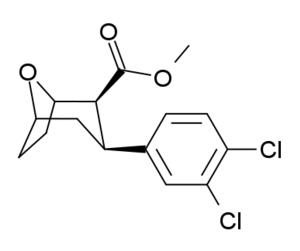
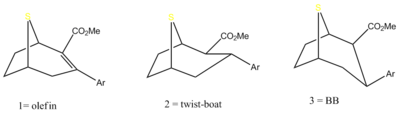
| Compound | X | 2 Group | config | 8 | DA | 5-HT | NE |
| Tropoxane | Cl,Cl | CO2Me | (racemic) β,β | O | 3.3 | 6.5 | No data |
| O-4210[36] | p-F | 3-methyl-5-isoxazole | β,β | S | 7.0 | >1000 | No data |

8-oxa bridgehead replacements
[edit]| Structure | Compound # (S. Singh) |
Para- (meta-) |
DAT (IC50 nM) displacement of [H3]WIN 35428 |
5-HTT (IC50 nM) [H3]Citalopram |
Selectivity 5-HTT/DAT |
|---|---|---|---|---|---|
 |
R/S-90a | H | >1000 | >1000 | - |
 |
R/S-90b | F | 546 | 2580 | 4.7 |
 |
R/S-90c | Cl | 10 | 107 | 10.7 |
 |
R/S-90d | Br | 22 | 30 | 1.4 |
 |
R/S-90e | I | 7 | 12 | 1.7 |
 |
R/S-90f | 3,4-Cl2 | 3.35 | 6.52 | 1.9 |
 |
R-90g | 3,4-Cl2 | 3.27 | 4.67 | 1.4 |
 |
S-90h | 3,4-Cl2 | 47 | 58 | 1.2 |
 |
R/S-91a | H | 1990 | 11440 | 5.7 |
 |
R/S-91b | F | >1000 | >10000 | - |
 |
R/S-91c | Cl | 28.5 | 816 | 28.6 |
 |
R/S-91d | Br | 9 | 276 | 30.7 |
 |
R/S-91e | I | 42 | 72 | 1.7 |
 |
R/S-91f | 3,4-Cl2 | 3.08 | 64.5 | 20.9 |
 |
R-91g | 3,4-Cl2 | 2.34 | 31 | 13.2 |
 |
S-91h | 3,4-Cl2 | 56 | 2860 | 51.1 |
8-carba bridgehead replacements
[edit]| Structure | Compound # (S. Singh) |
DAT (IC50 nM) displacement of [H3]WIN 35428 |
5-HTT (IC50 nM) [H3]Citalopram |
Selectivity 5-HTT/DAT |
|---|---|---|---|---|
 |
R/S-98a | 7.1 ± 1.7 | 5160 ± 580 | 726 |
 |
R/S-98b | 9.6 ± 1.8 | 33.4 ± 0.6 | 3.5 |
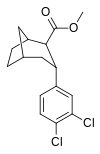 |
R/S-98c | 14.3 ± 1.1 | 180 ± 65 | 12.6 |
N-alkyl
[edit]

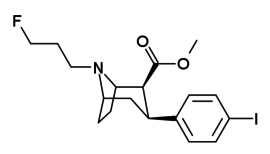
| Compound | X | 2 Group | config | 8 | DAT | SERT | NET |
|---|---|---|---|---|---|---|---|
| FP-β-CPPIT | Cl | 3′-phenylisoxazol-5′-yl | β,β | NCH2CH2CH2F | - | - | - |
| FE-β-CPPIT | Cl | (3′-phenylisoxazol-5′-yl) | β,β | NCH2CH2F | - | - | - |
| Altropane (IACFT) | F | CO2Me | β,β | NCH2CH=CHF | - | - | - |
| FECNT[37] | I | CO2Me | β,β | NCH2CH2F | - | - | - |
| RTI-310 U.S. patent 5,736,123 | I | CO2Me | β,β | N-Prn | 1.17 | - | - |
| RTI-311 | I | CO2Me | β,β | NCH2CH=CH2 | 1.79 | - | - |
| RTI-312 U.S. patent 5,736,123 | I | CO2Me | β,β | NBun | 0.76 | - | - |
| RTI-313 U.S. patent 5,736,123 | I | CO2Me | β,β | NCH2CH2CH2F | 1.67 | - | - |
| Ioflupane (FP-CIT) | 123I | CO2Me | β,β | NCH2CH2CH2F | - | - | - |
| PE2I[37] | Me | CO2Me | β,β | NCH2CH=CHI | - | - | - |
| RTI-251 | Cl | CO2Me | β,β | NCH2CO2Et | 1.93 | 10.1 | 114 |
| RTI-252 | Cl | CO2Me | β,β | NCH2CH2CO2Et | 2.56 | 35.2 | 125 |
| RTI-242 | Cl | β,β (bridged) -C(O)CH(CO2Me)CH2N | 7.67 | 227 | 510 | ||
Bi- and tri-cyclic aza compounds and their uses.[38][39]
| Structure | Short Name (S. Singh) |
Nitrogen side-chain (N8) |
DAT [3H]GBR 12935 Ki (nM) |
5-HTT [3H]Paroxetine Ki (nM) |
NET [3H]Nisoxetine Ki (nM) |
Selectivity 5-HTT/DAT |
Selectivity NET/DAT |
|---|---|---|---|---|---|---|---|
| Cocaine | H | 350 ± 80 | >10000 | >30000 | >28.6 | - | |
| GBR 12909 | - | 0.06 ± 0.02 | 52.8 ± 4.4 | >20000 | 880 | - | |
| WIN 35428 11b |
H | 14.7 ± 2.9 | 181 ± 21 | 635 ± 110 | 12.3 | 43.2 | |
| RTI-55 11e |
H | 1.40 ± 0.20 | 0.46 ± 0.06 | 2.80 ± 0.40 | 0.3 | 2 | |
 |
82a | CH2CH=CH2 | 22.6 ± 2.9ɑ | - | - | - | - |
 |
82b | CH2CH2CH3 | 43.0 ± 17.7ɑ | - | - | - | - |
 |
82c | CH2C6H5 | 58.9 ± 1.65b | 1073c | - | 18.2 | - |
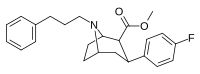 |
82d | (CH2)3C6H5 | 1.4 ± 0.2b | 133 ± 7c | - | 95.0 | - |
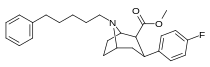 |
82e | (CH2)5C6H5 | 3.4 ± 0.83b | 49.9 ± 10.2c | - | 14.7 | - |
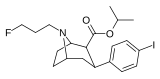 |
83a | CH2CH2CH2F | 1.20 ± 0.29 | 48.7 ± 8.4 | 10000 | 40.6 | 8333 |
 |
83b | CH2CH2F | 4.40 ± 0.35 | 21.7 ± 8.3 | >10000 | 4.9 | - |
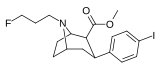 |
84a | CH2CH2CH2F | 3.50 ± 0.39 | 0.110 ± 0.02 | 63.0 ± 4.0 | 0.03 | 18 |
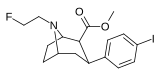 |
84b | CH2CH2F | 4.00 ± 0.73 | 0.140 ± 0.02 | 93.0 ± 17.0 | 0.03 | 23.2 |
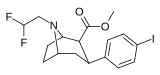 |
84c | CH2CHF2 | 15.1 ± 3.7 | 9.6 ± 1.5 | >5000 | 0.6 | - |
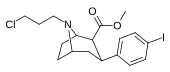 |
84d | CH2CH2CH2Cl | 3.10 ± 0.57 | 0.32 ± 0.06 | 96.0 ± 29.0 | 0.1 | 31.0 |
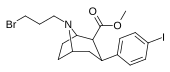 |
84e | CH2CH2CH2Br | 2.56 ± 0.57 | 0.35 ± 0.08 | 164 ± 47 | 0.1 | 64.1 |
 |
84f | CH2CH2CH2I | 38.9 ± 6.3 | 8.84 ± 0.53 | 5000 | 0.2 | 128 |
 |
84g | CH2...methylcyclopropane | 4.30 ± 0.87 | 1.30 ± 0.25 | 198 ± 9.6 | 0.3 | 46.0 |
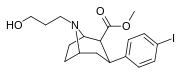 |
84h | CH2CH2CH2OH | 5.39 ± 0.21 | 2.50 ± 0.20 | 217 ± 19 | 0.5 | 40.2 |
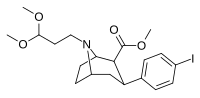 |
84i | CH2CH2(OCH3)2 | 6.80 ± 1.10 | 1.69 ± 0.09 | 110 ± 7.7 | 0.2 | 16.2 |
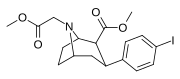 |
84j | CH2CO2CH3 | 11.9 ± 1.4 | 0.81 ± 0.10 | 29.1 ± 1.0 | 0.07 | 2.4 |
 |
84k | CH2CON(CH3)2 | 12.2 ± 3.8 | 6.40 ± 1.70 | 522 ± 145 | 0.5 | 42.8 |
 |
84l | CH2CH2CH2OMs | 36.3 ± 2.1 | 17.3 ± 1.2 | 5000 | 0.5 | 138 |
 |
84m | COCH(CH3)2 | 2100 ± 140 | 102 ± 23 | >10000 | 0.05 | - |
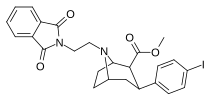 |
84n | (CH2)2Pht | 4.23 ± 0.48 | 0.84 ± 0.02 | 441 ± 66.0 | 0.2 | 104 |
 |
84o | (CH2)3Pht | 9.10 ± 1.10 | 0.59 ± 0.07 | 74.0 ± 11.6 | 0.06 | 8.1 |
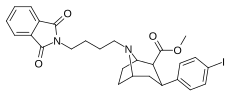 |
84p | (CH2)4Pht | 2.38 ± 0.22 | 0.21 ± 0.02 | 190 ± 18.0 | 0.09 | 79.8 |
 |
84q | (CH2)5Pht | 2.40 ± 0.17 | 0.34 ± 0.03 | 60.0 ± 3.10 | 0.1 | 25.0 |
 |
84r | (CH2)8Pht | 2.98 ± 0.30 | 0.20 ± 0.02 | 75.0 ± 3.6 | 0.07 | 25.2 |
 |
84sd | CH2CH=CH-CH3 | 15 ± 1 | 75 ± 5 | 400 ± 80 | 5.0 | 26.7 |
 |
84td | CH2C(Br)=CH2 | 30 ± 5 | 200 ± 40 | >1000 | 6.7 | - |
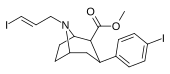 |
84ud | CH2CH=CH2I(E) | 30 ± 5 | 960 ± 60 | 295 ± 33 | 32.0 | 9.8 |
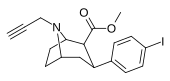 |
84vd | CH2C≡CH | 14 ± 1 | 100 ± 30 | >1000 | 7.1 | - |
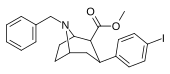 |
84wd | CH2C6H5 | 42 ± 12 | 100 ± 17 | 600 ± 100 | 2.4 | 14.3 |
 |
84xd | CH2C6H4-2-CH3 | 93 ± 19 | 225 ± 40 | >1000 | 2.4 | - |
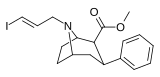 |
85ad | para-H | 113 ± 41 | 100 ± 20 | >1000 | 0.9 | - |
 |
85bd | para-Cl, meta-Cl | 29 ± 4 | 50 ± 6 | 500 ± 120 | 1.7 | 17.2 |
 |
85cd | para-Me | 17 ± 7 | 500 ± 30 | >1000 | 29.4 | - |
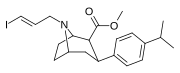 |
85dd | para-CH(CH3)2 | 500 ± 120 | 450 ± 80 | >1000 | 0.9 | - |
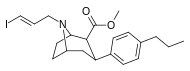 |
85ed | para-n-C3H7 | 500 ± 100 | 300 ± 12 | 750 ± 160 | 0.6 | 1.5 |
- ɑIC50 for displacement of [3H]cocaine. IC50 for cocaine = 67.8 ± 8.7 (nM)
- bIC50 values for displacement of [3H]WIN 35428
- cIC50 values for displacement of [3H]citalopram
- dThe standard Ki value for the displacement of [3H]GBR 12935, [3H]paroxetine, and [3H]nisoxetine were 27 ± 2, 3 ± 0.2, and 80 ± 28 nM, respectively, for these experiments
Structure 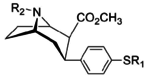
|
Compound | R1 | R2 | Inhibition of [3H]WIN 35,428 @ DAT IC50 (nM) |
Inhibition of [3H]Paroxetine @ 5-HTT Ki (nM) |
Inhibition of [3H]Nisoxetine @ NET Ki (nM) |
NET/DAT (uptake ratio) |
NET/5-HTT (uptake ratio) |
|---|---|---|---|---|---|---|---|---|
| See 7a—7h table | ||||||||
| 7a | CH3 | CH3 | 9 ± 3 | 0.7 ± 0.2 | 220 ± 10 | 24 | 314 | |
| 7b | C2H5 | CH3 | 232 ± 34 | 4.5 ± 0.5 | 1170 ± 300 | 5 | 260 | |
 |
8a | CH3 | H | 28 ± 6 | 0.19 ± 0.01 | 21 ± 6 | 0.8 | 110 |
 |
8b | C2H5 | H | 177 ± 62 | 1.26 ± 0.05 | 118 ± 13 | 0.7 | 94 |
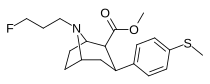 |
9a | CH3 | FCH2CH2CH2 | 112 ± 2 | 3 ± 1 | 960 ± 100 | 9 | 320 |
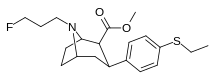 |
9b | C2H5 | FCH2CH2CH2 | 1,200 ± 200 | 27 ± 2 | >2,000 | 2 | 74 |
 |
10a | CH3 | CH2=CH2CH2 | 71 ± 25 | 5.5 ± 0.8 | 2,000 ± 500 | 28 | 364 |
 |
10b | C2H5 | CH2=CH2CH2 | 1,100 ± 100 | 47 ± 3 | >2,000 | 2 | 43 |
 |
11a | CH3 | CH3CH2CH2 | 74 ± 20 | 5.7 ± 0.6 | 1,200 ± 140 | 16 | 211 |
 |
11b | C2H5 | CH3CH2CH2 | 900 ± 300 | 49 ± 6 | >2,000 | 2 | 41 |
Bridged N-constrained phenyltropanes (fused/tethered)
[edit]p-methyl aryl front & back N-bridged phenyltropanes
[edit]

| Compound # (S. Singh's #) |
2β=R | [3H]Mazindol binding | [3H]DA uptake | [3H]5-HT uptake | [3H]NE uptake | selectivity [3H]5-HT/[3H]DA |
|---|---|---|---|---|---|---|
| cocaine | CO2CH3 | 375 ± 68 | 423 ± 147 | 155 ± 40 | 83.3 ± 1.5 | 0.4 |
| (–)-40 (–)-128 |
54.3 ± 10.2 | 60.3 ± 0.4 | 1.76 ± 0.23 | 5.24 ± 0.07 | 0.03 | |
| (+)-40 (+)-128 |
79 ± 19 | 114 ± 28 | 1.48 ± 0.07 | 4.62 ± 0.31 | 0.01 | |
| (±)-40 (±)-128 |
61.7 ± 8.5 | 60.3 ± 0.4 | 2.32 ± 0.23 | 2.69 ± 0.12 | 0.04 | |
| 29β | 620 | 1420 | 8030 | — | — | |
| 30β | 186 | 492 | 97.7 | — | — | |
| 31β | 47.0 | 211 | 28.5 | — | — | |
| 29α | 4140 | 20100 | 3920 | — | — | |
| 30α | 3960 | 8850 | 696 | 1150 | — | |
| 45 129 |
6.86 ± 0.43 | 24.0 ± 1.3 | 1.77 ± 0.04 | 1.06 ± 0.03 | 0.07 | |
| 42a 131a |
n-Bu | 4.00 ± 0.07 | 2.23 ± 0.12 | 14.0 ± 0.6 | 2.99 ± 0.17 | 6.3 |
| 41a 130a |
n-Bu | 17.2 ± 1.13 | 10.2 ± 1.4 | 78.9 ± 0.9 | 15.0 ± 0.4 | 7.8 |
| 42b 131b |
Et | 3.61 ± 0.43 | 11.3 ± 1.1 | 25.7 ± 4.3 | 4.43 ± 0.01 | 2.3 |
| 50a 133a |
n-Bu | 149 ± 6 | 149 ± 2 | 810 ± 80 | 51.7 ± 12 | 5.4 |
| 49a 132a |
n-Bu | 13.7 ± 0.8 | 14.2 ± 0.1 | 618 ± 87 | 3.84 ± 0.35 | 43.5 |
| (–)-4 | 10500 | 16500 | 1890 | 70900 | — | |
| (+)-4 | 18500 | 27600 | 4630 | 38300 | — | |
| (–)-5 | 9740 | 9050 | 11900 | 4650 | — | |
| (+)-5 | 6770 | 10500 | 25100 | 4530 | — | |
| RTI -4229/COC -242 | N8/2β-C (O) CH (CO2ME) CH2N Пара -хлор |
— | 7.67 ± 0.31 ɑ | 226.54 ± 27.37 беременный | 510.1 ± 51.4 в | — |
- ɑ Значение для смещения [ 3 H] выиграть 35 428 привязка @ что
- беременный Значение для смещения [ 3 H] связывание пароксетина с SERT
- в Значение для смещения [ 3 H] нисоксетин из сети
Слитые производные тропана в качестве ингибиторов обратного захвата нейротрансмиттера. Сингх отмечает, что все протестированные протестированные производные, отображаемые в 2,5–104 с более высокой аффинностью DAT, чем кокаин. В 2,8–190 раз, более сильные в DAT, также имели повышенную эффективность на двух других участках коврика (Net & Sert); Сеть имеет 1,6—78 × повышенную активность. (+)-128 дополнительно демонстрировали 100 × большую активность @ sert, тогда как 132a и 133a имели 4 × 5,2 × слабая активность 5-HTT ( IE SERT). Фронт-мостиковые ( например, 128 и 129) имели лучшее соотношение обратного захвата 5-HT/DA в пользу SERT, в то время как предпочтительное размещение с обратным мостиком ( например, 130—133) с взаимодействием DAT. [ 1 ] Патент США 5 998 405
3,4-Cl 2 арил-фенилтропаны
[ редактировать ]

| Код | Сложный | От (мкм) | Ne (мкм) | 5-HT (мкм) |
|---|---|---|---|---|
| 1 | (1 S, 2S, 4S, 7R) -2- (3,4-дихлор-фенил) -8-азатрицикло [5.4.0.0 4,8 ]-Undecan-11-One O-метил-охла | 0.012 | 0.0020 | 0.0033 |
| 2 | (1 S, 2S, 4S, 7R) -2- (3,4-дихлор-фенил) -8-азатрицикло [5.4.0.0 4,8 ]-Undecan-11-One | 0.18 | 0.035 | 0.0075 |
| 3 | (1 S, 3S, 4S, 8R) -3- (3,4-дихлор-фенил) -7-азатрицикло [5.3.0.04,8]-декан-5-One O-метил-ох. | 0.0160 | 0.0009 | 0.0032 |
| 4 | (1 S, 2S, 4S, 7R) -2- (3,4-дихлор-фенил) -8-азатрицикло [5.4.0.04,8]-Undecan-11-OL | 0.0750 | 0.0041 | 0.0028 |
| 5 | (1 S, 3S, 4S, 8R) -3- (3,4-дихлор-фенил) -7-азатрицикло [5.3.0.04,8]-декан-5-один | 0.12 | 0.0052 | 0.0026 |
| 6 | (1 S, 3S, 4S, 8R) -3- (3,4-дихлор-фенил) -7-азатрицикло [5.3.0.04,8] -decan-5-ol | 0.25 | 0.0074 | 0.0018 |
| 7 | (1S, 3S, 4S, 8R) -3- (3,4-дихлор-фенил) -7-азатрицикло [5.3.0.04,8] декабря 5-ил ацетат | 0.21 | 0.0061 | 0.0075 |
| 8 | (1S, 3S, 4S, 8R) -3- (3,4-дихлорфенил) -5-метокси-7-азатрицикло [5.3.0.04,8] декана | 0.022 | 0.0014 | 0.0001 |
- 1 -хлорэтилхлороформа используется для удаления N -метил транс -арилтропанов.
- 2 ° амин реагирует с Br (CH 2 ) NCO 2 et.
- Основание, используемое для абстрактного протона α- в CO 2 ET Group и завершить стадию закрытия трициклического кольца ( циклизация Dieckmann ).
Чтобы сделать другой тип аналога (см. Патент на козиковский выше)
- Удалить N-Me
- Добавить ɣ-бром-хлорпропановый
- Разрешить циклизацию с базой K 2 CO 3 и Ki Cat.
C2 + C3 (боковая цепь) слитые (карбоксилат и бензол соединен)
[ редактировать ]
(1R, 2S, 10R, 12S) -15-метил-15-азатетрацикло (10.2.1.0 2 , 10 .0 4 , 9 ) Pentadeca-4 (9), 5,7-Tien-3-One [ 3 ]
C3 до 1 ′ + 2 '( Ortho ) Tropane Locant Dual Arene Bridged
[ редактировать ]
Родительское соединение серии спироциклических бензоил -модификации кокаина аналогов, созданных с помощью метода связывания сузуки орто -обозначенных арилбороновых кислот, и энол -трифлат, полученный из кокаина; который технически имеет три метиленовые длины аналогов кокаина, а также единственную длину, которая определяет серию фенилтропана. Обратите внимание, что карбометоксильная группа связана (из -за ограничений в синтетических процессах, используемых при создании этого соединения) Alpha, настроенной; который не является обычным, наиболее распространенным, конформацией, предпочитаемой для связывающего кармана PT-кокаина-рецептора из большинства такого подтипа химических веществ. Вышеупомянутые и ниже изображения показывают, что заветные соединения синтезировались, дополнительно с вариациями на -экзомерию эндо их структур. [ 40 ]
Циклоалкановые изменения кольцевой системы Tropane
[ редактировать ]Азанонан (внешнее кольцо расширено)
[ редактировать ]3-фенил-9-азабицикло [3.3.1] неэн-производные
Чтобы лучше выяснить требования к связыванию в MAT, единица метилена на тропане была расширена одним для создания азанонановых аналогов. [ я ] Которые являются началом классов модификаций, которые начинают вызывать проблемы и влияния макроциклического стереоконтроля .
Несмотря на ослабленную гибкость кольцевой системы, азотные ограниченные варианты (такие, которые были созданы для создания мостового класса фенилтропанов), которые могли бы лучше соответствовать жесткому размещению, необходимому для удовлетворения пространственных требований, необходимых в связывающем кармане, не были синтезированы. Хотя типы с передним мостиком были синтезированы для гомологов веперидинов: тенденция равных значений для любого изомеров этого типа следовала тенденции противоположного и уменьшенной пластичности молекулы, чтобы бороться с обоснованием для дальнейшего ограничения фармакофора в пределах этой области. Вместо этого такие результаты подтверждают потенциал эффективности слияния азота на увеличенном тропане, как и на соединениях, приведенных ниже.
| Структура | Сложный # (С. Сингх) |
K I ( NM ) |
|---|---|---|
 |
Кокаин | 32 ± 5 390 ± 220 |
 |
Win 35065-2 | 33 ± 17 310 ± 220 |
 |
146a | 4600 ± 510 |
 |
146b | 5730 ± 570 |
 |
146c | 3450 ± 310 |
 |
146d | 3470 ± 350 |
 |
147 | 13900 ± 2010 |
Азакоррнан (внешнее кольцо сократилось)
[ редактировать ]3-фенил-7-азабицикло [2.2.1] производные гептана
Кольцевые аналоги фенилтропанов не допускали достаточного проникновения фенила в сайт связывания мишени на MAT для сродства в эффективном диапазоне. Расстояние от азота до фенилцентроида в течение 155A составило 4,2 и 155C составляло 5,0 Å соответственно. (В то время как Тропарил был 5,6 и соединением 20А 5,5 ангстрем). Однако гомологи паперидина (обсуждаемые ниже) имели сопоставимые потенции. [ J ]

Некарбоксильный (и субстрат DAT, выпущенный агент) вариант экзо-2-фенил-7-азабицикло (2.2.1) гептана-1-карбоновая кислота (NB Карбокси в последнем разделяет положение C1 Tropane с двумя углерода содержащий мост азот , ;
С помощью функции карбокси эфира удалили результирующие производные составные действия в качестве субстратного препарата DAT, таким образом, амфетаминергический релиз Mat & VMAT, но аналогичный фенилтропанам (которые обычно являются только лигандами повторного воспитания). [ 41 ] ср. Exp-561 & btq .
в положении, в котором он будет на гомологах пиперидина т.е. бензоилоксиса, карбамоилы и т. Д.) Или с азотом Азакорнейны с более длинными заменами в 3β-положении ( алкилфенилы ( облегчить структуру соединения с коррелятивной пропорцией, функциональной для данного фрагмента), не были синтезированы, несмотря на выводы о том, что длина азота с фенилом была проблемой в дисперсии достаточной, чтобы быть мешающим фактором для правильного связывания сжатой топологии. Азакоррнан. Кэрролл, однако, перечислил бензоилокси азаборнанов в патентах. [ 3 ]
| Структура | Сложный # (С. Сингх) |
K I ( NM ) |
|---|---|---|
 |
Кокаин | 32 ± 5 390 ± 220 |
 |
Win 35065-2 | 33 ± 17 310 ± 220 |
 |
155а | 60,400 ± 4,800 |
  |
155b | 96,500 ± 42 |
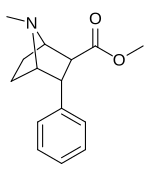 |
155с | 5,620 ± 390 |
 |
155d | 18,900 ± 1,700 |
пиперидина Гомологи (внутренний двухуглеродистый мост вырезал)
[ редактировать ]Гомологи пиперидина имели сопоставимые сходные и активные спреды в их соответствующие аналоги фенилтропана. Без столь же расхождения между различными изомерами класса пиперидина относительно аффинности и значений связывания, как и в фенилтропанах.
P -Hloro & связанный (гомологи фенилтропанов)
[ редактировать ]| Структура | Сложный # (С. Сингх) |
X = to - / 4'- Замена |
R = 2-тропановое положение | Что (IC 50 нм ) [ЧАС 3 ] Выиграть 35428 смещение связывания |
(IC 50 нм ) [ЧАС 3 ] Чтобы получить |
Селективность Поглощение/привязка |
|---|---|---|---|---|---|---|
 | ||||||
| Кокаин | ЧАС | Co 2 я | 102 ± 9 | 239 ± 1 | 2.3 | |
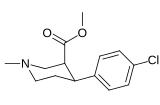 | ||||||
| (±) -166a | Калькуляция | β-co 2 ch 3 | 53.7 ± 1.9 | 37.8 ± 7.9 | 0.7 | |
| (-)-166a | Калькуляция | β-co 2 ch 3 | 24.8 ± 1.6 | 85.2 ± 2.6 | 3.4 | |
| (+)-166a | Калькуляция | β-co 2 ch 3 | 1360 ± 125 | 5090 ± 172 | 3.7 | |
 | ||||||
| (-)-167a | Калькуляция | β-Co 2 OH | 75.3 ± 6.2 | 49.0 ± 3.0 | 0.6 | |
| (+)-167a | Калькуляция | β-Co 2 OH | 442 ± 32 | — | — | |
 | ||||||
| (-)-168a | Калькуляция | B-Co 2 OAC | 44.7 ± 10.5 | 62.9 ± 2.7 | 1.4 | |
| (+)-168a | Калькуляция | B-Co 2 OAC | 928 ± 43 | 2023 ± 82 | 2.2 | |
 | ||||||
| (-)-169a [ 42 ] | Калькуляция | β -n -pr | 3.0 ± 0.5 | 8.3 ± 0.6 | 2.8 | |
 | ||||||
| (-)-170a | ЧАС | β-co 2 ch 3 | 769 ± 19 | — | — | |
 | ||||||
| (±) -166b | Калькуляция | α-Co 2 CH 3 | 197 ± 8 | — | — | |
| (+)-166b | Калькуляция | α-Co 2 CH 3 | 57.3 ± 8.1 | 34.6 ± 3.2 | 0.6 | |
| (-)-166b | Калькуляция | α-Co 2 CH 3 | 653 ± 38 | 195 ± 8 | 0.3 | |
 | ||||||
| (+)-167b | Калькуляция | α-Co 2 OH | 240 ± 18 | 683 ± 47 | 2.8 | |
 | ||||||
| (+)-168b | Калькуляция | A-Co 2 OAC | 461 ± 11 | — | — | |
 | ||||||
| (+)-169b | Калькуляция | α -n -pr | 17.2 ± 0.5 | 23.2 ± 2.2 | 1.3 |
Гетероциклический N -Десметил [ 43 ]

Нафтил и связанный (гомологи фенилтропанов)
[ редактировать ]| Структура | Сложный # | [ЧАС 3 ] Поглощение DA (NM) IC 50 |
[ЧАС 3 ] Поглощение DA (NM) K я |
[ЧАС 3 ]NE uptake (nM) IC 50 |
[ЧАС 3 ]NE uptake (nM) K я |
[ЧАС 3 ] 5-HTT поглощение (NM) IC 50 |
[ЧАС 3 ] 5-HTT поглощение (NM) K я |
Коэффициент поглощения И / 5-HT k ( ) |
Коэффициент поглощения NE/5-HT ( K i ) |
|---|---|---|---|---|---|---|---|---|---|
 |
Кокаин | 459 ± 159 | 423 ± 147 | 127 ± 4.1 | 108 ± 3.5 | 168 ± 0.4 | 155 ± 0.4 | 2.7 | 0.69 |
 |
Флуоксетин | > 4500 | > 2500 | 193 ± 4.1 | 176 ± 3.5 | 8.1 ± 0.7 | 7.3 ± 0.7 | 624 | 24 |
 |
20 | 75 ± 9.1 | 69 ± 8.1 | 101 ± 3.3 | 88 ± 2.9 | 440 ± 30 | 391 ± 27 | 0.18 | 0.23 |
 |
6 | 23 ± 1.0 | 21 ± 0.9 | - | 34 ± 0.8 | 8.2 ± 0.3 | 7.6 ± 0.2 | 2.8 | 4.5 |
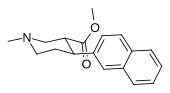 |
7 | > 1000 | 947 ± 135 | - | 241 ± 1.7 | 8.2 ± 0.3 | 7.6 ± 0.2 | 22.6 | 5.7 |
 |
8 | 94 ± 9.6 | 87 ± 8.9 | - | 27 ± 1.6 | 209 ± 17 | 192 ± 16 | 0.45 | 0.14 |
 |
9 | 293 ± 6.4 | 271 ± 5.9 | - | 38 ± 4.0 | 13 ± 0.7 | 12 ± 0.7 | 23 | 3.2 |
 |
19 | 97 ± 8.6 | 90 ± 8.0 | 34 ± 2.5 | 30 ± 2.3 | 3.9 ± 0.5 | 3.5 ± 0.5 | 26 | 8.6 |
 |
10 | 326 ± 1.2 | 304 ± 1.1 | 337 ± 37 | 281 ± 30 | 113 ± 4.3 | 101 ± 3.8 | 3.0 | 2.8 |
 |
14 | 144 ± 20 | 131 ± 18 | 204 ± 5.6 | 175 ± 4.8 | 155 ± 3.9 | 138 ± 3.5 | 0.95 | 1.3 |
 |
15 | > 1800 | > 1700 | > 1300 | > 1100 | 275 ± 39 | 255 ± 37 | > 6 | > 4 |
 |
16 | > 1000 | 964 ± 100 | > 1200 | > 1000 | 334 ± 48 | 309 ± 44 | 3.1 | 3.5 |
 |
17 | 213 ± 30 | 187 ± 26 | 399 ± 12 | 364 ± 9.2 | 189 ± 37 | 175 ± 34 | 1.1 | 2.1 |
 |
18 | 184 ± 30 | 173 ± 26 | 239 ± 42 | 203 ± 36 | 67 ± 4.5 | 62 ± 4.1 | 2.8 | 3.3 |
дистально азотный «диметиламин» (пиперидиноподобные циклогексиловые гомологи фенилтропанов) [ 3 ]
[ редактировать ]

ср. Fencamfamine
Радиоактивно -меченые
[ редактировать ]

| Код | Хард K I (NM) | Нейтральный k i (нм) | Dat K IS (NM) | Радиолабель | In vivo исследование | Рефс. |
|---|---|---|---|---|---|---|
| 1 | 0.2 | 102.2 | 29.9 | 11 В | Нечеловеческий примат | [ 46 ] |
| 2 | 0.2 | 31.7 | 32.6 | 11 В | Нечеловеческий примат | [ 47 ] |
| 3 | 0.05 | 24 | 3.47 | 123 я | Крыса | [ 48 ] |
| 4 | 0.08 | 28 | 13 | 18 Фон | Нечеловеческий примат | [ 49 ] |
| 5 | 0.11 | 450 | 22 | 11 В | Крыса , обезьяна | [ 50 ] |



Комплексы переходных металлов
[ редактировать ]Эти соединения включают переходные металлы в их гетероатомической конформации, в отличие от нерадолябельных хелатов , где их элемент выбирается для внутреннего воздействия на связывание и функцию, они помечены «хвостом» (или аналогичным известные свойства связывания и вместо этого предназначены для добавления радиоактивности достаточно, чтобы их можно было легко отслеживать с помощью методов наблюдения, которые используют радиоактивность. Что касается аномалий связывания в спектре непосредственно упомянутых типов: другие факторы, не рассматриваемые иначе, учитывая его относительно более низкую активность, «соединение 89C » указывается, чтобы выступать вперед на арилевом месте на его форме к лиганду мата Акцепторный сайт в том, что он вреден для его эффективности. Это рассматривается из-за стерической основной массы восьмипозиционной хелата, заменяющей составляющую, переопределяя средства, с помощью которых он должен был быть выделен из факторов связывания на хвосте, и, в конечном итоге, тем не менее, мешающим его способности связывать. Однако для того, чтобы затронуть это несоответствие, уменьшение привязки азота в положении восьми с помощью единицы метилена ( 89d ) было показано, что он привнес потенцию аналогового аналога аналога аналога аналога 89c, имеющего IC 50 из 1,09 ± 0,02 @ Dat & 2,47 ± 0,14 нм @ sert; Сделать 89 ° С более чем тридцать три раза слабее на этих участках поглощения мата. [ k ]
| Структура | Сложный # (С. Сингх) |
X = to - / 4'- Замена |
Конфигурация | Что (IC 50 нм ) смещение [h 3 ] Выиграть 35428 |
5-HT (IC 50 нм ) [ЧАС 3 ] Циталопрам |
Селективность 5-HTT/DAT |
|---|---|---|---|---|---|---|
 |
Выиграть 35428 | Фон | - | 11.0 ± 1.0 | 160 ± 20 | 14.5 |
| +2β-хелатированные фенилтропаны | ||||||
 |
73 Тродат-1 ɑ |
Калькуляция | - | R = 13,9, s = 8,42 беременный | - | - |
 |
74 Тротек-1 |
Фон | - | Сайт высокой аффинности = 0,15 ± 0,04 в Место с аффинностью = 20,3 ± 16,1 в |
- | - |
| N -уплотненные фенилтропаны | ||||||
 |
89а | Фон | 2B | 5.99 ± 0.81 | 124 ± 17 | 20.7 |
 |
89b | Фон | 2A | 2960 ± 157 | 5020 ± 1880 | 1.7 |
 |
89с | 3,4-CL 2 | 2B | 37.2 ± 3.4 | 264 ± 16 | 7.1 |
 |
89d | Калькуляция | - | 0.31 ± 0.03 дюймовый | - | - |
- ɑ IUPAC: [2-[[2-[[[3- (4-хлорфенил) -7-метил-8-азабицикло [3,2,1] Oct-2-ил] метил]-(2-меркаптоэтил) амино]] этил] амино] этантиолато- (3-)-n2, n2 ′, s2, s2 '] oxo- [1'''r' '-(' 'exo' ',' 'exo' ')]-[99mtc] Technetium
- беременный R - & s - Изомерные значения являются K I (NM) для смещения [ 125 I] IPT с Technetium-99M заменен Rhenium
- в IC 50 (нм) значения для смещения [ 3 H] выиграть 35428 с лигандом Tricarbonyltechnium заменен на Rhenium. (IC 50 для Win 35428 составляли 2,62 ± 1,06 @ Связывание с высокой аффинностью и 139 ± 72 @ сайты связывания с низким сродством)
- дюймовый K Я ценность для смещения [ 125 I] IPT Radioligand.
Выберите аннотации выше
[ редактировать ]Фенилтропаны могут быть сгруппированы с помощью «n замещения» «стереохимии» «2-Substitution» и природы 3-фенильной группы заместителя X.
Часто это оказывает существенное влияние на селективность, потенцию и продолжительность, а также токсичность, поскольку фенилтропаны очень универсальны. Для получения дополнительных примеров интересных фенилтропанов см. Некоторые из более поздних патентов, например, патент на США 6 329 520 , патент США 7 011,813 , патент на США 6 531,483 и патент на США 7 291,737 .
Потенция in vitro не следует путать с фактической дозировкой, поскольку фармакокинетические факторы могут оказать существенное влияние на то, какую долю введенной дозы на самом деле попадают на сайты связывания цели в мозге, и поэтому препарат, который очень мощный при связывании с Цель, тем не менее, имеет только умеренную потенцию in vivo . Например, RTI-336 требует более высокой дозировки, чем кокаин. Соответственно, активная доза RTI-386 чрезвычайно плохая, несмотря на относительно высокую аффинность связывания DAT ex vivo .
Сестринские вещества
[ редактировать ]Многие молекулярные лекарственные структуры имеют чрезвычайно сходную фармаркологию с фенилтропанами, однако из -за определенных технических особенностей не соответствуют прозвищу фенилтропана. именно классы аналогов дофаминергического кокаина, которые находятся в классе пиперидина (категория, которая включает в себя ) или класса бензтропина (например, дифторопин : который очень близок к соблюдению критерия фенилтропана. метилфенидат Это, а от того, чтобы находиться в семействе фенилтропановых структурных структур, таких как беноциклидин или суноксерин .
Большинство любого варианта с местным локаном тропана-3-β (или α), соединяющего связь, отличающуюся от, например, дольше, чем единая единица метилена (то есть «фенил»), включая алкилфенилы (см. Аналог стирола, первое изображение, приведенное в примере ниже) более правильно это «аналог кокаина», а не фенилтропан. Особенно, если эта связь передает функциональность блокировщика натриевых каналов молекуле.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]Цитаты
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж k л м не а п Q. ведущий с Т в v В х и С аа Аб и объявление Но из в Сингх, Сатендра (2000). «Chem Inform Abstract: химия, дизайн и взаимосвязь структурной активности антагонистов кокаина» (PDF) . Химиноформа . 31 (20): нет. doi : 10.1002/chin.200020238 . Зеркало Hotlink.
- ^ ПУБЛИКАЦИЯ ПРИБОРЫ США по патентам # США 2008/0153870 A1 MJ Kuhar, et al. 26 июня 2008 года. Институт исследования Треугольника.
- ^ Jump up to: а беременный в дюймовый и фон глин час я Дж Патент США 6 479 509
- ^ Jump up to: а беременный в Тамагнан, Жиль (2005). «Синтез и моноаминовый транспортный аффинность нового 2β-карбометокси-3β- [4- (замещенный тиофенил)] фенилтропанов: обнаружение селективного антагониста SERT с пикомолярной активностью». Биоорганическая и лекарственная химия . 15 (4): 1131–1133. doi : 10.1016/j.bmcl.2004.12.014 . PMID 15686927 .
- ^ Schmitt, KC; Ротман, РБ; Рейт, я (июль 2013). «Неклассическая фармакология транспортера дофамина: атипичные ингибиторы, аллостерические модуляторы и частичные субстраты» . J Pharmacol Exp Ther . 346 (1): 2–10 Рис. 1. DOI : 10.1124/jpet.111.191056 . PMC 3684841 . PMID 23568856 .
- ^ Патент США 6 479 509 метод содействия прекращению курения.
- ^ Блау, будь; Кеверлайн, Ки; Nie, Z.; Navarro, H.; Кухар, MJ; Кэрролл, Ф.И. (2002). «Синтез и транспортер-связывающие свойства 3β-4 ′-(фенилалкил, -фенилалкенил и -фенилалкинл) фенилтропано-2β-карбоновые метиловые эфиры: доказательство дистанционного фенил-связывающего домена на транспропертере допамина». Журнал лекарственной химии . 45 (18): 4029–4037. doi : 10.1021/jm020098n . PMID 12190324 .
- ^ Jump up to: а беременный Blough, Bruce E.; Кеверлайн, Кэтрин I.; Ни, Чжэ; Наварро, Эрнан; Кухар, Майкл Дж.; Кэрролл, Ф. Айви (2002). «Синтез и транспортер-связывающие свойства 3β- [4 '-(фенилалкил, -фенилалкенил и -фенилалкинл) фенил] метил-эфиры тропано-2β-карбоновой кислоты: свидетельство дистанционного фенил-связывающего домена на транспропертере допамина». Журнал лекарственной химии . 45 (18): 4029–37. doi : 10.1021/jm020098n . PMID 12190324 .
- ^ Блау; и др. (Сентябрь 1996). «Синтез и транспортер связывающие свойства 3β- (4'-алкил-, 4'-алкенил- и 4'-алкинилфенил) β-карбоновые метиловые эфиры нортропана-2: серотониновые транспортерные аналоги». J Med Chem . 39 (20): 4027–35. doi : 10.1021/jm960409s . PMID 8831768 . S2CID 21616809 .
- ^ Jump up to: а беременный Мельцер, ПК; Лян, да; Браунелл, Ал; Эльмале, доктор; Мадрас, Б.К. (1993). «Замененные 3-фенилтропановые аналоги кокаина: синтез, ингибирование связывания в местах распознавания кокаина и позитронно-эмиссионная томография». Журнал лекарственной химии . 36 (7): 855–62. doi : 10.1021/jm00059a010 . PMID 8464040 .
- ^ Jump up to: а беременный Мельцер, ПК; Макфи, М.; Мадрас, Б.К. (2003). «Синтез и биологическая активность 2-карбометокси-3-катехол-8-азабицикло [3.2.1] октанов». Биоорганические и лекарственные химические письма . 13 (22): 4133–4137. doi : 10.1016/j.bmcl.2003.07.014 . PMID 14592523 .
- ^ RH Kline, Davies, E. Saikali, T. Sexton & Sr Childers (1993). «Новые 2-замещенные аналоги кокаина: свойства связывания на участках транспорта дофамина в стриатуме крыс». Европейский журнал фармакологии . 244 (1): 93–97. doi : 10.1016/0922-4106 (93) 90063-F . PMID 8420793 .
{{cite journal}}: Cs1 maint: несколько имен: список авторов ( ссылка ) - ^ Джин, C; Наварро, ха; Кэрролл, Ф.И. (2008). «Развитие 3-фенилтропновых аналогов с высоким сродством к транспортерам дофамина и серотонина и низким сродством к транспортеру норэпинефрина» . Журнал лекарственной химии . 51 (24): 8048–8056. doi : 10.1021/jm801162z . PMC 2841478 . PMID 19053748 . Таблица 1.
- ^ Джин, C; Наварро, ха; Кэрролл, Ф.И. (2008). «Развитие 3-фенилтропновых аналогов с высоким сродством к транспортерам дофамина и серотонина и низким сродством к транспортеру норэпинефрина» . Журнал лекарственной химии . 51 (24): 8048–8056. doi : 10.1021/jm801162z . PMC 2841478 . PMID 19053748 . Таблица 2.
- ^ Жонг, Десонг; Kotian, Pravin; Вирик, Кристофер Д.; Сельцман, Герберт Х.; Кеплер, Джон А.; Кухар, Майкл Дж.; Boja, John W.; Кэрролл, Ф. Айви (1999). "Синтез 3β- (4- [ 125 I] йодофенил) тропан-2-β-пирролидин карбоксамид ([[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[[ 125 I] rti-229) ". Журнал помеченных соединений и радиофармацевтических препаратов . 42 (3): 281–286. DOI : 10.1002/(SICI) 1099-1344 (199903) 42: 3 <281 :: AID-JLCR188> 3.0. Co; 2-х .
- ^ Кэрролл, FI; Серый; Авраам; Куземко; Левин; Боя; Кухар (1993). «3-арил-2- (3'-замещенное-1 ', 2', 4'-оксадиазол-5'-ил) аналоги тропана кокаина: аффинность в сайте связывания кокаина в транспортере дофаина, серотонином и норепинефрин Полем Журнал лекарственной химии . 36 (20): 2886–2890. doi : 10.1021/jm00072a007 . PMID 8411004 .
- ^ Jump up to: а беременный Методы контроля вредителей беспозвоночных с использованием лигандов связывания рецептора кокаина. Патент США 5 935 953
- ^ Кэрролл, Ф.; Говард, Дж.; Howell, L.; Fox, B.; Кухар М. (2006). «Развитие дофаминового транспортера селективного RTI-336 в качестве фармакотерапии для злоупотребления кокаином» . Журнал AAPS . 8 (1): E196 - E203. doi : 10.1208/aapsj080124 . PMC 2751440 . PMID 16584128 .
- ^ Кэрролл, Ф.; Говард, Дж.; Howell, L.; Fox, B.; Кухар М. (2006). «Развитие дофаминового транспортера селективного RTI-336 в качестве фармакотерапии для злоупотребления кокаином» . Журнал AAPS . 8 (1): E196 - E203. doi : 10.1208/aapsj080124 . PMC 2751440 . PMID 16584128 .
- ^ Дэвис, Хью М.Л.; Рен, Пингда; Конг, Норман; Секстон, Тэмми; Чилдерс, Стивен Р. (2001). «Аффинность синтеза и моноамина 3β- (4- (2-пирролил) фенил) -8-азабицикло [3.2.1] октаны и 3β- (5-индолил) -8-азабицикло [3.2.1] октаны». Биоорганические и лекарственные химические письма . 11 (4): 487–489. doi : 10.1016/s0960-894x (00) 00701-0 . ISSN 0960-894X . PMID 11229754 .
- ^ Дэвис, HM; Гиллиатт, V; Кун, Ла; Saikali, E; Рен, P; Хаммонд, PS; Секстон, т; Childers, SR (2001). «Синтез 2β-ацил-3β- (замещенного нафтила) -8-азабицикло [3.2.1] октаны и их сродство связывания в местах транспорта дофамина и серотонина». Журнал лекарственной химии . 44 (10): 1509–1515. doi : 10.1021/jm000363+ . PMID 11334561 .
- ^ Кэрролл, FI; Гао; Авраам; Левин; Лью; Патель; Боя; Кухар (1992). «Зонды для рецептора кокаина. Потенциально необратимые лиганды для транспортера дофамина». Журнал лекарственной химии . 35 (10): 1813–1817. doi : 10.1021/jm00088a017 . PMID 1588560 .
- ^ Wu; Рейт, М.; Уокер, Q.; Kuhn, C.; Кэрролл, Ф.; Гаррис П. (2002). «Одновременный авторецептор опосредованный контроль высвобождения и поглощения дофамина во время нейротрансмиссии: вольтамперометрическое исследование in vivo» . Журнал нейробиологии . 22 (14): 6272–6281. doi : 10.1523/jneurosci.22-14-06272.2002 . PMC 6757948 . PMID 12122086 .
- ^ Мурти, V; Мартин, TJ; Ким, с; Дэвис, HM; Childers, SR (август 2008 г.). «Характеристика in vivo нового фенилизотиоцианатного аналога тропана при моноаминовых транспортерах в мозге крысы». J. Pharmacol. Эксплуат Существующий 326 (2): 587–95. doi : 10.1124/jpet.108.1388442 . PMID 18492949 . S2CID 5996473 .
- ^ Сюй, Л.; Kulkarni, SS; Izenwasser, S.; Кац, JL; Kopajtic, T.; Ломензо, SA; Ньюман, ах; Труделл, М.Л. (2004). «Синтез и моноаминовое транспортер связывание 2- (дневные производные деривативов-3β-арилтропана» . Журнал лекарственной химии . 47 (7): 1676–82. doi : 10.1021/jm030430a . PMID 15027858 .
- ^ Хонг, WC; Kopajtic, Ta; Сюй, Л.; Ломензо, SA; Джин, Б.; Мадура, JD; Surratt, CK; Труделл, ML; Кац, JL (2016). «Аналоги с 2-сарилтропановым кокаином 3-саблетропанового кокаина дают атипичные эффекты без индуцированных внутренних конформаций транспортера дофамина» . Журнал фармакологии и экспериментальной терапии . 356 (3): 624–634. doi : 10.1124/jpet.115.230722 . ISSN 1521-0103 . PMC 4767397 . PMID 26769919 . Статья nih.gov (включая структурные изображения)
- ^ Cesati, RR 3 -й; Тамагнан, G; Болдуин, RM; Zoghbi, SS; Иннис, RB; Кула, NS; Baldessarini, RJ; Katzenellenbogen, JA (2002). «Синтез циклопентадиенилтрикарбонил -фенилтропанов с помощью двойного переноса лиганда: органометаллические лиганды для транспортера дофамина». BioConjug Chem . 13 (1): 29–39. doi : 10.1021/bc010011x . PMID 11792176 .
{{cite journal}}: CS1 Maint: числовые имена: список авторов ( ссылка ) - ^ Блум, Джейкоб WG; Уилер, Стивен Э. (2011). «Вывод ароматичности из ароматических взаимодействий». Ангев. Химический 123 (34): 7993–7995. Bibcode : 2011angch.123.7993b . doi : 10.1002/ange.201102982 .
- ^ Новый спироциклический тропанил-Δ 2 -Исоксазолин усиливает связывание циталопрама и пароксетина с транспортерами серотонина, а также поглощением серотонина. Bioorg Med Chem 2012, 10 ноября; 20 (21): 6344-55. EPUB 2012 10 сентября.
- ^ Ханна, Мона М. (2007). «Синтез некоторых производных тропана ожидаемой активности при обратном захвате норэпинефрина и/или серотонина». Биоорганический . 15 (24): 7765–7772. doi : 10.1016/j.bmc.2007.08.055 . PMID 17870537 .
- ^ Гудман, Марк М. (2003). «Синтез и характеристика йода-123, помеченного 2β-карбометокси-3β- (4 ′-( z ) -2-odoethenyl) фенил) нортропаном. Лиганд для визуализации in vivo транспортеров серотонина с помощью однофотонной томографии» томографии »с томографией с одним фотонной эмиссией». Журнал лекарственной химии . 46 (6): 925–935. doi : 10.1021/jm0100180 . PMID 12620070 .
- ^ Blough, B.; Авраам, П.; Левин, А.; Kuhar, M.; Boja, J.; Кэрролл, Ф. (1996). «Синтез и транспортер связывающие свойства 3β- (4'-алкил-, 4'-алкенил- и 4'-алкинилфенил) нортропано-2β-карбоновые метиловые эфиры: селективные аналоги серотонина». Журнал лекарственной химии . 39 (20): 4027–4035. doi : 10.1021/jm960409s . PMID 8831768 . S2CID 21616809 .
- ^ Spealman, Rd; Келлехер, RT (март 1981). «Самоуправление производных кокаина с помощью белок-обезьян». Журнал фармакологии и экспериментальной терапии . 216 (3): 532–536. ISSN 0022-3565 . PMID 7205634 .
- ^ Кэрролл, Ф.; Tyagi, S.; Blough, B.; Kuhar, M.; Наварро, Х. (2005). «Синтез и моноаминовые транспортерные свойства связывания 3α- (замещенный фенил) нортропано-2β-карбоновая кислота метиловых эфиров. Селективные соединения транспортера норэпинефрина» . Журнал лекарственной химии . 48 (11): 3852–3857. doi : 10.1021/jm058164j . PMID 15916437 .
- ^ Пурушотам, м; Шери, а; Pham-Huu, DP; Мадрас, БК; Яновский, а; Мельцер, ПК (2011). «Синтез и биологическая оценка 2- (3-метил или 3-фенилизоксазол-5-ил) -3-арил-8-тиабицикло3.2.1octanes» . Биоорганические и лекарственные химические письма . 21 (1): 48–51. doi : 10.1016/j.bmcl.2010.11.076 . PMC 3015105 . PMID 21146984 .
- ^ Jump up to: а беременный Ву, Сяоай; Cai, Huawei; Ge, побежал; Ли, Лин; Цзя, Чжиюн (2015). «Недавний прогресс агентов визуализации для болезни Паркинсона» . Текущая нейрофармакология . 12 (6): 551–563. doi : 10.2174/1570159x136666141204221238 . ISSN 1570-159X . PMC 4428027 . PMID 25977680 .
- ^ Патент США 6150 376
- ^ WO 0007994 , Kozikowski, Alan P. & Smith, Miles P., «Соединения Bi- и Tri-Cyclic Aza и их использование», опубликовано 2000-02-17, назначенные в Джорджтаунский университет
- ^ Сакамури, Сукумар; и др. (2000). «Синтез новых спироциклических аналогов кокаина с использованием муфты Suzuki». Тетраэдр буквы . 41 (13): 2055–2058. doi : 10.1016/s0040-4039 (00) 00113-1 .
- ^ exo-2-фенил-7-азабицикло [2.2.1] Гептан-1-карбоновая кислота: новый аналог пролина. Источник: буквы тетраэдра, том 36, номер 39, 25 сентября 1995 г., с. 7123-7126 (4)
- ^ Kozikowski, AP; Аральди, Гл; Boja, J.; Meil, Wm; Джонсон, KM; Flippen-Anderson, JL; Джордж, C.; Saiah, E. (1998). «Химия и фармакология аналогов кокаина на основе пиперидина. Идентификация мощных ингибиторов DAT, лишенных скелета Tropane». Журнал лекарственной химии . 41 (11): 1962–9. Citeseerx 10.1.1.512.7158 . doi : 10.1021/jm980028+ . PMID 9599245 .
- ^ NIH US Национальная библиотека медицины. PubChem CID: 44337825, Inchi Key: Mhdrabcqawnsik-bzrylmusa-n
- ^ Дальнейшие SAR Исследования аналогов кокаина на основе пиперидина. 2. Мощные ингибиторы обратного захвата дофамина и серотонина J. Med. Химический 2000,43,1215-1222
- ^ Нейпир, Сьюзен; Бингхэм, Матильда (2009). Транспортеры как цели для лекарств . Темы по лекарственной химии. Тол. 4. Bibcode : 2009ttd..book ..... n . doi : 10.1007/978-3-540-87912-1 . ISBN 978-3-540-87911-4 .
- ^ Stehouwer, Jeffrey S. (2006). "Синтез, радиосинтез и биологическая оценка углерода-11, меченного 2β-карбометокси-3β- (3 '-(z) -2-халоэтенил) фенил) нортропаны: кандидаты радиолиганды для визуализации серотонина с понизиционной томографией томографии эмиссии попотрона с томографией по позитрон-эмиссии с томографией по позитрон-эмиссии с томографией по позитрон-эмиссион " . Журнал лекарственной химии . 49 (23): 6760–6767. doi : 10.1021/jm060641q . PMID 17154506 .
- ^ Дайс, Джеффри А. (2007). «Конформационно ограниченные гомотриптамины 3. Индольные тетрагидропиридины и циклогексениламины в качестве селективных ингибиторов обратного захвата серотонина». Биоорганическая и лекарственная химия . 17 (11): 3099–3104. doi : 10.1016/j.bmcl.2007.03.040 . PMID 17391962 .
- ^ Шмитц, Уильям Д. (2005). «Гомотриптамина как мощные и селективные ингибиторы обратного захвата серотонина (СИОЗС)». Биоорганическая и лекарственная химия . 15 (6): 1619–1621. doi : 10.1016/j.bmcl.2005.01.059 . PMID 15745809 .
- ^ Плиссон, Кристоф (2007). «Синтез и in vivo оценка фторина-18 и йода-123, помеченных 2β-карбо-карбо (2-фторэтокси) -3β- (4 ′-(z) -2-odoethenyl) фенил) нортропаном в качестве кандидата серотонина транспортер. Полем Журнал лекарственной химии . 50 (19): 4553–4560. doi : 10.1021/jm061303s . PMID 17705359 .
- ^ McMahon, CG; McMahon, CN; Leow, LJ (2006). «Новые агенты в лечении преждевременной эякуляции» . Нейропсихиатрическое заболевание и лечение . 2 (4): 489–503. doi : 10.2147/nedt.2006.2.4.489 . PMC 2671940 . PMID 19412497 .
- ^ Leung, K (2004). " N -4-Fluorobut-2-yn-1-ил-2β-карбо- [ 11 C] метокси-3β-фенилтропан ». PMID 22073420 .
{{cite journal}}: CITE Journal требует|journal=( помощь ) - ^ Стензингер, W; Blömker, A; Hiddemann, W; Де Лу, Дж. (1990). «Лечение рефрактерной множественной миеломы с режимом винкристина-адриамицина-дексаметазона (VAD)». Блут 61 (2–3): 55–9. doi : 10.1007/bf02076700 . PMID 2207342 . S2CID 25860357 .
- ^ MA, S; Ченг, MH; Гатри, да; Ньюман, ах; Бахар, я; Соркин, А (2017). «Цель-таргетинг дофамина переносчика на филоподию требует внешней конформации транспортера» . SCI Rep . 7 (1): 5399. Bibcode : 2017natsr ... 7,5399 м . doi : 10.1038/s41598-017-05637-x . PMC 5511133 . PMID 28710426 .
IM-PACT Индексы (точные местоположения в цитируемых источниках) и ноги
[ редактировать ]- ^ [ 1 ] ← Страница № 929 (5 -я страница статьи) § II
- ^ Многие из RTI фенилтропанов являются « RTI-4229- × × × », где × является специфическим номером фенилтропанового кода.
—
Например, RTI-55 является вступлением в действие RTI-4229-55 , но приведенным ниже как просто RTI-55 ради простоты в стенографии (следуя, как это сделано в самой литературе), так как предмет в контексте полностью находится в рамках действия категория кодированной фенилтропана в настоящем документе. Иногда (более редко) он дается как rti-coc-× × × ” для« производного кока- аин ».
—
Стоит упомянуть в обозначениях, чтобы объяснить, что другие соединения, совершенно не связанные, можно найти с той же « Rti- x × x ». Следовательно, следует ожидать, что в разных контекстах соединение или химическое вещество с тем же названием очень, возможно, может быть связано с совершенно другим веществом другого химического ряда, не аналогичного для тех, кто в этой теме. - ^ [ 1 ] ← Страница № 970 (46 -я страница статьи) §B, 10 -я строка
- ^ [ 1 ] ← Страница № 971 (47 -я страница статьи) 1 -й ¶, 10 -я строка
- ^ Бета ( то есть 2,3 r ectus)- c arbmethoxy -p henyl -t ropane
- ^ Бета ( есть 2,3 r ) c arbmethoxy- f ectus то -
- ^ [ 1 ] ← Страница № 940 (16 -я страница статьи) Под таблицей 8., выше § 4
- ^ [ 1 ] ← Страница № 941 (17 -я страница статьи) Рисунок 10
- ^ [ 1 ] ← Страница № 967 (43 -я страница статьи) 2 -й столбец
- ^ [ 1 ] ← Страница № 967 (43 -я страница статьи) 2 -й столбец
- ^ [ 1 ] ← Страница № 955 (31 -я страница статьи) 1 -й (слева) столбец, 2 -й ¶