Гидантоин
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Имидазолидин-2,4-дион | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| КЭБ | |||
| ХЭМБЛ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.006.650 | ||
| КЕГГ | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| C3H4N2OC3H4N2O2 | |||
| Молярная масса | 100.077 g·mol −1 | ||
| Температура плавления | 220 ° С (428 ° F; 493 К) | ||
| 39,7 г/л (100 °С) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Гидантоин , или гликолимочевина , представляет собой гетероциклическое органическое соединение с формулой CH 2 C(O)NHC(O)NH. Это бесцветное твердое вещество, образующееся в результате реакции гликолевой кислоты и мочевины . Это окисленное производное имидазолидина . В более общем смысле гидантоины могут относиться к группам или классу соединений с той же кольцевой структурой, что и исходное соединение. Например, фенитоин (упомянутый ниже) имеет две фенильные группы, замещенные на атоме углерода под номером 5 в молекуле гидантоина. [1]
Синтез
[ редактировать ]Гидантоин был впервые выделен в 1861 году Адольфом фон Байером в ходе исследования мочевой кислоты . Он получил его путем гидрирования аллантоина , отсюда и название.
Фридрих Урек синтезировал 5-метилгидантоин в 1873 году из аланина сульфата и цианата калия в ходе процесса, известного теперь как синтез гидантоина в Урехе . [2] Этот метод очень похож на современный метод с использованием алкила и арилцианатов. 5,5-диметиловое соединение также можно получить из ацетонциангидрина (также открытого Уреком: см. реакцию циангидрина ) и карбоната аммония . [3] Этот тип реакции называется реакцией Бюхерера-Бергса . [4] [5]
Гидантоин также можно синтезировать либо путем нагревания аллантоина с иодистоводородной кислотой , либо путем «нагревания бромацетилмочевины с спиртовым аммиаком». [6] Циклическая структура гидантоинов была подтверждена Дороти Хан в 1913 году. [7]
Практическое значение имеют гидантоины, полученные конденсацией циангидрина с карбонатом аммония . Другой полезный путь, следующий за работой Урека, включает конденсацию аминокислот с цианатами и изоцианатами:
Использование и возникновение
[ редактировать ]Фармацевтика
[ редактировать ]Гидантоиновую группу можно найти в нескольких важных с медицинской точки зрения соединениях. [1] В фармацевтике производные гидантоина образуют класс противосудорожных средств ; [8] Фенитоин и фосфенитоин содержат гидантоиновые фрагменты и оба используются в качестве противосудорожных средств при лечении судорожных расстройств. Производное гидантоина дантролен используется в качестве миорелаксанта для лечения злокачественной гипертермии , злокачественного нейролептического синдрома , спастичности и интоксикации экстази . Ропитоин является примером антиаритмического гидантоина.
Пестициды
[ редактировать ]Производное гидантоина Имипротрин представляет собой пиретроидный инсектицид . Ипродион – популярный фунгицид, содержащий группу гидантоина. [9]
Синтез аминокислот
[ редактировать ]Гидролиз гидантоинов дает аминокислоты:
Сам гидантоин реагирует с горячей разбавленной соляной кислотой с образованием глицина . Метионин производится в промышленности из гидантоина, полученного из метионаля . [9]
Метилирование
[ редактировать ]Метилирование гидантоина дает множество производных. Диметилгидантоин (ДМГ) [10] может относиться к любому диметиловому производному гидантоина, но особенно к 5,5-диметилгидантоину . [11]
ион галогена
[ редактировать ]Некоторые N -галогенированные производные гидантоина используются в качестве хлорирующих или бромирующих агентов в дезинфицирующих /дезинфицирующих средствах или биоцидных продуктах. Тремя основными N -галогенированными производными являются дихлордиметилгидантоин (DCDMH), бромхлордиметилгидантоин (BCDMH) и дибромдиметилгидантоин (DBDMH). Смешанный этилметиловый аналог, 1,3-дихлор-5-этил-5-метилимидазолидин-2,4-дион ( бромхлорэтилметилгидантоин ), также используется в смесях с указанными выше.

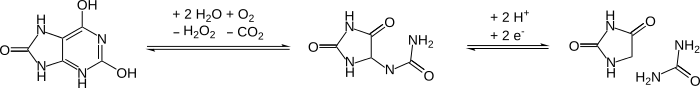
Окисление ДНК до гидантоинов после гибели клеток
[ редактировать ]Высокая доля цитозиновых и тиминовых оснований в ДНК со временем после смерти организма окисляется до гидантоинов. Такие модификации блокируют ДНК-полимеразы и, таким образом, препятствуют ПЦР работе . Подобные повреждения являются проблемой при работе с древними образцами ДНК. [12]
Внешние ссылки и дальнейшее чтение
[ редактировать ]- Уэр, Элинор (1950). «Химия гидантоинов». хим. Откр. 46 (3): 403–470. дои : 10.1021/cr60145a001 . ПМИД 24537833 .
- [1] Английский перевод обзорной статьи Генриха Бильца и Карла Слотты о получении гидантоинов на немецкий язык 1926 года.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Коннерт, Лора; Ламати, Фредерик; Мартинес, Жан; Колачино, Эвелина (2017). «Последние достижения в синтезе гидантоинов: современное состояние ценного каркаса» (PDF) . Химические обзоры . 117 (23): 13757–13809. doi : 10.1021/acs.chemrev.7b00067 . ПМИД 28644621 . S2CID 23653941 .
- ^ Урех, Фридрих (1873). «О лактураминовой кислоте и лактилмочевине» . Анна Либиха. (на немецком языке). 165 (1): 99–103. дои : 10.1002/jlac.18731650110 .
- ^ Вагнер, ЕС; Байзер, Мануэль (1940). «5,5-Диметилгидантоин» . Органические синтезы . 20 : 42. дои : 10.15227/orgsyn.020.0042 ; Сборник томов , т. 3, с. 323 .
- ^ Бухерер, HT ; Штайнер, В. (1934). « J. Prakt. Chem. » (на немецком языке). 140 : 291.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Бергс, нем. погладить. 566 094 ( 1929 ) [CA, 27, 1001 ( 1933 )].
- ^ Чисхолм, Хью , изд. (1911). . Британская энциклопедия . Том. 14 (11-е изд.). Издательство Кембриджского университета. стр. 29–30.
- ^ Оукс, Элизабет Х. (2007). Энциклопедия ученых мира . Факты в файле . п. 298. ИСБН 9780816061587 .
- ^ «Гидантоиновые противосудорожные средства» . наркотики.com .
- ^ Перейти обратно: а б Драуз, Карлхайнц; Грейсон, Ян; Климанн, Аксель; Криммер, Ганс Петер; Лейхтенбергер, Вольфганг; Векбекер, Кристоф (2007). «Аминокислоты». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a02_057.pub2 . ISBN 978-3527306732 .
- ^ «5,5-Диметилгидантоин (ДМГ) — высокоэффективный галогенный стабилизатор для проточной части, PaperCo» .
- ^ «5,5-Диметилгидантоин» .
- ^ Хофрейтер, Михаэль; Серр, Дэвид; Пойнар, Хендрик Н.; Куч, Мелани; Паабо, Сванте (2001). «Древняя ДНК». Обзоры природы Генетика . 2 (5): 353–359. дои : 10.1038/35072071 . ПМИД 11331901 . S2CID 205016024 .