Протеаза

Протеаза ферментом (также называемая пептидазой , протеиназой или протеолитическим ) [ 1 ] является ферментом , который катализирует протеолиз , разбивая белки на более мелкие полипептиды или отдельные аминокислоты и стимулируя образование новых белковых продуктов. [ 2 ] Они делают это путем расщепления пептидных связей внутри белков путем гидролиза , реакции, когда вода разбивает связи . Протеазы участвуют в многочисленных биологических путях, включая расщепление проглоченных белков, белковой катаболизм (расщепление старых белков), [ 3 ] [ 4 ] и клеточная передача сигналов .
В отсутствие функциональных ускоренных акселератов протеолиз был бы очень медленным, что занимает сотни лет . [ 5 ] Протеазы можно найти во всех формах жизни и вирусов . Они независимо развивались несколько раз , и разные классы протеазы могут выполнять одну и ту же реакцию с помощью совершенно разных каталитических механизмов .
Классификация
[ редактировать ]На основе каталитического остатка
[ редактировать ]Протеазы могут быть классифицированы на семь широких групп: [ 6 ]
- Сериновые протеазы - с помощью серинового спирта
- Цистеиновые протеазы - с использованием цистеинового тиола
- Треонинные протеазы - с использованием треонина вторичного алкоголя
- Аспартические протеазы - с использованием аспартатной карбоновой кислоты
- Глутамические протеазы - с использованием глутаматной карбоновой кислоты
- Металлопротеазы - используя металл , обычно цинк [ 3 ] [ 4 ]
- Лиязы аспарагинового пептида - с использованием аспарагина для выполнения реакции элиминации (не требуя воды)
Протеазы были впервые сгруппированы в 84 семейства в соответствии с их эволюционными отношениями в 1993 году и классифицированы по четырем каталитическим типам: серина , цистеина , аспарата и металло . протеазам [ 7 ] Треониновые протеазы не были описаны до 1995 и 2004 и глутамические годов соответственно. Механизм, используемый для расщепления пептидной связи , включает в себя аминокислотный остаток с цистеином и треонином (протеазами) или нуклеофильной молекулой воды (аспартическая, глутамическая и металлопротеазы), чтобы он мог атаковать пептидную карбонильную группу. Одним из способов создания нуклеофила является каталитическая триада , где остаток гистидина используется для активации серина , цистеина или треонина в качестве нуклеофила. Однако это не эволюционная группировка, поскольку типы нуклеофилов конверсировались в разных суперсемейках , а некоторые суперсемейства демонстрируют дивергентную эволюцию с разными различными нуклеофилами. Металлопротеазы, аспартические и глутамические протеазы используют свои остатки активного сайта для активации молекулы воды, которая затем атакует носкую связь. [ 8 ]
Пептидные лиязы
[ редактировать ]Седьмой каталитический тип протеолитических ферментов, аспарагинового пептида , был описан в 2011 году. Его протеолитический механизм является необычным, поскольку, а не гидролиз , он выполняет реакцию элиминации . [ 9 ] Во время этой реакции каталитический аспарагин образует циклическую химическую структуру, которая расщепляется в остатках аспарагина в белках в правильных условиях. Учитывая его принципиально различный механизм, его включение в качестве пептидазы может быть спорной. [ 9 ]
На основе эволюционной филогения
[ редактировать ]Современная классификация эволюционных суперсемейств протеазы находится в базе данных Merops. [ 10 ] В этой базе данных протеазы классифицируются в первую очередь по «клану» ( суперсемейство ) на основе структуры, механизма и порядка каталитического остатка (например, клан PA , где P указывает на смесь семейств нуклеофилов). Внутри каждого «клана» протеазы классифицируются на семьи на основе сходства последовательностей (например, семейства S1 и C3 в клане PA). Каждая семья может содержать много сотен связанных протеаз (например , трипсин , эластаза , тромбин и стрептогризин в семье S1).
В настоящее время известно более 50 кланов, каждый из которых указывает на независимое эволюционное происхождение протеолиза. [ 10 ]
На основе оптимального pH
[ редактировать ]В качестве альтернативы, протеазы могут быть классифицированы по оптимальному рН , в котором они активны:
- Кислотные протеазы
- Нейтральные протеазы, связанные с гиперчувствительностью 1 типа . Здесь он высвобождается тучными клетками и вызывает активацию комплемента и кининов . [ 11 ] Эта группа включает в себя кальпэйнс .
- Основные протеазы (или щелочные протеазы )
Ферментативная функция и механизм
[ редактировать ]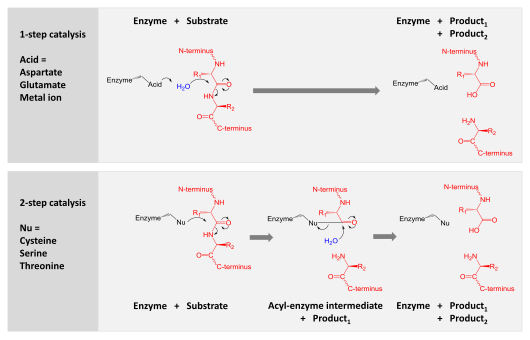
Протеазы участвуют в переваривании длинных белковых цепей на более короткие фрагменты путем разделения пептидных связей , которые связывают аминокислотные остатки. Некоторые отделяют терминальные аминокислоты от белковой цепи ( экзопептидазы , такие как аминопептидазы , карбоксипептидаза А ); Другие атакуют внутренние пептидные связи белка ( эндопептидазы , такие как трипсин , химотрипсин , пепсин , папаин , эластаза ).
Катализ
[ редактировать ]Катализ достигается одним из двух механизмов:
- Аспартические, глутамические и металло-протоизы активируют молекулу воды, которая выполняет нуклеофильную атаку на пептидную связь, чтобы гидролизовать ее.
- Протеазы серина, треонина и цистеина используют нуклеофильный остаток (обычно в каталитической триаде ). Этот остаток выполняет нуклеофильную атаку, чтобы ковалентно связать протеазу с белком субстрата, высвобождая первую половину продукта. Этот ковалентный ацил-анзим промежуточный соединение затем гидролизуется активированной водой для завершения катализа путем освобождения второй половины продукта и восстанавливая свободный фермент
Специфичность
[ редактировать ]Протеолиз может быть очень беспорядочным , так что широкий спектр белковых субстратов гидролизован. Это относится к пищеварительным ферментам, таким как трипсин , которые должны быть способны расщеплять массив белков, употребляемых в более мелкие пептидные фрагменты. Компатичные протеазы обычно связываются с одной аминокислотой на субстрате, и поэтому имеют специфичность только для этого остатка. Например, трипсин специфичен для последовательностей ... k \ ... или ... r \ ... ('\' = сайт расщепления). [ 12 ]
И наоборот, некоторые протеазы очень специфичны и только расщепляют субстраты с определенной последовательности. Кровяная свертывание (такого как тромбин ) и вирусная обработка полипротеинов (такая как протеаза TEV ) требует этого уровня специфичности для достижения точных событий расщепления. Это достигается с помощью протеаз, имеющих длинную связующую расщелину или туннель с несколькими карманами, которые связываются с указанными остатками. Например, протеаза TEV является специфической для последовательности ... enlyfq \ s ... ('\' = сайт расщепления). [ 13 ]
Деградация и автолиз
[ редактировать ]Протеазы, будучи самими белками, расщепляются другими молекулами протеазы, иногда одного и того же разнообразия. Это действует как метод регулирования активности протеазы. Некоторые протеазы менее активны после аутолиза (например, протеаза TEV ), в то время как другие более активны (EG Trypsinogen ).
Биоразнообразие протеаз
[ редактировать ]Протеазы встречаются во всех организмах, от прокариот до эукариот до вирусов . Эти ферменты участвуют во множестве физиологических реакций от простого расщепления пищевых белков до высокорегулируемых каскадов (например, сгибание крови Каскад , система комплемента , пути апоптоза и каскад, активирующий профенолоксидазу, активирующий профенолоксидазу). Протеазы могут либо нарушать специфические пептидные связи ( ограниченный протеолиз ), в зависимости от аминокислотной последовательности белка, либо полностью разбить пептид до аминокислот ( неограниченный протеолиз ). Активность может быть деструктивным изменением (отмены функции белка или перевариваемой его до его основных компонентов), она может быть активацией функции, или может быть сигналом в сигнальном пути.
Растения
[ редактировать ]Геномы растений кодируют сотни протеаз, в основном из неизвестной функции. Те, у кого известная функция в значительной степени участвуют в регуляции развития . [ 14 ] Растительные протеазы также играют роль в регуляции фотосинтеза . [ 15 ]
Животные
[ редактировать ]Протеазы используются по всему организму для различных метаболических процессов. Кислотные протеазы, секретируемые в желудок (например, пепсин ) и сериновые протеазы, присутствующие в двенадцатиперстной кишке ( трипсин и химотрипсин ), позволяют нам переваривать белок в пище. Протеазы, присутствующие в крови сыворотки ( тромбин , плазмин , фактор Hageman и т. Д.), Играют важную роль в свертывании крови, а также лизис сгустков и правильное действие иммунной системы. Другие протеазы присутствуют в лейкоцитах ( эластаза , катепсин G ) и играют несколько разных ролей в метаболическом контроле. Некоторые змеиные яды также являются протеазами, такими как ямы гемотоксин и мешают кровь, свернувшей кровь. Протеазы определяют время жизни других белков, играющих важные физиологические роли, такие как гормоны, антитела или другие ферменты. Это один из самых быстрых «переключения» и «отключения» регуляторных механизмов в физиологии организма.
Благодаря сложному кооперативному действию, протеазы могут катализировать каскадные реакции, что приводит к быстрому и эффективному усилению реакции организма на физиологический сигнал.
Бактерии
[ редактировать ]Бактерии секретируют протеазы для гидролизации пептидных связей в белках и, следовательно, разбивают белки на их составляющие аминокислоты . Бактериальные и грибковые протеазы особенно важны для глобальных циклов углерода и азота при утилизации белков, и такая активность имеет тенденцию регулироваться питательными сигналами в этих организмах. [ 16 ] Чистое влияние питательной регуляции активности протеазы среди тысяч видов, присутствующих в почве, может наблюдаться на общем уровне микробного сообщества, поскольку белки разбиваются в ответ на ограничение углерода, азота или серы. [ 17 ]
AAA+ Бактерии содержат протеазы, ответственные за общий контроль качества белка (например, протеасома ) путем разворачивания или неправильно свернутых белков .
Секретированная бактериальная протеаза также может действовать как экзотоксин и быть примером фактора вирулентности в бактериальном патогенезе (например, отшелоновный токсин ). Бактериальные экзотоксические протеазы разрушают внеклеточные структуры.
Вирусы
[ редактировать ]Геномы некоторых вирусов кодируют один массивный полипротеин , который нуждается в протеазе, чтобы расщеплять это в функциональные единицы (например, вирус гепатита С и пикорнавирусы ). [ 18 ] Эти протеазы (например, протеаза TEV ) обладают высокой специфичностью и расщепляют только очень ограниченный набор последовательностей субстрата. Поэтому они являются общей мишенью для ингибиторов протеазы . [ 19 ] [ 20 ]
Археи
[ редактировать ]Archaea использует протеазы для регуляции различных клеточных процессов от клеточного подписи , метаболизма , секреции и контроля качества белка. [ 21 ] [ 22 ] Только две АТФ-зависимые протеазы обнаружены в археи: мембрана, связанная с протеазой Lonb и растворимый протеосома 20S . [ 21 ]
Использование
[ редактировать ]Область исследований протеазы огромна. С 2004 года примерно 8000 статей, связанных с этой областью, были опубликованы каждый год. [ 23 ] Протеазы используются в промышленности, медицине и в качестве основного инструмента биологического исследования. [ 24 ] [ 25 ]
Пищеварительные протеазы являются частью многих моющих средств для стирки , а также широко используются в хлебной промышленности в области эксплуатации хлеба . Разнообразные протеазы используются с медицинской точки зрения как для их нативной функции (например, контроль крови) или для полностью искусственных функций ( например , для целевой деградации патогенных белков). Высокие специфические протеазы, такие как протеаза TEV и тромбин, обычно используются для расщепления слитых белков и аффинных метров контролируемым образом. Протеазасодержащие растительные решения под названием «Вегетарианский Реннет» использовался в течение сотен лет в Европе и на Ближнем Востоке для изготовления кошерных и халяльных сыров . Вегетарианский Реннет из Withania Coagulans используется на протяжении тысячелетий в качестве аюрведического лекарства от пищеварения и диабета на индийском субконтиненте. Он также используется для создания панира .
Ингибиторы
[ редактировать ]Активность протеаз ингибируется ингибиторами протеазы . [ 26 ] Одним из примеров ингибиторов протеазы является суперсемейство Serpin . Он включает в себя альфа 1-антитрипсин (который защищает организм от чрезмерных эффектов собственных воспалительных протеаз), альфа 1-антихимотрипсин (который делает также), C1-ингибитор (который защищает организм от чрезмерной активации своей собственной системы комплемента ), антитробин (который защищает организм от чрезмерной коагуляции ), ингибитор активатора плазминогена-1 (который защищает организм от неадекватной коагуляции путем блокирования фибринолиза , вызванного протеазой ), и нейросерпина . [ 27 ]
Природные ингибиторы протеазы включают семейство липокалиновых белков, которые играют роль в регуляции и дифференцировке клеток. липофильные Было обнаружено, что лиганды, прикрепленные к белкам липокалина, обладают ингибирующими свойствами опухолевой протеазы. Природные ингибиторы протеазы не следует путать с ингибиторами протеазы, используемыми при антиретровирусной терапии. Некоторые вирусы с ВИЧ/СПИДом среди них зависят от протеаз в их репродуктивном цикле. Таким образом, ингибиторы протеазы развиваются в качестве противовирусных терапевтических агентов.
Другие природные ингибиторы протеазы используются в качестве защитных механизмов. Обычными примерами являются ингибиторы трипсина, обнаруженные в семенах некоторых растений, наиболее известными для людей, являются соевыми бобами, основной продовольственной культурой, где они действуют, чтобы препятствовать хищникам. Сырые соевые бобы токсичны для многих животных, включая людей, до тех пор, пока не будут денатурированы ингибиторы протеазы.
Смотрите также
[ редактировать ]- Лигаза
- Протеаза
- PA клан
- Конвергентная эволюция
- Протеолиз
- Каталитическая триада
- Карта протеолиза
- Протеазы в ангиогенезе
- Внутренние протеазы
- Ингибитор протеазы (фармакология)
- Ингибитор протеазы (биология)
- Topfind - база данных специфичности протеазы, субстратов, продуктов и ингибиторов
- Merops - база данных эволюционных групп протеазы
Ссылки
[ редактировать ]- ^ «Протеолитический фермент | Описание, типы и функции | Британская» .
- ^ López-Otín C, Bond JS (ноябрь 2008 г.). «Протеазы: многофункциональные ферменты в жизни и болезнях» . Журнал биологической химии . 283 (45): 30433–30437. doi : 10.1074/jbc.r800035200 . PMC 2576539 . PMID 18650443 .
- ^ Jump up to: а беременный King JV, Liang WG, Scherpelz KP, Schilling AB, Meredith SC, Tang WJ (июль 2014 г.). «Молекулярная основа распознавания субстрата и деградации человеческой протеазой» . Структура 22 (7): 996–1007. doi : 10.1016/j.str.2014.05.003 . PMC 4128088 . PMID 24931469 .
- ^ Jump up to: а беременный Shen Y, Joachimiak A, Rosner MR, Tang WJ (октябрь 2006 г.). «Структуры человеческого инсулина, разрушающего фермент, выявляют новый механизм распознавания субстрата» . Природа . 443 (7113): 870–874. Bibcode : 2006natur.443..870s . doi : 10.1038/nature05143 . PMC 3366509 . PMID 17051221 .
- ^ Радзицка А., Вольфенден Р. (июль 1996 г.). «Скорости некатализированного гидролиза пептидной связи в нейтральном растворе и сродства переходного состояния протеаз». Журнал Американского химического общества . 118 (26): 6105–6109. doi : 10.1021/ja954077c .
Чтобы оценить относительную профессиональность ферментов, которые катализируют гидролиз внутренних и С-концевых пептидных связей [...]
- ^ ODA K (январь 2012 г.). «Новые семейства карбоксильных пептидаз: серин-карбоксильные пептидазы и глутамические пептидазы» . Журнал биохимии . 151 (1): 13–25. doi : 10.1093/jb/mvr129 . PMID 22016395 .
- ^ Rawlings ND, Barrett AJ (февраль 1993 г.). «Эволюционные семейства пептидаз» . Биохимический журнал . 290 (Pt 1): 205–218. doi : 10.1042/bj2900205 . PMC 1132403 . PMID 8439290 .
- ^ Санман, Лора Э. (июнь 2014 г.). «Профилирование протеаз на основе деятельности» . Ежегодный обзор биохимии . 83 : 249–273. doi : 10.1146/annurev-biochem-060713-035352 . PMID 24905783 .
- ^ Jump up to: а беременный Ролингс Н.Д., Барретт А.Дж., Бейтман А (ноябрь 2011 г.). «Лиазы аспарагинового пептида: седьмой каталитический тип протеолитических ферментов» . Журнал биологической химии . 286 (44): 38321–38328. doi : 10.1074/jbc.m111.260026 . PMC 3207474 . PMID 21832066 .
- ^ Jump up to: а беременный Rawlings ND, Barrett AJ, Bateman A (январь 2010 г.). «Меропс: база данных пептидазы» . Исследование нуклеиновых кислот . 38 (проблема базы данных): D227 - D233. doi : 10.1093/nar/gkp971 . PMC 2808883 . PMID 19892822 .
- ^ Митчелл Р.С., Кукер В., Абби А.К., Н Фаусто Н. (2007). Патология . Филадельфия: Сандс. п. 122. ISBN 978-1-4160-2973-1 .
- ^ Родригес Дж., Гупта Н., Смит Р.Д., Певзнер П.А. (январь 2008 г.). «Трипсин вырезал перед пролином?». Журнал исследований протеома . 7 (1): 300–305. doi : 10.1021/pr0705035 . PMID 18067249 .
- ^ Renicke C, Spadaccini R, Taxis C (2013-06-24). «Протеаза вируса табака с повышенной толерантностью субстрата в положении P1 '» . Plos один . 8 (6): E67915. BIBCODE : 2013PLOSO ... 867915R . doi : 10.1371/journal.pone.0067915 . PMC 3691164 . PMID 23826349 .
- ^ Ван дер Хурн Р.А. (2008). «Протеазы растений: от фенотипов до молекулярных механизмов». Ежегодный обзор биологии растений . 59 : 191–223. doi : 10.1146/annurev.arplant.59.032607.092835 . HDL : 11858/00-001M-0000-0012-37C7-9 . PMID 18257708 .
- ^ Zelisko A, Jackowski G (октябрь 2004 г.). «Зависимая от старения деградация LHCB3 опосредована тилакоидной мембраной протеазой». Журнал физиологии растений . 161 (10): 1157–1170. doi : 10.1016/j.jplph.2004.01.006 . PMID 15535125 .
- ^ Симс Г.К. (2006). «Голод азота способствует биодеградации N-гетероциклических соединений в почве» . Почвенная биология и биохимия . 38 (8): 2478–2480. doi : 10.1016/j.soilbio.2006.01.006 . Архивировано из оригинала 2021-04-28 . Получено 2018-12-29 .
- ^ Sims GK, Wander MM (2002). «Протеолитическая активность при ограничении азота или серы». Приложение Почвенная экол . 568 (3): 1–5. Bibcode : 2002 Appse..19..217s . doi : 10.1016/s0929-1393 (01) 00192-5 .
- ^ Тонг Л (декабрь 2002 г.). «Вирусные протеазы». Химические обзоры . 102 (12): 4609–4626. doi : 10.1021/cr010184f . PMID 12475203 .
- ^ Скореньский М., Синьчик М. (2013). «Вирусные протеазы как цели для дизайна лекарств». Текущий фармацевтический дизайн . 19 (6): 1126–1153. doi : 10.2174/13816128130613 . PMID 23016690 .
- ^ Курт Йилмаз Н., Суонстром Р., Шиффер Калифорния (июль 2016 г.). «Улучшение ингибиторов вирусной протеазы для противодействия лекарственной устойчивости» . Тенденции в микробиологии . 24 (7): 547–557. doi : 10.1016/j.tim.2016.03.010 . PMC 4912444 . PMID 27090931 .
- ^ Jump up to: а беременный Giménez Mi, Cerletti M, De Castro Re (2015). «Архаальные мембраны, связанные с протеазами: понимание вулкани Haloferax и других Haloarchaea» . Границы в микробиологии . 6 : 39. doi : 10.3389/fmicb.2015.00039 . PMC 4343526 . PMID 25774151 .
- ^ Maupin-Furlow JA (декабрь 2018 г.). Робинсон Н.П. (ред.). «Протеолитические системы археи: нарезка, нарезка и манинг в крайности» . Новые темы в науках о жизни . 2 (4): 561–580. doi : 10.1042/etls20180025 . PMC 7497159 . PMID 32953999 .
- ^ Barrett AJ, Rawlings ND, Woessnerd JF (2004). Справочник по протеолитическим ферментам (2 -е изд.). Лондон, Великобритания: Elsevier Academic Press. ISBN 978-0-12-079610-6 .
- ^ Hooper NM, ed. (2002). Протеазы в биологии и медицине . Лондон: Portland Press. ISBN 978-1-85578-147-4 .
- ^ Feijoo-Siota L, Villa TG (28 сентября 2010 г.). «Нативные и биотехнологически спроектированные протеазы завода с промышленными применениями». Технология питания и биопроцесса . 4 (6): 1066–1088. doi : 10.1007/s11947-010-0431-4 . S2CID 84748291 .
- ^ Сауттан С (июль 2001 г.). «Геномная перспектива на протеазы человека как на лекарства». Drug Discovery сегодня . 6 (13): 681–688. doi : 10.1016/s1359-6446 (01) 01793-7 . PMID 11427378 .
- ^ Puente XS, López-Otín C (апрель 2004 г.). «Геномный анализ протеаз крыс и ингибиторов протеазы» . Исследование генома . 14 (4): 609–622. doi : 10.1101/gr.1946304 . PMC 383305 . PMID 15060002 .
Внешние ссылки
[ редактировать ]- Международное протеолизное общество
- Merops-база данных пептидазы архивировал 2006-11-14 на машине Wayback
- Список ингибиторов протеазы
- Протеаза резка предиктор
- Список протеаз и их специфики (см . Также архив 2011-04-30 на машине Wayback )
- Карта протеолиза из Центра протеолитических путей
- База данных сайтов протеолиза - кураторская экспертная аннотация от пользователей
- Сайты вырезания протеазы графический интерфейс
- База данных протеазы TopFind, покрывающие участки вырезания, субстраты и белковые термины
- Протеазы в Национальной медицинской библиотеке Медицинской библиотеки США (Mesh)