Магний карбонат

| |
| |

| |
| Имена | |
|---|---|
| Другие имена | |
| Идентификаторы | |
| |
3D model ( JSmol )
|
|
| Чеби | |
| Химический | |
| Chemspider | |
| Echa Infocard | 100.008.106 |
| E номер | E504 (i) (регуляторы кислотности, ...) |
PubChem CID
|
|
| Rtecs номер |
|
| НЕКОТОРЫЙ |
|
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| Mgco 3 | |
| Молярная масса | 84,3139 г/моль (безводный) |
| Появление | Бесцветные кристаллы или белый твердый Гигроскопический |
| Запах | Без запаха |
| Плотность | 2,958 г/см 3 (Безводная) 2,825 г/см 3 (Дигидрат) 1,837 г/см 3 (тригидрат) 1,73 г/см 3 (Пентахират) |
| Точка плавления | 350 ° C (662 ° F; 623 K) разлагается (безводный) 165 ° C (329 ° F; 438 K) (тригидрат) |
| Безводный: 0,0139 г/100 мл (25 ° C) 0,0063 г/100 мл (100 ° C) [ 1 ] | |
Продукт растворимости ( K SP )
|
10 −7.8 [ 2 ] |
| Растворимость | Растворимый в кислотном, водном CO 2 Нерастворимый в ацетоне , аммиак |
| −32.4·10 −6 см 3 /мол | |
Показатель преломления ( N D )
|
1.717 (безводный) 1.458 (дигидрат) 1.412 (тбигидрат) |
| Структура | |
| Тригональный | |
| R 3 C, № 167 [ 3 ] | |
| Термохимия | |
Теплоемкость ( C )
|
75,6 J/моль · K [ 1 ] |
Std Molar
энтропия ( с ⦵ 298 ) |
65,7 J/моль · k [ 1 ] [ 4 ] |
Энтальпия STD
образование (Δ f h ⦵ 298 ) |
-1113 кДж / раз [ 4 ] |
Свободная энергия Гиббса (Δ f g ⦵ )
|
-1029,3 кДж / раз [ 1 ] |
| Фармакология | |
| A02AA01 ( WHO ) A06AD01 ( Кто ) | |
| Опасности | |
| NFPA 704 (Огненная бриллиант) | |
| точка возгорания | Неплохо |
| Niosh (пределы воздействия на здоровье США): | |
Пел (допустимый)
|
|
| Лист данных безопасности (SDS) | ICSC 0969 |
| Связанные соединения | |
Другие анионы
|
Магний бикарбонат |
Другие катионы
|
Бериллий карбонат Карбонат кальция Карбонат стронция Барий карбонат Радиум карбонат |
Связанные соединения
|
Артинит Гидромагнезит Дипингингит |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
Вы можете помочь расширить эту статью с помощью текста, переведенного из соответствующей статьи на немецком языке . (Декабрь 2018 г.) Нажмите [Показать] для важных инструкций по переводу. |
Магний карбонат , Mg Co 3 (архаичное название Magnesia alba ) - это неорганическая соль, которая является бесцветным или белым твердым. Несколько гидратированных и основных форм карбоната магния также существуют в качестве минералов .
Формы
[ редактировать ]Наиболее распространенными форматами магния являются безводная соль, называемая магнезитом ( MGCO 3 ) и DI, TRI и PentAhydrates, известные как Barringtonite ( Mgco 3 · 2h 2 O ), Nesquehonite ( MGCO 3 · 3H 2 O ) и Lansfordite ( MGCO 3 · 5H 2 O ) соответственно. [ 6 ] Некоторые основные формы, такие как Artinite ( Mg 2 CO 3 (OH) 2 · 3H 2 O ), Гидромагнезит ( Mg 5 (co 3 ) 4 (OH) 2 · 4H 2 O ), и дипингит ( Mg 5 (co 3 ) 4 (OH) 2 · 5H 2 O ) также встречается в виде минералов . Все эти минералы бесцветные или белые.
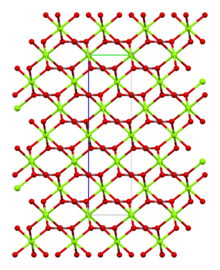
Магнезит состоит из бесцветных или белых тригональных кристаллов . Безводная соль практически нерастворим в воде , ацетоне и аммиаке . Все формы карбоната магния реагируют с кислотами . Магнезит кристаллизуется в структуре кальцита , в которой Мг 2+ окружен шестью . кислорода атомами [ 3 ]
| Карбонатная координация | Координация магния | Единица ячейка |
|---|---|---|

|
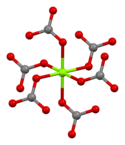
|

|
Дигидрат имеет триклиническую структуру, в то время как тригидрат имеет моноклинную структуру.
гидроксисата магния Ссылки на «Свет» и «тяжелые» карбонаты магния фактически относятся к гидромагнезу и дипингиту , соответственно. [ 7 ] «Световая» форма осаждается из растворов магния с использованием щелочного карбоната при «нормальных температурах», в то время как «тяжелый» может быть получен из концентрированных растворов с закислением с последующими осадками до сухости, промыванием осадков и сушке при 100 с. [ 8 ]
Подготовка
[ редактировать ]Карбонат магния обычно получают путем добычи минерального магнезита . Семьдесят процентов мирового предложения добывается и подготовлен в Китае. [ 9 ]
Карбонат магния может быть приготовлен в лаборатории путем реакции между любой растворимой магнийской солью и бикарбонатом натрия :
- MGCL 2 (aq) + 2 nahco 3 (aq) → mgco 3 (s) + 2 naCl (aq) + h 2 o (l) + co 2 (g)
Если хлорид магния (или сульфат) обрабатывается водным карбонатом натрия, осадок базового карбоната магния - гидратированный комплекс карбоната магния и гидроксида магния - а не сам карбонат магния: самих карбонат магния: образуется:
- 5 Mgcl 2 (aq) + 5 Na 2 Co 3 (aq) + 5 H 2 O (L) → Mg 4 (Co 3 ) 3 (OH) 2 · 3H 2 O (S) + Mg (HCO 3 ) 2 ( aq) + 10 naCl (aq)
Промышленные маршруты высокой чистоты включают путь через бикарбонат магния , который можно сформировать путем объединения суспензии гидроксида магния и диоксида углерода при высоком давлении и умеренной температуре. [ 6 ] Бикарбонат затем высушивают в вакууме, в результате чего он теряет углекислый газ и молекулу воды:
- Mg (OH) 2 + 2 CO 2 → Mg (HCO 3 ) 2
- Mg (HCO 3 ) 2 → MGCO 3 + CO 2 + H 2 O
Химические свойства
[ редактировать ]С кислотами
[ редактировать ]Как и многие общие металлические карбонаты группы 2, карбонат магния реагирует с водными кислотами для высвобождения углекислого газа и воды :
- MGCO 3 + 2 HCl → MgCl 2 + CO 2 + H 2 O
- Mgco 3 + h 2 so 4 → mgso 4 + co 2 + h 2 o
Разложение
[ редактировать ]При высоких температурах MGCO 3 разлагается на оксид магния и диоксид углерода . Этот процесс важен в производстве оксида магния. [ 6 ] Этот процесс называется кальцинированием :
- MGCO 3 → MGO + CO 2 (ΔH = +118 кДж/моль)
Температура разложения дается как 350 ° C (662 ° F). [ 10 ] [ 11 ] Тем не менее, прокал для оксида обычно не считается полным ниже 900 ° C из -за мешающей чтения врученного углекислого газа.
Гидраты солей теряют воду при разных температурах во время разложения. [ 12 ] Например, в тригидрате MGCO 3 · 3H 2 O , которая молекулярная формула может быть написана как Mg (HCO 3 ) (OH) · 2H 2 O , стадии дегидратации происходят при 157 ° C и 179 ° C следующим образом: [ 12 ]
- Mg (HCO 3 ) (OH) · 2 (H 2 O) → Mg (HCO 3 ) (OH) · (H 2 O) + H 2 O при 157 ° C
- Mg (HCO 3 ) (OH) · (H 2 O) → Mg (HCO 3 ) (OH) + H 2 O при 179 ° C
Использование
[ редактировать ]Основным использованием карбоната магния является производство оксида магния путем калькуляции . Магнезит и доломитовые минералы используются для производства рефрактерных кирпичей . [ 6 ] MGCO 3 также используется в полах , огнеупортере , огнетую композиции , косметике , пыльном порошке и зубной пасте . Другие применения являются как наполнитель , подавляющий дым в пластмассах, усиливающий агент в неопреновой резине, сушильный агент и задержка цвета в пищевых продуктах.
Из -за низкой растворимости в воде и гигроскопических свойствах, MGCO 3 был впервые добавлен в столовую соль ( NaCl ) в 1911 году, чтобы заставить его течь более свободно. Компания Morton Salt приняла лозунг «Когда он входит», подчеркивая, что его соль, которая содержала MGCO 3 , не будет держаться в влажной погоде. [ 13 ]

Карбонат порошкообразного магния, известный как лазание мела или тренажерный мелок, также используется в качестве сухожичного агента на руках спортсменов в скалолазании , гимнастике , пауэрлифтинг, тяжелой атлетике и других видах спорта, в которых необходима твердое сцепление. [ 9 ] Вариант - жидкий мел .
Как пищевая добавка , карбонат магния известен как E504. Его единственный известный побочный эффект заключается в том, что он может работать как слабительное в высоких концентрациях. [ 14 ]
Карбонат магния используется в таксидермии для отбеливающих черепов. Его можно смешать с перекисью водорода , чтобы создать пасту, которая распространяется на черепе, чтобы придать ему белую отделку.
Карбонат магния используется в качестве матового белого покрытия для проекционных экранов . [ 15 ]
Медицинское использование
[ редактировать ]Это слабительное , чтобы ослабить кишечник .
Кроме того, карбонат магния высокой чистоты используется в качестве антацида и в качестве добавки в столовой соли , чтобы держать его свободным. Карбонат магния может делать это, потому что он не растворяется в воде, только в кислоте, где он будет разжигать (пузырь). [ 16 ]
Безопасность
[ редактировать ]Карбонат магния нетоксичен и не используется.
Статус сборника
[ редактировать ]Смотрите также
[ редактировать ]- Ацетат кальция/карбонат магния
- Упсалит , зарегистрированная аморфная форма карбоната магния
Примечания и ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый «Магний карбонат» .
- ^ Bénézeth, Pascale; Saldi, Jiuseppe D.; Дандуранд, Жан-Луи; Шотт, Жак (2011). «Экспериментальное определение продукта растворимости магнезита при 50-200 ° C». Химическая геология . 286 (1–2): 21–31. Bibcode : 2011Chgeo.286 ... 21b . doi : 10.1016/j.chemgeo.2011.04.016 .
- ^ Jump up to: а беременный Росс, Нэнси Л. (1997). «Уравнение состояния и поведения магнезита высокого давления». Являюсь. Минерал. 82 (7–8): 682–688. Bibcode : 1997ammin..82..682r . doi : 10.2138/AM-1997-7-805 . S2CID 43668770 .
- ^ Jump up to: а беременный Zumdahl, Steven S. (2009). Химические принципы 6 -е изд . Houghton Mifflin Company. п. A22. ISBN 978-0-618-94690-7 .
- ^ Niosh Pocket Guide к химическим опасностям. "#0373" . Национальный институт безопасности и гигиены труда (NIOSH).
- ^ Jump up to: а беременный в дюймовый Маргарет Сигер; Уолтер Отто; Вильгельм Флик; Фридрих Бикельхаупт; Отто С. Аккерман. «Магниевые соединения». Энциклопедия промышленной химии Уллмана . Вейнхайм: Wiley-VCH. Doi : 10.1002/14356007.a15_595.pub2 . ISBN 978-3527306732 .
- ^ Бота, А.; Strydom, CA (2001). «Приготовление карбоната с гидрокси магния из гидроксида магния». Гидрометаллургия . 62 (3): 175. BIBCODE : 2001HYDME..62..175B . doi : 10.1016/s0304-386x (01) 00197-9 .
- ^ JR Partington (1951). Общая и неорганическая химия, 2 -е изд .
- ^ Jump up to: а беременный Allf, Брэдли (21 мая 2018 г.). «Скрытая экологическая стоимость лазания на мела» . Скалолочный журнал . Cruz Bay Publishing . Получено 22 мая 2018 года .
Фактически, Китай производит 70 процентов мирового магнезита. Большая часть этого производства - как добыча, так и обработка - сосредоточена в небольшом уголке Liaoning, холмистой промышленной промышленности на северо -востоке Китая между Пекином и Северной Кореей.
- ^ "Ястат MSDS" .
- ^ Weast, Robert C.; и др. (1978). Справочник по химии и физике CRC (59 -е изд.). Уэст -Палм -Бич, Флорида: CRC Press. п. B-133. ISBN 0-8493-0549-8 .
- ^ Jump up to: а беременный «Термический анализ традиционной и контролируемой скорости Nesquehonite Mg (HCO 3 ) (OH) · 2 (H 2 O)» (PDF) .
- ^ «Ее дебют - Мортон Соль» . Получено 27 декабря 2017 года .
- ^ «Food-Info.net: e-Numbers: E504: карбонаты магния» . 080419 Food-Info.net
- ^ Noronha, Shonan (2015). Сертифицированный специалист по технологиям . McGraw Hill Education. п. 256. ISBN 978-0071835657 .
- ^ "Что такое карбонат магния?" Полем Наука . Получено 15 апреля 2018 года .
- ^ Британская фармакопейская комиссия Секретариат (2009). «Индекс, BP 2009» (PDF) . Архивировано из оригинала (PDF) 11 апреля 2009 года . Получено 31 января 2010 года .
- ^ «Японская фармакопея, пятнадцатое издание» (PDF) . 2006. Архивировано из оригинала (PDF) 22 июля 2011 года . Получено 31 января 2010 года .
