Антагонист мю-опиоидных рецепторов периферического действия
периферического действия мю-опиоидных рецепторов Антагонисты ( ПАМОРА ) представляют собой класс химических соединений , которые используются для устранения побочных эффектов , вызванных опиоидов взаимодействием с рецепторами вне центральной нервной системы (ЦНС), главным образом с теми, которые расположены в желудочно-кишечном тракте . PAMORA разработаны для специфического ингибирования определенных опиоидных рецепторов в желудочно-кишечном тракте и имеют ограниченную способность преодолевать гематоэнцефалический барьер . Таким образом, PAMORA не влияют на анальгетический эффект опиоидов в центральной нервной системе. [ 1 ]
Открытие и развитие
[ редактировать ]Известно, что опиоидные препараты вызывают запор, вызванный опиоидами (ОИК), подавляя опорожнение желудка и уменьшая перистальтические волны, что приводит к задержке всасывания лекарств и большему поглощению воды из кала . это может привести к твердому и сухому стулу и запорам . У некоторых пациентов [ 2 ]
ОИК является одним из наиболее распространенных побочных эффектов, вызываемых опиоидами, поэтому открытие PAMORA может предотвратить эффекты, которые часто ставят под угрозу управление болью . [ 3 ]
Метилналтрексона бромид был первым препаратом этого класса, одобренным FDA . [ 4 ] Его открыл в 1979 году Леон Голдберг, фармаколог из Чикагского университета . Став свидетелем страданий умирающего друга с ОИК, Голдберг протестировал различные производные налтрексона , препарата , который, как известно, блокирует действие опиоидов. Его целью было найти препарат, который не мог бы пройти через гематоэнцефалический барьер , не влияя при этом на обезболивающее действие опиоидов. После смерти Голдберга его коллеги в университете продолжили разработку этого соединения. Он был одобрен FDA в апреле 2008 года первоначально для применения ОИК у взрослых пациентов с поздними стадиями заболевания, а затем у взрослых пациентов с хронической нераковой болью. [ 5 ]
В конце 1970-х годов Деннис М. Циммерман и его коллеги из Lilly Research Laboratories , штат Индиана, провели исследование структурных концепций антагонистов наркотиков, определенных в ряду 4-фенилпиперидина. [ 6 ] Они сообщили, что N -метил- транс -3,4-диметил-4-фенилпиперидин является чистым антагонистом опиоидных рецепторов с новым фармакофором . Чтобы увеличить эффективность , они присоединили фенольную группу к ароматическому кольцу . N -метил- транс -3,4-диметил-4-(3-гидроксифенил)пиперидина Эта структура была использована для проектирования и разработки других антагонистов опиоидных рецепторов, таких как алвимопан . [ 5 ] Позднее, в 2008 году, алвимопан был одобрен для внутрибольничного применения для улучшения функции желудочно-кишечного тракта после частичной резекции толстой или тонкой кишки с первичным анастомозом . Налоксегол был одобрен в сентябре 2014 года, а налдемедин — в марте 2017 года для лечения ОИК у взрослых пациентов с хроническим раком. [ 7 ] [ 8 ] [ 9 ] [ 10 ]
Механизм действия
[ редактировать ]PAMORA действуют путем ингибирования связывания агониста опиоидов с μ-опиоидным рецептором (MOR). Целью лечения ПАМОРАМИ является восстановление функции кишечной нервной системы (ЭНС). MOR обнаруживается в нескольких местах тела, а PAMORAs является конкурентным антагонистом связывания с рецептором. MOR в желудочно-кишечном тракте являются основными рецепторами, которые PAMORA призваны блокировать и предотвращать связывание опиоидных агонистов. [ 11 ] PAMORA используются для лечения дисфункции кишечника, вызванной опиоидами (OIBD), потенциального побочного эффекта, вызванного хроническим употреблением опиоидов. PAMORA действуют на три патофизиологических механизма этого неблагоприятного эффекта. Они влияют на перистальтику кишечника , секрецию кишечника и сфинктера . функцию [ 12 ]
Влияние PAMORA на моторику кишечника заключается в том, что он может повышать тонус покоя в круговом мышечном слое. Антагонист усиливает влияние на тоническое торможение мышечного тонуса . Это нормализует тонус кругового мышечного слоя и, следовательно, предотвратит ритмические сокращения, вызванные опиоидами. Сочетание этих двух факторов приводит к сокращению времени в пути . Подразумевается, что эти эффекты уменьшат пассивное всасывание жидкости, что помогает уменьшить симптомы OIBD, такие как запор, спазм кишечника и спазмы в животе . [ 13 ]
Влияние PAMORA на секрецию кишечника поможет обратить вспять снижение образования цАМФ , которое индуцируют опиоидные агонисты. [ 14 ] Также антагонист установит нормальную секрецию хлоридов . Агонисты опиоидов также могут снижать за счет секрецию пептидов усиления активности симпатической нервной системы через мю-рецепторы ЭНС, что может привести к более сухому и твердому стулу. ПАМОРЫ противодействуют этому, поэтому стул становится мягче и менее сухим. [ 13 ]
Влияние PAMORA на функцию сфинктера теоретически заключается в регулировании координации движений. Антагонист может предотвратить дисфункцию сфинктера Одди , вызванную опиоидами. [ 15 ] Антагонисты также могут уменьшить дисфункцию анального сфинктера, вызванную опиоидами. Дисфункция связана с напряжением , геморроем и неполным опорожнением. [ 16 ]
Отношения структура-деятельность
[ редактировать ]Несмотря на то, что препараты, нацеленные на мю-опиоидные рецепторы (MOR), используются в течение длительного времени, мало что известно о взаимосвязи структура-активность и взаимодействиях лиганд -рецептор на основе четко определенных биологических эффектов на активацию или ингибирование рецептора. Кроме того, точно не известны различия в характере взаимодействия рецептор-лиганд агонистов и антагонистов. Одна теория утверждает, что биологическая активность морфинанов может определяться размером N-заместителей. Например, антагонисты обычно имеют более крупные заместители, такие как аллил- или циклопропилметил у азота морфинана, тогда как агонисты обычно содержат метильную группу . С другой стороны, агонистическая активность проявляется и у лигандов с более крупными группами у азота морфинана, и поэтому эта гипотеза подвергается сомнению. [ 17 ]
Структура
[ редактировать ]
Бромид метилналтрексона, налоксегол и налдемедин имеют сходную структуру, которая недалеко от химической структуры морфина и других агонистов MOR. Все они содержат жесткую пентациклическую структуру, включающую бензольное кольцо (А), тетрагидрофурановое кольцо (В), два циклогексановых кольца (С и D) и пиперидиновое кольцо (Е). [ 18 ] Наиболее важными функциональными группами для биологического действия опиоидов являются группа фенола гидроксильная , N-метильная группа, эфирный мостик между C4 и C5, двойная связь между атомами углерода C7 и C8 и гидроксильные группы при C3 и C6. Фенольное кольцо и его 3-гидроксильная группа жизненно важны для анальгетического эффекта, поскольку удаление ОН-группы снижает анальгетическую активность в 10 раз. Есть и другой принцип действия гидроксильной группы на C6: удаление увеличивает ее активность. Повышенная активность обусловлена главным образом повышенной липофильностью и повышенной способностью преодолевать гематоэнцефалический барьер. Налдемедин имеет гидроксильную группу, метилналтрексона бромид — кетоновую группу, а налоксегол — сложный эфир . Двойная связь между C7 и C8 не требуется для анальгетического эффекта, а уменьшение двойной связи увеличит активность. Ни один из антагонистов не имеет в своей структуре двойной связи. Считается, что N-заместитель в скелете определяет фармакологическое поведение и его взаимодействие с MOR. Также считается, что он играет ключевую роль в отличии антагонистов от агонистов. Аллильная группа, метилциклопропильная группа или метилциклобутил в качестве N-заместителей обладают антагонистической активностью. Считается, что [ 19 ] [ 20 ] [ 21 ]
Связывающий сайт
[ редактировать ]Агонисты и антагонисты образуют определенные химические связи с аминокислотами , которые строят MOR. Предполагается, что большинство антагонистов, а также агонистов образуют заряженное взаимодействие с Asp147 и водородную связь с Tyr148. Однако большинство антагонистов также образуют дополнительные полярные взаимодействия с другими аминокислотными остатками, такими как Lys233, Gln124, Gln229, Asn150, Trp318 и Tyr128. Лишь небольшое меньшинство агонистов образуют такие же дополнительные полярные взаимодействия. Известно, что как агонисты, так и антагонисты образуют водородные связи с His297. [ 22 ]
Можно заключить, что взаимодействия с аминокислотными остатками Asp147 и Tyr148 необходимы для связывания лиганда с рецептором, а молекулы, образующие дополнительные полярные взаимодействия с другими остатками, чаще являются антагонистами, чем агонистами. [ 17 ]
Группа N-заместителя может образовывать гидрофобные связи с Tyr326 и Trp293, а ароматическое и циклогексановое кольца могут образовывать связи, аналогичные Met151. Обратная сторона лиганда также может образовывать гидрофобную связь, но с Val300 и Ile296. [ 22 ]
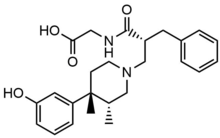
Метилналтрексона бромид
[ редактировать ]Метилналтрексона бромид представляет собой форму бромидной соли метилналтрексона, четвертичного метилового производного нороксиморфона . Метильная группа и образование четвертичной соли увеличивают полярность и снижают растворимость в липидах, тем самым ограничивая проникновение через гематоэнцефалический барьер. Метилналтрексон имеет сродство к MOR в восемь раз выше, чем к κ-опиоидным рецепторам (KOR) и δ-опиоидным рецепторам (DOR). [ 23 ] Налтрексон образует взаимодействие с Asp147 и Tyr148 наряду с водородной связью с Lys233. [ 24 ]

Алвимопан
[ редактировать ]
были разработаны периферически селективные транс-3,4-диметил-4-(3-гидроксифенил)пиперидиновые опиоидные антагонисты для лечения нарушений моторики желудочно-кишечного тракта Циммерманом и его коллегами . Исходя из этого, они получили каркас из 4-(3-гидроксифенил)-3,4-диметилпиперидина с функциональными группами, охватывающими различные размеры, заряд и полярность, для достижения антагонизма периферических опиоидных рецепторов при одновременном снижении воздействия лекарств на ЦНС. In vitro μ-Ki, in vivo AD50 и ED50 , а также периферический индекс (соотношение) были исследованы для нескольких селективных аналогов, и на основании этого они обнаружили, что транс-3,4-диметил-4-(3-гидроксифенил) пиперидин, алвимопан дали наилучшие результаты. [ 5 ] Большая цвиттер-ионная структура и высокая полярность препятствуют проникновению алвимопана через гематоэнцефалический барьер, поэтому эффективность связывания периферических MOR в 200 раз выше, чем у центральных MOR. [ 25 ]
Налоксегол
[ редактировать ]Налоксегол представляет собой модифицированное полиэтиленгликолем производное α- налоксола . Налоксегол имеет форму, аналогичную налоксону, виде гетеропентациклического соединения, оба из которых имеют аллильную группу , присоединенную к амину пиперидинового в кольца. Однако налоксегол имеет монометокси-концевой олигомер ПЭГ с n =7 , соединенный с 6-альфа-гидроксильной группой ɑ-налоксола через эфирную связь. Фрагмент ПЭГ увеличивает молекулярную массу и, следовательно, ограничивает поступление налоксегола в ЦНС . [ 26 ] Кроме того, пегилированный налоксегол становится субстратом для P-гликопротеина переносчика оттока , который транспортирует соединение из ЦНС. [ 27 ]
Налдемидин
[ редактировать ]Налдемедин имеет химическую структуру, аналогичную налтрексону, но с дополнительной боковой цепью, которая увеличивает молекулярную массу и площадь полярной поверхности вещества. Как и налоксегол, налдемедин является субстратом транспортера оттока P-гликопротеина. Эти свойства приводят к меньшему проникновению в ЦНС и уменьшают возможное воздействие эффектов опиоидных агонистов. [ 28 ] Налдемедин является двойным антагонистом MOR и DOR. Известно, что активация ДОР вызывает тошноту и/или рвоту, поэтому двойной антагонист может уменьшить как ОИК, так и тошноту/рвоту. [ 29 ]
Фармакокинетика
[ редактировать ]Молекулярная масса , биодоступность , связывание с белками , период полувыведения , время достижения максимальной концентрации в плазме и аффинность связывания представлены в таблице ниже. [ 26 ] [ 23 ]
| Химическое название | Химическая структура | Молекулярная масса (г/моль) | Биодоступность (%) | Связывание с белками плазмы (%) | т 1/2 (ч) | т макс | Ки м (нМ) | Ки к (нМ) | Ки δ (нМ) |
|---|---|---|---|---|---|---|---|---|---|
| Метилналтрексона бромид | 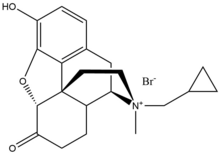 |
436,3 | Низкий | 11-15 | 8 | 30 мин. | 5.50 | 32.1 | 3453.8 |
| Алвимопан | 424,53 | 6 | 80-90 | 10-17 | 2 часа | 0.77 | 40 | 4.4 | |
| Налоксегол | 651,798 | ЧТО | 4,2 | 6-11 | 2 часа | 7.42 | 8.65 | 203.0 | |
| Налдемидин | 570,6 | 29 | 93-94 | 11 | 45 мин. | 0.34 | 0.94 | 0.43 |
- t 1/2 : Биологический период полураспада.
- t max : Время достижения максимальной концентрации в плазме.
- pK i : измерение связывания лиганда . аффинности
Метилналтрексона бромид имеет низкую биодоступность при пероральном приеме, поэтому его вводят подкожно через день . Около половины дозы выводится с мочой и несколько меньше с калом, при этом 85% выводится в неизмененном виде. [ 24 ]
Алвимопан имеет значительно низкую биодоступность (6%) из-за его высокой аффинности связывания и низкой скорости диссоциации . По существу, алвимопан опосредуется секрецией желчи со средним плазменным клиренсом 400 мл/мин. Метаболизм алвимопана осуществляется через кишечную флору , что приводит к гидролизу алвимопана до активного амидного метаболита (ADL 08-0011). Однако метаболит считается клинически незначимым из-за его низкой аффинности связывания. [ 25 ]
Когда налоксегол принимают с жирной пищей, абсорбция увеличивается. Клиренс происходит в основном за счет печеночного метаболизма (P450-CYP3A), действие метаболитов неизвестно. Налоксегол имеет небольшие фрагменты, которые выводятся почками . [ 30 ]
Налдемедин метаболизируется преимущественно через CYP3A до нор-нальдемедина, он также метаболизируется через УДФ-глюкуронозилтрансферазу 1А3 до налдемедина 3-G, но в меньшей степени. Оба этих метаболита являются антагонистами опиоидных рецепторов, но менее эффективны, чем исходное соединение . [ 35 ]
ПАМОРА в разработке
[ редактировать ]
Акселопран — это пероральный препарат ПАМОРА, который разрабатывается компанией Theravane Biopharma. Он завершил фазу II клинических испытаний у более чем 400 пациентов с ОИК. Акселопран имеет химическую структуру, отличную от других ПАМОРА, но схожий механизм действия . Он действует как антагонист MOR, KOR и DOR, но с более высоким сродством к MOR и KOR, чем к DOR. Как и в других ПАМОРАх, основной целью является лечение ОИК. [ 36 ] Акселопран также исследуется в комбинации с фиксированными дозами (FDC) с оксикодоном . Это делается с использованием технологии нанесения распылением для создания FDC акселопрана и оксикодона с контролируемым высвобождением. [ 37 ]
Существует потребность в оптимизации селективности и сродства к рецепторам, сопровождаемой исследованием соединений-кандидатов относительно пути их введения . Таковы основные цели и будущие стратегии открытия лекарств и развития PAMORA. Преимущественно MOR проявляют функционально селективный агонизм. Следовательно, будущими возможными соединениями-кандидатами, нацеленными на OIC, являются PAMORA с оптимизированной селективностью и сродством. [ 27 ]
Ссылки
[ редактировать ]- ^ Флоттманн, Эйке; Буи, Кхань; Состек, Марк; Пайза, Кемаль; Элдон, Майкл (май 2017 г.). «Фармакологический профиль налоксегола, антагониста мю-опиоидных рецепторов периферического действия, для лечения запоров, вызванных опиоидами» . Журнал фармакологии и экспериментальной терапии . 361 (2): 280–291. дои : 10.1124/jpet.116.239061 . ПМК 5399635 . ПМИД 28336575 .
- ^ Сизар, Омид; Гупта, Мохит (2019). «Запор, вызванный опиоидами» . Национальный центр биотехнологической информации . Издательство StatPearls. ПМИД 29630236 . Проверено 4 июня 2019 г.
- ^ Буи, Кхань; Чжоу, Дяньсун; Сюй, Хунмэй; Флоттманн, Эйке; Аль-Хунити, Нидал (июнь 2017 г.). «Клиническая фармакокинетика и фармакодинамика налоксегола, антагониста µ-опиоидных рецепторов периферического действия». Клиническая фармакокинетика . 56 (6): 573–582. дои : 10.1007/s40262-016-0479-z . ПМИД 28035588 . S2CID 3458268 .
- ^ «Препарат, разработанный в Чикагском университете, получил одобрение FDA» . Новости Чикагского университета . 30 апреля 2008 года . Проверено 30 апреля 2008 г.
- ^ Перейти обратно: а б с д Кэрролл, Ф. Айви; Долле, Роланд Э. (2014). «Открытие и разработка N-замещенного транс-3,4-диметил-4-(3'-гидроксифенил)пиперидина класса чистых антагонистов опиоидных рецепторов» . ХимМедХим . 9 (8): 1638–1654. дои : 10.1002/cmdc.201402142 . ISSN 1860-7187 . ПМЦ 5588862 . ПМИД 24981721 .
- ^ Циммерман, Деннис М.; Никандер, Родни; Хорнг, Чон С.; Вонг, Дэвид Т. (сентябрь 1978 г.). «Новые структурные концепции наркотических антагонистов, определенные в ряду 4-фенилпиперидина». Природа . 275 (5678). Перепечатка и разрешения: 332–334. Бибкод : 1978Natur.275..332Z . дои : 10.1038/275332a0 . ПМИД 692714 . S2CID 4149532 .
- ^ «Упаковка одобренного препарата: капсулы Энтерег (Альвинопан) 21775» . www.accessdata.fda.gov . FDA . Проверено 18 июля 2008 г.
- ^ Крокетт, Сет Д.; Грир, Катарина Б.; Гейдельбо, Джоэл Дж.; Фальк-Иттер, Ингве; Хэнсон, Брайан Дж.; Султан, Шахназ (январь 2019 г.). «Руководство Института Американской гастроэнтерологической ассоциации по медикаментозному лечению запоров, вызванных опиоидами» . Гастроэнтерология . 156 (1): 218–226. дои : 10.1053/j.gastro.2018.07.016 . ПМИД 30340754 .
- ^ «Пакет одобрения лекарственного средства: таблетки МОВАНТИК (налоксегол)» . www.accessdata.fda.gov . FDA.
- ^ «Симпроик (налдемедин) таблетки» . www.accessdata.fda.gov . FDA . Проверено 4 мая 2017 г.
- ^ Штрайхер, Джон М.; Бильски, Эдвард Дж. (25 сентября 2017 г.). «Антагонисты мю-опиоидных рецепторов периферического действия для лечения побочных эффектов, связанных с опиоидами: механизм действия и клинические последствия» . Журнал аптечной практики . 31 (6): 658–669. дои : 10.1177/0897190017732263 . ISSN 0897-1900 . ПМК 6291905 . ПМИД 28946783 .
- ^ Брок, Кристина; Олесен, Сорен Шоу; Олесен, Энн Эструп; Фрокьяер, Йенс Брондум; Андресен, Трина; Древес, Асбьёрн Мор (1 октября 2012 г.). «Дисфункция кишечника, вызванная опиоидами». Наркотики . 72 (14): 1847–1865. дои : 10.2165/11634970-000000000-00000 . ISSN 1179-1950 . ПМИД 22950533 . S2CID 173168 .
- ^ Перейти обратно: а б Томас, Джей (2008). «Опиоидная дисфункция кишечника» . Журнал управления болью и симптомами . 35 (1): 103–113. дои : 10.1016/j.jpainsymman.2007.01.017 . ISSN 0885-3924 . ПМИД 17981003 .
- ^ Гелардини, Карла; Чезаре Маннелли, Лоренцо; Бьянки, Энрика (2015). «Фармакологическая основа опиоидов» . Клинические случаи минерального и костного обмена . 12 (3): 219–221. дои : 10.11138/ccmbm/2015.12.3.219 . ISSN 1724-8914 . ПМК 4708964 . ПМИД 26811699 .
- ^ Торрес, Даниэле; Парринелло, Гаспаре; Трапанезе, Катерина; Ликата, Джузеппе (2017). «Внезапная сильная боль в животе после однократного приема низкой дозы парацетамола/кодеина у пациента, подвергшегося холецистэктомии: изучение истории болезни». Американский журнал терапии . 17 (4): e133–134. дои : 10.1097/MJT.0b013e3181baf253 . ISSN 1536-3686 . ПМИД 19829093 .
- ^ Брок, Кристина; Олесен, Сорен Шоу; Олесен, Энн Эструп; Фрокьяер, Йенс Брондум; Андресен, Трина; Древес, Асбьёрн Мор (01 октября 2012 г.). «Опиоид-индуцированная дисфункция кишечника: патофизиология и лечение». Наркотики . 72 (14): 1847–1865. дои : 10.2165/11634970-000000000-00000 . ISSN 1179-1950 . ПМИД 22950533 . S2CID 173168 .
- ^ Перейти обратно: а б Казерер, Тереза; Лантеро, Акилино; Шмидхаммер, Гельмут; Спетеа, Мариана; Шустер, Даниэла (18 февраля 2016 г.). «Мю-опиоидный рецептор: новые антагонисты и структурное моделирование» . Научные отчеты . 6 : 21548. Бибкод : 2016NatSR...621548K . дои : 10.1038/srep21548 . ISSN 2045-2322 . ПМЦ 4757823 . ПМИД 26888328 .
- ^ ДеРуитер, Джек (2000). Принципы действия лекарств (PDF) . Обернское образование.
- ^ Хадду, Танила Бен; Бени, Сабольч; Хостафи, Шандор; Мальфачини, Давиде; Кало, Джироламо; Шмидхаммер, Гельмут; Спетеа, Мариана (11 июня 2014 г.). «Фармакологические исследования вариаций N-заместителей в морфине и оксиморфоне: связывание опиоидных рецепторов, передача сигналов и антиноцицептивная активность» . ПЛОС ОДИН . 9 (6): e99231. Бибкод : 2014PLoSO...999231B . дои : 10.1371/journal.pone.0099231 . ISSN 1932-6203 . ПМК 4053365 . ПМИД 24919067 .
- ^ Труонг, Фонг М.; Хасан, Серджио А.; Ли, Ён Сок; Копайтич, Тереза А.; Кац, Джонатан Л.; Чаддердон, Аарон М.; Трейнор, Джон Р.; Дешам, Джеффри Р.; Джейкобсон, Артур Э.; Райс, Кеннер К. (15 апреля 2017 г.). «Модуляция сродства и эффективности опиоидных рецепторов посредством N-замещения 9β-гидрокси-5-(3-гидроксифенил)морфана: синтез и исследование компьютерного моделирования» . Биоорганическая и медицинская химия . 25 (8): 2406–2422. дои : 10.1016/j.bmc.2017.02.064 . ISSN 0968-0896 . ПМК 5407189 . ПМИД 28314512 .
- ^ Кавамура, Н.; Катаока, Т.; Имаи, Э.; Ивамура, Т.; Хори, М.; Нива, М.; Нодзаки, М.; Фудзимура, Х. (1 января 1981 г.). «Антагонист-агонистическая активность некоторых N-замещенных бензоморфанов» . Достижения в области эндогенных и экзогенных опиоидов . Эльзевир: 411–413. дои : 10.1016/B978-0-444-80402-0.50138-8 . ISBN 9780444804020 .
- ^ Перейти обратно: а б Манглик, Аашиш; Круз, Эндрю С.; Кобилка, Тонг Сан; Тиан, Фун Сан; Матисен, Джеспер М.; Сунахара, Роджер К.; Пардо, Леонардо; Вайс, Уильям И.; Кобилка, Брайан К.; Гранье, Себастьен (май 2012 г.). «Кристаллическая структура µ-опиоидного рецептора, связанного с антагонистом морфинана» . Природа . 485 (7398): 321–326. Бибкод : 2012Natur.485..321M . дои : 10.1038/nature10954 . ISSN 1476-4687 . ПМЦ 3523197 . ПМИД 22437502 .
- ^ Перейти обратно: а б «Метилналтрексона бромид» . pubchem.ncbi.nlm.nih.gov .
- ^ Перейти обратно: а б Р. Уильям, Хипкин; Долле, Роланд Э. (2010). «Глава 9 - Антагонисты опиоидных рецепторов при желудочно-кишечной дисфункции». Годовые отчеты по медицинской химии . 45 : 142–155. дои : 10.1016/S0065-7743(10)45009-5 . ISBN 9780123809025 .
- ^ Перейти обратно: а б Забирович, Эрик С.; Ган, Тонг Дж. (2019). 34 – Фармакология послеоперационной тошноты и рвоты . Эльзевир. стр. 671–692. дои : 10.1016/B978-0-323-48110-6.00034-X . ISBN 9780323481106 . S2CID 81387334 .
- ^ Перейти обратно: а б «Налоксегол» . pubchem.ncbi.nlm.nih.gov .
- ^ Перейти обратно: а б Штрайхер, Джон М.; Бильски, Эдвард Дж. (декабрь 2018 г.). «Антагонисты мю-опиоидных рецепторов периферического действия для лечения побочных эффектов, связанных с опиоидами: механизм действия и клинические последствия» . Журнал аптечной практики . 31 (6): 658–669. дои : 10.1177/0897190017732263 . ISSN 0897-1900 . ПМК 6291905 . ПМИД 28946783 .
- ^ Ху, Кеннет; Бриджман, Мэри Барна (октябрь 2018 г.). «Налдемедин (симпроик) для лечения запоров, вызванных опиоидами» . Фармация и терапия . 43 (10): 601–627. ISSN 1052-1372 . ПМК 6152697 . ПМИД 30271103 .
- ^ Инагаки, Масахару, Ёсинори; Гото, Ёсихиса; Хасегава, Такаси; Коикэ, Кацуми, Канемаса, Тошиюки; 2019). «Открытие налдемедина: мощное средство для перорального применения». доступный антагонист опиоидных рецепторов для лечения побочных эффектов, вызванных опиоидами» . Bioorganic & Medicinal Chemistry Letters . 29 (1): 73–77. doi : 10.1016/j.bmcl.2018.11.007 . ISSN 0960-894X . PMID 30446313 .
- ^ Перейти обратно: а б Туран, Алпарслан; Саасу, Ваэль; Овсепян, Карен; Ты, Цзин. «Дополнительные эффекты перорального приема налоксегола (Мовантик)» (PDF) . Clinicaltrials.gov .
- ^ «Алвимопан (АДЛ 8-2698) | Антагонист опиоидных рецепторов | МедХимЭкспресс» . МедхимЭкспресс.com .
- ^ «Метилналтрексона бромид» . pubchem.ncbi.nlm.nih.gov .
- ^ Канемаса, Тосиюки; Койке, Кацуми; Клауд, Токо; Оно, Хироко; Хорита, Наруми; Тиба, Хироки; Накамура, Ацуши; Мориока, Ясухидэ; Кихара, Цуёси; Хасэгава, Минору (1 мая 2019 г.). «Фармакологические эффекты налдемедина, антагониста мю-опиоидных рецепторов периферического действия, на моделях запора, вызванного опиоидами in vitro и in vivo» . Нейрогастроэнтерология и моторика . 31 (5): e13563. дои : 10.1111/nmo.13563 . ISSN 1365-2982 . ПМК 6850587 . ПМИД 30821019 .
- ^ «Опиоидный рецептор | каппа, мю Опиоидный рецептор» . www.selleckchem.com . Проверено 10 октября 2019 г.
- ^ Маркхэм, Энтони (май 2017 г.). «Налдемедин: первое глобальное одобрение». Наркотики . 77 (8): 923–927. дои : 10.1007/s40265-017-0750-0 . ПМИД 28466424 . S2CID 19271743 .
- ^ Паннеманс, Джаспер; Вануйцель, Тим; Тэк, Ян (октябрь 2018 г.). «Новые разработки в лечении желудочно-кишечных симптомов, вызванных опиоидами» . Объединенный европейский гастроэнтерологический журнал . 6 (8): 1126–1135. дои : 10.1177/2050640618796748 . ПМК 6169055 . ПМИД 30288274 .
- ^ «Тераванс Биофарма: Программы | Нарушение моторики желудочно-кишечного тракта» . САЙТ .