Аминокислота с разветвленной цепью
Эта статья нуждается в более надежных медицинских ссылках для проверки или слишком сильно полагается на первоисточники . ( ноябрь 2018 г. ) |  |
Аминокислота с разветвленной цепью ( BCAA ) — это аминокислота, имеющая алифатическую боковую цепь с разветвлением (центральный атом углерода, связанный с тремя или более атомами углерода). Среди протеиногенных аминокислот выделяют три BCAA: лейцин , изолейцин и валин . [1] Непротеиногенные BCAA включают 2-аминоизомасляную кислоту и аллоизолейцин .


Три протеиногенных BCAA входят в число девяти незаменимых аминокислот для человека, на их долю приходится 35% незаменимых аминокислот в мышечных белках и 40% предварительно сформированных аминокислот, необходимых млекопитающим. [2] Синтез BCAA происходит во всех местах растений, внутри пластид клетки, что определяется наличием мРНК , которые кодируют ферменты метаболического пути. [3] [4] [5] Окисление BCAA может усиливать окисление жирных кислот и играть роль в ожирении. Физиологически BCAA играют роль в иммунной системе и функционировании мозга. BCAA эффективно расщепляются ферментами дегидрогеназой и декарбоксилазой, экспрессируемыми иммунными клетками, и необходимы для роста и пролиферации лимфоцитов, а также цитотоксической активности Т-лимфоцитов. [4] Наконец, BCAA имеют один и тот же транспортный белок в мозг с ароматическими аминокислотами (Trp, Tyr и Phe). Попадая в мозг, BCAA могут играть роль в синтезе белка, синтезе нейротрансмиттеров и производстве энергии. [4]
Требования
[ редактировать ]Совет по продовольствию и питанию (FNB) Института медицины США установил рекомендуемые диетические нормы (RDA) для незаменимых аминокислот в 2002 году. Что касается лейцина, для взрослых 19 лет и старше — 42 мг/кг массы тела в день; для изолейцина 19 мг/кг массы тела/день; для валина 24 мг/кг массы тела/день. [6] Для человека весом 70 кг (154 фунта) это соответствует 2,9, 1,3 и 1,7 г/день. Диеты, которые соответствуют или превышают рекомендуемую суточную норму по общему белку (0,8 г/кг/день; 56 граммов для человека весом 70 кг), соответствуют или превышают рекомендуемую норму для аминокислот с разветвленной цепью.
Синтез
[ редактировать ]В параллельных путях синтеза изолейцина, валина и лейцина участвуют пять ферментов: треониндегидрогеназа, синтаза ацетогидроксикислот, редуктоизомераза кетокислот, дегидрогеназа дигидроксикислот и аминотрансфераза . [3] Треониндегидрогеназа катализирует дезаминирование и дегидратацию треонина до 2-кетобутирата и аммиака. Изолейцин образует петлю отрицательной обратной связи с треониндегидрогеназой. Синтаза ацетогидроксикислоты является первым ферментом параллельного пути, осуществляющим реакцию конденсации на обеих стадиях: конденсацию пирувата в ацетолактат по валиновому пути и конденсацию пирувата и 2-кетобутирата с образованием ацетогидроксибутирата по изолейциновому пути. Следующая кетокислотредуктоизомераза восстанавливает ацетогидроксикислоты, полученные на предыдущем этапе, с образованием дигидроксикислот как по валиновому, так и по изолейциновому пути. Дегидрогеназа дигидроксикислот преобразует дигидроксикислоты на следующем этапе. Последний этап параллельного пути осуществляется аминотрансферазой, которая дает конечные продукты валин и изолейцин. [3] Для образования лейцина из 2-оксоловалерата необходим ряд еще четырех ферментов — изопропилмалатсинтазы, изопропилмалатизомеразы, изопропилмалатдегидрогеназы и аминотрансферазы. [3]
Деградация
[ редактировать ]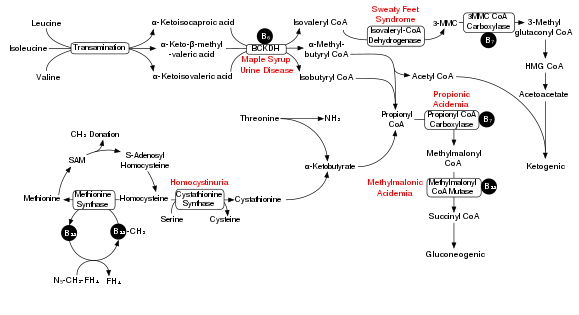
Деградация аминокислот с разветвленной цепью включает комплекс дегидрогеназы альфа-кетокислот с разветвленной цепью (BCKDH). Дефицит этого комплекса приводит к накоплению аминокислот с разветвленной цепью ( лейцина , изолейцина и валина ) и их токсичных побочных продуктов в крови и моче, что дало этому состоянию название « моча кленового сиропа» . С другой стороны, неконтролируемая активность этого комплекса вызывает дефицит киназы дегидрогеназы кетокислот с разветвленной цепью .
Комплекс BCKDH превращает аминокислоты с разветвленной цепью в производные ацил-КоА , которые после последующих реакций превращаются либо в ацетил-КоА , либо в сукцинил-КоА , которые вступают в цикл лимонной кислоты . [7]
В процесс вовлечены ферменты: аминотрансфераза с разветвленной цепью и 3-метил-2-оксобутаноатдегидрогеназа .
Болезнь мочи кленового сиропа
[ редактировать ]На крысиной модели болезни мочи кленового сиропа острое введение BCAA увеличивает повреждение ДНК в области гиппокампа головного мозга. [8] На рисунке рядом показан путь деградации BCAA и, в частности, ключевая роль недостаточного количества BCKDH в заболевании мочи кленового сиропа. Хроническое введение BCAA по сравнению с срочным приемом увеличивало повреждение ДНК не только в гиппокампе, но и в полосатом теле мозга. [8] Антиоксидантное лечение смогло предотвратить повреждение ДНК в этих областях мозга, что позволяет предположить, что BCAA вызывают повреждение ДНК посредством производства окислительного стресса .
Передача сигналов ячейки
[ редактировать ]В то время как большинство аминокислот окисляются в печени, BCAA окисляются в первую очередь в скелетных мышцах и других периферических тканях. [4] Было протестировано влияние введения BCAA на рост мышц диафрагмы крыс, и был сделан вывод, что не только смесь BCAA в отдельности оказывает такое же влияние на рост, как полная смесь аминокислот, но и смесь аминокислот со всеми аминокислотами, кроме BCAA, не оказывает такого же эффекта. влияют на рост мышц диафрагмы крыс. [9] Введение изолейцина или валина по отдельности не повлияло на рост мышц, хотя введение только лейцина, по-видимому, почти так же эффективно, как и полная смесь BCAA. Лейцин косвенно активирует киназу S6 p70 , а также стимулирует сборку комплекса eIF4F , который необходим для связывания мРНК при инициации трансляции. [9] Киназа S6 P70 является частью сигнального пути комплекса рапамицина (mTOR) у млекопитающих , и было показано, что она обеспечивает адаптивную гипертрофию и восстановление мышц крыс. [10] В состоянии покоя инфузия белка стимулирует синтез белка через 30 минут после начала инфузии, и синтез белка остается повышенным в течение еще 90 минут. [11] Инфузия лейцина в покое оказывает шестичасовой стимулирующий эффект и увеличивает синтез белка за счет фосфорилирования киназы S6 p70 в скелетных мышцах. [11] После упражнений с отягощениями без приема BCAA занятия с отягощениями не влияют на фосфорилирование mTOR и даже приводят к снижению фосфорилирования Akt. Было обнаружено некоторое фосфорилирование киназы S6 p70. Когда BCAA вводились после тренировки, достаточное фосфорилирование киназы S6 p70 и S6 указывало на активацию сигнального каскада. [11]
Роль при сахарном диабете 2 типа
[ редактировать ]Помимо передачи сигналов в клетках, путь mTOR также играет роль в росте бета-клеток, что приводит к секреции инсулина . [12] Высокий уровень глюкозы в крови запускает процесс сигнального пути mTOR, в котором лейцин играет косвенную роль. [10] [13] Комбинация глюкозы, лейцина и других активаторов заставляет mTOR подавать сигналы о пролиферации бета-клеток и секреции инсулина. Более высокие концентрации лейцина вызывают гиперактивность пути mTOR, а киназа S6 активируется, что приводит к ингибированию субстрата инсулинового рецептора посредством фосфорилирования серина. [12] [13] В клетке повышенная активность комплекса mTOR приводит к возможной неспособности бета-клеток высвобождать инсулин, а ингибирующее действие киназы S6 приводит к резистентности к инсулину в клетках, способствуя развитию диабета 2 типа . [12]
Метформин способен активировать киназу AMP, которая фосфорилирует белки, участвующие в пути mTOR, а также приводит к переходу комплекса mTOR из неактивного состояния в активное. [12] Предполагается, что метформин действует как конкурентный ингибитор аминокислоты лейцина в пути mTOR.
Влияние добавок BCAA на физические упражнения
[ редактировать ]BCAA оказывают инсулиноподобное воздействие на глюкозу , вызывая снижение уровня глюкозы. BCAA, принимаемые перед тренировкой, могут окисляться скелетными мышцами и использоваться в качестве энергии во время тренировки, уменьшая потребность печени в повышении уровня гликогенолиза . Во время анаэробных упражнений молекулы пирувата , образующиеся в результате метаболизма глюкозы, превращаются в молочную кислоту , накопление которой может привести к метаболическому ацидозу с уровнем pH всего 6,4. [14] Высокие уровни молочной кислоты вызывают остановку метаболизма глюкозы, чтобы уменьшить дальнейшее снижение pH. Было доказано, что добавки BCAA снижают уровень молочной кислоты в мышцах, позволяя продолжить метаболизм глюкозы. [15] Это приводит к снижению скорости гликогенолиза в печени и, как следствие, к снижению уровня глюкозы в плазме. Тем не менее, исследования, проведенные в отношении долгосрочного воздействия BCAA на уровень глюкозы, показали, что постоянный прием BCAA не оказывает заметного влияния на уровень глюкозы в крови вне тренировок. [15]
BCAA снижают уровень циркулирующих свободных жирных кислот (СЖК) в крови. [15] СЖК конкурируют за места связывания на альбумине с триптофаном , и когда уровни СЖК в крови снижаются, уровни свободного триптофана также снижаются, поскольку большее количество связывается с альбумином. Во время физических упражнений уровень свободного триптофана, поступающего в мозг, увеличивается, вызывая повышение уровня 5-гидрокситриптамина (5-НТ, также известного как серотонин ), который способствует ощущению усталости . Благодаря снижению уровня СЖК в крови BCAA могут помочь снизить уровень свободного триптофана, поступающего в мозг, и помочь уменьшить ощущение усталости в результате нагрузки. [16] Снижение захвата триптофана в мозге приводит к снижению синтеза и высвобождения серотонина (у крыс. [17] ) Снижение уровня серотонина может достигать 90%; низкий уровень серотонина уменьшает ощущение усталости, но также приводит к отсутствию концентрации, плохому контролю над импульсами, агрессивному поведению и плохому планированию.
BCAA также ингибирует усвоение тирозина в мозге (тирозин является еще одной ароматической аминокислотой, такой как триптофан); снижение поглощения подавляет синтез и высвобождение катехоламинов в мозге. Катехоламины связаны с повышенной физической работоспособностью. Одновременное снижение синтеза катехоламинов и серотонина может объяснить относительно нейтральное влияние BCAA на физическую работоспособность. [17]
Также обнаружено, что BCAA снижают повышение уровня аммиака в сыворотке крови , которое происходит во время физических упражнений. Это достигается за счет увеличения количества аммиака, используемого в синтезе глютамина , что предотвращает чрезмерное накопление аммиака в крови. [15] Повышенный уровень аммиака в мозге приводит к снижению уровня ГАМК и глутамата , вызывая усиление центральной усталости . Повышенный уровень аммиака в мышечной ткани также увеличивает активность фосфофруктокиназы (PFK), что приводит к увеличению молочной кислоты, основной причины мышечной усталости. [18]
Кроме того, было показано, что добавки BCAA снижают уровень креатинкиназы в мышечных клетках после тренировки. Креатинкиназа является индикатором повреждения мышц и отвечает за перенос фосфатной группы из АТФ для создания молекулы фосфокреатина . [19] Было показано, что добавки BCAA снижают уровень креатинкиназы, что приводит к повышению уровня внутриклеточного АТФ и уменьшению чувства усталости. [20] См. также DOMS .
Исследовать
[ редактировать ]Диетические BCAA использовались в попытке лечения некоторых случаев печеночной энцефалопатии . [21] Они могут облегчить симптомы печеночной энцефалопатии, но нет никаких доказательств того, что они улучшают уровень смертности, питание или общее качество жизни, поскольку необходимы дальнейшие исследования. [22]
Некоторые исследования показали возможную связь между высокой заболеваемостью боковым амиотрофическим склерозом (БАС) среди профессиональных игроков в американский футбол и итальянских футболистов и некоторыми спортивными добавками, включая BCAA. [23] В исследованиях на мышах было показано, что BCAA вызывают гипервозбудимость клеток, аналогичную той, которая обычно наблюдается у пациентов с БАС. Предполагаемый основной механизм заключается в том, что гипервозбудимость клеток приводит к увеличению абсорбции кальция клеткой и, таким образом, приводит к гибели клеток, особенно нейрональных клеток, которые имеют особенно низкую способность к буферизации кальция. [23] Тем не менее, какая-либо связь между BCAA и ALS еще предстоит полностью установить. Хотя BCAA могут вызывать повышенную возбудимость, аналогичную той, которая наблюдается у мышей с БАС, текущие исследования не показывают, действительно ли диета, обогащенная BCAA, при приеме в течение длительного периода времени, действительно вызывает симптомы, подобные БАС. [23]
Уровни BCAA в крови повышены у тучных, инсулинорезистентных людей, а также на моделях мышей и крыс с диабетом, вызванным диетой, что позволяет предположить возможность того, что BCAA способствуют патогенезу ожирения и диабета. [24] [25] Диеты с ограничением BCAA улучшают толерантность к глюкозе и способствуют худобе у мышей с нормальным весом. [26] восстанавливает чувствительность к инсулину и нормальную массу тела мышам с ожирением [27] и способствует повышению чувствительности к инсулину у крыс с ожирением. [28] У худых и тучных мышей эти преимущества ограничения BCAA опосредованы изолейцином и валином, а не ограничением лейцина. [29]
Ограничение диетических BCAA продлевает продолжительность жизни мух. [30] в то время как ограничение BCAA у мышей продлевает продолжительность жизни самцов и снижает хрупкость, но не продлевает продолжительность жизни самок. [31] У мышей добавление в рацион только BCAA сокращает продолжительность жизни и способствует ожирению. [32] Однако потребление добавки незаменимых аминокислот, обогащенной BCAA, продлевает продолжительность жизни мышей. [33]
См. также
[ редактировать ]- Комплекс дегидрогеназы альфа-кетокислот с разветвленной цепью
- Болезнь мочи кленового сиропа — избыточное накопление BCAA в организме.
- Дефицит BCKDK — недостаточный уровень BCAA в организме.
Ссылки
[ редактировать ]- ^ Соуерс С. «Практическое описание аминокислот с разветвленной цепью» (PDF) . Хантингтонский колледж медицинских наук. Архивировано из оригинала (PDF) 28 августа 2017 года . Проверено 22 марта 2011 г.
- ^ Шимомура Ю., Мураками Т., Накаи Н., Нагасаки М., Харрис Р.А. (июнь 2004 г.). «Упражнения способствуют катаболизму BCAA: влияние добавок BCAA на скелетные мышцы во время тренировки» . Журнал питания . 134 (6 Доп.): 1583S–1587S. дои : 10.1093/jn/134.6.1583S . ПМИД 15173434 .
- ^ Jump up to: а б с д Сингх Б.К., Шанер Д.Л. (июль 1995 г.). «Биосинтез аминокислот с разветвленной цепью: от пробирки до поля» . Растительная клетка . 7 (7): 935–944. дои : 10.1105/tpc.7.7.935 . ПМК 160890 . ПМИД 12242394 .
- ^ Jump up to: а б с д Монируджаман М (2014). «Метаболическая и физиологическая роль аминокислот с разветвленной цепью» . Достижения молекулярной биологии . 2014 : 1–6. дои : 10.1155/2014/364976 . hdl : 1993/30476 .
- ^ Бабчиа Н., Калипель А., Мурио Ф., Фаусса А.М., Маскарелли Ф. (январь 2010 г.). «Сигнальные пути PI3K/Akt и mTOR/P70S6K в клетках увеальной меланомы человека: взаимодействие с B-Raf/ERK» . Исследовательская офтальмология и визуальные науки . 51 (1): 421–9. дои : 10.1167/iovs.09-3974 . ПМИД 19661225 .
- ^ Медицинский институт (2002). «Белки и аминокислоты» . Диетическая норма потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот . Вашингтон, округ Колумбия: Издательство национальных академий. стр. 589–768. дои : 10.17226/10490 . ISBN 978-0-309-08525-0 .
- ^ Сирс Д.Д., Сяо Г., Сяо А., Ю Дж.Г., Кортни Ч.Х., Офресио Дж.М. и др. (ноябрь 2009 г.). «Механизмы инсулинорезистентности человека и тиазолидиндион-опосредованной сенсибилизации инсулина» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (44): 18745–50. Бибкод : 2009PNAS..10618745S . дои : 10.1073/pnas.0903032106 . ПМЦ 2763882 . ПМИД 19841271 .
- ^ Jump up to: а б Скаини, Г.; Иеремиас, IC; Мораис, Миссури; Борхес, Джорджия; Муньоз, БП; Леффа, Д.Д.; Андраде, В.М.; Шук, П.Ф.; Феррейра, GC; Стрек, Э.Л. (2012). «Повреждение ДНК на животной модели болезни мочи кленового сиропа». Молекулярная генетика и обмен веществ . 106 (2): 169–174. дои : 10.1016/j.ymgme.2012.04.009 . ПМИД 22560665 .
- ^ Jump up to: а б Кимбалл С.Р., Джефферсон Л.С. (январь 2006 г.). «Сигнальные пути и молекулярные механизмы, посредством которых аминокислоты с разветвленной цепью опосредуют трансляционный контроль синтеза белка» . Журнал питания . 136 (1 доп.): 227S–31S. дои : 10.1093/jn/136.1.227S . ПМИД 16365087 .
- ^ Jump up to: а б Бодин С.К., Ститт Т.Н., Гонсалес М., Клайн В.О., Стовер Г.Л., Бауэрляйн Р. и др. (ноябрь 2001 г.). «Путь Akt/mTOR является важнейшим регулятором гипертрофии скелетных мышц и может предотвратить мышечную атрофию in vivo». Природная клеточная биология . 3 (11): 1014–9. дои : 10.1038/ncb1101-1014 . ПМИД 11715023 . S2CID 16284975 .
- ^ Jump up to: а б с Бломстранд Э., Элиассон Дж., Карлссон Х.К., Кёнке Р. (январь 2006 г.). «Аминокислоты с разветвленной цепью активируют ключевые ферменты синтеза белка после физических упражнений» . Журнал питания . 136 (1 доп.): 269S–73S. дои : 10.1093/jn/136.1.269S . ПМИД 16365096 .
- ^ Jump up to: а б с д Мельник БК (март 2012 г.). «Передача сигналов лейцина в патогенезе диабета 2 типа и ожирения» . Всемирный журнал диабета . 3 (3): 38–53. дои : 10.4239/WJD.v3.i3.38 . ПМК 3310004 . ПМИД 22442749 .
- ^ Jump up to: а б Балькасар Моралес Н., Агилар де Плата К (июль 2012 г.). «Роль пути AKT/mTORC1 в пролиферации β-клеток поджелудочной железы» . Колумбия Медика . 43 (3): 235–43. дои : 10.25100/cm.v43i3.783 . ПМК 4001958 . ПМИД 24893199 .
- ^ Сахлин К. (1986). «Мышечная усталость и накопление молочной кислоты». Acta Physiologica Scandinavica. Дополнение . 556 : 83–91. ПМИД 3471061 .
- ^ Jump up to: а б с д Хормознежад Р., Джавид А.З., Мансури А. (август 2019 г.). «Влияние добавок BCAA на центральную усталость, субстрат энергетического метаболизма и повреждение мышц при выполнении упражнений: систематический обзор с метаанализом». Спортивные науки для здоровья . 15 (2): 265–279. дои : 10.1007/s11332-019-00542-4 . S2CID 78093727 .
- ^ Уотсон П., Ширреффс С.М., Моэн Р.Дж. (декабрь 2004 г.). «Влияние острых добавок аминокислот с разветвленной цепью на длительную работоспособность в теплой среде». Европейский журнал прикладной физиологии . 93 (3): 306–14. дои : 10.1007/s00421-004-1206-2 . ПМИД 15349784 . S2CID 20597074 .
- ^ Jump up to: а б Чой С., Дисильвио Б., Фернстром М.Х., Фернстром Дж.Д. (ноябрь 2013 г.). «Поральные добавки с аминокислотами с разветвленной цепью, которые снижают уровень серотонина в мозге во время физических упражнений у крыс, также снижают уровень катехоламинов в мозге» . Аминокислоты . 45 (5): 1133–42. дои : 10.1007/s00726-013-1566-1 . ПМИД 23904096 . S2CID 1957988 .
- ^ Матч Б.Дж., Банистер Э.В. (1983). «Обмен аммиака при физических нагрузках и утомлении: обзор» . Медицина и наука в спорте и физических упражнениях . 15 (1): 41–50. дои : 10.1249/00005768-198315010-00009 . ПМИД 6341752 .
- ^ Моэн Р.Дж., Глисон М. (2010). Биохимические основы спортивной результативности (2-е изд.). Издательство Оксфордского университета. стр. 81–82. ISBN 978-0-19-920828-9 . Проверено 6 декабря 2019 г.
- ^ Рахими М.Х., Шаб-Бидар С., Моллахоссейни М., Джафарян К. (октябрь 2017 г.). «Добавка аминокислот с разветвленной цепью и повреждение мышц, вызванное физическими упражнениями, при восстановлении после физических упражнений: метаанализ рандомизированных клинических исследований». Питание . 42 : 30–36. дои : 10.1016/j.nut.2017.05.005 . ПМИД 28870476 .
- ^ Чадалавада Р., Сапати Кантри Р.С., Максвелл Дж., Маллен К. (июнь 2010 г.). «Питание при печеночной энцефалопатии». Питание в клинической практике . 25 (3): 257–64. дои : 10.1177/0884533610368712 . ПМИД 20581319 .
- ^ Глууд Л.Л., Дам Г., Лес И, Маркезини Г., Борре М., Агаард Н.К., Вилструп Х. (май 2017 г.). «Аминокислоты с разветвленной цепью для людей с печеночной энцефалопатией» . Кокрановская база данных систематических обзоров . 5 (5): CD001939. дои : 10.1002/14651858.cd001939.pub4 . ПМК 6481897 . ПМИД 28518283 .
- ^ Jump up to: а б с Мануэль М., Хекман CJ (март 2011 г.). «Сильнее не всегда значит лучше: могут ли пищевые добавки для бодибилдеров привести к БАС?» . Экспериментальная неврология . 228 (1): 5–8. дои : 10.1016/j.expneurol.2010.12.007 . ПМК 3049458 . ПМИД 21167830 .
- ^ Линч CJ, Адамс С.Х. (декабрь 2014 г.). «Аминокислоты с разветвленной цепью в метаболической передаче сигналов и резистентности к инсулину» . Обзоры природы. Эндокринология . 10 (12): 723–36. дои : 10.1038/nrendo.2014.171 . ПМЦ 4424797 . ПМИД 25287287 .
- ^ Ньюгард С.Б., Ан Дж., Бэйн Дж.Р., Мюлбауэр М.Дж., Стивенс Р.Д., Лиен Л.Ф. и др. (апрель 2009 г.). «Метаболический признак, связанный с аминокислотами с разветвленной цепью, который отличает людей с ожирением от худых и способствует резистентности к инсулину» . Клеточный метаболизм . 9 (4): 311–26. дои : 10.1016/j.cmet.2009.02.002 . ПМК 3640280 . ПМИД 19356713 .
- ^ Фонтана Л., Каммингс Н.Э., Арриола Апело С.И., Нойман Дж.К., Каса И., Шмидт Б.А. и др. (июль 2016 г.). «Снижение потребления аминокислот с разветвленной цепью улучшает метаболическое здоровье» . Отчеты по ячейкам . 16 (2): 520–530. дои : 10.1016/j.celrep.2016.05.092 . ПМЦ 4947548 . ПМИД 27346343 .
- ^ Каммингс Н.Э., Уильямс Э.М., Каса И., Конон Э.Н., Шайд М.Д., Шмидт Б.А. и др. (февраль 2018 г.). «Восстановление метаболического здоровья за счет снижения потребления аминокислот с разветвленной цепью» . Журнал физиологии . 596 (4): 623–645. дои : 10.1113/JP275075 . ПМК 5813603 . ПМИД 29266268 .
- ^ Уайт П.Дж., Лэпворт А.Л., Ан Дж., Ван Л., МакГарра Р.В., Стивенс Р.Д. и др. (июль 2016 г.). «Ограничение аминокислот с разветвленной цепью у крыс с ожирением Цукера улучшает чувствительность мышц к инсулину за счет повышения эффективности окисления жирных кислот и экспорта ацил-глицина» . Молекулярный метаболизм . 5 (7): 538–551. doi : 10.1016/j.molmet.2016.04.006 . ПМЦ 4921791 . ПМИД 27408778 .
- ^ Ю Д., Ричардсон Н.Е., Грин К.Л., Спайсер А.Б., Мерфи М.Э., Флорес В. и др. (май 2021 г.). «Неблагоприятные метаболические эффекты аминокислот с разветвленной цепью опосредуются изолейцином и валином» . Клеточный метаболизм . 33 (5): 905–922.e6. дои : 10.1016/j.cmet.2021.03.025 . ПМК 8102360 . ПМИД 33887198 .
- ^ Юричич П., Грёнке С., Партридж Л. (январь 2020 г.). «Аминокислоты с разветвленной цепью оказывают эквивалентное воздействие на другие незаменимые аминокислоты на продолжительность жизни и особенности старения у дрозофилы» . Журналы геронтологии. Серия А, Биологические и медицинские науки . 75 (1): 24–31. дои : 10.1093/gerona/glz080 . ПМК 6909895 . ПМИД 30891588 .
- ^ Ричардсон Н.Э., Конон Э.Н., Шустер Х.С., Митчелл А.Т., Бойл С., Роджерс А.С. и др. (январь 2021 г.). «Пожизненное ограничение потребления аминокислот с разветвленной цепью в рационе оказывает специфическое для пола преимущество, снижая слабость и продолжительность жизни мышей» . Природное старение . 1 (1): 73–86. дои : 10.1038/s43587-020-00006-2 . ПМК 8009080 . ПМИД 33796866 .
- ^ Солон-Бит С.М., Коггер В.К., Пульпител Т., Валь Д., Кларк Х., Бэгли Е. и др. (май 2019 г.). «Аминокислоты с разветвленной цепью влияют на здоровье и продолжительность жизни косвенно через аминокислотный баланс и контроль аппетита» . Природный метаболизм . 1 (5): 532–545. дои : 10.1038/s42255-019-0059-2 . ПМК 6814438 . PMID 31656947 .
- ^ Д'Антона Г., Рагни М., Кардиле А., Тедеско Л., Доссена М., Бруттини Ф. и др. (октябрь 2010 г.). «Добавка аминокислот с разветвленной цепью способствует выживанию и поддерживает биогенез митохондрий сердечной и скелетных мышц у мышей среднего возраста» . Клеточный метаболизм . 12 (4): 362–372. дои : 10.1016/j.cmet.2010.08.016 . ПМИД 20889128 .
Внешние ссылки
[ редактировать ]- Разветвленные цепи+аминокислоты+ Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Путь деградации аминокислот с разветвленной цепью
- Путь синтеза у дрожжей (WikiPathways)

