Прилежащее ядро
| Прилежащее ядро | |
|---|---|
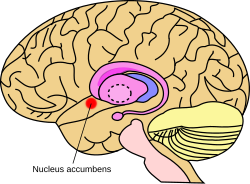 Примерное расположение прилежащего ядра в головном мозге | |
 Прилежащее ядро мозга мыши | |
| Подробности | |
| Часть | Мезолимбический путь Базальные ганглии ( вентральное полосатое тело ) |
| Части | Оболочка прилежащего ядра Ядро прилежащего ядра |
| Идентификаторы | |
| латинский | прилежащее ядро перегородки |
| Акроним(ы) | НАк или НАкк |
| МеШ | D009714 |
| Нейроимена | 277 |
| НейроЛекс ID | бирнлекс_727 |
| ТА98 | A14.1.09.440 |
| ТА2 | 5558 |
| ФМА | 61889 |
| Анатомические термины нейроанатомии | |
( Прилежащее ядро NAc или NAcc ; также известное как прилежащее ядро или ранее как прилежащее ядро перегородки , что по латыни означает « ядро, прилегающее к перегородке ») представляет собой область в базальном отделе переднего мозга ростральную по отношению к преоптической области гипоталамуса , . [1] Прилежащее ядро и обонятельный бугорок вместе образуют вентральное полосатое тело . Вентральное полосатое тело и дорсальное полосатое тело вместе образуют полосатое тело , которое является основным компонентом базальных ганглиев . [2] Дофаминергические нейроны мезолимбического пути проецируются на ГАМКергической шипиковые нейроны среды прилежащего ядра и обонятельного бугорка. [3] [4] Каждое полушарие головного мозга имеет свое прилежащее ядро, которое можно разделить на две структуры: ядро прилежащего ядра и оболочку прилежащего ядра. Эти субструктуры имеют различную морфологию и функции.
Различные субрегионы NAcc (ядро или оболочка) и субпопуляции нейронов в каждой области ( нейроны со средними шипами D1-типа и D2-типа ) ответственны за различные когнитивные функции . [5] [6] В целом, прилежащее ядро играет значительную роль в когнитивной обработке мотивации , отвращения , вознаграждения (т. е. значимости стимула , удовольствия и положительного подкрепления ) и с подкреплением обучения (например, инструментального переноса по Павлову ); [4] [7] [8] [9] [10] следовательно, он играет важную роль в возникновении зависимости . [4] [8] Кроме того, часть прилежащего ядра центрально участвует в индукции медленноволнового сна . [11] [12] [13] [14] Прилежащее ядро играет меньшую роль в обработке страха (форма отвращения), импульсивности и эффекта плацебо . [15] [16] [17] участвует в кодировании новых двигательных программ . Он также [4]
Структура
[ редактировать ]Прилежащее ядро представляет собой совокупность нейронов, имеющую внешнюю оболочку и внутреннее ядро. [4]
Вход
[ редактировать ]Основные глутаматергические входы в прилежащее ядро включают префронтальную кору (особенно прелимбическую и подлимбическую кору ), базолатеральную миндалевидное тело , вентральный гиппокамп , ядра таламуса (в частности, срединные ядра таламуса и интраламинарные ядра таламуса ) и глутаматергические проекции вентральной покрышки. район (ВТА). [18] Прилежащее ядро получает дофаминергические сигналы из вентральной покрышки, которые соединяются через мезолимбический путь . Прилежащее ядро часто описывают как часть кортико-базальных ганглиев-таламо-кортикальной петли . [19]
Дофаминергические сигналы от ВТА модулируют активность ГАМКергических нейронов в прилежащем ядре. Эти нейроны активируются прямо или косвенно эйфорическими препаратами (например, амфетамином , опиатами и т. д.) и участием в полезных событиях (например, сексе, музыке, физических упражнениях и т. д.). [20] [21]
Другой основной источник сигнала поступает из CA1 и вентрального в дорсомедиальную субикулюма гиппокампа область прилежащего ядра. Небольшая деполяризация клеток прилежащего ядра коррелирует с позитивностью нейронов гиппокампа, делая их более возбудимыми. Коррелированные клетки этих возбужденных состояний средних шипистых нейронов прилежащего ядра поровну распределяются между субикулюмом и СА1. Обнаружено, что нейроны субикулюма гиперполяризуются (увеличивают негативность), в то время как нейроны CA1 «колеблются» (огонь > 50 Гц), чтобы выполнить эту настройку. [22]
Прилежащее ядро — одна из немногих областей, которая получает высокую плотность гистаминергических проекций из туберомаммилярного ядра (единственного источника гистаминовых нейронов в головном мозге). [23]
Выход
[ редактировать ]Выходные нейроны прилежащего ядра посылают аксональные проекции к базальным ганглиям и вентральному аналогу бледного шара , известному как вентральный бледный шар (VP). ВП, в свою очередь, проецируется на медиальное дорсальное ядро дорсального таламуса , которое проецируется на префронтальную кору, а также обратно на вентральное и дорсальное полосатое тело . Другие эфференты от прилежащего ядра включают соединения с хвостом вентральной области покрышки . [24] черная субстанция и формация моста ретикулярная . [1]
Оболочка
[ редактировать ]( Оболочка прилежащего ядра NAccshell ) является субструктурой прилежащего ядра. Оболочка и ядро вместе образуют целое прилежащее ядро.
Расположение: Оболочка представляет собой внешнюю область прилежащего ядра и, в отличие от ядра, считается частью расширенной миндалевидного тела , расположенной на его ростральном полюсе.
Типы клеток: Нейроны в прилежащем ядре в основном представляют собой нейроны со средними шипами (MSN), содержащие в основном типа D1 (т. е. DRD1 и DRD5 ) или типа D2 (т. е. DRD2 , DRD3 и DRD4 ) дофаминовые рецепторы . Субпопуляция MSN содержит рецепторы как D1-типа, так и D2-типа, при этом примерно 40% MSN полосатого тела экспрессируют мРНК как DRD1 , так и DRD2 . [19] [25] [26] Эти MSN NAcc смешанного типа с рецепторами как типа D1, так и типа D2 в основном ограничены оболочкой NAcc. [19] Нейроны в оболочке по сравнению с ядром имеют меньшую плотность дендритных шипиков , меньше терминальных сегментов и меньшее количество ветвящихся сегментов, чем в ядре. Нейроны оболочки проецируются в субкомиссуральную часть вентрального паллидума , а также в вентральную область покрышки, а также в обширные области гипоталамуса и расширенной миндалевидного тела. [27] [28] [29]
Функция: Оболочка прилежащего ядра участвует в когнитивной обработке вознаграждения , включая субъективные реакции «приязни» на определенные приятные стимулы , мотивационную значимость и положительное подкрепление . [4] [5] [30] [31] Было также показано, что эта оболочка NAcc опосредует специфический павловский инструментальный перенос - феномен, при котором классический условный стимул модифицирует оперантное поведение . [32] [9] [10] «Гедоническая горячая точка» или центр удовольствия, который отвечает за приятный или «нравящийся» компонент некоторых внутренних вознаграждений, также расположен в небольшом отсеке внутри медиальной оболочки NAcc. [30] [33] [34] Наркотики, вызывающие привыкание, оказывают большее влияние на высвобождение дофамина в оболочке, чем в ядре. [4]
Основной
[ редактировать ]Ядро прилежащего ядра ( NAcc core ) — это внутренняя субструктура прилежащего ядра.
Расположение: Прилежащее ядро является частью вентрального полосатого тела , расположенного в базальных ганглиях. Типы клеток: Ядро NAcc состоит в основном из средних шипистых нейронов, содержащих в основном дофаминовые рецепторы D1- или D2-типа. Средние шипистые нейроны D1-типа опосредуют когнитивные процессы, связанные с вознаграждением. [5] [35] [36] тогда как средние шипистые нейроны D2-типа опосредуют познание, связанное с отвращением. [6] Нейроны ядра по сравнению с нейронами оболочки имеют повышенную плотность дендритных шипиков, ветвящихся и терминальных сегментов. Из ядра нейроны передаются в другие подкорковые области, такие как бледный шар и черная субстанция. ГАМК является одним из основных нейротрансмиттеров в NAcc, и ГАМК-рецепторов также много. [27] [29]
Функция: Прилежащее ядро участвует в когнитивной обработке двигательных функций, связанных с вознаграждением и подкреплением, а также в регуляции медленноволнового сна . [4] [11] [12] [13] В частности, ядро кодирует новые двигательные программы, которые способствуют получению заданного вознаграждения в будущем. [4] Нейроны непрямого пути (т.е. типа D2) в ядре NAcc, которые совместно экспрессируют А 2А активацию аденозиновых рецепторов , в зависимости от активации способствуют медленноволновому сну. [11] [12] [13] Также было показано, что ядро NAcc опосредует общий павловско-инструментальный перенос - феномен, при котором классический условный стимул изменяет оперантное поведение. [32] [9] [10]
Типы ячеек
[ редактировать ]Примерно 95% нейронов NAcc представляют собой ГАМКергические средние шипиковые нейроны (MSN), которые в первую очередь экспрессируют рецепторы либо типа D1, либо типа D2; [20] около 1–2% остальных типов нейронов представляют собой крупные ашиковые холинергические интернейроны и еще 1–2% — ГАМКергические интернейроны. [20] По сравнению с ГАМКергическими MSN в оболочке, те, что находятся в ядре, имеют повышенную плотность дендритных шипов, ветвящихся и терминальных сегментов. Из ядра нейроны передаются в другие подкорковые области, такие как бледный шар и черная субстанция. ГАМК является одним из основных нейротрансмиттеров в NAcc, и ГАМК-рецепторов также много. [27] [29] Эти нейроны также являются основными проекционными или выходными нейронами прилежащего ядра.
Нейрохимия
[ редактировать ]Некоторые из нейротрансмиттеров, нейромодуляторов и гормонов, которые передают сигналы через рецепторы в прилежащем ядре, включают:
Дофамин : Дофамин высвобождается в прилежащее ядро после воздействия раздражителей , в том числе рекреационных наркотиков, таких как замещенные амфетамины , кокаин , никотин и морфин . [37] [38]
Фенэтиламин и тирамин : Фенэтиламин и тирамин представляют собой следовые амины , которые синтезируются в нейронах, экспрессирующих гидроксилазу ароматических аминокислот (AADC) фермент , который включает все дофаминергические нейроны. [39] Оба соединения действуют как дофаминергические нейромодуляторы , которые регулируют обратный захват и высвобождение дофамина в Nacc посредством взаимодействия с VMAT2 и TAAR1 в окончаниях аксонов мезолимбических дофаминовых нейронов.
Глюкокортикоиды и дофамин. Глюкокортикоидные рецепторы являются единственными рецепторами кортикостероидов в оболочке прилежащего ядра. L-ДОФА , стероиды и, в частности, глюкокортикоиды в настоящее время известны как единственные известные эндогенные соединения, которые могут вызывать психотические проблемы, поэтому понимание гормонального контроля над дофаминергическими проекциями в отношении глюкокортикоидных рецепторов может привести к новым методам лечения психотических симптомов. Недавнее исследование показало, что подавление глюкокортикоидных рецепторов привело к уменьшению высвобождения дофамина, что может привести к будущим исследованиям с использованием антиглюкокортикоидных препаратов для потенциального облегчения психотических симптомов. [40]
ГАМК: Недавнее исследование на крысах, которые использовали агонисты и антагонисты ГАМК, показало, что ГАМК А рецепторы в оболочке NAcc обладают ингибирующим контролем над поведением при повороте под влиянием дофамина, а ГАМК В рецепторы обладают тормозным контролем над поведением при повороте, опосредованным ацетилхолином . [27] [41]
Глутамат : исследования показали, что локальная блокада глутаматергических NMDA-рецепторов в ядре NAcc нарушает пространственное обучение. [42] Другое исследование показало, что и NMDA, и AMPA (оба рецепторы глутамата ) играют важную роль в регулировании инструментального обучения. [43]
Серотонин (5-HT). В целом синапсы 5-HT более распространены и имеют большее количество синаптических контактов в оболочке NAcc, чем в ядре. Они также крупнее и толще и содержат больше крупных везикул с плотным ядром, чем их аналоги в ядре.
Функция
[ редактировать ]Награда и подкрепление
[ редактировать ]Прилежащее ядро, являющееся частью системы вознаграждения, играет важную роль в обработке вознаграждающих стимулов, подкрепляющих стимулов (например, еды и воды), а также стимулов, одновременно вознаграждающих и подкрепляющих (наркотики, вызывающие привыкание, секс и физические упражнения). [4] [44] Преобладающей реакцией нейронов прилежащего ядра на вознаграждение сахарозой является торможение; обратное верно в ответ на введение аверсивного хинина . [45] Веские данные, полученные в результате фармакологических манипуляций, также позволяют предположить, что снижение возбудимости нейронов прилежащего ядра приносит пользу, как, например, было бы верно в случае стимуляции мю-опиоидных рецепторов . [46] Сигнал , зависящий от уровня кислорода в крови (ЖИРНЫЙ) в прилежащем ядре избирательно увеличивается во время восприятия приятных, эмоционально возбуждающих изображений и во время мысленных образов приятных, эмоциональных сцен. Однако, поскольку BOLD считается косвенным показателем регионального чистого возбуждения и торможения, степень, в которой BOLD измеряет валентно-зависимую обработку, неизвестна. [47] [48] Из-за обилия входных сигналов NAcc из лимбических областей и сильных выходных сигналов NAcc в двигательные области Гордон Могенсен описал прилежащее ядро как интерфейс между лимбической и моторной системами. [49] [50]

Прилежащее ядро причинно связано с ощущением удовольствия. Микроинъекции мю-опиоидных агонистов, δ-опиоидных агонистов или κ-опиоидных агонистов в ростродорсальный квадрант медиальной оболочки усиливают «симпатию», тогда как более каудальные инъекции могут ингибировать реакции отвращения, реакции симпатии или и то, и другое. [30] Области прилежащего ядра, которым можно приписать причинную роль в производстве удовольствия, ограничены как анатомически, так и химически, поскольку, помимо опиоидных агонистов, только эндоканнабиноиды усиливать симпатию могут . В прилежащем ядре в целом дофамин, агонисты рецепторов ГАМК или антагонисты АМРА модифицируют исключительно мотивацию, в то время как то же самое верно для опиоидов и эндоканнабиноидов за пределами горячей точки в медиальной оболочке. Ростро-каудальный градиент существует для усиления реакций аппетита по сравнению с реакциями страха, последний из которых, как традиционно считается, требует только функции рецептора D1, а первый требует функции как D1, так и D2. Одна из интерпретаций этого открытия, гипотеза растормаживания, утверждает, что ингибирование прилежащих MSN (которые являются ГАМКергическими) растормаживает нижестоящие структуры, позволяя выражать аппетитное или потребительское поведение. [52] Мотивационные эффекты антагонистов АМРА и, в меньшей степени, агонистов ГАМК анатомически гибки. Стрессовые условия могут расширить области, вызывающие страх, в то время как знакомая обстановка может уменьшить размер области, вызывающей страх. Более того, кортикальный входной сигнал из орбитофронтальной коры (OFC) смещает реакцию в сторону аппетитного поведения, а инфралимбический входной сигнал, эквивалентный субгенуальной поясной извилине человека, подавляет ответ независимо от валентности. [30]
Прилежащее ядро не является ни необходимым, ни достаточным для инструментального обучения, хотя манипуляции могут повлиять на выполнение задач инструментального обучения. Одной из задач, где эффект поражений NAcc очевиден, является павловско-инструментальный перенос (PIT), где сигнал в сочетании с конкретным или общим вознаграждением может усилить инструментальную реакцию. Повреждения ядра NAcc ухудшают производительность после девальвации и подавляют эффект общего подоходного налога. С другой стороны, поражения скорлупы лишь ухудшают эффект специфического ПИТ. Считается, что это различие отражает консумационные и аппетитные условные реакции в оболочке NAcc и ядре NAcc соответственно. [53]
В дорсальном полосатом теле наблюдается дихотомия между D1-MSN и D2-MSN, причем первые усиливают и усиливают локомоцию, а вторые отталкивают и снижают локомоцию. Традиционно считалось, что такое различие применимо и к прилежащему ядру, но данные фармакологических и оптогенетических исследований противоречивы. Более того, подмножество NAcc MSN экспрессируют как D1, так и D2 MSN, и фармакологическая активация рецепторов D1 по сравнению с D2 не обязательно обязательно активирует именно нейронные популяции. Хотя большинство исследований не показывают влияния избирательной оптогенетической стимуляции MSN D1 или D2 на двигательную активность, в одном исследовании сообщается об уменьшении базальной локомоции при стимуляции D2-MSN. Хотя в двух исследованиях сообщалось об уменьшении усиливающего эффекта кокаина при активации D2-MSN, в одном исследовании не было обнаружено никакого эффекта. Сообщалось также, что активация NAcc D2-MSN усиливает мотивацию по оценке PIT, а активность рецептора D2 необходима для усиления эффектов стимуляции VTA. [54] Исследование 2018 года показало, что активация D2 MSN усиливает мотивацию за счет ингибирования вентрального паллидума, тем самым растормаживая ВТА. [55]
Материнское поведение
[ редактировать ]Исследование фМРТ, проведенное в 2005 году, показало, что когда крысы-матери находились в присутствии своих детенышей, области мозга, участвующие в подкреплении, включая прилежащее ядро, были очень активными. [56] Уровни дофамина увеличиваются в прилежащем ядре во время материнского поведения, тогда как поражения в этой области нарушают материнское поведение. [57] Когда женщинам предъявляют фотографии неродственных младенцев, фМРТ показывает повышенную активность мозга в прилежащем ядре и прилежащем хвостатом ядре, пропорционально степени, в которой женщины находят этих младенцев «милыми». [58]
Отвращение
[ редактировать ]Активация MSN D1-типа в прилежащем ядре участвует в вознаграждении, тогда как активация MSN D2-типа в прилежащем ядре способствует отвращению . [6]
Медленноволновой сон
[ редактировать ]В конце 2017 года исследования на грызунах, в которых использовались оптогенетические и хемогенетические методы, показали, что непрямой путь (т. е. D2-типа) средние шипистые нейроны в ядре прилежащего ядра, которые коэкспрессируют аденозиновые рецепторы А 2А и проецируются на вентральное паллидум , участвуют в регуляция медленноволнового сна . [11] [12] [13] [14] В частности, оптогенетическая активация этих основных нейронов NAcc непрямого пути индуцирует медленноволновой сон, а хемогенетическая активация тех же нейронов увеличивает количество и продолжительность эпизодов медленноволнового сна. [12] [13] [14] Хемогенетическое ингибирование этих ядерных нейронов NAcc подавляет сон. [12] [13] Напротив, средние шипистые нейроны D2-типа в оболочке NAcc, которые экспрессируют рецепторы аденозина А2А, не играют роли в регуляции медленноволнового сна. [12] [13]
Клиническое значение
[ редактировать ]Зависимость
[ редактировать ]Современные модели зависимости от хронического употребления наркотиков включают изменения в экспрессии генов в мезокортиколимбической проекции . [20] [59] [60] Наиболее важными факторами транскрипции , которые вызывают эти изменения, являются ΔFosB циклического аденозинмонофосфата ( cAMP , белок, связывающий элемент ответа ) ( CREB ), и ядерный фактор каппа B ( NFκB ). [20] ΔFosB является наиболее значимым фактором транскрипции гена при зависимости, поскольку его вирусная или генетическая сверхэкспрессия в прилежащем ядре необходима и достаточна для многих нейронных адаптаций и поведенческих эффектов (например, зависимого от экспрессии увеличения способности к самостоятельному введению и повышения чувствительности к вознаграждению ), наблюдаемых у наркомания. [20] [35] [61] Сверхэкспрессия ΔFosB связана, среди прочего, с зависимостью от алкоголя (этанола) , каннабиноидов , кокаина , метилфенидата , никотина , опиоидов , фенциклидина , пропофола и замещенных амфетаминов . [20] [59] [61] [62] [63] Увеличение экспрессии ΔJunD в прилежащем ядре может снижать или, при значительном увеличении, даже блокировать большинство нервных изменений, наблюдаемых при хроническом злоупотреблении наркотиками (т.е. изменений, опосредованных ΔFosB). [20]
ΔFosB также играет важную роль в регулировании поведенческих реакций на естественные вознаграждения, такие как вкусная еда, секс и физические упражнения. [20] [21] Естественные вознаграждения, такие как злоупотребление наркотиками, индуцируют ΔFosB в прилежащем ядре, и хроническое приобретение этих вознаграждений может привести к аналогичному патологическому состоянию зависимости из-за сверхэкспрессии ΔFosB. [20] [21] [44] Следовательно, ΔFosB также является ключевым фактором транскрипции, участвующим в пристрастии к естественным вознаграждениям; [20] [21] [44] в частности, ΔFosB в прилежащем ядре имеет решающее значение для усиления эффектов сексуального вознаграждения. [21] Исследования взаимодействия между естественным и лекарственным вознаграждением показывают, что психостимуляторы и сексуальное поведение действуют на схожие биомолекулярные механизмы, вызывая ΔFosB в прилежащем ядре, и обладают эффектами перекрестной сенсибилизации, опосредованными через ΔFosB. [44] [64]
Подобно вознаграждениям за лекарства, вознаграждения, не связанные с наркотиками, также повышают уровень внеклеточного дофамина в оболочке NAcc. Вызванное лекарством высвобождение дофамина в оболочке NAcc и ядре NAcc обычно не склонно к привыканию (т. е. развитию толерантности к лекарству : уменьшению высвобождения дофамина от будущего воздействия препарата в результате повторного воздействия препарата); напротив, повторное воздействие препаратов, которые вызывают высвобождение дофамина в оболочке и ядре NAcc, обычно приводит к сенсибилизации (т. е. количество дофамина, высвобождаемого в NAcc в результате будущего воздействия препарата, увеличивается в результате повторного воздействия препарата). Сенсибилизация высвобождения дофамина в оболочке NAcc после повторного воздействия препарата способствует усилению ассоциаций «стимул-лекарство» (т. е. классического обусловливания , которое возникает, когда употребление наркотиков неоднократно сочетается со стимулами окружающей среды), и эти ассоциации становятся менее склонными к исчезновению (т. е. «отучению»). эти классически обусловленные ассоциации между употреблением наркотиков и раздражителями окружающей среды становятся более трудными). После повторного спаривания эти классически обусловленные стимулы окружающей среды (например, контексты и объекты, которые часто сочетаются с употреблением наркотиков) часто становятся сигналы о наркотиках , которые действуют как вторичные подкрепления употребления наркотиков (т.е., как только эти ассоциации установлены, воздействие парного стимула окружающей среды вызывает тягу или желание употреблять наркотик, с которым они стали ассоциироваться ). [27] [38]
В отличие от лекарств, высвобождение дофамина в оболочке NAcc под действием многих типов вознаграждающих нелекарственных стимулов обычно подвергается привыканию после повторного воздействия (т. е. количество дофамина, высвобождаемого в результате будущего воздействия вознаграждающих нелекарственных стимулов, обычно уменьшается в результате многократного воздействия этого раздражителя). [27] [38]
Депрессия
[ редактировать ]В апреле 2007 года две исследовательские группы сообщили о вставке электродов в прилежащее ядро, чтобы использовать глубокую стимуляцию мозга для лечения тяжелой депрессии . [65] В 2010 году эксперименты показали, что глубокая стимуляция прилежащего ядра мозга позволила уменьшить симптомы депрессии у 50% пациентов, которые не реагировали на другие методы лечения, такие как электросудорожная терапия . [66] Прилежащее ядро также использовалось в качестве мишени для лечения небольших групп пациентов с резистентным к терапии обсессивно-компульсивным расстройством. [67]
Абляция
[ редактировать ]Для лечения зависимости и при попытке лечения психических заболеваний была проведена радиочастотная абляция прилежащего ядра. Результаты неубедительны и противоречивы. [68] [69]
Эффект плацебо
[ редактировать ]Было показано, что активация NAcc происходит в ожидании эффективности препарата, когда пользователю дают плацебо , что указывает на способствующую роль прилежащего ядра в эффекте плацебо . [16] [70]
Дополнительные изображения
[ редактировать ]- Дофамин и серотонин
- Корональный срез МРТ, показывающий прилежащее ядро, обведенное красным.
- Сагиттальный срез МРТ с выделением (красным), указывающим на прилежащее ядро.
- Прилежащее ядро выделено зеленым на корональных изображениях Т1 МРТ.
- Прилежащее ядро выделено зеленым на сагиттальных МРТ-изображениях Т1.
- Прилежащее ядро выделено зеленым на поперечных изображениях Т1 МРТ.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Карлсон Н.Р. (2013). Физиология поведения (11-е изд.). Бостон: Пирсон. [ нужна страница ]
- ^ Прилежащее ядро
- ^ Икемото С. (ноябрь 2010 г.). «Схема вознаграждения мозга за пределами мезолимбической дофаминовой системы: нейробиологическая теория» . Неврологические и биоповеденческие обзоры . 35 (2): 129–50. doi : 10.1016/j.neubiorev.2010.02.001 . ПМЦ 2894302 . ПМИД 20149820 .
Недавние исследования по внутричерепному самостоятельному введению нейрохимических веществ (лекарств) показали, что крысы учатся самостоятельно вводить различные лекарства в мезолимбические дофаминовые структуры — заднюю вентральную область покрышки, медиальное прилежащее ядро оболочки и медиальный обонятельный бугорок. ... В 1970-х годах было признано, что обонятельный бугорок содержит полосатый компонент, который заполнен ГАМКергическими средними шиповидными нейронами, получающими глутаматергические входы из кортикальных областей и дофаминергические входы из ВТА и проецирующимися на вентральное паллидум, как и прилежащее ядро.
Рисунок 3. Вентральное полосатое тело и самостоятельный прием амфетамина. - ^ Перейти обратно: а б с д и ж г час я дж Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). Сидор А., Браун Р.Ю. (ред.). Молекулярная нейрофармакология: фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. стр. 147–148, 367, 376. ISBN. 978-0-07-148127-4 .
Нейроны VTA DA играют решающую роль в мотивации, поведении, связанном с вознаграждением (глава 15), внимании и различных формах памяти. Такая организация системы DA, широкая проекция ограниченного числа клеточных тел, обеспечивает скоординированные ответы на новые мощные вознаграждения. Таким образом, действуя в различных терминальных полях, дофамин придает мотивационную значимость («желание») самому вознаграждению или связанным с ним сигналам (область оболочки прилежащего ядра), обновляет ценность, придаваемую различным целям в свете этого нового опыта (орбитальная префронтальная кора), помогает консолидировать несколько форм памяти (миндалевидное тело и гиппокамп) и кодирует новые двигательные программы, которые облегчат получение этого вознаграждения в будущем (область ядра прилежащего ядра и дорсальное полосатое тело). В этом примере дофамин модулирует обработку сенсомоторной информации в различных нейронных цепях, чтобы максимизировать способность организма получать будущие вознаграждения. ...
Схема вознаграждения мозга, на которую воздействуют наркотики, вызывающие привыкание, обычно обеспечивает удовольствие и усиление поведения, связанного с естественными подкреплениями, такими как еда, вода и сексуальный контакт. Дофаминовые нейроны в VTA активируются пищей и водой, а высвобождение дофамина в NAc стимулируется присутствием естественных подкреплений, таких как еда, вода или сексуальный партнер. ...
NAc и VTA являются центральными компонентами схемы, лежащей в основе вознаграждения и памяти о вознаграждении. Как упоминалось ранее, активность дофаминергических нейронов в ВТА, по-видимому, связана с предсказанием вознаграждения. NAc участвует в обучении, связанном с подкреплением и модуляцией двигательных ответов на стимулы, удовлетворяющие внутренние гомеостатические потребности. Оболочка NAc, по-видимому, особенно важна для начального действия препарата в схеме вознаграждения; наркотики, вызывающие привыкание, по-видимому, оказывают большее влияние на высвобождение дофамина в оболочке, чем в ядре NAc. - ^ Перейти обратно: а б с Саддорис, член парламента, Каччапалья Ф, Вайтман Р.М., Карелли Р.М. (август 2015 г.). «Дифференциальная динамика высвобождения дофамина в ядре и оболочке прилежащего ядра выявляет дополнительные сигналы для прогнозирования ошибок и побудительной мотивации» . Журнал неврологии . 35 (33): 11572–82. doi : 10.1523/JNEUROSCI.2344-15.2015 . ПМК 4540796 . ПМИД 26290234 .
Здесь мы обнаружили, что высвобождение дофамина в реальном времени в прилежащем ядре (основная мишень дофаминовых нейронов среднего мозга) поразительно варьируется между субрегионами ядра и оболочки. В своей основе динамика дофамина согласуется с теориями, основанными на обучении (такими как ошибка прогнозирования вознаграждения), тогда как в оболочке дофамин согласуется с теориями, основанными на мотивации (например, значимость стимулов).
- ^ Перейти обратно: а б с Калипари Э.С., Багот Р.К., Пурушотаман И., Дэвидсон Т.Дж., Йоргасон Дж.Т., Пенья С.Дж., Уокер Д.М., Пирпиниас С.Т., Гиз К.Г., Рамакришнан С., Дейссерот К., Нестлер Э.Дж. (март 2016 г.). «Визуализация in vivo идентифицирует временную подпись средних шипистых нейронов D1 и D2 в вознаграждении за кокаин» . Труды Национальной академии наук Соединенных Штатов Америки . 113 (10): 2726–31. Бибкод : 2016PNAS..113.2726C . дои : 10.1073/pnas.1521238113 . ПМК 4791010 . ПМИД 26831103 .
Повышенная активность мезолимбической дофаминовой системы является центральным механизмом, лежащим в основе подкрепляющего и вознаграждающего действия наркотиков, вызывающих злоупотребление, включая кокаин, а также навязчивого поиска наркотиков, который развивается с течением времени и характеризует состояние зависимости (10–12). Действие дофамина при NAc опосредовано преимущественно за счет активации дофаминовых рецепторов D1 или D2, которые экспрессируются преимущественно неперекрывающимися популяциями средних шипистых нейронов (MSN) (13). Эти два подтипа MSN оказывают противоположные эффекты на поведение: оптогенетическая активация нейронов типа D1 способствует положительному подкреплению и усиливает формирование ассоциаций вознаграждения и контекста кокаина, а активация нейронов типа D2 является аверсивной и снижает вознаграждение за кокаин (14, 15). ; соответствующие различия в поведенческих реакциях наблюдаются в ответ на агонисты или антагонисты рецепторов D1 и D2 (16). ... Предыдущая работа продемонстрировала, что оптогенетическая стимуляция MSN D1 способствует вознаграждению, тогда как стимуляция MSN D2 вызывает отвращение.
- ^ Венцель Дж. М., Раушер Н. А., Чер Дж. Ф., Олесон Э. Б. (январь 2015 г.). «Роль фазового высвобождения дофамина в прилежащем ядре в кодировании отвращения: обзор нейрохимической литературы» . ACS Химическая нейронаука . 6 (1): 16–26. дои : 10.1021/cn500255p . ПМЦ 5820768 . ПМИД 25491156 .
Таким образом, стимулы, вызывающие страх, способны по-разному изменять фазовую передачу дофамина в субрегионах NAcc. Авторы предполагают, что наблюдаемое увеличение дофамина оболочки NAcc, вероятно, отражает общую мотивационную значимость, возможно, из-за облегчения состояния страха, вызванного CS, когда не проводится УЗИ (шок для ног). Это рассуждение подтверждается отчетом Будыгина и его коллег. 112 показывая, что у анестезированных крыс прекращение зажима хвоста приводит к увеличению высвобождения дофамина в панцире.
- ^ Перейти обратно: а б Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 10: Нейронный и нейроэндокринный контроль внутренней среды». В Сидоре А., Брауне Р.Ю. (ред.). Молекулярная нейрофармакология: фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. п. 266. ИСБН 978-0-07-148127-4 .
Дофамин действует в прилежащем ядре, придавая мотивационное значение стимулам, связанным с вознаграждением.
- ^ Перейти обратно: а б с Саламоне Дж.Д., Пардо М., Йон С.Е., Лопес-Крус Л., СанМигель Н., Корреа М. (2016). «Мезолимбический дофамин и регуляция мотивированного поведения». Актуальные темы поведенческой нейронауки . 27 : 231–57. дои : 10.1007/7854_2015_383 . ISBN 978-3-319-26933-7 . ПМИД 26323245 .
Значительное количество данных указывает на то, что прилежащий DA важен для павловского подхода и перехода от павловского к инструментальному [(PIT)] ... PIT - это поведенческий процесс, который отражает влияние павловских условных стимулов (CS) на инструментальную реакцию. Например, представление Павловской CS в сочетании с едой может увеличить результативность инструментального поведения, подкрепляемого едой, такого как нажатие рычага. PIT, специфичный для результата, возникает, когда павловский безусловный стимул (US) и инструментальное подкрепление являются одним и тем же стимулом, тогда как общий PIT, как говорят, возникает, когда павловский US и подкрепление различны. ... Более поздние данные показывают, что прилежащее ядро и оболочка, по-видимому, опосредуют различные аспекты PIT; Поражения оболочки и инактивация уменьшали PIT, специфичный для исхода, тогда как основные поражения и инактивация подавляли общий PIT (Corbit and Balleine 2011). Эти различия между ядром и оболочкой, вероятно, обусловлены различными анатомическими входами и паллидными выходами, связанными с этими прилежащими субрегионами (Root et al. 2015). Эти результаты позволили Корбиту и Баллейну (2011) предположить, что прилежащее ядро опосредует общие возбуждающие эффекты сигналов, связанных с вознаграждением. PIT обеспечивает фундаментальный поведенческий процесс, посредством которого условные стимулы могут оказывать активирующее воздействие на инструментальную реакцию.
- ^ Перейти обратно: а б с Корбит Л.Х., Баллейн Б.В. (2016). «Обучающие и мотивационные процессы, способствующие павловско-инструментальному переносу и их нейронные основы: дофамин и не только». Актуальные темы поведенческой нейронауки . 27 : 259–89. дои : 10.1007/7854_2015_388 . ISBN 978-3-319-26933-7 . ПМИД 26695169 .
Такие эффекты предполагают, что определенные мотивационные состояния контролируют возбуждающее воздействие павловских процессов стимулирования на инструментальную производительность... Поведенческие данные подтверждаются доказательствами того, что отдельные нейронные цепи, сосредоточенные в ядре и оболочке NAc, опосредуют общие и специфические формы передачи, соответственно, и Продолжающаяся работа начинает объяснять, как павловские и инструментальные процессы обучения, которые происходят независимо и в разное время, интегрируются в нейронные цепи, управляющие поведенческим контролем.
- ^ Перейти обратно: а б с д Черасс Y, Ураде Y (ноябрь 2017 г.). «Диетический цинк действует как модулятор сна» . Международный журнал молекулярных наук . 18 (11): 2334. doi : 10.3390/ijms18112334 . ПМЦ 5713303 . ПМИД 29113075 .
Совсем недавно лаборатория Фуллера также обнаружила, что сон может способствовать активации гамма-аминомасляной кислоты (ГАМКергической) популяции нейронов, расположенных в парафациальной зоне [11,12], в то время как роль ГАМКергических A2AR-экспрессирующих нейронов прилежащего ядра [13] и полосатого тела только что были обнаружены [14,15].
- ^ Перейти обратно: а б с д и ж г Валенсия Гарсия S, Форт P (февраль 2018 г.). «Прилежащее ядро, новая область регулирования сна посредством интеграции мотивационных стимулов» . Акта Фармакологика Синика . 39 (2): 165–166. дои : 10.1038/aps.2017.168 . ПМК 5800466 . ПМИД 29283174 .
Прилежащее ядро состоит из контингента нейронов, специфически экспрессирующих подтип постсинаптического А2А-рецептора (А2AR), что делает их возбудимыми аденозином, его естественным агонистом, наделенным мощными свойствами, способствующими сну [4]. ... В обоих случаях значительная активация нейронов, экспрессирующих A2AR, в NAc способствует медленному сну (SWS) за счет увеличения количества и продолжительности эпизодов. ... После оптогенетической активации ядра наблюдалось аналогичное продвижение SWS, тогда как при активации нейронов, экспрессирующих A2AR, внутри оболочки не наблюдалось никаких существенных эффектов.
- ^ Перейти обратно: а б с д и ж г Оиси Ю, Сюй Ц, Ван Л, Чжан Б.Дж., Такахаши К., Таката Ю, Луо Ю.Дж., Черасс Ю., Шиффманн С.Н., де Керхове д'Эксарде А., Ураде Ю., Цюй ВМ, Хуан З.Л., Лазарус М. (сентябрь 2017 г.). «Медленноволновой сон контролируется подмножеством основных нейронов прилежащего ядра у мышей» . Природные коммуникации . 8 (1): 734. Бибкод : 2017NatCo...8..734O . дои : 10.1038/s41467-017-00781-4 . ПМК 5622037 . ПМИД 28963505 .
Здесь мы показываем, что хемогенетическая или оптогенетическая активация возбуждающих нейронов непрямого пути, экспрессирующих аденозиновый рецептор A2A, в центральной области NAc сильно индуцирует медленноволновой сон. Хемогенетическое ингибирование нейронов непрямого пути NAc предотвращает индукцию сна, но не влияет на гомеостатический отскок сна.
- ^ Перейти обратно: а б с Юань XS, Ван Л, Донг Х, Цюй ВМ, Ян С.Р., Черасс Ю, Лазарь М, Шиффманн С.Н., д'Эксерд АК, Ли RX, Хуан ЗЛ (октябрь 2017 г.). «Нейроны 2А-рецепторов контролируют сон в активном периоде через нейроны парвальбумина во внешнем бледном шаре» . электронная жизнь . 6 : e29055. doi : 10.7554/eLife.29055 . ПМЦ 5655138 . ПМИД 29022877 .
- ^ Швинбахер И., Фендт М., Ричардсон Р., Шницлер Х.У. (ноябрь 2004 г.). «Временная инактивация прилежащего ядра нарушает приобретение и выражение испуга, вызванного страхом, у крыс». Исследования мозга . 1027 (1–2): 87–93. дои : 10.1016/j.brainres.2004.08.037 . ПМИД 15494160 . S2CID 18338111 .
- ^ Перейти обратно: а б Зубиета Дж. К., Столер К.С. (март 2009 г.). «Нейробиологические механизмы реакции плацебо» . Анналы Нью-Йоркской академии наук . 1156 (1): 198–210. Бибкод : 2009NYASA1156..198Z . дои : 10.1111/j.1749-6632.2009.04424.x . ПМК 3073412 . ПМИД 19338509 .
- ^ Басар К., Сесия Т., Гроневеген Х., Штайнбуш Х.В., Виссер-Вандевалле В., Темель Й. (декабрь 2010 г.). «Прилежащее ядро и импульсивность». Прогресс нейробиологии . 92 (4): 533–57. doi : 10.1016/j.pneurobio.2010.08.007 . ПМИД 20831892 . S2CID 16964212 .
- ^ Гипсон С.Д., Купчик Ю.М., Каливас П.В. (январь 2014 г.). «Быстрая, преходящая синаптическая пластичность при зависимости» . Нейрофармакология . 76 Часть Б: 276–86. doi : 10.1016/j.neuropharm.2013.04.032 . ПМК 3762905 . ПМИД 23639436 .
В рамках упрощенной схемы PFC-NAc-VTA NAc служит «воротами», через которые информация о направлении поведенческих сигналов обрабатывается от лимбической коры к моторным подсхемам. Считается, что переход к компульсивному поиску наркотиков возникает из-за нарушения способности этой подсхемы эффективно обрабатывать информацию о негативных обстоятельствах окружающей среды, что приводит к неспособности подавлять преобладающие реакции, связанные с наркотиками; таким образом, наркоман становится склонным к рецидивам.
Рисунок 1. Глутаматергические афференты к прилежащему ядру, участвующие в аддиктивном поведении. - ^ Перейти обратно: а б с Ягер Л.М., Гарсия А.Ф., Вунш А.М., Фергюсон С.М. (август 2015 г.). «Все тонкости полосатого тела: роль в наркозависимости» . Нейронаука . 301 : 529–541. doi : 10.1016/j.neuroscience.2015.06.033 . ПМЦ 4523218 . ПМИД 26116518 .
[Стриатум] получает дофаминергические сигналы из вентральной покрышки (VTA) и черной субстанции (SNr), а также глутаматергические сигналы из нескольких областей, включая кору, гиппокамп, миндалевидное тело и таламус (Swanson, 1982; Phillipson and Griffiths, 1985; Финч, 1996; Гроеневеген и др., 1999; Бритт и др., 2012). Эти глутаматергические входы вступают в контакт с головками дендритных отростков стриарных ГАМКергических средних шипиковых проекционных нейронов (MSN), тогда как дофаминергические входы синапсируются на шейке позвоночника, обеспечивая важное и сложное взаимодействие между этими двумя входами при модуляции активности MSN... Следует также отметить, что существует небольшая популяция нейронов в NAc, которые коэкспрессируют как рецепторы D1, так и D2, хотя это в основном ограничено оболочкой NAc (Bertran-Gonzalez et al., 2008). ... Нейроны в подразделениях ядра NAc и оболочки NAc также различаются функционально. Ядро NAc участвует в обработке условных раздражителей, тогда как оболочка NAc более важна в обработке безусловных раздражителей; Классически считается, что эти две популяции полосатого MSN оказывают противоположные эффекты на продукцию базальных ганглиев. Активация dMSN вызывает чистое возбуждение таламуса, что приводит к возникновению положительной кортикальной обратной связи; тем самым действуя как сигнал «инициировать» поведение. Однако активация iMSN вызывает общее торможение таламической активности, что приводит к образованию отрицательной кортикальной обратной связи и, следовательно, служит «тормозом» для подавления поведения... появляется также все больше свидетельств того, что iMSN играют роль в мотивации и зависимости ( Лобо и Нестлер, 2011; Грютер и др., 2013). ... В совокупности эти данные позволяют предположить, что iMSN обычно сдерживают поведение, связанное с употреблением наркотиков, и рекрутирование этих нейронов на самом деле может защищать от развития компульсивного употребления наркотиков.
- ^ Перейти обратно: а б с д и ж г час я дж к Робисон А.Дж., Нестлер Э.Дж. (октябрь 2011 г.). «Транскрипционные и эпигенетические механизмы зависимости» . Обзоры природы. Нейронаука . 12 (11): 623–37. дои : 10.1038/nrn3111 . ПМЦ 3272277 . ПМИД 21989194 .
ΔFosB напрямую связан с некоторыми видами поведения, связанными с зависимостью... Важно отметить, что генетическая или вирусная сверхэкспрессия ΔJunD, доминантно-негативного мутанта JunD, который противодействует ΔFosB- и другой AP-1-опосредованной транскрипционной активности, в NAc или OFC блокирует эту Ключевые последствия воздействия наркотиков 14,22–24 . Это указывает на то, что ΔFosB одновременно необходим и достаточен для многих изменений, вызываемых в мозге хроническим воздействием наркотиков. ΔFosB также индуцируется в NAc MSN D1-типа при хроническом потреблении нескольких натуральных вознаграждений, включая сахарозу, пищу с высоким содержанием жиров, секс, бег на колесах, где он способствует этому потреблению. 14,26–30 . Это предполагает участие ΔFosB в регуляции естественного вознаграждения в нормальных условиях и, возможно, во время патологических состояний, подобных привыканию. ... 95% нейронов NAc представляют собой ГАМКергические MSN (нейроны со средними шипами), которые в дальнейшем можно дифференцировать на те MSN, которые экспрессируют рецептор дофамина D1 (MSN типа D1) и экспрессируют динорфин и вещество P, и те, которые экспрессируют дофамин D2. рецептор (MSN типа D2) и экспрессируют энкефалин 132 . Лекарственная индукция ΔFosB 133,134 , а влияние ΔFosB и G9a на морфологию и поведение клеток различается между MSN типа D1 и типа D2. 135 , и нейрональная активность этих двух типов клеток вызывает противоположные эффекты на полезные свойства кокаина. 131 . ... Около 1–2% нейронов NAc представляют собой аспидные крупные холинергические интернейроны, которые, как было показано, играют важную роль в вознаграждении за кокаин. 130 и такое же количество составляют ГАМКергические интернейроны, функции которых менее изучены.
- ^ Перейти обратно: а б с д и Блюм К., Вернер Т., Карнес С., Карнес П., Боуиррат А., Джордано Дж., Оскар-Берман М., Голд М. (2012). «Секс, наркотики и рок-н-ролл: гипотеза об общей мезолимбической активации как функции полиморфизма гена вознаграждения» . Журнал психоактивных препаратов . 44 (1): 38–55. дои : 10.1080/02791072.2012.662112 . ПМК 4040958 . ПМИД 22641964 .
Было обнаружено, что ген deltaFosB в NAc имеет решающее значение для усиления эффекта сексуального вознаграждения. Питчерс и его коллеги (2010) сообщили, что сексуальный опыт вызывает накопление DeltaFosB в нескольких лимбических областях мозга, включая NAc, медиальную префронтальную кору, VTA, хвостатое ядро и скорлупу, но не в медиальном преоптическом ядре. Затем индукцию c-Fos, нижележащей (подавленной) мишени DeltaFosB, измеряли у сексуально опытных и наивных животных. Количество клеток c-Fos-IR, индуцированных спариванием, было значительно снижено у сексуально опытных животных по сравнению с контрольной группой, не подвергавшейся сексуальному насилию. Наконец, уровнями DeltaFosB и его активностью в NAc манипулировали с помощью вирусно-опосредованного переноса генов для изучения его потенциальной роли в опосредовании сексуального опыта и облегчении сексуальной активности, вызванном опытом. Животные со сверхэкспрессией DeltaFosB демонстрировали повышенное облегчение сексуальной деятельности при наличии сексуального опыта по сравнению с контрольной группой. Напротив, экспрессия DeltaJunD, доминантно-негативного партнера по связыванию DeltaFosB, ослабляла облегчение сексуальной активности, вызванное сексуальным опытом, и задерживала долгосрочное поддержание облегчения по сравнению с группой со сверхэкспрессией DeltaFosB. В совокупности эти данные подтверждают критическую роль экспрессии DeltaFosB в NAc в усилении эффектов сексуального поведения и облегчении сексуальной деятельности, вызванном сексуальным опытом. ...как наркомания, так и сексуальная зависимость представляют собой патологические формы нейропластичности наряду с возникновением аберрантного поведения, включающего каскад нейрохимических изменений, главным образом в схемах вознаграждения мозга.
- ^ Гото Ю., О'Доннелл П. (февраль 2001 г.). «Синхронная активность гиппокампа и прилежащего ядра in vivo» . Журнал неврологии . 21 (4): RC131. doi : 10.1523/jneurosci.21-04-j0003.2001 . ПМЦ 6762233 . ПМИД 11160416 .
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 6: Широко распространенные системы: моноамины, ацетилхолин и орексин». В Сидоре А., Брауне Р.Ю. (ред.). Молекулярная нейрофармакология: фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. стр. 175–176. ISBN 978-0-07-148127-4 .
В головном мозге гистамин синтезируется исключительно нейронами, тела которых расположены в туберомаммиллярном ядре (TMN), расположенном в заднем гипоталамусе. У человека на каждой стороне имеется около 64 000 гистаминергических нейронов. Эти клетки проецируются по всему головному и спинному мозгу. Области, которые получают особенно плотные проекции, включают кору головного мозга, гиппокамп, неостриатум, прилежащее ядро, миндалевидное тело и гипоталамус. ... Хотя наиболее изученной функцией гистаминовой системы головного мозга является регуляция сна и пробуждения, гистамин также участвует в обучении и памяти ... Также оказывается, что гистамин участвует в регуляции питания и энергетического баланса.
- ^ Барро М., Сесак С.Р., Жорж Ф., Пистис М., Хонг С., Джоу Т.С. (октябрь 2012 г.). «Тормозная дофаминовая система: новая основная структура ГАМК для мезолимбической и нигростриарной функций» . Журнал неврологии . 32 (41): 14094–101. doi : 10.1523/JNEUROSCI.3370-12.2012 . ПМЦ 3513755 . ПМИД 23055478 .
- ^ Ферре С., Луис С., Жюстинова З., Кирос С., Орру М., Наварро Г., Канела Э.И., Франко Р., Гольдберг С.Р. (июнь 2010 г.). «Взаимодействие аденозин-каннабиноидных рецепторов. Влияние на функцию полосатого тела» . Бр. Дж. Фармакол . 160 (3): 443–453. дои : 10.1111/j.1476-5381.2010.00723.x . ПМЦ 2931547 . ПМИД 20590556 .
Два класса MSN, которые однородно распределены в полосатом теле, можно дифференцировать по их выходной связности и экспрессии дофаминовых и аденозиновых рецепторов и нейропептидов. В дорсальном полосатом теле (в основном представленном хвостатым ядром-скорлупой) энкефалинэргические MSN соединяют полосатое тело с бледным шаром (латеральным бледным шаром) и экспрессируют пептид энкефалин и высокую плотность дофаминовых D2- и аденозиновых А2А-рецепторов (они также экспрессируют аденозиновые рецепторы). А1-рецепторы), в то время как динорфинергические MSN соединяют полосатое тело с черной субстанцией (компактная и сетчатая части) и энтопедункулярным ядром (медиальный бледный шар) и экспрессируют пептиды динорфин и вещество Р, а также дофамин D1 и аденозин А1, но не рецепторы А2А... Эти два разных фенотипа MSN также присутствуют в вентральном полосатом теле (в основном представленном прилежащим ядром и обонятельным бугорком). Однако, хотя они фенотипически равны своим дорсальным аналогам, у них есть некоторые различия с точки зрения связи. Во-первых, не только энкефалинэргические, но и динорфинергические MSN проецируются на вентральный аналог латерального бледного шара, вентральный бледный шар, который фактически имеет характеристики как латерального, так и медиального бледного шара в своих афферентных и эфферентных связях. Помимо вентрального бледного тела, медиального бледного шара и черной субстанции-VTA, вентральное полосатое тело посылает проекции на расширенную миндалевидное тело, латеральный гипоталамус и покрышкообразное ядро ножки. ... Также важно отметить, что небольшой процент MSN имеет смешанный фенотип и экспрессирует рецепторы как D1, так и D2 (Surmeier et al., 1996).
- ^ Ниси А., Куроива М., Шуто Т. (июль 2011 г.). «Механизмы модуляции передачи сигналов рецептора дофамина d (1) в нейронах полосатого тела» . Передний Нейроанат . 5 : 43. дои : 10.3389/fnana.2011.00043 . ПМК 3140648 . ПМИД 21811441 .
Дофамин играет решающую роль в регуляции психомоторных функций мозга (Bromberg-Martin et al., 2010; Cools, 2011; Gerfen and Surmeier, 2011). Рецепторы дофамина представляют собой суперсемейство гептаспиральных рецепторов, связанных с G-белком, и сгруппированы в две категории: D1-подобные (D1, D5) и D2-подобные (D2, D3, D4) рецепторы, в зависимости от функциональных свойств стимулировать аденилатциклазу. (AC) через Gs/olf и для ингибирования AC через Gi/o соответственно... Было продемонстрировано, что рецепторы D1 образуют гетероолигомер с рецепторами D2, и что гетероолигомер рецептора D1–D2 предпочтительно соединяется с Gq. Передача сигналов /PLC (Rashid et al., 2007a,b). Экспрессия дофаминовых рецепторов D1 и D2 в значительной степени разделена в нейронах прямого и непрямого пути в дорсальном полосатом теле соответственно (Gerfen et al., 1990; Hersch et al., 1995; Heiman et al., 2008). Однако известно, что некоторая часть средних шиповатых нейронов экспрессирует рецепторы как D1, так и D2 (Hersch et al., 1995). Анализ экспрессии генов с использованием метода RT-PCR для отдельных клеток показал, что 40% нейронов со средними шипами экспрессируют мРНК рецепторов D1 и D2 (Surmeier et al., 1996).
- ^ Перейти обратно: а б с д и ж Шираяма Ю., Чаки С. (октябрь 2006 г.). «Нейрохимия прилежащего ядра и ее связь с депрессией и антидепрессивным действием у грызунов» . Современная нейрофармакология . 4 (4): 277–91. дои : 10.2174/157015906778520773 . ПМЦ 2475798 . ПМИД 18654637 .
- ^ Мередит Г.Е., Аголия Р., член парламента от искусств, Груневеген Х.Дж., Зам Д.С. (сентябрь 1992 г.). «Морфологические различия между проекционными нейронами ядра и оболочки прилежащего ядра крысы». Нейронаука . 50 (1): 149–62. дои : 10.1016/0306-4522(92)90389-j . ПМИД 1383869 . S2CID 11278705 .
- ^ Перейти обратно: а б с Мередит Дж.Э., Пеннарц К.М. , Гроневеген Х.Дж. (1993). «Клеточная основа химической передачи сигналов в прилежащем ядре». Химическая передача сигналов в базальных ганглиях . Прогресс в исследованиях мозга. Том. 99. стр. 3–24. дои : 10.1016/s0079-6123(08)61335-7 . ISBN 978-0-444-81562-0 . ПМИД 7906426 .
- ^ Перейти обратно: а б с д Берридж К.К., Крингельбах М.Л. (май 2015 г.). «Системы удовольствия в мозге» . Нейрон . 86 (3): 646–64. дои : 10.1016/j.neuron.2015.02.018 . ПМЦ 4425246 . ПМИД 25950633 .
- ^ Балики М.Н., Мансур А., Бария А.Т., Хуанг Л., Бергер С.Е., Филдс Х.Л., Апкариан А.В. (октябрь 2013 г.). «Разделение прилежащего человека на предполагаемое ядро и оболочку диссоциирует кодирование ценностей вознаграждения и боли» . Журнал неврологии . 33 (41): 16383–93. doi : 10.1523/JNEUROSCI.1731-13.2013 . ПМЦ 3792469 . ПМИД 24107968 .
Недавние данные показывают, что инактивация рецепторов D2 в непрямом стриатопаллидном пути у грызунов необходима как для приобретения, так и для выражения аверсивного поведения, а активация рецептора D1 прямого пути контролирует обучение, основанное на вознаграждении (Hikida et al., 2010; Hikida et al. ., 2013). Кажется, мы можем заключить, что прямые и непрямые пути NAc, через рецепторы D1 и D2, выполняют различные роли ожидания и оценки в оболочке и ядре NAc, что согласуется с наблюдениями относительно пространственной сегрегации и разнообразия ответов дофаминергических нейронов среднего мозга. для условий вознаграждения и отвращения, некоторые из которых кодируют мотивационную ценность, другие — мотивационную значимость, каждый из которых связан с разными сетями мозга и играет различную роль в мотивационном контроле (Бромберг-Мартин и др., 2010; Коэн и др., 2012; Ламмель и др., 2013). ... Таким образом, предыдущие результаты в сочетании с текущими наблюдениями подразумевают, что ответ pshell NAc отражает сигнал прогнозирования/ожидания или значимости, а ответ pcore NAc представляет собой ответ оценки (прогнозирующий сигнал вознаграждения), который сигнализирует об отрицательном значении подкрепления. прекращения боли (т.е. ожидаемой анальгезии).
- ^ Перейти обратно: а б Картони Э., Пуглиси-Аллегра С., Бальдассар Дж. (ноябрь 2013 г.). «Три принципа действия: павловско-инструментальная гипотеза переноса» . Границы поведенческой нейронауки . 7 : 153. дои : 10.3389/fnbeh.2013.00153 . ПМЦ 3832805 . ПМИД 24312025 .
- ^ Ричард Дж.М., Кастро, округ Колумбия, Дифеликантонио АГ, Робинсон М.Дж., Берридж К.К. (ноябрь 2013 г.). «Картирование мозговых цепей вознаграждения и мотивации: по стопам Энн Келли» . Неврологические и биоповеденческие обзоры . 37 (9 ч. А): 1919–31. doi : 10.1016/j.neubiorev.2012.12.008 . ПМК 3706488 . ПМИД 23261404 .
- ^ Берридж К.К., Робинсон Т.Э., Олдридж Дж.В. (февраль 2009 г.). «Анализ компонентов вознаграждения: «нравится», «желать» и учиться» . Современное мнение в фармакологии . 9 (1): 65–73. дои : 10.1016/j.coph.2008.12.014 . ПМК 2756052 . ПМИД 19162544 .
- ^ Перейти обратно: а б Нестлер Э.Дж. (декабрь 2013 г.). «Клеточная основа памяти при наркомании» . Диалоги в клинической неврологии . 15 (4): 431–43. doi : 10.31887/DCNS.2013.15.4/enestler . ПМЦ 3898681 . ПМИД 24459410 .
НЕСМОТРЯ НА ЗНАЧИМОСТЬ МНОЖЕСТВЕННЫХ ПСИХОСОЦИАЛЬНЫХ ФАКТОРОВ, ПО СВОЕЙ ОСНОВЕ, НАРКОТИКИЯ ВКЛЮЧАЕТ БИОЛОГИЧЕСКИЙ ПРОЦЕСС: способность многократного воздействия злоупотребляемого наркотика вызывать изменения в уязвимом мозге, которые приводят к компульсивному поиску и приему наркотиков и потере контроля. над употреблением наркотиков, которые определяют состояние наркомании. ... Большой объем литературы продемонстрировал, что такая индукция ΔFosB в нейронах NAc D1-типа увеличивает чувствительность животного к лекарству, а также к естественным вознаграждениям и способствует самостоятельному приему лекарства, предположительно посредством процесса положительного подкрепления ... Например субрегионы оболочки и ядра NAc демонстрируют различия в синаптической пластичности, индуцированной лекарственными средствами, как и средние шипистые нейроны типа D1 и D2 внутри каждого субрегиона. 60,63,64,67
- ^ Думитриу Д., Лаплант К., Гроссман Ю.С., Диас К., Янссен В.Г., Руссо С.Дж., Моррисон Дж.Х., Нестлер Э.Дж. (май 2012 г.). «Субрегиональная, дендритная компартмента и специфичность подтипа шипов в регуляции кокаином дендритных шипов в прилежащем ядре» . Журнал неврологии . 32 (20): 6957–66. doi : 10.1523/JNEUROSCI.5718-11.2012 . ПМК 3360066 . ПМИД 22593064 .
Стойкое изменение плотности позвоночника в ядре, но не в оболочке, хорошо согласуется с устоявшейся идеей о том, что оболочка преимущественно участвует в развитии зависимости, в то время как ядро опосредует долгосрочное выполнение усвоенного поведения, связанного с зависимостью (Ito et al., 2004). Ди Кьяра, 2002; Мередит и др., 2008). В соответствии с идеей о том, что ядро NAc является локусом длительной нейропластичности, вызванной лекарствами, несколько исследований показали, что электрофизиологические изменения в ядре сохраняются дольше, чем в их аналогах в оболочке. ... Более того, представленные здесь данные подтверждают идею о том, что оболочка NAc преимущественно участвует в немедленном вознаграждении за прием препарата, тогда как ядро может играть более явную роль в долгосрочных аспектах зависимости.
- ^ Понтьери Ф.Е., Танда Дж., Ди Кьяра Дж. (декабрь 1995 г.). «Внутривенное введение кокаина, морфия и амфетамина преимущественно увеличивает внеклеточный дофамин в «оболочке» по сравнению с «ядром» прилежащего ядра крысы» . Труды Национальной академии наук Соединенных Штатов Америки . 92 (26): 12304–8. Бибкод : 1995PNAS...9212304P . дои : 10.1073/pnas.92.26.12304 . JSTOR 2369093 . ПМК 40345 . ПМИД 8618890 .
- ^ Перейти обратно: а б с Ди Кьяра Дж. (декабрь 2002 г.). «Дофамин в прилежащем ядре: дифференциальная роль в поведении и зависимости». Поведенческие исследования мозга . 137 (1–2): 75–114. дои : 10.1016/s0166-4328(02)00286-3 . ПМИД 12445717 . S2CID 54410118 .
- ^ Эйден Л.Е., Вэйхэ Э. (январь 2011 г.). «VMAT2: динамический регулятор функции моноаминергических нейронов мозга, взаимодействующий с наркотиками» . Анналы Нью-Йоркской академии наук . 1216 (1): 86–98. Бибкод : 2011NYASA1216...86E . дои : 10.1111/j.1749-6632.2010.05906.x . ПМЦ 4183197 . ПМИД 21272013 .
VMAT2 является везикулярным транспортером ЦНС не только для биогенных аминов DA, NE, EPI, 5-HT и HIS, но, вероятно, также для следовых аминов TYR, PEA и тиронамина (THYR). ЦНС млекопитающих можно было бы идентифицировать как нейроны, экспрессирующие VMAT2 для хранения и биосинтетический фермент декарбоксилазу ароматических аминокислот (AADC).
- ^ Барро М., Маринелли М., Абрус Д.Н., Руже-Пон Ф., Ле Моал М., Пьяцца П.В. (март 2000 г.). «Дофаминергическая гиперчувствительность оболочки прилежащего ядра является гормонозависимой». Европейский журнал неврологии . 12 (3): 973–9. дои : 10.1046/j.1460-9568.2000.00996.x . ПМИД 10762327 . S2CID 6111417 .
- ^ Акияма Г., Икеда Х., Мацузаки С., Сато М., Морибе С., Косикава Н., Кулс А.Р. (июнь 2004 г.). «рецепторы GABAA и GABAB в оболочке прилежащего ядра по-разному модулируют поворотное поведение, опосредованное рецепторами дофамина и ацетилхолина». Нейрофармакология . 46 (8): 1082–8. doi : 10.1016/j.neuropharm.2004.02.007 . ПМИД 15111014 . S2CID 25631633 .
- ^ Смит-Роу С.Л., Садегян К., Келли А.Е. (август 1999 г.). «Пространственное обучение и работоспособность в лабиринте радиальных рукавов ухудшаются после блокады рецепторов N-метил-D-аспартата (NMDA) в субрегионах полосатого тела». Поведенческая нейронаука . 113 (4): 703–17. дои : 10.1037/0735-7044.113.4.703 . ПМИД 10495079 .
- ^ Гиртлер С., Бон И., Хаубер В. (март 2005 г.). «Участие рецепторов NMDA и AMPA/KA в ядре прилежащего ядра в инструментальном обучении, управляемом сигналами, прогнозирующими вознаграждение». Европейский журнал неврологии . 21 (6): 1689–702. дои : 10.1111/j.1460-9568.2005.03983.x . ПМИД 15845096 . S2CID 14206373 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д Олсен CM (декабрь 2011 г.). «Естественные награды, нейропластичность и ненаркотическая зависимость» . Нейрофармакология . 61 (7): 1109–22. doi : 10.1016/j.neuropharm.2011.03.010 . ПМК 3139704 . ПМИД 21459101 .
Перекрестная сенсибилизация также является двунаправленной, поскольку прием амфетамина в анамнезе облегчает сексуальное поведение и усиливает связанное с этим увеличение NAc DA... Как описано в отношении пищевого вознаграждения, сексуальный опыт также может привести к активации сигнальных каскадов, связанных с пластичностью. Транскрипционный фактор delta FosB увеличивается в NAc, PFC, дорсальном полосатом теле и VTA после повторного сексуального поведения (Wallace et al., 2008; Pitchers et al., 2010b). Это естественное увеличение дельта-FosB или вирусная сверхэкспрессия дельта-FosB в NAc модулирует сексуальную активность, а блокада NAc дельта-FosB ослабляет это поведение (Hedges et al., 2009; Pitchers et al., 2010b). Кроме того, вирусная сверхэкспрессия дельта-FosB усиливает обусловленное предпочтение места в сочетании с сексуальным опытом (Hedges et al., 2009). ...
Таблица 1 - ^ Дэй Джей Джей, Карелли Р.М. (апрель 2007 г.). «Прилежащее ядро и Павловское вознаграждение за обучение» . Нейробиолог . 13 (2): 148–59. дои : 10.1177/1073858406295854 . ПМК 3130622 . ПМИД 17404375 .
В соответствии с другими сообщениями (Никола и др., 2004; Таха и Филдс, 2006), преобладающей реакцией нейронов NAc на инфузию сахарозы было снижение активности (рис. 2). Как видно на рисунке 2, те же нейроны демонстрировали противоположные реакции, когда аверсивный раствор хинина вводился внутрь полости рта. Одна из гипотез предполагает, что торможение, наблюдаемое во время доставки вознаграждения, происходит среди ГАМК-содержащих нейронов NAc, которые проецируются на важные двигательные области, такие как вентральное паллидум (VP).
- ^ Карлесон В.А., Томас М.Дж. (2009). «Биологические субстраты вознаграждения и отвращения: гипотеза активности прилежащего ядра» . Нейрофармакология . 56 (Приложение 1): 122–32. doi : 10.1016/j.neuropharm.2008.06.075 . ПМЦ 2635333 . ПМИД 18675281 .
В совокупности эти исследования предоставили два важнейших доказательства, которые сыграли важную роль в формулировке нашей текущей рабочей гипотезы: во-первых, дофамин-зависимое вознаграждение ослабляется блокадой D2-подобных рецепторов, которые являются ингибирующими рецепторами, экспрессируемыми преимущественно в НАЦ на МСН непрямого пути; и, во-вторых, события, которые, как ожидается, уменьшат общую возбудимость NAc (например, стимуляция Gi-связанных опиоидных рецепторов, снижение стимуляции возбуждающих NMDA-рецепторов, снижение возбуждающего воздействия) достаточны для вознаграждения. Эта интерпретация привела к разработке модели вознаграждения, в которой критическим событием является снижение активации MSN в NAc.
- ^ Коста В.Д., Ланг П.Дж., Сабатинелли Д., Версаче Ф., Брэдли М.М. (сентябрь 2010 г.). «Эмоциональные образы: оценка удовольствия и возбуждения в схеме вознаграждения мозга» . Картирование человеческого мозга . 31 (9): 1446–57. дои : 10.1002/hbm.20948 . ПМК 3620013 . ПМИД 20127869 .
- ^ Сабатинелли Д., Брэдли М.М., Ланг П.Дж., Коста В.Д., Версаче Ф. (сентябрь 2007 г.). «Удовольствие, а не значимость активирует прилежащее ядро человека и медиальную префронтальную кору». Журнал нейрофизиологии . 98 (3): 1374–9. дои : 10.1152/jn.00230.2007 . ПМИД 17596422 . S2CID 14938485 .
- ^ Могенсон Г.Дж., Джонс Д.Л., Йим Сай (1980). «От мотивации к действию: функциональный интерфейс между лимбической системой и двигательной системой». Прогресс нейробиологии . 14 (2–3): 69–97. дои : 10.1016/0301-0082(80)90018-0 . ПМИД 6999537 . S2CID 14029796 .
- ^ Харт Дж., Люнг Б.К., Баллейн Б.В. (февраль 2014 г.). «Дорсальный и вентральный потоки: особая роль субрегионов полосатого тела в приобретении и выполнении целенаправленных действий» . Нейробиология обучения и памяти . 108 : 104–18. дои : 10.1016/j.nlm.2013.11.003 . ПМЦ 4661143 . ПМИД 24231424 .
- ^ Кастро, округ Колумбия, Коул С.Л., Берридж К.К. (2015). «Роль латерального гипоталамуса, прилежащего ядра и вентрального паллидума в еде и голоде: взаимодействие между гомеостатическими схемами и схемами вознаграждения» . Границы системной нейронауки . 9 : 90. дои : 10.3389/fnsys.2015.00090 . ПМЦ 4466441 . ПМИД 26124708 .
- ^ Берридж К.К., Крингельбах М.Л. (июнь 2013 г.). «Нейронаука аффекта: мозговые механизмы удовольствия и неудовольствия» . Современное мнение в нейробиологии . 23 (3): 294–303. дои : 10.1016/j.conb.2013.01.017 . ПМЦ 3644539 . ПМИД 23375169 .
- ^ Инь Х.Х., Остлунд С.Б., Баллейн Б.В. (октябрь 2008 г.). «Обучение, ориентированное на вознаграждение, помимо дофамина в прилежащем ядре: интегративные функции сетей кортико-базальных ганглиев» . Европейский журнал неврологии . 28 (8): 1437–48. дои : 10.1111/j.1460-9568.2008.06422.x . ПМК 2756656 . ПМИД 18793321 .
- ^ Соарес-Кунья К, Коимбра Б, Соуза Н, Родригес АЖ (сентябрь 2016 г.). «Переоценка полосатых D1- и D2-нейронов при вознаграждении и отвращении» (PDF) . Неврологические и биоповеденческие обзоры . 68 : 370–386. doi : 10.1016/j.neubiorev.2016.05.021 . hdl : 1822/47044 . ПМИД 27235078 . S2CID 207092810 .
- ^ Соарес-Кунья К, Коимбра Б, Домингес А.В., Васконселос Н., Соуза Н., Родригес А.Х. (19 апреля 2018 г.). «Микросхема прилежащего ядра, лежащая в основе увеличения мотивации, вызванного D2-MSN» . эНейро . 5 (2): ЭНЕВРО.0386–18.2018. дои : 10.1523/ENEURO.0386-18.2018 . ПМЦ 5957524 . ПМИД 29780881 .
Оптогенетическая активация D2-MSN снижала активность вентрального паллидума (VP), снижая ингибирующий тон VTA, что приводило к увеличению дофаминергической активности. Важно отметить, что оптогенетическая активация терминалей D2-MSN в ВП была достаточной, чтобы резюмировать усиление мотивации.
- ^ Феррис К.Ф., Кулкарни П., Салливан Дж.М., Хардер Дж.А., Мессенджер Т.Л., Фебо М. (январь 2005 г.). «Сосание щенка более полезно, чем кокаин: данные функциональной магнитно-резонансной томографии и трехмерного компьютерного анализа» . Журнал неврологии . 25 (1): 149–56. arXiv : 1510.02343 . doi : 10.1523/jneurosci.3156-04.2005 . ПМК 6725197 . ПМИД 15634776 .
- ^ Нуман М. (январь 2007 г.). «Мотивационные системы и нейронные схемы материнского поведения крыс» . Развивающая психобиология . 49 (1): 12–21. дои : 10.1002/dev.20198 . ПМИД 17186513 .
- ^ Глокер М.Л., Ланглебен Д.Д., Рупарел К., Лугхед Дж.В., Вальдес Дж.Н., Гриффин М.Д., Сахсер Н., Гур Р.К. (июнь 2009 г.). «Детская схема модулирует систему вознаграждения мозга у нерожавших женщин» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (22): 9115–9. Бибкод : 2009PNAS..106.9115G . дои : 10.1073/pnas.0811620106 . JSTOR 40482823 . ПМК 2690007 . ПМИД 19451625 .
- ^ Перейти обратно: а б Хайман С.Е., Маленка Р.К., Нестлер Э.Дж. (2006). «Нейральные механизмы зависимости: роль обучения и памяти, связанных с вознаграждением». Ежегодный обзор неврологии . 29 : 565–98. дои : 10.1146/annurev.neuro.29.051605.113009 . ПМИД 16776597 .
- ^ Штайнер Х., Ван Ваес В. (январь 2013 г.). «Регуляция генов, связанных с зависимостью: риски воздействия усилителей когнитивных функций по сравнению с другими психостимуляторами» . Прогресс нейробиологии . 100 : 60–80. дои : 10.1016/j.pneurobio.2012.10.001 . ПМЦ 3525776 . ПМИД 23085425 .
- ^ Перейти обратно: а б Раффл Дж.К. (ноябрь 2014 г.). «Молекулярная нейробиология зависимости: о чем вообще (Δ)FosB?». Американский журнал о злоупотреблении наркотиками и алкоголем . 40 (6): 428–37. дои : 10.3109/00952990.2014.933840 . ПМИД 25083822 . S2CID 19157711 .
ΔFosB является важным фактором транскрипции, участвующим в молекулярных и поведенческих путях развития зависимости после неоднократного воздействия наркотиков. Образование ΔFosB во многих областях мозга и молекулярный путь, ведущий к образованию комплексов AP-1, хорошо изучены. Установление функционального назначения ΔFosB позволило продолжить определение некоторых ключевых аспектов его молекулярных каскадов, включая такие эффекторы, как GluR2 (87,88), Cdk5 (93) и NFkB (100). Более того, многие из этих выявленных молекулярных изменений теперь напрямую связаны со структурными, физиологическими и поведенческими изменениями, наблюдаемыми после хронического воздействия наркотиков (60,95,97,102). Новые горизонты исследований молекулярной роли ΔFosB были открыты благодаря эпигенетическим исследованиям, а недавние достижения проиллюстрировали роль ΔFosB, действующего на ДНК и гистоны, действительно как молекулярный переключатель (34).
- ^ Kanehisa Laboratories (29 октября 2014 г.). «Алкоголизм – Homo sapiens (человек)» . Путь КЕГГ . Проверено 31 октября 2014 г.
- ^ Ким Ю, Тейлан М.А., Барон М., Сэндс А., Нэрн А.С., Грингард П. (февраль 2009 г.). «Индуцированное метилфенидатом образование дендритных шипов и экспрессия DeltaFosB в прилежащем ядре» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (8): 2915–20. Бибкод : 2009PNAS..106.2915K . дои : 10.1073/pnas.0813179106 . ПМК 2650365 . ПМИД 19202072 .
- ^ Питчерс К.К., Виалу В., Нестлер Э.Дж., Лавиолетт С.Р., Леман М.Н., Кулен Л.М. (февраль 2013 г.). «Естественные и лекарственные вознаграждения действуют на общие механизмы нейронной пластичности, при этом ΔFosB является ключевым медиатором» . Журнал неврологии . 33 (8): 3434–42. doi : 10.1523/JNEUROSCI.4881-12.2013 . ПМЦ 3865508 . ПМИД 23426671 .
Злоупотребление наркотиками вызывает нейропластичность в естественном пути вознаграждения, в частности в прилежащем ядре (NAc), тем самым вызывая развитие и проявление аддиктивного поведения. ... В совокупности эти результаты показывают, что злоупотребление наркотиками и естественное поведение вознаграждения действуют на общие молекулярные и клеточные механизмы пластичности, которые контролируют уязвимость к наркозависимости, и что эта повышенная уязвимость опосредована ΔFosB и его нижестоящими мишенями транскрипции. ... Сексуальное поведение приносит большое удовлетворение (Tenk et al., 2009), а сексуальный опыт вызывает сенсибилизированное поведение, связанное с наркотиками, включая перекрестную сенсибилизацию к двигательной активности, индуцированной амфетамином (Amph) (Bradley and Meisel, 2001; Pitchers et al. ., 2010a) и повышенное вознаграждение Amph (Pitchers et al., 2010a). Более того, сексуальный опыт вызывает нейронную пластичность NAc, аналогичную той, которая вызывается воздействием психостимуляторов, включая увеличение плотности дендритных отростков (Meisel and Mullins, 2006; Pitchers et al., 2010a), изменение трафика глутаматных рецепторов и снижение синаптической силы в префронтальной коре. -отвечающие нейроны оболочки NAc (Pitchers et al., 2012). Наконец, было обнаружено, что периоды воздержания от сексуального опыта имеют решающее значение для усиления вознаграждения Amph, спиногенеза NAc (Pitchers et al., 2010a) и торговли глутаматными рецепторами (Pitchers et al., 2012). Эти результаты показывают, что естественное и лекарственное вознаграждение имеют общие механизмы нейронной пластичности.
- ↑ Мозговые электроды помогают лечить депрессию. Архивировано 16 марта 2012 г. в Wayback Machine , Technology Review , 26 апреля 2007 г.
- ^ Беверник Б.Х., Хюрлеманн Р., Матуш А., Кайзер С., Груберт С., Хадрисевич Б., Аксмахер Н., Лемке М., Купер-Махкорн Д., Коэн М.Х., Брокманн Х., Ленарц Д., Штурм В., Шлепфер Т.Э. (январь 2010 г.). «Глубокая стимуляция прилежащего мозга снижает уровень депрессии и тревоги при резистентной к лечению депрессии». Биологическая психиатрия . 67 (2): 110–6. doi : 10.1016/j.biopsych.2009.09.013 . ПМИД 19914605 . S2CID 26242126 .
- ^ Оомс П., Мантионе М., Фиги М., Шуурман П.Р., ван ден Мункхоф П., Денис Д. (февраль 2014 г.). «Глубокая стимуляция мозга при обсессивно-компульсивных расстройствах: долгосрочный анализ качества жизни». Журнал неврологии, нейрохирургии и психиатрии . 85 (2): 153–8. дои : 10.1136/jnnp-2012-302550 . ПМИД 23715912 . S2CID 54572260 .
- ^ «Спорная хирургия при зависимости сжигает центр удовольствия мозга», автор Майя Салавиц. 13 декабря 2012 г.
- ^ «Китай запрещает необратимую процедуру на мозге», автор Замиска Николас. 28 апреля 2008 г. The Wall Street Journal.
- ^ Скотт DJ, Столер К.С., Эгнатук CM, Ван Х, Кеппе Р.А., Зубьета Дж.К. (июль 2007 г.). «Индивидуальные различия в реакции на вознаграждение объясняют ожидания и эффекты, вызванные плацебо» . Нейрон . 55 (2): 325–36. дои : 10.1016/j.neuron.2007.06.028 . ПМИД 17640532 .
- «Идентифицирована область мозга, ответственная за эффект плацебо» . ЭврекАлерт! (Пресс-релиз). 18 июля 2007 г.
Внешние ссылки
[ редактировать ]- Роль ядра лежит в цепи вознаграждения. Часть книги «Мозг сверху вниз». на сайте thebrain.mcgill.ca.
- Nucleus Accumbens - клеточно-центрированная база данных
- Окрашенные изображения срезов мозга, включающие «прилежащее ядро% 20», в проекте BrainMaps.





