Цитотоксические Т-клетки

Цитотоксическая Т-клетка известная как TC ( также , цитотоксический Т-лимфоцит , CTL , Т-киллерная клетка , цитолитическая Т-клетка , CD8 + Т-клетка или Т-клетка-киллер ) — это Т-лимфоцит (тип лейкоцита ), который убивает раковые клетки, клетки, инфицированные внутриклеточными патогенами (такими как вирусы или бактерии), или клетки, поврежденные другими способами. [1]
Большинство цитотоксических Т-клеток экспрессируют Т-клеточные рецепторы (TCR), которые могут распознавать специфический антиген . Антиген — это молекула, способная стимулировать иммунный ответ и часто вырабатываемая раковыми клетками , вирусами, бактериями или внутриклеточными сигналами. Антигены внутри клетки связываются с молекулами MHC класса I и переносятся на поверхность клетки молекулой MHC класса I, где они могут быть распознаны Т-клеткой. Если TCR специфичен для этого антигена, он связывается с комплексом молекулы MHC класса I и антигена, и Т-клетка разрушает клетку.
Чтобы TCR мог связаться с молекулой MHC класса I, первый должен сопровождаться гликопротеином , который CD8 связывается с постоянной частью молекулы MHC класса I. Поэтому эти Т-клетки называются CD8. + Т-клетки .
Сродство - между CD8 и молекулой MHC обеспечивает тесную связь TC клетки и клетки-мишени во время антигенспецифической активации. CD8 + Т-клетки распознаются как Т - клетки после их активации и обычно классифицируются как имеющие заранее определенную цитотоксическую роль в иммунной системе. Однако CD8 + Т-клетки также обладают способностью вырабатывать некоторые цитокины , такие как TNF-α и IFN-γ , обладающие противоопухолевым и противомикробным действием.
Разработка
[ редактировать ]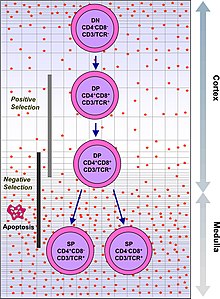
Иммунная система должна распознавать миллионы потенциальных антигенов. В организме человека менее 30 000 генов, поэтому невозможно иметь по одному гену на каждый антиген. Вместо этого ДНК в миллионах лейкоцитов в костном мозге перемешивается, создавая клетки с уникальными рецепторами, каждый из которых может связываться с различным антигеном. Некоторые рецепторы связываются с тканями самого человеческого тела, поэтому, чтобы организм не атаковал сам себя, эти самореактивные лейкоциты уничтожаются во время дальнейшего развития в тимусе , в котором йод необходим для его развития и деятельности. [2]
TCR состоят из двух частей, обычно альфа- и бета-цепи. (Некоторые TCR имеют гамма- и дельта-цепи. Им свойственно противодействовать стрессу и составлять часть эпителиального барьера. [3] ). Гемопоэтические стволовые клетки костного мозга мигрируют в тимус , где они подвергаются V(D)J-рекомбинации своей ДНК TCR бета-цепи с образованием развивающейся формы белка TCR, известной как пре-TCR. Если эта перегруппировка успешна, клетки затем перестраивают свою ДНК TCR альфа-цепи, чтобы создать функциональный комплекс альфа-бета TCR. Этот высоковариабельный продукт генетической перестройки в генах TCR помогает создавать миллионы различных Т-клеток с разными TCR, помогая иммунной системе организма реагировать практически на любой белок захватчика. Подавляющее большинство Т-клеток экспрессируют альфа-бета-TCR (αβ-Т-клетки), но некоторые Т-клетки в эпителиальных тканях (например, в кишечнике) экспрессируют гамма-дельта-TCR ( гамма-дельта-Т-клетки ), которые распознают небелковые антигены. Последние характеризуются способностью распознавать непредставленные антигены. Кроме того, они могут распознавать микробные белки токсического шока и белки стресса собственных клеток. [4] Т-γδ-клетки обладают широкой функциональной пластичностью после распознавания инфицированных или трансформированных клеток, поскольку способны продуцировать цитокины (IFN-γ, TNF-α, IL-17) и хемокины (IP-10, лимфотактин), запускать цитолиз клеток-мишеней. (перфорины, гранзимы...) и взаимодействуют с другими клетками, такими как эпителиальные клетки, моноциты, дендритные клетки, нейтрофилы и В-клетки. При некоторых инфекциях, таких как цитомегаловирус человека , происходит клональная экспансия периферических γδ Т-клеток, имеющих специфические TCR, что указывает на адаптивный характер иммунного ответа, опосредованного этими клетками. [5]
Т-клетки с функционально стабильными TCR экспрессируют CD4 и CD8 корецепторы и поэтому называются «двойно-положительными» (DP) Т-клетками (CD4 + CD8 + ). Дважды положительные Т-клетки подвергаются воздействию широкого спектра аутоантигенов в тимусе и проходят два критерия отбора:
- позитивный отбор , при котором те дважды положительные Т-клетки, которые связываются с чужеродным антигеном в присутствии собственного MHC. Они дифференцируются в CD4 + или CD8 + в зависимости от того, какой MHC связан с представленным антигеном (MHC1 для CD8, MHC2 для CD4). В этом случае клеткам был бы представлен антиген в контексте MHC1. Позитивный отбор означает отбор тех TCR, которые способны распознавать собственные молекулы MHC.
- негативный отбор , при котором те дважды положительные Т-клетки, которые слишком сильно связываются с MHC, представленными аутоантигенами , подвергаются апоптозу , поскольку в противном случае они могли бы стать аутореактивными, что приводит к аутоиммунитету .
Положительно отбираются только те Т-клетки, которые слабо связываются с комплексами MHC-аутоантиген. Те клетки, которые выдерживают позитивный и негативный отбор, дифференцируются в одноположительные Т-клетки (либо CD4 + или CD8 + ), в зависимости от того, распознает ли их TCR антиген, представленный MHC класса I (CD8), или антиген, представленный MHC класса II (CD4). Это CD8 + Т-клетки, которые созревают и становятся цитотоксическими Т-клетками после их активации антигеном, ограниченным классом I.
Активация
[ редактировать ]Этот раздел может сбивать с толку или быть неясным для читателей . ( Август 2023 г. ) |

Т-клетки проходят разные стадии в зависимости от того, сколько раз они контактировали с антигеном. В первую очередь, наивные Т-лимфоциты — это те клетки, которые еще не встретили антиген в тимусе. Затем Т-лимфоциты становятся Т-клетками памяти. К этому типу Т-клеток относятся те, которые хотя бы один раз контактировали с антигеном, но впоследствии вернулись в спокойное или неактивное состояние, готовые снова ответить на антиген, против которого они были стимулированы. Наконец, когда запускается специфический иммунный ответ, эти наивные Т-клетки и Т-клетки памяти активируются, давая начало эффекторным Т-клеткам, способным убивать патогены или опухолевые клетки. [6] [7]
Порог активации этих клеток очень высок, и процесс может происходить по двум путям: тимус-независимым (с помощью инфицированных АПК ) или тимус-зависимым (с помощью CD4+ Т-клеток ). При независимом от тимуса пути, поскольку APC инфицирован, он сильно активируется и экспрессирует большое количество корецепторов для коактивации. Если APC не инфицированы, необходимо задействовать клетки CD4: либо для активации APC путем совместной стимуляции (более распространенный вариант), либо для прямой активации Tc-клетки путем секреции IL-2 .
Если происходит активация, лимфоцит поляризует свои гранулы в направлении синапса и высвобождает их, производя «смертельный удар». В этот момент он отделяется от целевой клетки и может переходить к другой, и еще одной. Клетка-мишень погибает примерно через 6 часов, обычно в результате апоптоза. [8]
MHC класса I экспрессируется всеми клетками- хозяевами , за исключением безъядерных , таких как эритроциты . Когда эти клетки инфицированы внутриклеточным патогеном , клетки разрушают чужеродные белки посредством процессинга антигена . В результате образуются пептидные фрагменты, некоторые из которых презентируются MHC класса I рецептору Т-клеточного антигена (TCR) на CD8. + Т-клетки.
Активация цитотоксических Т-клеток зависит от нескольких одновременных взаимодействий между молекулами, экспрессируемыми на поверхности Т-клетки, и молекулами на поверхности антигенпрезентирующей клетки (АПК). Например, рассмотрим модель двух сигналов для активации TC - клеток.
| Сигнал | Т-клетка | БТР | Описание |
| Первый сигнал | ТКР | связанная с пептидом MHC класса I, молекула | происходит второе взаимодействие Между корецептором CD8 и молекулой MHC класса I для стабилизации этого сигнала. |
| Второй сигнал | Молекула CD28 на Т-клетке | либо CD80 , либо CD86 (также называемые B7-1 и B7-2) | CD80 и CD86 известны как костимуляторы активации Т-клеток. Этому второму сигналу можно помочь (или заменить) путем стимуляции Т - клеток цитокинами, высвобождаемыми Т-хелперными клетками . |
Простая активация наивного CD8 + Т-клетки требуют взаимодействия с профессиональными антигенпрезентирующими клетками, главным образом со зрелыми дендритными клетками . Чтобы генерировать Т-клетки долговременной памяти и обеспечивать повторяющуюся стимуляцию цитотоксических Т-клеток, дендритные клетки должны взаимодействовать с обоими активированными CD4. + Т-хелперы и CD8 + Т-клетки. [9] [7] Во время этого процесса CD4 + Т-хелперы «лицензируют» дендритные клетки на передачу мощного активирующего сигнала наивному CD8. + Т-клетки. [10] Это лицензирование антигенпрезентирующих клеток CD4 + Т-хелперные клетки действуют путем передачи сигналов между CD154/CD40L на Т-хелперной клетке и рецептором CD40 на антигенпрезентирующей клетке во время образования иммунологического синапса. [11]
Хотя в большинстве случаев активация зависит от распознавания антигена TCR, были описаны альтернативные пути активации. Например, было показано, что цитотоксические Т-клетки активируются при воздействии на них других Т-клеток CD8, что приводит к толеризации последних. [12]
После активации Т - клетка подвергается клональной экспансии с помощью цитокина интерлейкина 2 (IL-2), который является фактором роста и дифференцировки Т-клеток. Это увеличивает количество клеток, специфичных для целевого антигена, которые затем могут путешествовать по организму в поисках антиген-положительных соматических клеток .
Эффекторные функции
[ редактировать ]При воздействии инфицированных/дисфункциональных соматических клеток Т - клетки выделяют цитотоксины перфорин , гранзимы и гранулизин . Под действием перфорина гранзимы проникают в цитоплазму клетки-мишени, и их функция сериновой протеазы запускает каспазный каскад, представляющий собой серию цистеиновых протеаз, которые в конечном итоге приводят к апоптозу (запрограммированной гибели клеток). Это называется «летальным ударом» и позволяет наблюдать волнообразную гибель клеток-мишеней. [13] Благодаря высокому порядку липидов и отрицательно заряженному фосфатидилсерину, присутствующему в их плазматической мембране, Т С- клетки устойчивы к воздействию цитотоксинов перфорина и гранзима. [14]
Второй способ индуцировать апоптоз - это взаимодействие клеточной поверхности между TC и инфицированной клеткой. Когда TC активируется , он начинает экспрессировать поверхностный белок- лиганд FAS (FasL)(Apo1L)(CD95L), который может связываться с молекулами Fas (Apo1)(CD95), экспрессируемыми на клетке-мишени. Однако считается, что это взаимодействие Fas-Fas-лиганда более важно для избавления от нежелательных Т-лимфоцитов во время их развития или для литической активности определенных Т - клеток, чем для цитолитической активности эффекторных клеток TC . Взаимодействие Fas с FasL позволяет рекрутировать сигнальный комплекс, индуцированный смертью (DISC). [15] Домен смерти, ассоциированный с Fas (FADD), транслоцируется вместе с DISC, позволяя рекрутировать прокаспазы 8 и 10. [15] Эти каспазы затем активируют эффекторные каспазы 3, 6 и 7, что приводит к расщеплению субстратов смерти, таких как ламин А , ламин В1, ламин В2, PARP ( поли-АДФ-рибозо-полимераза ) и ДНК-PKcs (ДНК-активируемая протеинкиназа). . Конечным результатом является апоптоз клетки, экспрессирующей Fas.Т-клетки CD8 также могут проявлять смерть клеток, индуцированную активацией, или AICD, опосредованную комплексом рецепторов CD3. Недавно было показано, что белок TLT-1, высвобождаемый тромбоцитами, индуцирует AICD-подобную гибель клеток в CD8 Т-клетках. [16]
Предполагается, что транскрипционный фактор эомезодермин играет ключевую роль в CD8. + Функция Т-клеток, действуя как регуляторный ген в адаптивном иммунном ответе. [17] Исследования, изучающие влияние потери функции эомезодермина, показали, что снижение экспрессии этого транскрипционного фактора приводит к уменьшению количества перфорина, продуцируемого CD8. + Т-клетки. [17]
Роль в патогенезе заболевания
[ редактировать ]В отличие от антител , которые эффективны как против вирусных , так и против бактериальных инфекций, цитотоксические Т-клетки в основном эффективны против вирусов. [18]
Во время заражения вирусом гепатита B (HBV) цитотоксические Т-клетки убивают инфицированные клетки и производят противовирусные цитокины, способные очищать HBV от жизнеспособных гепатоцитов. Они также играют важную патогенетическую роль, способствуя почти всем поражениям печени, связанным с инфекцией HBV. [19] Было показано, что тромбоциты способствуют накоплению вирусспецифических цитотоксических Т-клеток в инфицированной печени. [20] В некоторых исследованиях на мышах инъекции CXCR5+ CD8+T-клеток показали значительное снижение уровня HBsAg . Кроме того, повышение уровня CXCL13 способствовало рекрутированию внутрипеченочных CXCR5+CD8+T-клеток, и эти типы клеток продуцировали высокие уровни HBV-специфического интерферона (IFN)-γ и IL-21 , что может помочь улучшить контроль над вирусом. хроническая инфекция ВГВ. [21]
Цитотоксические Т-клетки участвуют в прогрессировании артрита . Основным проявлением ревматоидного артрита является поражение суставов. Синовиальная оболочка характеризуется гиперплазией , повышенной васкуляризацией и инфильтрацией воспалительных клеток; преимущественно CD4+ Т-лимфоциты, которые являются основными организаторами клеточно-опосредованных иммунных ответов. Согласно различным исследованиям, ревматоидный артрит тесно связан с антигенами главного комплекса гистосовместимости (MHC) класса II. Единственные клетки в организме, которые экспрессируют антигены MHC класса II, являются конститутивными антигенпрезентирующими клетками . Это убедительно свидетельствует о том, что ревматоидный артрит вызван неидентифицированными артритогенными антигенами. Антиген может представлять собой любой экзогенный антиген, такой как вирусные белки, или эндогенный белок. [22] Недавно был идентифицирован ряд возможных эндогенных антигенов, например, гликопротеин хряща человека 39, белок, связывающий тяжелые цепи, и цитруллинированный белок. Активированные CD4+ Т-лимфоциты стимулируют моноциты, макрофаги и синовиальные фибробласты к выработке цитокинов интерлейкин-1 , интерлейкин-6 и фактора некроза опухоли альфа (TNFa), а также к секреции металлопротеиназ. Первые три из них играют ключевую роль в воспалении при ревматоидном артрите. Эти активированные лимфоциты также стимулируют В-клетки к выработке иммуноглобулинов, включая ревматоидный фактор. [23] Их патогенная роль неизвестна, но может быть связана с активацией комплемента посредством образования иммунных комплексов. Более того, несколько исследований на животных показывают, что цитотоксические Т-клетки могут оказывать преимущественно провоспалительное действие при заболевании. Также изучено, что выработка цитокинов клетками CD8+ может ускорить прогрессирование артрита. [24]
CD8 + Было обнаружено, что Т-клетки играют роль в ВИЧ- инфекции. Со временем ВИЧ разработал множество стратегий обхода иммунной системы клетки-хозяина. Например, ВИЧ имеет очень высокую частоту мутаций, что позволяет ему избежать распознавания CD8. + Т-клетки. [25] Они также способны подавлять экспрессию поверхностных белков MHC класса I клеток, которые они заражают, чтобы в дальнейшем избежать разрушения CD8. + Т-клетки. [25] Если CD8 + Т-клетки не могут найти, распознать и связаться с инфицированными клетками, вирус не будет уничтожен и продолжит расти.
Кроме того, CD8 + Т-клетки могут быть вовлечены в развитие диабета 1 типа . [26] Исследования на моделях мышей с диабетом показали, что клетки CD4+ ответственны за массивную инфильтрацию мононуклеарных лейкоцитов в островки поджелудочной железы . Однако было показано, что клетки CD8+ играют эффекторную роль, ответственную за окончательное разрушение островковых бета-клеток. Однако в исследованиях на мышах NOD, несущих нулевую мутацию в локусе бета-2 микроглобулина (B2M) и, следовательно, не имеющих молекул главного комплекса гистосовместимости класса I и CD8+ Т-клеток, было обнаружено, что у них не развивается диабет. [27]
CD8 + Т-клетки могут быть необходимы для лечения периферической нейропатии, вызванной химиотерапией (CIPN). [28] [29] Мыши без CD8 + Т-клетки демонстрируют пролонгированный CIPN по сравнению с нормальными мышами и инъекцией образованного CD8. + Т-клетки разрешают или предотвращают CIPN.
Цитотоксические Т-лимфоциты участвуют в развитии различных заболеваний и расстройств, например, в отторжении трансплантата (цитотоксические Т-лимфоциты атакуют новый орган после обнаружения его как чужеродного из-за различий HLA между донором и реципиентом); [30] при избыточной выработке цитокинов при тяжелой инфекции SARS-CoV-2 (из-за усиленной реакции лимфоцитов генерируется большое количество провоспалительных цитокинов , повреждающих субъекта); [31] [32] воспалительные и дегенеративные заболевания центральной нервной системы, такие как рассеянный склероз (Т-клетки становятся чувствительными к определенным белкам, таким как миелин , атакуя здоровые клетки и привлекая больше иммунных клеток, усугубляя заболевание). [33]
См. также
[ редактировать ]- CTL-опосредованная цитотоксичность
- CD4 + Т-клетки
- Список различных типов клеток в организме взрослого человека
Ссылки
[ редактировать ]- ^ Аль-Шура АН (2020). «Лимфоциты». Передовая гематология в интегрированной сердечно-сосудистой китайской медицине . Эльзевир. стр. 41–46. дои : 10.1016/b978-0-12-817572-9.00007-0 . ISBN 978-0-12-817572-9 . S2CID 241913878 .
Т-хелперы/CD4+ • экспрессируют гликопротеины CD4 на своей клеточной поверхности, которые активируются в присутствии пептидных антигенов на поверхности вторгающихся патогенов; •немедленно реагировать, чтобы защитить иммунную систему; •секретируют различные белки-цитокины в зависимости от иммунного ответа.
- ^ Вентури С., Вентури М. (сентябрь 2009 г.). «Йод, тимус и иммунитет». Питание . 25 (9): 977–979. дои : 10.1016/j.nut.2009.06.002 . ПМИД 19647627 .
- ^ Кабелиц Д., Веш Д. (2003). «Особенности и функции гамма-дельта-Т-лимфоцитов: внимание к хемокинам и их рецепторам». Критические обзоры по иммунологии . 23 (5–6): 339–370. doi : 10.1615/CritRevImmunol.v23.i56.10 . ПМИД 15030305 .
- ^ Десеке М., Принц I (сентябрь 2020 г.). «Распознавание лиганда с помощью γδ TCR и распознавание гомеостаза и стрессовых состояний» . Клеточная и молекулярная иммунология . 17 (9): 914–924. дои : 10.1038/s41423-020-0503-y . ПМК 7608190 . ПМИД 32709926 .
- ^ Тюенгель Дж., Ранчал С., Маслова А., Аулах Г., Пападопулу М., Дрисслер С. и др. (октябрь 2021 г.). «Характеристика адаптивноподобных γδ Т-клеток у младенцев Уганды во время первичной цитомегаловирусной инфекции» . Вирусы . 13 (10): 1987. doi : 10.3390/v13101987 . ПМЦ 8537190 . ПМИД 34696417 .
- ^ Рохас-Эспиноза О (2017). Иммунология (по памяти) (Издание четвертое изд.). Мехико: Médica Panamericana. ISBN 978-968-7988-28-3 . OCLC 1022564980 .
- ^ Jump up to: а б Хойер С., Проммерсбергер С., Пфайффер И.А., Шулер-Турнер Б., Шулер Г., Дорри Дж., Шафт Н. (декабрь 2014 г.). «Одновременное взаимодействие ДК с CD4(+) и CD8(+) Т-клетками улучшает вторичное расширение CTL: для танго нужны трое» . Европейский журнал иммунологии . 44 (12): 3543–3559. дои : 10.1002/eji.201444477 . ПМИД 25211552 . S2CID 5655814 .
- ^ Аббас А.К., Лихтман А.Х., Пиллаи С. (2018). Клеточная и молекулярная иммунология (Девятое изд.). Филадельфия, Пенсильвания. ISBN 978-0-323-52323-3 . OCLC 973917896 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Хивроз С., Шемин К., Турре М., Богинюст А. (2012). «Перекресток между Т-лимфоцитами и дендритными клетками». Критические обзоры по иммунологии . 32 (2): 139–155. doi : 10.1615/CritRevImmunol.v32.i2.30 . ПМИД 23216612 .
- ^ Ланзавеккья А (июнь 1998 г.). «Иммунология. Лицензия на убийство» . Природа . 393 (6684): 413–414. Бибкод : 1998Natur.393..413L . дои : 10.1038/30845 . ПМИД 9623994 .
- ^ Беннетт С.Р., Карбон Ф.Р., Карамалис Ф., Флавелл Р.А., Миллер Дж.Ф., Хит В.Р. (июнь 1998 г.). «Помощь в ответах цитотоксических Т-клеток опосредована передачей сигналов CD40». Природа . 393 (6684): 478–480. Бибкод : 1998Natur.393..478B . дои : 10.1038/30996 . ПМИД 9624004 . S2CID 4325396 .
- ^ Мильштейн О., Хейгин Д., Ласк А., Райх-Целигер С., Шезен Е., Офир Е. и др. (январь 2011 г.). «ЦТЛ реагируют активацией и секрецией гранул, выступая в качестве мишеней для распознавания Т-клеток» . Кровь . 117 (3): 1042–1052. doi : 10.1182/blood-2010-05-283770 . ПМК 3035066 . ПМИД 21045195 .
- ^ Чанг Х.Ф., Бзейх Х., Читирала П., Равичандран К., Слейман М., Краузе Э. и др. (февраль 2017 г.). «Подготовка смертельного удара: взаимодействие экзо- и эндоцитарных путей в цитотоксических Т-лимфоцитах» . Клеточные и молекулярные науки о жизни . 74 (3): 399–408. дои : 10.1007/s00018-016-2350-7 . ПМК 5241346 . ПМИД 27585956 .
- ^ Радд-Шмидт Дж.А., Ходел А.В., Нури Т., Лопес Дж.А., Чо Х.Дж., Вершур С. и др. (ноябрь 2019 г.). «Порядок липидов и заряд защищают Т-клетки-киллеры от случайной гибели» . Природные коммуникации . 10 (1): 5396. Бибкод : 2019NatCo..10.5396R . дои : 10.1038/s41467-019-13385-x . ПМК 6881447 . ПМИД 31776337 .
- ^ Jump up to: а б Бакши Р.К., Кокс М.А., Заджак А.Дж. (2014). «Цитотоксические Т-лимфоциты». Энциклопедия медицинской иммунологии . стр. 332–342. дои : 10.1007/978-0-387-84828-0_36 . ISBN 978-0-387-84827-3 .
- ^ Тьяги, Тарун; и др. (2023). «Продуцируемый тромбоцитами TLT-1 способствует прогрессированию опухоли путем подавления CD8+ Т-клеток» . Журнал экспериментальной медицины . 220 (1). дои : 10.1084/jem.20212218 . ПМЦ 9814191 . ПМИД 36305874 .
- ^ Jump up to: а б Пирс Э.Л., Маллен А.С., Мартинс Г.А., Кравчик С.М., Хатчинс А.С., Зедиак В.П. и др. (ноябрь 2003 г.). «Контроль функции эффекторных CD8+ Т-клеток с помощью транскрипционного фактора эомезодермина». Наука . 302 (5647): 1041–1043. Бибкод : 2003Sci...302.1041P . дои : 10.1126/science.1090148 . ПМИД 14605368 . S2CID 43479181 .
- ^ Кембалл CC, Алирезаи М, Уиттон Дж.Л. (сентябрь 2010 г.). «Вирусы Коксаки типа B и их взаимодействие с врожденной и адаптивной иммунной системой» . Будущая микробиология . 5 (9): 1329–1347. дои : 10.2217/fmb.10.101 . ПМК 3045535 . ПМИД 20860480 .
- ^ Ианнаконе М., Ситиа Г., Гуидотти Л.Г. (2006). «Патогенетические и противовирусные иммунные реакции против вируса гепатита В». Будущая вирусология . 1 (2): 189–96. дои : 10.2217/17460794.1.2.189 .
- ^ Ианнаконе М., Ситиа Г., Исогава М., Марчезе П., Кастро М.Г., Ловенштейн П.Р. и др. (ноябрь 2005 г.). «Тромбоциты опосредуют цитотоксическое повреждение печени, вызванное Т-лимфоцитами» . Природная медицина . 11 (11): 1167–1169. дои : 10.1038/nm1317 . ПМК 2908083 . ПМИД 16258538 .
- ^ Ли Ю, Тан Л, Го Л, Чен С, Гу С, Чжоу Ю и др. (март 2020 г.). «CXCL13-опосредованное рекрутирование внутрипеченочного CXCR5 + CD8 + Т-клетки способствуют вирусному контролю при хронической инфекции HBV» . Journal of Hepatology . 72 (3): 420–430. : 10.1016 /j.jhep.2019.09.031 . PMID 31610223. S2CID doi 204702318 .
- ^ Чанг М.Х., Нигрович П.А. (март 2019 г.). «Антителозависимые и независимые механизмы воспалительного артрита» . JCI-инсайт . 4 (5): e125278. doi : 10.1172/jci.insight.125278 . ПМК 6483516 . ПМИД 30843881 . S2CID 73512236 .
- ^ Коуп А.П., Шульце-Купс Х., Арингер М. (сентябрь 2007 г.). «Центральная роль Т-клеток при ревматоидном артрите» . Клиническая и экспериментальная ревматология . 25 (5 Приложение 46): С4-11. ПМИД 17977483 .
- ^ Карвальейру Х., да Силва Х.А., Соуто-Карнейру М.М. (январь 2013 г.). «Потенциальная роль CD8 (+) Т-клеток при ревматоидном артрите». Обзоры аутоиммунитета . 12 (3): 401–409. дои : 10.1016/j.autrev.2012.07.011 . ПМИД 22841983 .
- ^ Jump up to: а б Гульзар Н., Коупленд К.Ф. (январь 2004 г.). «CD8+ Т-клетки: функция и ответ на ВИЧ-инфекцию». Текущие исследования ВИЧ . 2 (1): 23–37. дои : 10.2174/1570162043485077 . ПМИД 15053338 .
- ^ Цай С., Шамели А., Сантамария П. (2008). «Глава 4 CD8+ Т-клетки при диабете 1 типа». Иммунопатогенез сахарного диабета 1 типа . Достижения иммунологии. Том. 100. С. 79–124. дои : 10.1016/S0065-2776(08)00804-3 . ISBN 9780123743268 . ПМИД 19111164 .
- ^ Ван Б., Гонсалес А., Бенуа С., Матис Д. (август 1996 г.). «Роль CD8+ Т-клеток в инициировании инсулинозависимого сахарного диабета». Европейский журнал иммунологии . 26 (8): 1762–1769. дои : 10.1002/eji.1830260815 . ПМИД 8765018 . S2CID 26229701 .
- ^ Лаумет Г., Эдралин Дж.Д., Данцер Р., Хейнен С.Дж., Кавелаарс А. (июнь 2019 г.). «Цисплатин обучает CD8+ Т-клетки предотвращать и устранять периферическую невропатию, вызванную химиотерапией, у мышей» . Боль . 160 (6): 1459–1468. doi : 10.1097/j.pain.0000000000001512 . ПМК 6527475 . ПМИД 30720585 .
- ^ Круковски К., Эйкелькамп Н., Лаумет Г., Хак К.Э., Ли Ю., Догерти П.М. и др. (октябрь 2016 г.). «CD8+ Т-клетки и эндогенный IL-10 необходимы для разрешения нейропатической боли, вызванной химиотерапией» . Журнал неврологии . 36 (43): 11074–11083. doi : 10.1523/JNEUROSCI.3708-15.2016 . ПМК 5098842 . ПМИД 27798187 .
- ^ Вибе С., Никерсон П.В. (февраль 2020 г.). «Молекулярное несоответствие человеческого лейкоцитарного антигена для стратификации риска реципиентов трансплантата почки». Современное мнение о трансплантации органов . 25 (1): 8–14. doi : 10.1097/MOT.0000000000000714 . ПМИД 31789952 . S2CID 208537995 .
- ^ Чаннаппанавар Р., Перлман С. (июль 2017 г.). «Патогенные коронавирусные инфекции человека: причины и последствия цитокинового шторма и иммунопатология» . Семинары по иммунопатологии . 39 (5): 529–539. дои : 10.1007/s00281-017-0629-x . ПМК 7079893 . ПМИД 28466096 .
- ^ Сарзи-Путтини П., Джорджи В., Сиротти С., Маротто Д., Ардиццоне С., Риццардини Г. и др. (март 2020 г.). «COVID-19, цитокины и иммуносупрессия: чему мы можем научиться из тяжелого острого респираторного синдрома?» . Клиническая и экспериментальная ревматология . 38 (2): 337–342. doi : 10.55563/clinexprheumatol/xcdary . ПМИД 32202240 . S2CID 214609305 .
- ^ Нойманн Х., Медана И.М., Бауэр Дж., Лассманн Х. (июнь 2002 г.). «Цитотоксические Т-лимфоциты при аутоиммунных и дегенеративных заболеваниях ЦНС». Тенденции в нейронауках . 25 (6): 313–319. дои : 10.1016/S0166-2236(02)02154-9 . ПМИД 12086750 . S2CID 12593103 .
Внешние ссылки
[ редактировать ] СМИ, связанные с цитотоксическими Т-клетками, на Викискладе?
СМИ, связанные с цитотоксическими Т-клетками, на Викискладе? - Группа T-cell – Кардиффский университет