Тиолаза
| Тиолаза, N-концевой домен | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Полотенце_н | ||
| Pfam | PF00108 | ||
| InterPro | IPR002155 | ||
| PROSITE | PDOC00092 | ||
| Краткое содержание | 1pxt / scope / supfam | ||
| CDD | CD00751 | ||
| |||
| Тиолаза, С-концевой домен | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Тиолаза_C | ||
| Pfam | PF02803 | ||
| InterPro | IPR002155 | ||
| PROSITE | PDOC00092 | ||
| Краткое содержание | 1pxt / scope / supfam | ||
| |||

Тиолазы , также известные как ацетил-кофермент Ацетилтрансферазы ( ACAT ), представляют собой ферменты, которые преобразуют два единицы ацетил-КоА в ацетоацетил-коа в пути мевалоната .
Тиолазы представляют собой вездесущие ферменты , которые играют ключевую роль во многих жизненно важных биохимических путях, включая путь бета -окисления деградации жирных кислот и различные биосинтетические пути. [ 1 ] Члены семейства тиолазы могут быть разделены на две широкие категории: деградативные тиолазы (EC 2.3.1.16) и биосинтетические тиолазы (EC 2.3.1.9). Эти два различных типа тиолазы обнаруживаются как у эукариот , так и у прокариот : ацетоацетил-коа-тиолаза (EC: 2.3.1.9) и 3-кетоацил-тиолаза (EC: 2.3.1.16). 3-кетоацил-коа- тиолаза (также называемая тиолазой I) имеет широкую специфичность длины цепи для своих субстратов и участвует в деградативных путях, таких как бета-окисление жирных кислот. Ацетоацетил-КоА-тиолаза (также называемая тиолазой II) специфична для тиолиза ацетоацетил -КоА и участвует в биосинтетических путях, таких как синтез бета-гидроксибутирической кислоты или биогенез стероидов .
Образование углерод -углеродной связи является ключевым этапом в биосинтетических путях, с помощью которых жирные кислоты и поликетид производятся тиолазы суперсемейства . Ферменты катализируют образование углерода-углеродости через тиоэфирную конденсацию , зависящую от тиоэфира [ 2 ] Механизм реакции. [ 3 ]
Функция
[ редактировать ]Тиолазы представляют собой семейство эволюционно связанных ферментов . Два разных типа тиолазы [ 4 ] [ 5 ] [ 6 ] встречаются как у эукариот, так и у прокариот: ацетоацетил-коа-тиолаза ( EC 2.3.1.9 ) и 3-кетоацил-коа-тиолаза ( EC 2.3.1.16 ). 3-кетоацил-коа-тиолаза (также называемая тиолазой I) имеет широкую специфичность длины цепи для своих субстратов и участвует в деградативных путях, таких как бета-окисление жирных кислот. Ацетоацетил-КоА-тиолаза (также называемая тиолазой II) специфична для тиолиза ацетоацетил-КоА и участвует в биосинтетических путях, таких как синтез поли-бета-гидроксибутирата или биогенез стероидов.
У эукариот есть две формы 3-кетоацил-коа-тиолазы: одна расположена в митохондрионе, а другая в пероксисомах.
Есть два консервативных остатка цистеина, важные для тиолазной активности. Первые, расположенные в N-концевом участке ферментов, участвуют в образовании промежуточного ацилгмента; Второй, расположенный на С-концевой конечности, является активной основой участка, участвующей в депротонировании в реакции конденсации.
Изозимы
[ редактировать ]| ЕС номер | Имя | Альтернативное имя | Изозимы | Субклеточное распределение |
|---|---|---|---|---|
| EC 2.3.1.9 | Ацетил-КоА C-ацетилтрансфераза | Дерлаза II; Ацетоацетил-коа-тиолаза |
ACAT1 | митохондриальный |
| Acat2 | цитозольный | |||
| EC 2.3.1.16 | Ацетил-КоА C-ацилтрансфераза | тиолаза I; 3-кетоацил-коа-тиолаза; β-кетотиолаза 3-кат |
ACAA1 | пероксисомальный |
| ACAA2 | митохондриальный | |||
| Хэтб | митохондриальный | |||
| EC 2.3.1.154 | Пропионил-КоА C2-триметилтридеканоилтрансфераза | 3-оксопристаноил-коа-тиолаза | ||
| EC 2.3.1.174 | 3-оксоадипил-коа-тиолаза | β-кетоадипил-коа-тиолаза | ||
| EC 2.3.1.176 | Propanoyl-Coa c-actyltransferase | Пероксисомальная тиолаза 2 | SCP2 | пероксисомальный/цитозольный |
Неспецифический белок липид-трансфер (NSL-TP) (также известный как белок-носитель 2 ), который является белком, который, по-видимому, существует в двух разных формах: белок 14 кД (SCP-2) и более крупный белок 58 кД (SCP- x). Первый находится в цитоплазме или митохондриях и участвует в транспорте липидов; Последнее встречается в пероксисомах . С-концевая часть SCP-X идентична SCP-2, в то время как N-концевая часть является эволюционной, связанной с тиолазами. [ 6 ]
Механизм
[ редактировать ]
Тиоэфиры являются более реактивными, чем эфиры кислорода, и являются общими промежуточными продуктами в метаболизме жирного кислоты. [ 7 ] Эти тиоэфиры производятся путем сопряжения жирной кислоты со свободной группой SH пантуинового фрагмента коэнзимента A (COA) или ацильного белка (ACP).
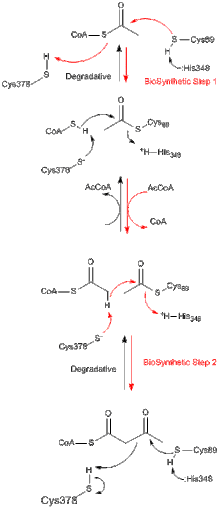
Все тиолазы, независимо от того, являются ли они биосинтетическими или деградирующими in vivo, предпочтительно катализируют деградацию 3-кетоацил-КоА с образованием ацетил-КоА и укороченного вида ацил-КоА, но также способны катализировать обратную конденсации реакцию . Замена энергии Гиббса деградации, которая не зависит от тиолазы, катализирующей реакцию). Из исследований биосинтетической тиолазы из Z. ramigera хорошо известно, что тиолаза возникает в двух шагах и следует за кинетикой пинг-понга. [ 8 ] На первом этапе как деградативных, так и биосинтетических реакций нуклеофильный Cys89 (или его эквивалент) ацирует субстрат ацил-КоА (или 3-кетоацил-CoA), что приводит к образованию ковалентного ацил-анцимана. [ 9 ] На втором этапе добавление COA (в деградативной реакции) или ацетил-КоА (в биосинтетической реакции) к промежуточному промежуточному ацил-анзименту запускает высвобождение продукта из фермента. [ 10 ] Каждый из промежуточных соединений тетраэдрической реакции, которые встречаются во время переноса ацетильной группы в нуклеофильный цистеин, соответственно, наблюдались в рентгеновских кристаллических структурах биосинтетической тиолазы из A. fumigatus. [ 11 ]
Структура
[ редактировать ]Большинство ферментов тиолазной суперсемейства - это димеры . Однако мономеры не наблюдались. Тетрамеры наблюдаются только в подсемействе тиолазы, и в этих случаях димеры димеризированы, чтобы стать тетрамерами. Кристаллическая структура тетрамерной биосинтетической тиолазы из зооглои Рамигера была определена при разрешении 2,0 Å. Структура содержит поразительный и новый «похожий на клетку» мотив тетрамеризации, который позволяет какое-то шарнирное движение двух узких димеров по отношению друг к другу. Тетрамер фермента ацетилирован в Cys89 и имеет молекулу COA, связанную в каждом из ее карманы активного сайта. [ 12 ]
Биологическая функция
[ редактировать ]В эукариотических клетках, особенно в клетках млекопитающих, тиолазы демонстрируют разнообразие внутриклеточной локализации, связанной с их метаболическими функциями, а также в субстратной специфичности. Например, они способствуют окислению β-окисления жирного кислота в пероксисомах и митохондриях , тела кетона в митохондриях, метаболизме [ 13 ] и ранние этапы пути мевалоната в пероксисомах и цитоплазме . [ 14 ] В дополнение к биохимическим исследованиям, анализ генетических расстройств дал понять основу их функций. [ 15 ] Генетические исследования идентифицировали трехиолазную систему в дрожжевой кандида-тропике , которая обладает тиолазной активностью в пероксисомах, где она может участвовать в бета-окислении и в цитозоле, где он участвует в пути мевалоната. [ 16 ] [ 17 ] Тиолаза имеет центральное значение в ключевых ферментативных путях, таких как жирный кислотный, стероидный и поликетный синтез. Подробное понимание его структурной биологии имеет большую медицинскую значимость, например, для лучшего понимания заболеваний, вызванных генетическими недостатками этих ферментов и для развития новых антибиотиков. [ 18 ] Использование сложной каталитической универсальности поликетид -синтаз для синтеза биологически и с медицинской точки зрения натуральных продуктов также является важной будущей перспективой исследований ферментов этой суперсемейства. [ 19 ]
Актуальность заболевания
[ редактировать ]Митохондриальная ацетоацетил-КоА-дефицит тиолазы, известная ранее как дефицит β-кетотиолазы , [ 20 ] является врожденной ошибкой метаболизма, включающей изолециновый катаболизм и метаболизм кетона. Основными клиническими проявлениями этого расстройства являются прерывистый кетоацидоз , но долгосрочные клинические последствия, по-видимому, доброкачественные, недостаточно задокументированы. Митохондриальная ацетоацетил-КоА-дефицит тиолазы легко диагностируется с помощью анализа органических кислот в моче и может быть подтвержден ферментативным анализом культивируемых фибробластов кожи или лейкоцитов крови. [ 21 ]
Дефицит β-кетотиолазы имеет переменную презентацию. Большинство пораженных пациентов присутствуют в возрасте от 5 до 24 месяцев с симптомами тяжелого кетоацидоза. Симптомы могут быть инициированы диетической нагрузкой, инфекцией или лихорадкой. Симптомы переходят от рвоты до обезвоживания и кетоацидоза. [ 22 ] Нейтропения и тромбоцитопения могут присутствовать, как и умеренная гипераммонемия. Глюкоза в крови обычно нормальная, но может быть низким или высоким в острых эпизодах. [ 23 ] Задержка развития может произойти, еще до первого острого эпизода, и двусторонний некроз стриата базальных ганглиев был замечен на МРТ мозга .
Ссылки
[ редактировать ]- ^ Thompson S, Mayerl F, Peoples OP, Masamune S, Sinskey AJ, Walsh CT (июль 1989 г.). «Механистические исследования бета-кетоацил тиолазы из Zoogloea ramigera: идентификация нуклеофила активного сайта как Cys89, его мутация с Ser89 и кинетическая и термодинамическая характеристика ферментов дикого типа и мутантных ферментов». Биохимия . 28 (14): 5735–42. doi : 10.1021/bi00440a006 . PMID 2775734 .
- ^ Хит Р.Дж., Рок Ко (октябрь 2002 г.). «Конденсация Claisen в биологии». Nat Prod rep . 19 (5): 581–96. doi : 10.1039/b110221b . PMID 12430724 .
- ^ Haapalainen AM, Meriläinen G, Wierenga RK (январь 2006 г.). «Суперсемейство тиолазы: конденсирующие ферменты с разнообразной специфичностью реакции». Тенденции Biochem. Наука 31 (1): 64–71. doi : 10.1016/j.tibs.2005.11.011 . PMID 16356722 .
- ^ Baker Me, Billheimer JT, Strauss JF (ноябрь 1991). «Сходство между аминоконцевой частью белка с стеролом млекопитающих (SCPX) и эшерациа-ацетил-коа-ацилтрансфераза (SCPX) и эшетихийской ацилтрансферазой: доказательства слияния гена в SCPX». ДНК -клеточная биол . 10 (9): 695–8. doi : 10.1089/dna.1991.10.695 . PMID 1755959 .
- ^ Ян Си, Ян XY, Хили-Луи Г., Шульц Х., Эльзинга М (июнь 1990 г.). «Нуклеотидная последовательность гена FADA. Первичная структура 3-кетоацил-кофермента тиолазы из Escherichia coli и структурная организация оперона Fadab». Дж. Биол. Химический 265 (18): 10424–9. PMID 2191949 .
- ^ Подпрыгнуть до: а беременный Igual JC, González-Bosch C, Dopazo J, Pérez-Oortín Je (август 1992). «Филогенетический анализ семейства тиолазы. Последствия для эволюционного происхождения пероксисомов». J. Mol. Эвол . 35 (2): 147–55. doi : 10.1007/bf00183226 . PMID 1354266 . S2CID 39746646 .
- ^ Ферментативные механизмы реакции . Сан -Франциско: WH Freeman. 1979. ISBN 978-0-7167-0070-8 .
- ^ Masamune, Satoru; Уолш, Кристофер Т.; Гамбони, Ремо; Томпсон, Стюарт; Дэвис, Джеффри Т.; Уильямс, Саймон Ф.; Народы, Оливер П.; Sinskey, Enthony J.; Уолш, Кристофер Т. (1989). «Конденсация Bio-Claisen, катализируемая тиолазой из зооглои Ramigera. Остатки цистеина активного сайта». J. Am. Химический Соц 111 (5): 1879, 1991. DOI : 10.1021/ja00187a053 .
- ^ Гилберт Х.Ф., Леннокс Б.Дж., Моссман К.Д., Карл В.К. (июль 1981 г.). «Соотношение переноса ацила к общей реакции тиолазы I от свинья сердца». Дж. Биол. Химический 256 (14): 7371–7. PMID 6114098 .
- ^ Mathieu M, Modis Y, Zeelen JP, et al. (Октябрь 1997). «1,8 кристаллическая структура димерной пероксисомальной 3-кетоацил-коа-тиолазы Saccharomyces cerevisiae: последствия для связывания субстрата и механизма реакции» . J. Mol. Биол. 273 (3): 714–28. doi : 10.1006/jmbi.1997.1331 . PMID 9402066 .
- ^ Маршалл, Эндрю С.; Бонд, Чарльз.; Брунинг, Джон Б. (25 января 2018 г.). «Структура цитозольной тиолазы Aspergillus fumigatus: захваченная тетраэдрическая реакция промежуточных продуктов и активация моновалентными катионами». Катализ ACS . 8 (3): 1973–1989. doi : 10.1021/acscatal.7b02873 . HDL : 2440/113865 .
- ^ Модис Y, Wierenga RK (октябрь 1999). «Биосинтетическая тиолаза в комплексе с промежуточным образом реакции: кристаллическая структура дает новое понимание каталитического механизма» . Структура 7 (10): 1279–90. doi : 10.1016/s0969-2126 (00) 80061-1 . PMID 10545327 .
- ^ Мидлтон Б (апрель 1973 г.). «Оксоцил-кофермент тиолазы тканей животных» . Биохимия. J. 132 (4): 717–30. doi : 10.1042/bj1320717 . PMC 1177647 . PMID 4721607 .
- ^ Hovik R, Brodal B, Bartlett K, Osmundsen H (июнь 1991 г.). «Метаболизм ацетил-КоА с помощью изолированных пероксисомальных фракций: образование ацетата и ацетоацетил-КоА» . J. Lipid Res. 32 (6): 993–9. PMID 1682408 .
- ^ Мидлтон Б., Бартлетт К (март 1983 г.). «Синтез и характеристика 2-метилацетоацетилового коэнзимента А и его использование в идентификации сайта дефекта в 2-метилацетоуксом и 2-метил-3-гидроксибутирической ацитурии». Клин Чим. Акт . 128 (2–3): 291–305. doi : 10.1016/0009-8981 (83) 90329-7 . PMID 6133656 .
- ^ Canayama N, Ueda M, Atomi H, Tanaka A (февраль 1998 г.). «Генетическая оценка физиологических функций тииолазы изоферментов в n-nalkalane-assimiling yeatast candidda trapicalis » J. Бактеророл. 180 (3): 690–8 Doi : 10.1128/ jb.180.3.690-6 106940PMC 9457876PMID
- ^ Уэда М., Канаяма Н., Танака А. (2000). «Генетическая оценка пероксисомальных и цитозольных ацетоацетил-коа-тиолазы изозимов у диплоидных дрожжей, ассимилирующих N-алкан, Candida Tropicalis». Клеточная биохимия и биофизика . 32 (весна): 285–290. doi : 10.1385/cbb: 32: 1-3: 285 . PMID 11330060 .
- ^ Прайс AC, Choi KH, Heath RJ, Li Z, White SW, Rock Co (март 2001 г.). «Ингибирование белка-белка-белка бета-кетоацил-ацила синтаз белка тиолактомицина и церулинина. Структура и механизм» . Дж. Биол. Химический 276 (9): 6551–9. doi : 10.1074/jbc.m007101200 . PMID 11050088 .
- ^ Keatinge-Clay AT, Maltby DA, Medzihradszky KF, Khosla C, Stroud RM (сентябрь 2004 г.). «Антибиотические фабрики попали в действие». НАТ Структура Мол Биол . 11 (9): 888–93. doi : 10.1038/nsmb808 . PMID 15286722 . S2CID 12394083 .
- ^ Daum RS, Lamm PH, Mamer OA, Scriver CR (декабрь 1971 г.). «Новое» расстройство изолецинового катаболизма » . Лансет . 2 (7737): 1289–90. doi : 10.1016/s0140-6736 (71) 90605-2 . PMID 4143539 .
- ^ Митчелл Г.А., Фукао Т. (2001). «Врожденные ошибки метаболизма тела кетона». В Scriver CR, Beaudet AL, Sly WS, Valle D (Eds.). Метаболические и молекулярные основы наследственного заболевания . Нью-Йорк: МакГроу-Хилл. С. 2326–2356. ISBN 978-0-07-913035-8 .
- ^ Hillman Re, Keating JP (февраль 1974 г.). «Дефицит бета-кетотиолазы как причина« синдрома кетотической гиперглицинемии » ». Педиатрия . 53 (2): 221–5. PMID 4812006 .
- ^ Робинсон Б.Х., Шервуд В.Г., Тейлор Дж., Балф Дж.В., Мамер О.А. (август 1979 г.). «Дефицит тиолазы ацетоацетила -тиолазы: причина тяжелого кетоацидоза в младенчестве, имитирующий салицилизм». J. Pediatr . 95 (2): 228–33. doi : 10.1016/s0022-3476 (79) 80658-7 . PMID 36452 .
Внешние ссылки
[ редактировать ]- Ацетил-КоА+C-ацетилтрансфераза в Национальной медицинской библиотеке Медицинской библиотеки США (Mesh)
- Обзор всей структурной информации, доступной в PDB для Uniprot : P28790 (3-кетоацил-коа-тиолаза) в PDBE-KB .
- Обзор всей структурной информации, доступной в PDB для Uniprot : Q56WD9 (3-кетоацил-коа-тиолаза 2, пероксисомальная) в PDBE-KB .