Тиолаза
| Тиолаза, N-концевой домен | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Тиолаза_N | ||
| Пфам | PF00108 | ||
| ИнтерПро | ИПР002155 | ||
| PROSITE | PDOC00092 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1pxt / SCOPe / СУПФАМ | ||
| CDD | cd00751 | ||
| |||
| Тиолаза, С-концевой домен | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Тиолаза_C | ||
| Пфам | PF02803 | ||
| ИнтерПро | ИПР002155 | ||
| PROSITE | PDOC00092 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1pxt / SCOPe / СУПФАМ | ||
| |||

Тиолазы , также известные как ацетил-коэнзим А-ацетилтрансферазы ( АСАТ ), представляют собой ферменты, которые превращают две единицы ацетил-КоА в ацетоацетил-КоА по мевалонатному пути .
Тиолазы представляют собой повсеместно встречающиеся ферменты , которые играют ключевую роль во многих жизненно важных биохимических путях, включая путь бета-окисления деградации жирных кислот и различные пути биосинтеза. [ 1 ] Членов семейства тиолаз можно разделить на две широкие категории: деградационные тиолазы (EC 2.3.1.16) и биосинтетические тиолазы (EC 2.3.1.9). Эти два разных типа тиолазы обнаружены как у эукариот , так и у прокариот : ацетоацетил-КоА-тиолаза (EC:2.3.1.9) и 3-кетоацил-КоА-тиолаза (EC:2.3.1.16). 3-кетоацил-КоА- тиолаза (также называемая тиолазой I) обладает широкой специфичностью по отношению к своим субстратам и участвует в путях деградации, таких как бета-окисление жирных кислот. Ацетоацетил-КоА-тиолаза (также называемая тиолазой II) специфична для тиолиза ацетоацетил -КоА и участвует в путях биосинтеза, таких как синтез бета-гидроксимасляной кислоты или биогенез стероидов .
Образование углерод-углеродной связи является ключевым этапом биосинтетического пути жирных кислот и поликетидов образования суперсемейства тиолаз . Ферменты катализируют образование углерод-углеродных связей посредством тиоэфирзависимой конденсации Кляйзена. [ 2 ] механизм реакции. [ 3 ]
Функция
[ редактировать ]Тиолазы представляют собой семейство эволюционно родственных ферментов . Два разных типа тиолазы [ 4 ] [ 5 ] [ 6 ] обнаружены как у эукариот, так и у прокариот: ацетоацетил-КоА-тиолаза ( КФ 2.3.1.9 ) и 3-кетоацил-КоА-тиолаза ( КФ 2.3.1.16 ). 3-кетоацил-КоА-тиолаза (также называемая тиолазой I) обладает широкой специфичностью по отношению к своим субстратам и участвует в путях деградации, таких как бета-окисление жирных кислот. Ацетоацетил-КоА-тиолаза (также называемая тиолазой II) специфична для тиолиза ацетоацетил-КоА и участвует в путях биосинтеза, таких как синтез полибета-гидроксибутирата или биогенез стероидов.
У эукариот существуют две формы 3-кетоацил-КоА-тиолазы: одна расположена в митохондриях, а другая - в пероксисомах.
Есть два консервативных остатка цистеина, важных для тиолазной активности. Первые, расположенные в N-концевом отделе ферментов, участвуют в образовании ацил-ферментного интермедиата; второй, расположенный на С-конце, представляет собой основание активного центра, участвующее в депротонировании в реакции конденсации.
изоферменты
[ редактировать ]| Номер ЕС | Имя | Альтернативное название | изоферменты | Субклеточное распределение |
|---|---|---|---|---|
| ЭК 2.3.1.9 | Ацетил-КоА С-ацетилтрансфераза | тиолаза II; Ацетоацетил-КоА-тиолаза |
ACAT1 | митохондриальный |
| ACAT2 | цитозольный | |||
| ЭК 2.3.1.16 | Ацетил-КоА С-ацилтрансфераза | тиолаза I; 3-кетоацил-КоА-тиолаза; β-кетотиолаза 3-ЭТАЖНЫЙ |
ACAA1 | пероксисомальный |
| ACAA2 | митохондриальный | |||
| ХАДХБ | митохондриальный | |||
| ЭК 2.3.1.154 | Пропионил-КоА С2-триметилтридеканоилтрансфераза | 3-оксопристаноил-КоА-тиолаза | ||
| ЭК 2.3.1.174 | 3-оксоадипил-КоА-тиолаза | β-кетоадипил-КоА-тиолаза | ||
| ЭК 2.3.1.176 | Пропаноил-КоА С-ацилтрансфераза | Пероксисомальная тиолаза 2 | SCP2 | пероксисомальный/цитозольный |
Неспецифический белок-переносчик липидов млекопитающих (nsL-TP) (также известный как белок-переносчик стерола 2 ) представляет собой белок, который, по-видимому, существует в двух разных формах: белок массой 14 кД (SCP-2) и более крупный белок массой 58 кд (SCP-2). х). Первый находится в цитоплазме или митохондриях и участвует в транспорте липидов; последний обнаружен в пероксисомах . С-концевая часть SCP-x идентична SCP-2, тогда как N-концевая часть эволюционно связана с тиолазами. [ 6 ]
Механизм
[ редактировать ]
Тиоэфиры более реакционноспособны, чем эфиры кислорода, и являются обычными промежуточными продуктами метаболизма жирных кислот. [ 7 ] Эти тиоэфиры получают путем конъюгации жирной кислоты со свободной SH-группой пантетеинового фрагмента либо кофермента А (КоА), либо ацильного белка-переносчика (ACP).
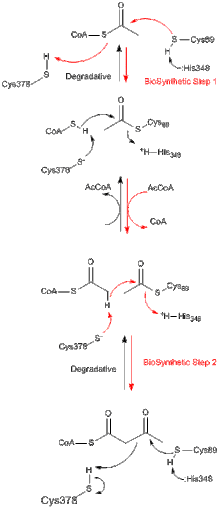
Все тиолазы, независимо от того, являются ли они биосинтетическими или деградирующими in vivo, преимущественно катализируют расщепление 3-кетоацил-КоА с образованием ацетил-КоА и укороченных форм ацил-СоА, но также способны катализировать обратную реакцию конденсации Кляйзена (отражая отрицательную реакцию Изменение энергии Гиббса деградации, независимое от тиолазы, катализирующей реакцию). Из исследований биосинтетической тиолазы Z. ramigera хорошо известно, что тиолазная реакция протекает в две стадии и следует кинетике пинг-понга. [ 8 ] На первом этапе реакций деградации и биосинтеза нуклеофильный Cys89 (или его эквивалент) атакует субстрат ацил-КоА (или 3-кетоацил-КоА), что приводит к образованию ковалентного промежуточного продукта ацил-фермент. [ 9 ] На втором этапе добавление КоА (в реакции деградации) или ацетил-КоА (в реакции биосинтеза) к промежуточному продукту ацил-фермента запускает высвобождение продукта из фермента. [ 10 ] Каждый из тетраэдрических промежуточных продуктов реакции, которые возникают при переносе ацетильной группы к нуклеофильному цистеину и от него соответственно, наблюдался в рентгеновских кристаллических структурах биосинтетической тиолазы A. fumigatus. [ 11 ]
Структура
[ редактировать ]Большинство ферментов суперсемейства тиолаз являются димерами . Однако мономеры не наблюдались. Тетрамеры наблюдаются только в подсемействе тиолаз, и в этих случаях димеры димеризуются, превращаясь в тетрамеры. Кристаллическая структура тетрамерной биосинтетической тиолазы Zoogloea ramigera определена с разрешением 2,0 Å. Структура содержит поразительный и новый «клеточный» мотив тетрамеризации, который допускает некоторое шарнирное движение двух плотных димеров относительно друг друга. Тетрамер фермента ацетилирован по Cys89 и имеет молекулу КоА, связанную с каждой из его молекул. Карманы активного сайта. [ 12 ]
Биологическая функция
[ редактировать ]В эукариотических клетках, особенно в клетках млекопитающих, тиолазы демонстрируют разнообразие внутриклеточной локализации, связанное с их метаболическими функциями, а также субстратной специфичностью. Например, они способствуют β-окислению жирных кислот в пероксисомах и митохондриях , кетоновых тел в митохондриях, метаболизму [ 13 ] и ранние этапы пути мевалоната в пероксисомах и цитоплазме . [ 14 ] Помимо биохимических исследований, анализ генетических нарушений прояснил основу их функций. [ 15 ] Генетические исследования выявили трехтиолазную систему у дрожжей Candidatropicis , которая обладает тиолазной активностью в пероксисомах, где она может участвовать в бета-окислении, и в цитозоле, где она участвует в мевалонатном пути. [ 16 ] [ 17 ] Тиолаза играет центральную роль в ключевых ферментативных путях, таких как синтез жирных кислот, стероидов и поликетидов. Детальное понимание его структурной биологии имеет большое медицинское значение, например, для лучшего понимания заболеваний, вызванных генетическим дефицитом этих ферментов, и для разработки новых антибиотиков. [ 18 ] Использование сложной каталитической универсальности поликетидсинтаз для синтеза биологически и медицински значимых натуральных продуктов также является важной будущей перспективой изучения ферментов этого суперсемейства. [ 19 ]
Актуальность заболевания
[ редактировать ]Дефицит митохондриальной ацетоацетил-КоА-тиолазы, известный ранее как дефицит β-кетотиолазы , [ 20 ] Это врожденная ошибка метаболизма, включающая катаболизм изолейцина и метаболизм кетоновых тел. Основными клиническими проявлениями этого заболевания являются периодический кетоацидоз , но долгосрочные клинические последствия, очевидно, доброкачественные, недостаточно документированы. Дефицит митохондриальной ацетоацетил-КоА-тиолазы легко диагностируется с помощью анализа органических кислот мочи и может быть подтвержден ферментативным анализом культивированных фибробластов кожи или лейкоцитов крови. [ 21 ]
Дефицит β-кетотиолазы имеет вариабельную форму. У большинства больных пациентов в возрасте от 5 до 24 месяцев наблюдаются симптомы тяжелого кетоацидоза. Симптомы могут быть вызваны белковой нагрузкой, инфекцией или лихорадкой. Симптомы прогрессируют от рвоты до обезвоживания и кетоацидоза. [ 22 ] Могут присутствовать нейтропения и тромбоцитопения, а также умеренная гипераммониемия. Уровень глюкозы в крови обычно нормальный, но в острых эпизодах может быть низким или высоким. [ 23 ] Задержка развития может произойти даже до первого острого эпизода, а двусторонний стриарный некроз базальных ганглиев головного мозга выявляется на МРТ .
Ссылки
[ редактировать ]- ^ Томпсон С., Майерл Ф., Пиплс ОП, Масамунэ С., Сински А.Дж., Уолш Коннектикут (июль 1989 г.). «Механистические исследования бета-кетоацилтиолазы из Zoogloea ramigera: идентификация нуклеофила активного центра как Cys89, его мутация на Ser89, а также кинетическая и термодинамическая характеристика ферментов дикого типа и мутантных ферментов». Биохимия . 28 (14): 5735–42. дои : 10.1021/bi00440a006 . ПМИД 2775734 .
- ^ Хит Р.Дж., Rock CO (октябрь 2002 г.). «Конденсация Кляйзена в биологии». Представитель Nat Prod . 19 (5): 581–96. дои : 10.1039/b110221b . ПМИД 12430724 .
- ^ Хаапалайнен А.М., Мериляйнен Г., Виеренга Р.К. (январь 2006 г.). «Суперсемейство тиолаз: конденсирующие ферменты с разнообразной специфичностью реакции». Тенденции биохимии. Наука . 31 (1): 64–71. дои : 10.1016/j.tibs.2005.11.011 . ПМИД 16356722 .
- ^ Бейкер М.Э., Биллхаймер Дж.Т., Штраус Дж.Ф. (ноябрь 1991 г.). «Сходство между аминоконцевой частью белка-переносчика стерола млекопитающих массой 58 кДа (SCPx) и ацетил-КоА-ацилтрансферазой Escherichia coli: свидетельства слияния генов в SCPx». ДНК Клеточная Биол . 10 (9): 695–8. дои : 10.1089/dna.1991.10.695 . ПМИД 1755959 .
- ^ Ян С.Ю., Ян XY, Хили-Луи Дж., Шульц Х., Эльзинга М. (июнь 1990 г.). «Нуклеотидная последовательность гена fadA. Первичная структура 3-кетоацил-кофермента А-тиолазы из Escherichia coli и структурная организация оперона fadAB». Ж. Биол. Хим . 265 (18): 10424–9. ПМИД 2191949 .
- ^ Перейти обратно: а б Игуаль Х.К., Гонсалес-Бош К., Допасо Х., Перес-Ортин Х.Е. (август 1992 г.). «Филогенетический анализ семейства тиолаз. Значение для эволюционного происхождения пероксисом». Дж. Мол. Эвол . 35 (2): 147–55. дои : 10.1007/BF00183226 . ПМИД 1354266 . S2CID 39746646 .
- ^ Механизмы ферментативных реакций . Сан-Франциско: WH Freeman. 1979. ISBN 978-0-7167-0070-8 .
- ^ Масамунэ, Сатору; Уолш, Кристофер Т.; Гамбони, Ремо; Томпсон, Стюарт; Дэвис, Джеффри Т.; Уильямс, Саймон Ф.; Пиплс, Оливер П.; Сински, Энтони Дж.; Уолш, Кристофер Т. (1989). «Био-Кляйзеновская конденсация, катализируемая тиолазой Zoogloea ramigera. Остатки цистеина в активном центре». Дж. Ам. хим. Соц . 111 (5): 1879, 1991. doi : 10.1021/ja00187a053 .
- ^ Гилберт Х.Ф., Леннокс Б.Дж., Моссман К.Д., Карл У.К. (июль 1981 г.). «Связь переноса ацила с общей реакцией тиолазы I из сердца свиньи». Ж. Биол. Хим . 256 (14): 7371–7. ПМИД 6114098 .
- ^ Матье М., Модис Ю., Зелен Дж. П. и др. (октябрь 1997 г.). «Кристаллическая структура 1,8 А димерной пероксисомальной 3-кетоацил-КоА-тиолазы Saccharomyces cerevisiae: значение для связывания субстрата и механизма реакции» . Дж. Мол. Биол. 273 (3): 714–28. дои : 10.1006/jmbi.1997.1331 . ПМИД 9402066 .
- ^ Маршалл, Эндрю С.; Бонд, Чарльз С.; Брюнинг, Джон Б. (25 января 2018 г.). «Структура цитозольной тиолазы Aspergillus fumigatus: захваченные промежуточные тетраэдрические реакции и активация моновалентными катионами». АКС-катализ . 8 (3): 1973–1989. дои : 10.1021/acscatal.7b02873 . hdl : 2440/113865 .
- ^ Модис Ю., Виренга Р.К. (октябрь 1999 г.). «Биосинтетическая тиолаза в комплексе с промежуточным продуктом реакции: кристаллическая структура дает новое понимание каталитического механизма» . Структура . 7 (10): 1279–90. дои : 10.1016/S0969-2126(00)80061-1 . ПМИД 10545327 .
- ^ Миддлтон Б. (апрель 1973 г.). «Оксоацил-кофермент А-тиолазы тканей животных» . Биохим. Дж. 132 (4): 717–30. дои : 10.1042/bj1320717 . ПМЦ 1177647 . ПМИД 4721607 .
- ^ Ховик Р., Бродал Б., Бартлетт К., Осмундсен Х. (июнь 1991 г.). «Метаболизм ацетил-КоА изолированными пероксисомальными фракциями: образование ацетата и ацетоацетил-КоА» . Дж. Липид Рез. 32 (6): 993–9. ПМИД 1682408 .
- ^ Миддлтон Б., Бартлетт К. (март 1983 г.). «Синтез и характеристика 2-метилацетоацетилкоэнзима А и его использование для идентификации места дефекта при 2-метилацетоуксусной и 2-метил-3-гидроксимасляной ацидурии». Клин. Хим. Акта . 128 (2–3): 291–305. дои : 10.1016/0009-8981(83)90329-7 . ПМИД 6133656 .
- ^ Канаяма Н., Уэда М., Атоми Х., Танака А. (февраль 1998 г.). «Генетическая оценка физиологических функций изоферментов тиолазы у н-щелочноассимилирующих дрожжей Candida тропических» . Дж. Бактериол. 180 (3): 690–8. дои : 10.1128/JB.180.3.690–698.1998 . ПМК 106940 . ПМИД 9457876 .
- ^ Уэда М., Канаяма Н., Танака А. (2000). «Генетическая оценка пероксисомальных и цитозольных изоферментов ацетоацетил-КоА-тиолазы в диплоидных дрожжах, ассимилирующих н-алканы, Candidatropicis». Клеточная биохимия и биофизика . 32 (Весна): 285–290. дои : 10.1385/cbb:32:1-3:285 . ПМИД 11330060 .
- ^ Прайс AC, Чой К.Х., Хит Р.Дж., Ли З., Уайт С.В., Рок CO (март 2001 г.). «Ингибирование бета-кетоацил-ацил-синтазы белков-переносчиков тиолактомицином и церуленином. Структура и механизм» . Ж. Биол. Хим . 276 (9): 6551–9. дои : 10.1074/jbc.M007101200 . ПМИД 11050088 .
- ^ Китинг-Клей А.Т., Молтби Д.А., Медзиградски К.Ф., Хосла С., Страуд Р.М. (сентябрь 2004 г.). «Завод по производству антибиотиков в действии». Нат. Структура. Мол. Биол . 11 (9): 888–93. дои : 10.1038/nsmb808 . ПМИД 15286722 . S2CID 12394083 .
- ^ Даум Р.С., Ламм П.Х., Мамер О.А., Скривер Ч.Р. (декабрь 1971 г.). «Новое» нарушение катаболизма изолейцина» . Ланцет . 2 (7737): 1289–90. дои : 10.1016/S0140-6736(71)90605-2 . ПМИД 4143539 .
- ^ Митчелл Г.А., Фукао Т. (2001). «Врожденные нарушения метаболизма кетоновых тел». В Scriver CR, Beaudet AL, Sly WS, Valle D (ред.). Метаболические и молекулярные основы наследственных заболеваний . Нью-Йорк: МакГроу-Хилл. стр. 2326–2356. ISBN 978-0-07-913035-8 .
- ^ Хиллман Р.Э., Китинг Дж.П. (февраль 1974 г.). «Дефицит бета-кетотиолазы как причина «синдрома кето-гиперглицинемии» ». Педиатрия . 53 (2): 221–5. ПМИД 4812006 .
- ^ Робинсон Б.Х., Шервуд В.Г., Тейлор Дж., Балф Дж.В., Мамер О.А. (август 1979 г.). «Дефицит ацетоацетил-КоА-тиолазы: причина тяжелого кетоацидоза в младенчестве, симулирующего салицилизм». Ж. Педиатр . 95 (2): 228–33. дои : 10.1016/S0022-3476(79)80658-7 . ПМИД 36452 .
Внешние ссылки
[ редактировать ]- Ацетил-КоА+С-ацетилтрансфераза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P28790 (3-кетоацил-КоА-тиолаза) на PDBe-KB .
- Обзор всей структурной информации, доступной в PDB для UniProt : Q56WD9 (3-кетоацил-КоА-тиолаза 2, пероксисомальная) на PDBe-KB .