альфа-2-макроглобулин
| A2M | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | A2M , A2MD, CPAMD5, FWP007, S863-7, TranscupRein, Alpha-2-Macroglobulin | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 103950 ; MGI : 2449119 ; Гомологен : 37248 ; GeneCards : A2M ; OMA : A2M - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
α 2 -макроглобулин ( α 2 м ) или альфа-2-макроглобулин представляет собой большой (720 кДа) плазменный белок, обнаруженный в крови . Он в основном продуцируется печенью , а также локально синтезируется макрофагами , фибробластами и адренокортикальными клетками . У людей это кодируется геном A2M .
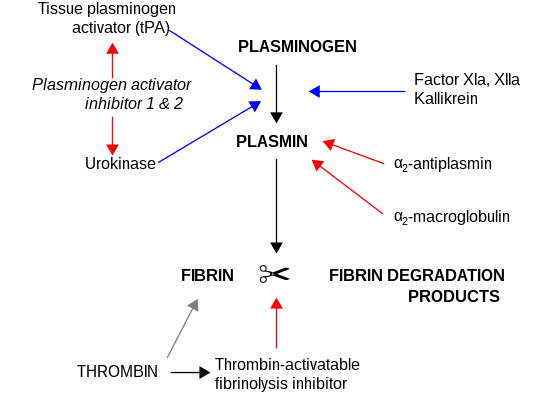
α 2 -макроглобулин действует как антипротеаза и способен инактивировать огромное разнообразие протеиназ. Он функционирует как ингибитор фибринолиза, ингибируя плазмин и калликреин . Он функционирует как ингибитор коагуляции, ингибируя тромбин . α 2 -макроглобулин может действовать как белок-носитель, поскольку он также связывается с многочисленными факторами роста и цитокинами, такими как фактор роста, полученный из тромбоцитов, основной фактор роста фибробластов, TGF-β, инсулин и IL-1β.
Никакого специфического дефицита с соответствующим заболеванием не было признано, и ни одно состояние заболевания не связано с низкими концентрациями α 2 -макроглобулина. Концентрация α 2 -макроглобулина повышается в 10 раз или более при нефротическом синдроме, когда в моче теряются другие белки с более низкой молекулярной массой. Потеря α 2 -макроглобулина в моче предотвращается его большим размером. Чистый результат состоит в том, что α 2 -макроглобулин достигает уровней сыворотки, равных или превышающим уровни альбумина при нефротическом синдроме, что оказывает влияние поддержания онкотического давления .
Структура
[ редактировать ]Человеческий α 2 -макроглобулин состоит из четырех идентичных субъединиц, связанных с помощью -sss- . [ 5 ] [ 6 ] В дополнение к тетрамерным формам α 2 -макроглобулина, димерного и в последнее время мономерные ингибиторы αM протеазы. были идентифицированы [ 7 ] [ 8 ]
Каждый мономер α 2 -макроглобулина человека состоит из нескольких функциональных доменов, включая домены макроглобулина, домен, содержащий эфир тиола и домен связывающего рецептора. [ 9 ] В целом, α 2 -макроглобулин является крупнейшим основным неиммуноглобулиновым белком в плазме человека.
Было показано, что аминокислотная последовательность α 2 -макроглобулина составляет 71% такую же, как у белка зоны беременности (PZP; также известный как α 2 -гликопротеин). [ 10 ]
Функция
[ редактировать ]Семейство α-макроглобулина (αM) белков включает ингибиторы протеазы , [ 11 ] типифицирован человека тетрамерным α 2 -макроглобулином (α 2 м); Меропса Они принадлежат к семейству ингибиторов протеиназы I39, клан IL. Эти ингибиторы протеазы имеют несколько определяющих свойств, которые включают (1) способность ингибировать протеазы из всех каталитических классов, (2) присутствие «области приманки» (также известную как последовательность аминокислот в α 2 -макроглобулино , или гомологичный белок, который содержит скопление пептидных связей для тех протеиназ, которые он ингибирует) и тиол эфир, (3) аналогичный механизм ингибирования протеазы и (4) инактивация ингибирующей способности реакцией эфира тиола с небольшим первичным амины . αM Ингибиторы протеазы ингибируют стерическими препятствиями. [ 12 ] Механизм расщеплению протеазы включает в себя расщепление области приманки, сегмент αM, который особенно восприимчив к протеолитическому , который инициирует конформационное изменение , так что αM падает вокруг протеазы. В полученном комплексе αM-протеазы активный сайт протеазы стерически защищен, что существенно уменьшает доступ к белковым субстратам . Два дополнительных события происходят в результате расщепления области приманки, а именно (1) эфир H-цистеинил-G-глутамил тиол становится высоко реактивным, и (2) основное конформационное изменение обнаруживает консервативный COOH-концевого рецептора связывания домен [ 13 ] (RBD). Воздействие RBD позволяет αM -протеазовому комплексу связываться с клиренса рецепторами и удалять из кровообращения. [ 14 ] Тетрамерные, димерные и, в последнее время, были идентифицированы мономерные ингибиторы αM протеазы. [ 7 ] [ 8 ]
α 2 -макроглобулин способен инактивировать огромное разнообразие протеиназ ( -цистеин -аспаратические и включая серин металлопротеиназы ) . Он функционирует как ингибитор фибринолиза , ингибируя плазмин и калликреин. Он функционирует как ингибитор коагуляции, ингибируя тромбин . [ 15 ] α 2 -макроглобулин в своей структуре имеет 35 -аминокислотную область «приманки». Протеиназы, связывающие и расщепление области приманки, связаны с α 2 M. Комплекс протеиназы -α 2 M распознается рецепторами макрофагов и очищается из системы.
α 2 Известно, что -макроглобулин связывает цинк , а также медь в плазме, даже сильнее, чем альбумин, и таковой также известен как транскупрейн . [ 16 ] От 10 до 15% меди в плазме человека хелатируется α 2 -макроглобулином. [ 17 ]
Болезнь
[ редактировать ]α 2 -макроглобулин уровни повышаются, когда уровни сывороточного альбумина низкие, [ 18 ] который чаще всего наблюдается при нефротическом синдроме , состоянии, в котором почки начинают вытекать некоторые из меньших белков крови. Из -за своего размера α 2 -макроглобулин сохраняется в кровотоке. Повышенная продукция всех белков означает, что концентрация α 2 -макроглобулина увеличивается. Это увеличение оказывает небольшое неблагоприятное влияние на здоровье, но используется в качестве диагностической подсказки.
Увеличение α 2 -макроглобулина с нормальным количеством альбумина в основном указывает на острое и/или хроническое воспаление. [ 19 ]
Общий вариант (29,5%) ( полиморфизм ) α 2 -макроглобулина приводит к повышенному риску болезни Альцгеймера . [ 20 ] [ 21 ]
α 2 -макроглобулин связывается и удаляет активные формы желатиназы ( MMP -2 и MMP-9 ) из циркуляции через рецепторы мусорщиков на фагоцитах.
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в GRCH38: Ensembl Release 89: ENSG00000175899 - ENSEMBL , май 2017 г.
- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg0000000030111 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Андерсен Г.Р., Кох Т.Дж., Долмер К., Соттруп-Женсен Л., Ниборг Дж (октябрь 1995). «Рентгеновская структура с низким разрешением альфа-2-макроглобулина, обработанного метиламином человека» . Дж. Биол. Химический 270 (42): 25133–41. doi : 10.1074/jbc.270.42.25133 . PMID 7559647 . S2CID 86387917 .
- ^ Sottrup-Jensen L, Stepanik TM, Kristensen T, Wierzbicki DM, Jones CM, Lønblad PB, et al. (1984). «Первичная структура человеческого альфа-2-макроглобулина. V. Полная структура» . J Biol Chem . 259 (13): 8318–27. doi : 10.1016/s0021-9258 (17) 39730-2 . PMID 6203908 .
- ^ Jump up to: а беременный Dodds AW, Law SK (декабрь 1998 г.). «Филогения и эволюция тиоэфирных связующих белков C3, C4 и Alpha 2-макроглобулина». Иммунол. Преподобный 166 : 15–26. doi : 10.1111/j.1600-065x.1998.tb01249.x . PMID 9914899 . S2CID 84262599 .
- ^ Jump up to: а беременный Армстронг П.Б., Куигли Дж.П. (1999). «Альфа2-макроглобулин: эволюционно консервативный рука врожденной иммунной системы». Девчонка Компонент Иммунол . 23 (4–5): 375–90. doi : 10.1016/s0145-305x (99) 00018-х . PMID 10426429 .
- ^ Doan N, Gettins PG (2007). «Alpha2-Macrogolobulin человека состоит из нескольких доменов, как и прогнозируется гомологией с компонентом комплемента C3» . Biochem J. 407 (1): 23–30. doi : 10.1042/bj20070764 . PMC 2267405 . PMID 17608619 .
- ^ Devriendt K, Van Den Berghe H, Cassiman JJ, Marynen P (1991). «Первичная структура белка зоны беременности. Молекулярное клонирование полноразмерного клона кДНК PZP с помощью полимеразной цепной реакции». Biochimica et Biophysica Acta (BBA) - структура и экспрессия гена . 1088 (1): 95–103. doi : 10.1016/0167-4781 (91) 90157-H . PMID 1989698 .
- ^ Sottrup-Jensen L (июль 1989 г.). «Альфа-макроглобулины: структура, форма и механизм образования протеиназного комплекса» . Дж. Биол. Химический 264 (20): 11539–42. doi : 10.1016/s0021-9258 (18) 80094-1 . PMID 2473064 .
- ^ Enghild JJ, Salvesen G, Thøgersen IB, Pizzo SV (июль 1989 г.). «Связывание и ингибирование протеиназы мономерным альфа-макроглобулиновым альфа-ингибитором 1-3» . Дж. Биол. Химический 264 (19): 11428–35. doi : 10.1016/s0021-9258 (18) 60482-x . PMID 2472396 .
- ^ Enghild JJ, Thøgersen IB, Roche PA, Pizzo SV (февраль 1989 г.). «Консервативная область в альфа-макроглобулинах участвует в связывании с рецептором альфа-макроглобулина млекопитающих». Биохимия . 28 (3): 1406–12. doi : 10.1021/bi00429a069 . PMID 2469470 .
- ^ Ван Левен Ф., Кассиман Дж.Дж., Ван ден Берге Х (декабрь 1986 г.). «Белок зоны беременности человека и альфа-2-макроглобулин. Высокоаффинное связывание комплексов с тем же рецептором на фибробластах и характеристика с помощью моноклональных антител» . Дж. Биол. Химический 261 (35): 16622–5. doi : 10.1016/s0021-9258 (18) 66612-8 . PMID 2430968 .
- ^ De Boer JP, Creasey AA, Chang A, Abbink JJ, Roem D, Eerenberg AJ, Hack CE, Taylor FB (декабрь 1993 г.). «Альфа-2-макроглобулин функционирует как ингибитор фибринолитических, свертывания и нейтрофильных протеиназ при сепсисе: исследования с использованием модели бабуна» . Инфекция Иммун . 61 (12): 5035–43. doi : 10.1128/iai.61.12.5035-5043.1993 . PMC 281280 . PMID 7693593 .
- ^ Лю Н., Ло Л.С., Аскари Ш., Джонс Л., Кидане Т.З, Нгуен Т.Т., Гофорт Дж., Чу Й.Х., Вивас Е., Цай М., Уэстбрук Т, Линдер М.К. (сентябрь 2007 г.). «TranccupRein - это макроглобулин, регулируемый доступностью меди и железа» . Журнал питательной биохимии . 18 (9): 597–608. doi : 10.1016/j.jnutbio.2006.11.005 . PMC 4286573 . PMID 17363239 .
- ^ Лю Н.М., Нгуен Т., Кидана Т., Мория М., Гофорт Дж., Чу А., Линдер М. (6 марта 2006 г.). «Транскрины являются сывороточными медными транспортными средствами семейства макроглобулина и могут регулироваться железом и медью» . Журнал FASEB . 20 (4): A553 - A554. doi : 10.1096/fasebj.20.4.a553-d . ISSN 0892-6638 . S2CID 90794136 .
- ^ Stevenson FT, Greene S, Kaysen GA (январь 1998 г.). «Концентрации 3-макроглобулина в сыворотке 2-макроглобулина и альфа 1-ингибитора 3 повышаются при гипоалбуминемии с помощью посттранскрипционных механизмов» . Kidney International . 53 (1): 67–75. doi : 10.1046/j.1523-1755.1998.00734.x . PMID 9453001 .
- ^ «Белковое электрофорез - сыворотка» . Медицинская школа Икана на горе Синай . Последнее обзор: 25.01.2022. Рассмотрен: Тодд Герстен, доктор медицинских наук и Дэвид Зив, доктор медицинских наук
- ^ Blacker D, Wilcox MA, Laird NM, Rodes L, Horvath SM, GO RC, Perry R, Watson B, Bassett SS, McInnis MG, Albert MS, Hyman BT, Tanzi RE (август 1998 г.). «Альфа-2 макроглобулин генетически связан с болезнью Альцгеймера». НАТ Генет . 19 (4): 357–60. doi : 10.1038/1243 . PMID 9697696 . S2CID 15628847 .
- ^ Kovacs DM (июль 2000 г.). «Альфа2-макроглобулин при болезни Альцгеймера позднего начала». Эксплуат Геронтол . 35 (4): 473–9. doi : 10.1016/s0531-5565 (00) 00113-3 . PMID 10959035 . S2CID 54409507 .
- McPherson & Pincus: клинический диагноз и лечение Генри с помощью лабораторных методов, 21 -е изд.
- Firestein: учебник Келли по ревматологии, 8 -е издание.
Внешние ссылки
[ редактировать ]- Онлайн -база данных Merops : для пептидаз и их ингибиторов i39.001 [ Постоянная мертвая ссылка ]
- Альфа+2-макроглобулин в Национальной медицинской библиотеке Медицинской библиотеки США (Mesh)
- A2M Местоположение человеческого гена в браузере генома UCSC .
- А2M Гена человека в браузере генома UCSC .



