Гексафторид урана
Вы можете помочь дополнить эту статью текстом, переведенным из соответствующей статьи на немецком языке . (Ноябрь 2012 г.) Нажмите [показать], чтобы просмотреть важные инструкции по переводу. |
 | |
 | |
 | |
| Имена | |
|---|---|
| ИЮПАК имена Гексафторид урана Фторид урана(VI) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| Сокращения | шестигранник |
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.116 |
| Номер ЕС |
|
| 2923 | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 2978 (<1% 235 в ) 2977 (>1% 235 в ) |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| УФ 6 | |
| Молярная масса | 352.02 g/mol |
| Появление | Бесцветное твердое вещество |
| Плотность | 5,09 г/см 3 , твердый |
| Точка кипения | 56,5 ° C (133,7 ° F; 329,6 К) (возгоняется при атмосферном давлении) |
| Гидролизуется | |
| Растворимость |
|
| Структура | |
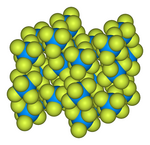
| Орторомбический , oP28 | |
| Пнма, нет. 62 | |
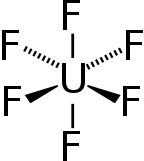
| Октаэдрический Ох ) ( | |
| 0 | |
| Термохимия | |
Стандартный моляр энтропия ( S ⦵ 298 ) | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Токсичные, коррозийные, радиоактивные [3] |
| СГС Маркировка : | |
   | |
| Опасность | |
| Х300 , Х330 , Х373 , Х411 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Паспорт безопасности (SDS) | КМГС 1250 |
| Родственные соединения | |
Другие анионы | Гексахлорид урана |
Другие катионы | |
Родственные фториды урана | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гексафторид урана , иногда называемый гексафторидом , представляет собой неорганическое соединение с формулой У Ф 6 . Гексафторид урана — летучее и токсичное белое твердое вещество, которое реагирует с водой , выделяя едкую плавиковую кислоту . Соединение мягко реагирует с алюминием , образуя тонкий поверхностный слой AlF 3 , который сопротивляется любой дальнейшей реакции соединения. UF 6 используется в процессе обогащения урана , из которого производят топливо для ядерных реакторов и ядерного оружия .
Подготовка
[ редактировать ]Молотая урановая руда— U 3 O 8 или « желтый жмых » — растворяют в азотной кислоте , получая раствор уранилнитрата. УО 2 (НО 3 ) 2 . Чистый уранилнитрат получают экстракцией растворителем , затем обрабатывают аммиаком с получением диураната аммония («АДУ», [NH 4 ] 2 U 2 O 7 ). Восстановление водородом дает UO 2 превращают , который с помощью плавиковой кислоты (HF) в тетрафторид урана , УФ 4 . Окисление с фтора выходом УФ 6 .
На предприятии Honeywell по переработке гексафторида урана используется другой процесс.
Во время ядерной переработки уран вступает в реакцию с трифторидом хлора с образованием УФ 6 :
- U + 2 ClF 3 → UF 6 + Cl 2
Характеристики
[ редактировать ]Физические свойства
[ редактировать ]При атмосферном давлении , UF 6 сублимируется при 56,5 °C. [4]

Твердотельная структура определена методом дифракции нейтронов при 77 К и 293 К. [5] [6]
- Шаростержневая модель элементарной ячейки гексафторида урана [7]
- Длины связей и углы газообразного гексафторида урана [8]
Химические свойства
[ редактировать ]Было показано, что гексафторид урана является окислителем. [9] и кислоту Льюиса , которая способна связываться с фторидом ; , что реакция фторида меди (II) с гексафторидом урана в ацетонитриле приводит к образованию гептафторураната меди (II) (VI), например, сообщается С 2+ [УФ - 7 ] 2 . [10]
Полимерные фториды урана(VI), содержащие органические катионы, выделены и охарактеризованы методом рентгеновской дифракции. [11]
Применение в топливном цикле
[ редактировать ]
Как одно из наиболее летучих соединений урана, гексафторид урана относительно удобен в обработке и используется в обоих основных методах обогащения урана , а именно в газовой диффузии и методе газовой центрифуги . Поскольку тройная точка УФ 6 ; 64 ° C (147 ° F; 337 К) и 152 кПа (22 фунта на квадратный дюйм; 1,5 атм); [12] близок к условиям окружающей среды, фазовые переходы могут быть достигнуты с небольшой термодинамической работой .
Фтор имеет только один встречающийся в природе стабильный изотоп, поэтому изотопологи фтора UF 6 различается по молекулярной массе исключительно в зависимости от присутствующего изотопа урана . [13] Это различие является основой физического разделения изотопов при обогащении.
Все остальные фториды урана — нелетучие твердые вещества, являющиеся координационными полимерами .
Коэффициент пересчета для 238 U изотополог UF 6 («шестигранник») к «U масса» составляет 0,676. [14]
Газовая диффузия требует примерно в 60 раз больше энергии, чем процесс газовой центрифуги: ядерное топливо, полученное методом газовой диффузии, производит в 25 раз больше энергии, чем используется в процессе диффузии, а топливо, произведенное центрифугой, производит в 1500 раз больше энергии, чем используется в центрифуге. процесс.
Помимо использования при обогащении, гексафторид урана использовался в передовом методе переработки ( летучесть фторида ), который был разработан в Чехии . В этом процессе отработанное ядерное топливо обрабатывается газообразным фтором для преобразования оксидов или элементарных металлов в смесь фторидов. Затем эту смесь перегоняют для разделения различных классов материалов. Некоторые продукты деления образуют нелетучие фториды, которые остаются в виде твердых веществ и затем могут быть либо подготовлены для хранения в качестве ядерных отходов, либо подвергнуты дальнейшей обработке либо сольватационными методами, либо электрохимически .
При обогащении урана производятся большие количества обедненного гексафторида урана (D УФ 6 или Д- UF 6 ) как отход. Длительное хранение D- UF 6 представляет угрозу для окружающей среды, здоровья и безопасности из-за своей химической нестабильности. Когда UF 6 подвергается воздействию влажного воздуха, он вступает в реакцию с водой в воздухе, образуя UO 2 F 2 ( фторид уранила ) и HF ( фторид водорода ) оба очень агрессивны и токсичны. В 2005 году 686 500 тонн D- UF 6 хранился в 57 122 баллонах, расположенных недалеко от Портсмута, штат Огайо ; Ок-Ридж, Теннесси ; и Падука, Кентукки . [15] [16] Баллоны для хранения необходимо регулярно проверять на наличие признаков коррозии и утечек. Расчетный срок службы стальных баллонов измеряется десятилетиями. [17]
Несчастные случаи и утилизация
[ редактировать ]В США произошло несколько аварий, связанных с гексафторидом урана, в том числе авария при заполнении баллонов и выброс материала на предприятии Sequoyah Fuels Corporation в 1986 году, когда, по оценкам, было обнаружено 29 500 фунтов газообразного газа. UF 6 сбежал. [18] [19] Правительство США конвертирует D UF 6 в твердые оксиды урана для утилизации. [20] Такое избавление от всего D Запасы UF- 6 могут стоить от 15 до 450 миллионов долларов. [21]
Ссылки
[ редактировать ]- ^ «Гексафторид урана» . Архивировано из оригинала 16 сентября 2013 г. Проверено 8 августа 2013 г.
- ^ Jump up to: а б с д Джонсон, Джеральд К. (1979). «Энтальпия образования гексафторида урана». Журнал химической термодинамики . 11 (5): 483–490. дои : 10.1016/0021-9614(79)90126-5 .
- ^ Фторид урана (VI)
- ^ Брикведде, Фердинанд Г.; Хоге, Гарольд Дж.; Скотт, Рассел Б. (1948). «Низкотемпературная теплоемкость, энтальпия и энтропия UF 4 и UF 6 » . Дж. Хим. Физ. 16 (5): 429–436. Бибкод : 1948ЖЧФ..16..429Б . дои : 10.1063/1.1746914 .
- ^ Дж. Х. Леви; Джон К. Тейлор; Пол В. Уилсон (1976). «Структура фторидов. Часть XII. Монокристаллическое нейтронографическое исследование гексафторида урана при 293 К». Дж. Хим. Soc., Далтон Транс. (3): 219–224. дои : 10.1039/DT9760000219 .
- ^ Дж. Х. Леви, Дж. К. Тейлор и А. Б. Во (1983). «Структурные исследования нейтронных порошков UF 6 , MoF 6 и WF 6 при 77 К». Журнал химии фтора . 23 : 29–36. дои : 10.1016/S0022-1139(00)81276-2 .
- ^ Дж. К. Тейлор, П. В. Уилсон, Дж. В. Келли: «Структуры фторидов. I. Отклонения от идеальной симметрии в структуре кристаллического UF 6 : нейтронографический анализ», Acta Crystallogr. , 1973 , B29 , стр. 7–12; дои : 10.1107/S0567740873001895 .
- ^ Кимура, Масао; Шомакер, Вернер; Смит, Дарвин В.; Бернар (1968). «Электронно-дифракционное исследование гексафторидов вольфрама, осмия, иридия, урана, нептуния и плутония» . Дж. Хим. Физ. 48 (8): 4001–4012. Бибкод : 1968ЖЧФ..48.4001К . дои : 10.1063/1.1669727 . Архивировано из оригинала 11 января 2023 г. Проверено 10 октября 2020 г.
- ^ Г.Х. Ола; Дж. Уэлч (1978). «Синтетические методы и реакции. 46. Окисление органических соединений гексафторидом урана в растворах галогеналканов». Дж. Ам. хим. Соц. 100 (17): 5396–5402. дои : 10.1021/ja00485a024 .
- ^ Дж. А. Берри; РТ Пул; А. Прескотт; ДВА Шарп; Дж. М. Уинфилд (1976). «Окислительные и акцепторные свойства фторид-ионов гексафторида урана в ацетонитриле». Дж. Хим. Soc., Далтон Транс. (3): 272–274. дои : 10.1039/DT9760000272 .
- ^ С.М. Уокер; PS Халасьямани; С. Аллен; Д. О'Хара (1999). «От молекул к каркасам: переменная размерность в системе UO 2 (CH 3 COO) 2 ·2H 2 O/HF(aq)/пиперазин. Синтез, структура и характеристика нульмерного (C 4 N 2 H 12 )UO 2 F 4 ·3H 2 O, Одномерный (C 4 N 2 H 12 ) 2 U 2 F 12 ·H 2 O, Двумерный (C 4 N 2 H 12 ) 2 (U 2 O 4 F 5 ) 4 ·11H 2 O, и трехмерный (C 4 N 2 H 12 )U 2 O 4 F 6 ". Дж. Ам. хим. Соц . 121 (45): 10513–10521. дои : 10.1021/ja992145f .
- ^ «Гексафторид урана: Источник: Приложение A к PEIS (DOE/EIS-0269): Физические свойства» . web.evs.anl.gov . Проверено 18 августа 2022 г.
- ^ «Обогащение урана и процесс газовой диффузии» . USEC Inc. Архивировано из оригинала 19 октября 2007 г. Проверено 24 сентября 2007 г.
- ^ «Конвертер единиц измерения молярной массы» . Кафе переводчиков . Миссиссога, Онтарио, Канада: Разработка программного обеспечения ANVICA. 1 февраля 2021 г.
- ^ «Сколько обедненного гексафторида урана хранится в США?» . обедненном UF 6 Часто задаваемые вопросы об . Аргоннская национальная лаборатория .
- ^ « исчерпанным UF 6 Документы программы управления » . Архивировано из оригинала 16 февраля 2008 г. Проверено 17 мая 2006 г.
- ^ «Что такое DUF 6 ? Опасен ли он и что с ним делать?» . Институт энергетических и экологических исследований. 24 сентября 2007 г.
- ^ Брюгге, Д.; Делемос, Дж.Л.; Буй, К. (2007). «Выброс топлива корпорации Sequoyah и разлив Черч-Рок: неопубликованные ядерные выбросы в общинах американских индейцев» . Американский журнал общественного здравоохранения . 97 (9): 1595–1600. дои : 10.2105/AJPH.2006.103044 . ЧВК 1963288 . PMID 17666688 .
- ^ «Были ли аварии с гексафторидом урана?» . обедненном UF 6 Часто задаваемые вопросы об . Аргоннская национальная лаборатория. Архивировано из оригинала 9 июня 2017 г.
- ^ «Что произойдет с гексафторидом урана, хранящимся в Соединенных Штатах?» . обедненном UF 6 Часто задаваемые вопросы об . Аргоннская национальная лаборатория.
- ^ «Есть ли какие-либо действующие в настоящее время установки по захоронению, которые могут принять весь оксид обедненного урана, который будет получен в результате переработки запасов обедненного UF- 6 Министерства энергетики ?» . обедненном UF 6 Часто задаваемые вопросы об . Аргоннская национальная лаборатория.
Дальнейшее чтение
[ редактировать ]- Справочник Гмелина по неорганической химии , Система № 55, Уран, Часть А, с. 121-123.
- Справочник Гмелина по неорганической химии , Система № 55, Уран, Часть С 8, с. 71-163.
- Р. ДеВитт: Гексафторид урана: Исследование физико-химических свойств , Технический отчет, GAT-280; Goodyear Atomic Corp., Портсмут, Огайо; 12 августа 1960 г.; дои : 10.2172/4025868 .
- Ингмар Гренте, Януш Дрозджински, Такео Фуджино, Эдгар С. Бак, Томас Э. Альбрехт-Шмитт , Стивен Ф. Вольф: Уран, заархивировано 18 января 2012 г. в Wayback Machine , в: Лестер Р. Морсс, Норман М. Эдельштейн, Жан Фюгер (Hrsg.): Химия актинидных и трансактинидных элементов , Springer, Дордрехт, 2006; ISBN 1-4020-3555-1 , с. 253–698; doi : 10.1007/1-4020-3598-5_5 (стр. 530–531, 557–564).
- Патент США 2535572: Получение UF 6 ; 26. Декабрь 1950 г.
- Патент США 5723837: Очистка гексафторида урана ; 3. Март 1998 г.
Внешние ссылки
[ редактировать ]- Саймон Коттон (Аппингемская школа, Ратленд, Великобритания): Гексафторид урана .
- Гексафторид урана (UF 6 ) – Физические и химические свойства UF 6 и его использование при переработке урана – Гексафторид урана и его свойства
- Гексафторид урана в WebElements
- Импорт западного гексафторида обедненного урана (урановых хвостов) в Россию [мертвая ссылка, 30 июня 2017 г.]

![Шаростержневая модель элементарной ячейки гексафторида урана[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Uranium-hexafluoride-unit-cell-3D-balls.png/180px-Uranium-hexafluoride-unit-cell-3D-balls.png)
![Длины связей и углы газообразного гексафторида урана [8]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Uranium_hexafluoride_dimensions.svg/180px-Uranium_hexafluoride_dimensions.svg.png)


