Цикл Кальвина
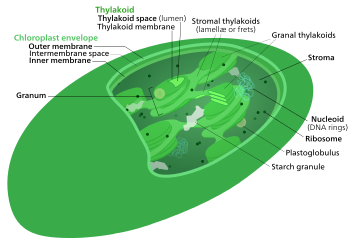
Цикл Кальвина , светонезависимые реакции , биосинтетическая фаза , темновые реакции или фотосинтетического восстановления углерода ( ПЦР ). цикл [1] Фотосинтез углекислый — это серия химических реакций, в ходе которых газ и соединения-переносчики водорода превращаются в глюкозу . Цикл Кальвина присутствует у всех фотосинтезирующих эукариот, а также у многих фотосинтезирующих бактерий. У растений эти реакции происходят в строме — заполненной жидкостью области хлоропласта за пределами тилакоидных мембран . Эти реакции берут продукты ( АТФ и НАДФН ) светозависимых реакций и осуществляют с ними дальнейшие химические процессы. Цикл Кальвина использует химическую энергию АТФ и восстанавливающую способность НАДФН в результате светозависимых реакций для производства сахаров для использования растением. Эти субстраты используются в серии окислительно-восстановительных ( окислительно-восстановительных ) реакций для поэтапного производства сахаров; не существует прямой реакции, превращающей несколько молекул CO 2 в сахар, . Есть три фазы светонезависимых реакций, которые вместе называются циклом Кальвина: карбоксилирование , реакции восстановления и регенерация рибулозо-1,5-бисфосфата (RuBP).
Хотя его еще называют «темновой реакцией», цикл Кальвина на самом деле не происходит в темноте или в ночное время. Это связано с тем, что для этого процесса требуется НАДФН, который недолговечен и возникает в результате светозависимых реакций. В темноте растения вместо этого выделяют сахарозу во флоэму из запасов крахмала , чтобы обеспечить растение энергией. Таким образом, цикл Кальвина происходит, когда свет доступен независимо от типа фотосинтеза ( фиксация углерода C3 , фиксация углерода C4 и метаболизм крассуловой кислоты (CAM) ); Растения CAM каждую ночь хранят яблочную кислоту в своих вакуолях и выделяют ее днем, чтобы этот процесс работал. [2]
Соединение с другими метаболическими путями
[ редактировать ]Реакции цикла Кальвина тесно связаны с цепью переноса электронов тилакоида . [3] поскольку энергия, необходимая для восстановления углекислого газа, обеспечивается НАДФН, образующимся в ходе светозависимых реакций . Процесс фотодыхания , также известный как цикл C2, также связан с циклом Кальвина, поскольку он является результатом альтернативной реакции фермента RuBisCO , а его конечным побочным продуктом является другая глицеральдегида-3-P молекула .
Цикл Кальвина
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( декабрь 2023 г. ) |
Цикл Кальвина , цикл Кальвина-Бенсона-Башама (CBB) , пентозофосфатный цикл (цикл RPP) или цикл C3 представляет собой серию биохимических окислительно-восстановительных которые происходят в строме хлоропластов реакций , фотосинтезирующих восстановительный организмов . Цикл был открыт в 1950 году Мелвином Кальвином , Джеймсом Бэшемом и Эндрю Бенсоном в Калифорнийском университете в Беркли. [4] с помощью радиоактивного изотопа углерода-14 . [ нужна ссылка ]
Фотосинтез в клетке происходит в два этапа. На первом этапе светозависимые реакции захватывают энергию света и используют ее для создания молекулы-хранилища энергии АТФ и переносчика водорода средней энергии НАДФН . Цикл Кальвина использует эти соединения для преобразования углекислого газа и воды в органические соединения. [5] который может быть использован организмом (и животными, которые им питаются). Этот комплекс реакций также называют фиксацией углерода . Ключевой фермент цикла называется RuBisCO . В следующих биохимических уравнениях химические соединения (фосфаты и карбоновые кислоты) существуют в равновесии между различными ионизированными состояниями, определяемыми pH . [ нужна ссылка ]
Ферменты цикла Кальвина функционально эквивалентны большинству ферментов, используемых в других метаболических путях, таких как глюконеогенез и пентозофосфатный путь , но ферменты цикла Кальвина обнаруживаются в строме хлоропластов, а не в цитозоле клетки , что разделяет реакции. Они активируются на свету (поэтому название «темновая реакция» вводит в заблуждение), а также продуктами светозависимой реакции. Эти регуляторные функции предотвращают превращение цикла Кальвина в углекислый газ. Энергия (в форме АТФ) будет тратиться впустую при проведении этих реакций, если они не имеют чистой продуктивности . [ нужна ссылка ]
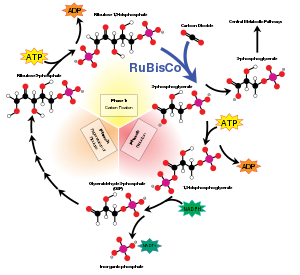
Сумма реакций в цикле Кальвина следующая: [ нужна ссылка ]
- 3 СО
2 + 6 НАДФН + 9 АТФ + 5 Н
2 O → глицеральдегид-3-фосфат (G3P) + 6 НАДФ + + 9 АДФ + 8 P i (P i = неорганический фосфат )
Гексозные (шестиуглеродные) сахара не являются продуктами цикла Кальвина. Хотя во многих текстах продукт фотосинтеза указан как C
66Ч
12 О
6 , это сделано главным образом для удобства, чтобы сопоставить уравнение аэробного дыхания , где шестиуглеродные сахара окисляются в митохондриях. Углеводными продуктами цикла Кальвина являются трехуглеродные молекулы сахарофосфатов, или «триозофосфаты», а именно глицеральдегид-3-фосфат (G3P). [ нужна ссылка ]
Шаги
[ редактировать ]На первой стадии цикла Кальвина молекула CO 2 включается в одну из двух трехуглеродных молекул ( глицеральдегид-3-фосфат или G3P), где она расходует две молекулы АТФ и две молекулы НАДФН , которые были произведены на светозависимой стадии. Эти три шага включают в себя: [ нужна ссылка ]


- Фермент RuBisCO катализирует карбоксилирование рибулозо-1,5-бисфосфата , RuBP, 5-углеродного соединения, диоксидом углерода (всего 6 атомов углерода) в двухстадийной реакции. [6] Продуктом первого этапа является эндиол-ферментный комплекс, способный улавливать CO.
2 или О
2 . Таким образом, эндиол-ферментный комплекс представляет собой настоящую карбоксилазу/оксигеназу. СО
2 , который захватывается эндиолом на втором этапе, образует нестабильное шестиуглеродное соединение, называемое 2-карбокси-3-кето-1,5-бифосфориботол (CKABP). [7] ) (или 3-кето-2-карбоксиарабинит-1,5-бисфосфат), который немедленно распадается на 2 молекулы 3-фосфоглицерата (также называемого 3-фосфоглицериновой кислотой, PGA, 3PGA или 3-PGA), трехуглеродного соединения. . [8] - Фермент фосфоглицераткиназа катализирует фосфорилирование 3-ФГК под действием АТФ (который образуется на светозависимой стадии). 1,3-бисфосфоглицерат (глицерат-1,3-бисфосфат) и АДФ Продуктами являются производятся два 3-PGA. . (Однако обратите внимание, что для каждого CO
2 , который входит в цикл, поэтому на этом этапе используются две АТФ на CO.
2 исправлено.) [ нужна ссылка ] - Фермент глицеральдегид-3-фосфатдегидрогеназа катализирует восстановление 1,3BPGA НАДФН (который является еще одним продуктом светозависимой стадии). Образуется глицеральдегид-3-фосфат (также называемый G3P, GP, TP, PGAL, GAP), а сам НАДФН окисляется и становится НАДФ. + . Опять же, два НАДФН используются на CO.
2 исправлено. [ нужна ссылка ]

Следующим этапом цикла Кальвина является регенерация РуБФ. Пять молекул G3P производят три молекулы RuBP, используя три молекулы АТФ. Поскольку каждая молекула CO 2 производит две молекулы G3P, три молекулы CO 2 производят шесть молекул G3P, из которых пять используются для регенерации RuBP, в результате чего чистый прирост составляет одну молекулу G3P на три молекулы CO 2 (как и следовало ожидать, исходя из количества участвуют атомы углерода). [ нужна ссылка ]


Стадию регенерации можно разбить на несколько этапов.
- Триозофосфатизомераза обратимо превращает весь G3P в дигидроксиацетонфосфат (DHAP), также трехуглеродную молекулу. [ нужна ссылка ]
- Альдолаза и фруктозо-1,6-бисфосфатаза превращают G3P и DHAP во фруктозо-6-фосфат (6C). Фосфат-ион переходит в раствор. [ нужна ссылка ]
- Затем фиксация другого CO
2 генерирует еще два G3P. [ нужна ссылка ] - В F6P два атома углерода удаляются транскетолазой , образуя эритрозо-4-фосфат (E4P). Два атома углерода транскетолазы присоединяются к G3P, образуя кетозо -ксилулозо-5-фосфат (Xu5P). [ нужна ссылка ]
- E4P и DHAP (образованный из одного G3P второго CO
2 фиксация) под действием фермента альдолазы превращаются в седогептулозо-1,7-бисфосфат (7С). [ нужна ссылка ] - Седогептулозо-1,7-бисфосфатаза (один из трех ферментов цикла Кальвина, уникальных для растений) расщепляет седогептулозо-1,7-бисфосфат до седогептулозо-7-фосфата , высвобождая ион неорганического фосфата в раствор. [ нужна ссылка ]
- Фиксация третьего CO
2 генерирует еще два G3P. В кетозном S7P два атома углерода удаляются транскетолазой , образуя рибозо-5-фосфат (R5P), а два атома углерода, оставшиеся на транскетолазе, передаются на один из G3P, давая другой Xu5P. В результате остается один G3P в виде продукта фиксации 3 CO.
2 , с образованием трех пентоз, которые можно конвертировать в Ru5P. [ нужна ссылка ] - R5P превращается в рибулозо-5-фосфат (Ru5P, RuP) под действием фосфопентозоизомеразы . Xu5P превращается в RuP под действием фосфопентозоэпимеразы . [ нужна ссылка ]
- Наконец, фосфорибулокиназа (еще один уникальный для растений фермент этого пути) фосфорилирует RuP в RuBP, рибулозо-1,5-бисфосфат, завершая цикл Кальвина . Для этого требуется ввод одного АТФ. [ нужна ссылка ]
Таким образом, из шести образующихся G3P пять используются для образования трех молекул RuBP (5C) (всего 15 атомов углерода), и только один G3P доступен для последующего превращения в гексозу. Для этого требуется девять молекул АТФ и шесть молекул НАДФН на три CO.
2 молекулы. Уравнение общего цикла Кальвина схематически показано ниже. [ нужна ссылка ]

RuBisCO также конкурентно реагирует с O
2 вместо CO
2 фотодыхания . Скорость фотодыхания выше при высоких температурах. Фотодыхание превращает RuBP в 3-PGA и 2-фосфогликолят, двухуглеродную молекулу, которая может быть преобразована через гликолат и глиоксалат в глицин. Через систему расщепления глицина и тетрагидрофолат два глицина превращаются в серин плюс CO.
2 . Серин можно снова превратить в 3-фосфоглицерат. Таким образом, только 3 из 4 атомов углерода двух фосфогликолятов могут быть превращены обратно в 3-ПГК. Видно, что фотодыхание имеет весьма негативные последствия для растения, поскольку вместо фиксации CO
2 , этот процесс приводит к потере CO
2 . Фиксация углерода C4 эволюционировала, чтобы обойти фотодыхание, но может происходить только у некоторых растений, произрастающих в очень теплом или тропическом климате, например у кукурузы. Более того, RuBisCO, катализирующие светонезависимые реакции фотосинтеза, обычно проявляют улучшенную специфичность к CO 2 по сравнению с O 2 , чтобы минимизировать реакцию оксигенации. Эта улучшенная специфичность развилась после того, как RuBisCO включил новую субъединицу белка. [9]
Продукты
[ редактировать ]Непосредственными продуктами одного цикла цикла Кальвина являются 2 молекулы глицеральдегид-3-фосфата (Г3Ф), 3 молекулы АДФ и 2 молекулы НАДФ. + . (АДФ и НАДП + на самом деле не являются «продуктами». Они регенерируются и позже снова используются в светозависимых реакциях ). Каждая молекула G3P состоит из 3 атомов углерода. Для продолжения цикла Кальвина необходимо восстановить RuBP (рибулозо-1,5-бисфосфат). Так, для этой цели используются 5 из 6 атомов углерода 2-х молекул G3P. Таким образом, за каждый ход производится только 1 чистый углерод, с которым можно играть. Для создания 1 избытка G3P требуется 3 атома углерода и, следовательно, 3 витка цикла Кальвина. Для создания одной молекулы глюкозы (которая может быть создана из двух молекул G3P) потребуется 6 витков цикла Кальвина. Избыток G3P также может быть использован для образования других углеводов, таких как крахмал, сахароза и целлюлоза, в зависимости от потребностей растения. [10]
Светозависимое регулирование
[ редактировать ]Эти реакции не возникают в темноте или ночью. Существует светозависимая регуляция ферментов цикла, поскольку для третьего этапа требуется НАДФН. [11]
Когда цикл необходимо включить или выключить, действуют две системы регуляции: система активации тиоредоксин / ферредоксин , которая активирует некоторые ферменты цикла; и активация фермента RuBisCo , активного в цикле Кальвина, который включает собственную активазу. [12]
Система тиоредоксин/ферредоксин активирует ферменты глицеральдегид-3-P дегидрогеназу, глицеральдегид-3-P фосфатазу, фруктозо-1,6-бисфосфатазу, седогептулозо-1,7-бисфосфатазу и киназу рибулозо-5-фосфатазы, которые являются ключевыми моментами. процесса. Это происходит, когда доступен свет, поскольку белок ферредоксин восстанавливается в комплексе фотосистемы I электронной цепи тилакоида, когда через него циркулируют электроны. [13] Затем ферредоксин связывается и восстанавливает белок тиоредоксин, который активирует ферменты цикла, разрывая цистиновую связь, обнаруженную во всех этих ферментах. Это динамический процесс, поскольку та же самая связь снова образуется другими белками, которые дезактивируют ферменты. Последствия этого процесса заключаются в том, что ферменты остаются в основном активированными днем и деактивируются в темноте, когда восстановленный ферредоксин больше не доступен. [ нужна ссылка ]
Фермент РуБисКо имеет свой, более сложный процесс активации. требуется, чтобы определенная лизин аминокислота была карбамилирована Для активации фермента . Этот лизин связывается с RuBP и приводит к нефункциональному состоянию, если его оставить некарбамилированным. Специфический фермент активаза, называемый активазой RuBisCo , помогает этому процессу карбамилирования, удаляя один протон из лизина и делая возможным связывание молекулы углекислого газа. Даже в этом случае фермент RuBisCo еще не функционирует, поскольку для его функционирования необходим ион магния, связанный с лизином. Этот ион магния высвобождается из просвета тилакоида при падении внутреннего рН за счет активной откачки протонов из потока электронов. Сама активаза RuBisCo активируется повышенными концентрациями АТФ в строме, вызванными ее фосфорилированием . [14]
Ссылки
[ редактировать ]- ^ Сильверстайн, Элвин (2008). Фотосинтез . Книги двадцать первого века. п. 21. ISBN 9780822567981 .
- ^ Кушман, Джон К. (2001). «Пластическая фотосинтетическая адаптация к засушливой среде» . Физиология растений . 127 (4): 1439–1448. дои : 10.1104/стр.010818 . ПМК 1540176 . ПМИД 11743087 .
- ^ Сайнис, Джаяшри Кришна; Дэни, Дикша Нархар; Дей, Гаутам Кумар (1 января 2003 г.). «Участие тилакоидных мембран в супрамолекулярной организации ферментов цикла Кальвина у Anacystis nidulans» . Журнал физиологии растений . 160 (1): 23–32. дои : 10.1078/0176-1617-00849 . ISSN 0176-1617 .
Результаты показали, что целостность тилакоидных мембран может иметь важное значение для организации последовательных ферментов цикла Кальвина in vivo и облегчения их функционирования.
- ^ Башем Дж., Бенсон А., Кэлвин М. (1950). «Путь углерода в фотосинтезе» (PDF) . J Биол Хим . 185 (2): 781–7. дои : 10.2172/910351 . PMID 14774424 . Архивировано из оригинала (PDF) 19 февраля 2009 г. Проверено 3 июля 2013 г.
- ^ Кэмпбелл, Нил А.; Брэд Уильямсон; Робин Дж. Хейден (2006). Биология: исследование жизни . Бостон, Массачусетс: Пирсон Прентис Холл. ISBN 0-13-250882-6 .
- ^ Фараздаги Х (2009). «Моделирование кинетики активации и реакции Рубиско при газообмене». Фотосинтез in silico . Достижения в области фотосинтеза и дыхания. Том. 29. С. 275–294. дои : 10.1007/978-1-4020-9237-4_12 . ISBN 978-1-4020-9236-7 .
- ^ Лоример, Г.Х.; Эндрюс, Ти Джей; Пирс, Дж.; Шлосс, СП (1986). «2´-карбокси-3-кето-D-арабинитол-1,5-бисфосфат, шестиуглеродный промежуточный продукт реакции рибулозобисфосфаткарбоксилазы» . Фил. Пер. Р. Сок. Лонд. Б. 313 (1162): 397–407. Бибкод : 1986РСТБ.313..397Л . дои : 10.1098/rstb.1986.0046 .
- ↑ Кэмпбелл и Рис Биология: 8-е издание, стр. 198. Бенджамин Каммингс, 7 декабря 2007 г.
- ^ Шульц, Л; Го, З; Зажицкий, Дж; Штайнхен, В; Шуллер, Дж. М.; Хеймерль, Т; Принц, С; Мюллер-Кахар, Огайо; Эрб, Ти Джей; Хохберг, GKA (14 октября 2022 г.). «Эволюция повышенной сложности и специфичности на заре формы I Rubiscos» . Наука . 378 (6616): 155–160. Бибкод : 2022Sci...378..155S . дои : 10.1126/science.abq1416 . ПМИД 36227987 . S2CID 252897276 .
- ^ Рассел, Вулф и др. Биология: изучение разнообразия жизни . Торонто: Колледж Нельсона для коренных народов, 1-е изд., Том. 1, 2010, стр. 151
- ^ Шрайер, Тина; Хибберд, Джулиан (1 марта 2019 г.). «Вариации цикла Кальвина-Бенсона: давление отбора и оптимизация?» . Журнал экспериментальной ботаники . 70 (6) (опубликовано 27 марта 2019 г.): 1697–1701. дои : 10.1093/jxb/erz078 . ПМК 6436154 . PMID 30916343 – через Oxford Academic.
- ^ Конварх, Роктотпал; Абда, Ибрагим М.; Харегу, Симацидк; Сингх, Ананд Пратап (01 января 2022 г.), Хан, Раджу; Мурали, С.; Гогои, Сатьябрат (ред.), «Глава 7 - Типичные доказательства био-наноперекрестных помех между углеродными точками и растительными системами» , «Углеродные точки в сельскохозяйственных системах », Academic Press, стр. 155–173, ISBN 978-0-323-90260-1 , получено 22 апреля 2023 г.
- ^ Бесс, я; Бьюкенен, Б. (1997). «Процессы животных и растений, связанные с тиоредоксином: новое поколение». Бот. Бык. акад. Грех. 38 : 1–11.
- ^ Рууска, Сари А.; Эндрюс, Т. Джон; Бэджер, Мюррей Р.; Прайс, Дж. Дин; фон Кеммерер, Сюзанна (1 февраля 2000 г.). «Роль транспорта электронов хлоропластов и метаболитов в модуляции активности Рубиско в табаке. Результаты исследований трансгенных растений с пониженным количеством комплекса цитохрома b/f или глицеральдегид-3-фосфатдегидрогеназы» . Физиология растений . 122 (2): 491–504. дои : 10.1104/стр.122.2.491 . ISSN 1532-2548 . ПМК 58886 . ПМИД 10677442 .
- Башам Дж. А. (2003). «Картирование цикла сокращения выбросов углерода: личная ретроспектива». Фотосинт. Рез . 76 (1–3): 35–52. дои : 10.1023/А:1024929725022 . ПМИД 16228564 . S2CID 52854452 .
- Диван, Джойс Дж. (2005). «Фотосинтетическая темновая реакция» . Биохимия и биофизика, Политехнический институт Ренсселера. Архивировано из оригинала 16 марта 2005 г. Проверено 24 октября 2012 г.
- Портис, Арчи; Парри, Мартин (2007). «Открытия в Рубиско (рибулозо-1,5-бисфосфаткарбоксилаза / оксигеназа): историческая перспектива» (PDF) . Исследования фотосинтеза . 94 (1): 121–143. дои : 10.1007/s11120-007-9225-6 . ПМИД 17665149 . S2CID 39767233 . Архивировано из оригинала (PDF) 12 марта 2012 г.
Дальнейшее чтение
[ редактировать ]- Rubisco Activase, с веб-сайта Plant Physiology Online. Архивировано 18 февраля 2009 г. на Wayback Machine.
- Тиоредоксины, с веб-сайта Plant Physiology Online. Архивировано 16 июня 2008 г. в Wayback Machine.
Внешние ссылки
[ редактировать ]- Биохимия цикла Кальвина в Политехническом институте Ренсселера.
- Цикл Кальвина и пентозофосфатный путь из биохимии , пятое издание Джереми М. Берга, Джона Л. Тимочко и Люберта Страйера. Опубликовано WH Freeman and Company (2002).