Пируват, фосфатдикиназа
| пируват, фосфатдикиназа | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.7.9.1 | ||
| Номер CAS. | 9027-40-1 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Пируват, фосфатдикиназа | |
|---|---|
 | |
| Идентификаторы | |
| Символ | ППДК |
| ИнтерПро | ИПР010121 |
| См. домены ниже. | |
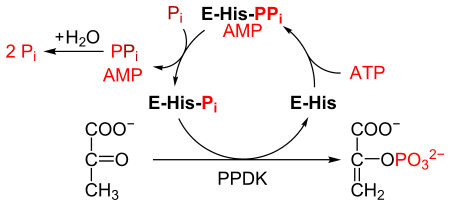
Пируват, фосфатдикиназа , или ППДК ( EC 2.7.9.1 ) — это фермент семейства трансфераз , который катализирует химическую реакцию.
- АТФ + пируват + фосфат АМФ + фосфоенолпируват + дифосфат
Этот фермент изучался в основном на растениях, но его изучали и на некоторых бактериях. [ 1 ] Это ключевой фермент глюконеогенеза и фотосинтеза, который отвечает за обращение вспять реакции, осуществляемой пируваткиназой при гликолизе Эмбдена-Мейергофа-Парнаса. Его не следует путать с пируватом, водной дикиназой .
Она относится к семейству трансфераз , а именно переносящих фосфорсодержащие группы ( фосфотрансфераз ) с парными акцепторами ( дикиназами ). Этот фермент участвует в метаболизме пирувата и фиксации углерода .
Номенклатура
[ редактировать ]Систематическое название этого класса ферментов — АТФ:пируват, фосфатфосфотрансфераза. Другие широко используемые названия включают пируват, ортофосфат-дикиназа, пируват-фосфат-дикиназа (фосфорилирующая), пируват-фосфат-дикиназа, пируват-неорганическая фосфат-дикиназа, пируват-фосфат-дикиназа, пируват-фосфат-лигаза, пируват-фосфат-дикиназа, пируват-фосфат-лигаза, пируват. , Пи-дикиназа и ППДК.
Механизм реакции
[ редактировать ]ППДК катализирует превращение пирувата в фосфоенолпируват (ФЭП), потребляя 1 молекулу АТФ и производя одну молекулу АМФ при этом . Механизм : состоит из 3 обратимых реакций [ 2 ]
- Фермент ППДК связывается с АТФ с образованием АМФ и дифосфорилированной ППДК.
- Дифосфорилированная ППДК связывается с неорганическим фосфатом , образуя дифосфат и (моно)фосфорилированную ППДК.
- Фосфорилированная ППДК связывается с пируватом, образуя фосфоенолпируват и регенерируя ППДК.
Реакция аналогична реакции, катализируемой пируваткиназой , которая также превращает пируват в ПЭП. [ 3 ] Однако пируваткиназа катализирует необратимую реакцию и не потребляет АТФ. Напротив, ППДК катализирует обратимую реакцию и потребляет 1 молекулу АТФ на каждую преобразованную молекулу пирувата.
В настоящее время детали каждого механистического этапа неизвестны. [ 3 ]
Структура
[ редактировать ]В активной форме ППДК представляет собой гомотетрамер с субъединицами около 95 кДа. [ 4 ]
Существует два разных реакционных центра, находящихся на расстоянии около 45 ангстрем друг от друга, в которых разные субстраты . связываются [ 5 ] нуклеотида ( АТФ ) Сайт связывания находится на N-конце , содержит 240 аминокислот и имеет характерный АТФ-захват. Сайт связывания пирувата/PEP находится на С-конце , содержит 340 аминокислот и имеет α/β-бочкообразную укладку. Существует также центральный домен, который содержит His 455, основной остаток, ответственный за катализ. His455 представляет собой акцептор фосфорила или донорный остаток. [ 3 ] Структура фермента предполагает, что плечо His455 совершает поворотное движение, перемещая фосфорильную группу между двумя реакционными центрами. [ 6 ] Во время этого поворота центральный домен поворачивается как минимум на 92 градуса и перемещается на 0,5 ангстрема. [ 7 ]
Исследования кристаллических структур ППДК показывают, что центральный домен расположен в разной близости к двум другим доменам в зависимости от источника фермента. [ 7 ] У кукурузы он ближе к С-концу, а у Clostridium symbiosum — к N-концу.
Исследования показали, что механизмы связывания PPDK аналогичны механизмам связывания D-Ala-D-Ala-лигазы и пируваткиназы . [ 5 ] В частности, ППДК очень похожа на пируваткиназу, которая также катализирует превращение пирувата в фосфоенолпируват; однако он делает это без промежуточного фосфорилированного фермента. [ 3 ] Хотя их аминокислотные последовательности различны, ключевые для катализа остатки сохраняются в обоих ферментах. Эксперименты по точечному мутагенезу показали, что каталитические остатки включают Arg 561, Arg 617, Glu 745, Asn 768 и Cys 831 (нумерация относительно симбиоза C белка , PDB : 1KBL , 1KC7 ). [ 3 ]
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Биологическая функция и эволюция
[ редактировать ]PPDK используется в пути C4 для повышения эффективности фиксации углекислого газа . [ 8 ] В средах с большим количеством света скорость фотосинтеза растений ограничивается скоростью поглощения углекислого газа (CO 2 ). Это можно улучшить, используя серию химических реакций для транспортировки CO 2 от клеток мезофилла (которые расположены на внешней стороне листа) к клеткам оболочки пучка (которые расположены внутри клеток). ППДК превращает пируват в ПЭП, который реагирует с CO 2 с образованием оксалоацетата . Когда CO 2 высвобождается в клетках оболочки пучка, пируват регенерируется, и цикл продолжается. [ 8 ]
Хотя реакция, катализируемая ППДК, обратима, в биологических условиях предпочтительным продуктом является ПЭП. Это связано с основным pH в строме , где происходит реакция, а также с высокими концентрациями аденилаткиназы и пирофосфатазы . Поскольку эти два фермента катализируют экзергонические реакции с участием АМФ и дисфосфата соответственно, они ускоряют реакцию, катализируемую ППДК. [ 9 ] Поскольку PPDK потребляет АТФ, путь C4 неблагоприятен для растений в средах с ограниченным доступом света, поскольку они не могут производить большие количества АТФ. [ 8 ]
ППДК очень распространена в листьях С4 и составляет до 10% общего белка . [ 10 ] Исследования показали, что фермент примерно на 96% идентичен у разных видов растений. Эксперименты по гибридизации показали, что генетические различия коррелируют со степенью, в которой растения реализуют путь C4 — необычные последовательности существуют у растений, которые также обладают характеристиками C3. [ 11 ] ППДК также содержится в небольших количествах в растениях С3. Эволюционная история предполагает, что когда-то она играла роль в гликолизе, как и аналогичная пируваткиназа , и в конечном итоге превратилась в путь C4. [ 10 ]
Помимо растений, ППДК также обнаружена у паразитической амеобы Entamoeba histolytica ( P37213 ) и бактерий Clostridium symbiosum ( P22983 ; а также у других бактерий). [ 12 ] В этих двух организмах PPDK функционирует аналогично (а иногда и вместо) пируваткиназы, катализируя реакцию в направлении производства АТФ в рамках гликолиза. Ингибиторы Entamoeba PPDK были предложены в качестве амебицидов против этого организма. [ 13 ]
Регулирование
[ редактировать ]
Растительная PPDK регулируется пируватом , регуляторным белком фосфатдикиназы (PDRP). [ 4 ] При высоком уровне света PDRP дефосфорилирует Thr 456 на PPDK с помощью AMP , тем самым активируя фермент. [ 10 ] PDRP деактивирует PPDK путем фосфорилирования того же треонина остатка с использованием дифосфата . PDRP является уникальным регулятором , поскольку он катализирует как активацию, так и деактивацию PPDK посредством двух разных механизмов. [ 10 ]
Исследования PPDK кукурузы показывают, что интроны , терминаторные последовательности и, возможно, другие энхансерные последовательности действуют совместно, увеличивая уровень функциональной и стабильной мРНК . PPDK кДНК экспрессировалась лишь незначительно в трансгенном рисе по сравнению с интактной ДНК, экспрессия которой была значительной. [ 14 ]
Структурные исследования
[ редактировать ]По состоянию на начало 2018 года 14 структур для этого класса ферментов решено PDB с кодами доступа 1DIK , 1GGO , 1H6Z , 1JDE , 1KBL , 1KC7 , 1VBG , 1VBH , 2DIK , 2FM4 , 5JVJ , 5JVL , 5JVN , 5LU4 .
Ссылки
[ редактировать ]- ^ Покалико DJ, Кэрролл LJ, Мартин Б.М., Бэббит ПК, Данауэй-Мариано Д. (декабрь 1990 г.). «Анализ гомологии последовательностей растительной и бактериальной пируватфосфатдикиназы, фермента I бактериальной фосфоенолпируват: системы сахарофосфотрансферазы и других ферментов, использующих PEP. Идентификация потенциальных каталитических и регуляторных мотивов». Биохимия . 29 (48): 10757–65. дои : 10.1021/bi00500a006 . ПМИД 2176881 .
- ^ Эванс Х.Дж., Вуд Х.Г. (декабрь 1968 г.). «Механизм пируват-фосфатдикиназной реакции» . Труды Национальной академии наук Соединенных Штатов Америки . 61 (4): 1448–53. Бибкод : 1968PNAS...61.1448E . дои : 10.1073/pnas.61.4.1448 . ПМК 225276 . ПМИД 4303480 .
- ^ Jump up to: а б с д и Херцберг О., Чен С.С., Лю С., Темпчик А., Ховард А., Вэй М. и др. (январь 2002 г.). «Пируватный сайт пируватфосфатдикиназы: кристаллическая структура фермент-фосфонопируватного комплекса и мутантный анализ». Биохимия . 41 (3): 780–7. дои : 10.1021/bi011799+ . ПМИД 11790099 .
- ^ Jump up to: а б Честейн CJ, Failing CJ, Манандхар Л., Циммерман М.А., Лакнер М.М., Нгуен Т.Х. (май 2011 г.). «Функциональная эволюция пирувата C (4), ортофосфат дикиназы» . Журнал экспериментальной ботаники . 62 (9): 3083–91. дои : 10.1093/jxb/err058 . ПМИД 21414960 .
- ^ Jump up to: а б Херцберг О., Чен С.С., Кападиа Г., МакГуайр М., Кэрролл Л.Дж., Но С.Дж., Данауэй-Мариано Д. (апрель 1996 г.). «Механизм поворотного домена ферментативного фосфопереноса между удаленными участками реакции» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (7): 2652–7. Бибкод : 1996PNAS...93.2652H . дои : 10.1073/pnas.93.7.2652 . ПМК 39685 . ПМИД 8610096 .
- ^ Лим К., Рид Р.Дж., Чен С.С., Темпчик А., Вэй М., Йе Д. и др. (декабрь 2007 г.). «Механизм поворотного домена в пируватфосфатдикиназы». Биохимия . 46 (51): 14845–53. CiteSeerX 10.1.1.421.2653 . дои : 10.1021/bi701848w . ПМИД 18052212 .
- ^ Jump up to: а б Наканиси Т., Накацу Т., Мацуока М., Саката К., Като Х. (февраль 2005 г.). «Кристаллические структуры пируватфосфатдикиназы кукурузы выявили альтернативную конформацию при движении поворотного домена». Биохимия . 44 (4): 1136–44. дои : 10.1021/bi0484522 . ПМИД 15667207 .
- ^ Jump up to: а б с Берг Дж., Тимочко Дж., Страйер Л. (2012). «Цикл Кальвина и пентозофосфатный путь». Биохимия (7-е изд.). Нью-Йорк: WH Freeman. стр. 599–600. ISBN 9780716787242 .
- ^ Честейн С. (2010). «Структура, функция и посттрансляционная регуляция пируват-ортофосфат-дикиназы C4». В Рагхавендре А (ред.). Фотосинтез C4 и связанные с ним механизмы концентрации CO2 . стр. 301–305. ISBN 9789048194063 .
- ^ Jump up to: а б с д Честейн С.Дж., Фрис Дж.П., Фогель Дж.А., Рандклев К.Л., Воссен А.П., Диттмер С.К. и др. (апрель 2002 г.). «Пируват, ортофосфат дикиназа в листьях и хлоропластах растений C (3) подвергается обратимому фосфорилированию, индуцированному светом / темнотой» . Физиология растений . 128 (4): 1368–78. дои : 10.1104/стр.010806 . ПМК 154264 . ПМИД 11950985 .
- ^ Роше Э., Штребель М., Вестхофф П. (октябрь 1994 г.). «Первичная структура фотосинтетической пируват-ортофосфат-дикиназы растения C3 Flaveria pringlei и анализ экспрессии последовательностей пируват-ортофосфат-дикиназы у видов C3, C3-C4 и C4 Flaveria». Молекулярная биология растений . 26 (2): 763–9. дои : 10.1007/bf00013761 . ПМИД 7948930 . S2CID 23276817 .
- ^ Кластеры UniProt 50–90%: из Clostridium PPDK.
- ^ Стивен П., Виджаян Р., Бхат А., Суббарао Н., Бамезай Р.Н. (сентябрь 2008 г.). «Молекулярное моделирование пируватфосфатдикиназы Entamoeba histolytica и виртуальный скрининг in silico новых ингибиторов». Журнал компьютерного молекулярного дизайна . 22 (9): 647–60. Бибкод : 2008JCAMD..22..647S . дои : 10.1007/s10822-007-9130-2 . ПМИД 17710553 . S2CID 25026913 .
- ^ Фукаяма Х., Цучида Х., Агари С., Номура М., Онодера Х., Оно К. и др. (ноябрь 2001 г.). «Значительное накопление C (4)-специфической пируват-ортофосфат-дикиназы в C (3)-растении, рисе» . Физиология растений . 127 (3): 1136–46. дои : 10.1104/стр.010641 . ПМК 129282 . ПМИД 11706193 .
Дальнейшее чтение
[ редактировать ]- Hatch MD, Slack CR (январь 1968 г.). «Новый фермент взаимного превращения пирувата и фосфопирувата и его роль в пути фотосинтеза дикарбоновой кислоты C4» . Биохимический журнал . 106 (1): 141–6. дои : 10.1042/bj1060141 . ПМЦ 1198479 . ПМИД 4305612 .
- Ривз Р.Э. (июнь 1968 г.). «Новый фермент с гликолитической функцией пируваткиназы» . Журнал биологической химии . 243 (11): 3202–4. дои : 10.1016/S0021-9258(18)93395-8 . ПМИД 4297474 .
- Ривз Р.Э. (ноябрь 1971 г.). «Пируват,фосфатдикиназа из Bacteroides symbiosus» . Биохимический журнал . 125 (2): 531–9. дои : 10.1042/bj1250531 . ПМК 1178089 . ПМИД 5144757 .
- Ривз Р.Э., Мензис Р.А., Сюй Д.С. (октябрь 1968 г.). «Пируват-фосфатдикиназная реакция. Судьба фосфата и равновесие» . Журнал биологической химии . 243 (20): 5486–91. дои : 10.1016/S0021-9258(18)91972-1 . ПМИД 4302788 .
