11β-гидроксистероиддегидрогеназа
11β-гидроксистероиддегидрогеназы ( HSD-11β или 11β-HSD ) Ферменты катализируют превращение инертных 11-кето-продуктов ( кортизона ) в активный кортизол или наоборот, [ 1 ] регулируя таким образом доступ глюкокортикоидов к стероидным рецепторам.
Геном человека кодирует два разных изофермента HSD-11β ( HSD-11β типа 1 и HSD-11β типа 2 ) в разных генах. Дегидрогеназная активность HSD-11β превращает 11бета-гидроксистероид в соответствующий 11-оксостероид путем восстановления НАДФ. + или НАД + . HSD-11β являются частью более крупного класса оксидоредуктаз , а HSD-11β типа 1 обладает оксидоредуктазной активностью (обратной дегидрогеназной активности). HSD-11β участвуют в c21- стероидных гормонов метаболизме , а также в метаболизме андрогенов и эстрогенов .
Структурные исследования
[ редактировать ]На сегодняшний день с помощью различных мутаций и ингибиторов решено несколько структур HSD-11β типа 1. Структуры HSD-11β типа 2 неизвестны.
Функция
[ редактировать ]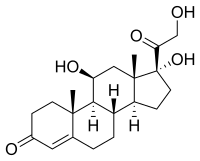

Кортизол , глюкокортикоид, связывает глюкокортикоидный рецептор. Однако из-за его молекулярного сходства с альдостероном он также связывает рецептор минералкортикоида в более высоких концентрациях. И альдостерон, и кортизол имеют одинаковое сродство к минералокортикоидным рецепторам; однако в циркуляции содержится гораздо больше кортизола, чем альдостерона. Чтобы предотвратить чрезмерную стимуляцию минералокортикоидных рецепторов кортизолом, HSD-11β преобразует биологически активный кортизол в неактивный кортизон, который больше не может связывать минералокортикоидный рецептор. [ 2 ] HSD-11βs локализуется совместно с внутриклеточными стероидными рецепторами надпочечников. Солодка , содержащая глицирризиновую кислоту и эноксолон , может ингибировать HSD-11β и приводить к явному синдрому избытка минералокортикоидов . В результате уровень кортизола повышается, и связывание кортизола с рецептором минералокортикоидов вызывает клинические признаки и симптомы гипокалиемии, алкалоза и гипертонии (т. е. избытка минералокортикоидов).
изоферменты
[ редактировать ]У человека существует два изофермента 11β-HSD: [ 3 ] [ 4 ] [ 5 ]
| Фермент | Ген | Кофакторная зависимость | Выражение | Реакции катализируются |
|---|---|---|---|---|
| HSD-11β Тип 1 | HSD11B1 | НАДФН -зависимый | Высокая экспрессия в ключевых метаболических тканях, включая печень , жировую ткань и центральную нервную систему . | Снижает кортизон до кортизола. |
| HSD-11β Тип 2 | HSD11B2 | ОНИ + -зависимый | Экспрессируется в селективных к альдостерону тканях, включая почки, печень, легкие, толстую кишку, слюнные железы, нейроны HSD2 и плаценту. | Окисляет кортизол до кортизона. |
Клиническое применение
[ редактировать ]HSD-11β представляют собой ферменты, участвующие в физиологии стероидных гормонов. HSD-11β типа 1 обнаруживается в метаболических тканях, на которые воздействуют глюкокортикоиды, и превращает кортизон в активный кортизол. [ 6 ] HSD-11β типа 1 действует как редуктаза, продуцирующая активный кортизол и усиливающая глюкокортикоиды. Этот фермент наиболее распространен в печени, но его можно найти в большинстве тканей организма. HSD11B-тип 1 увеличивает концентрацию глюкокортикоидов в печени и жировой ткани, избыток глюкокортикоидов вызывает ожирение с другими проявлениями, такими как гипертония и сахарный диабет. [ 7 ]
HSD-11β типа 2 экспрессируется тканями, селективными к альдостерону, и защищает минералокортикоидный рецептор от активации кортизолом, превращая его в кортизон с помощью фермента 11-оксоредуктазы. HSD-11β типа 2 защищает ткани от постоянной активации, снижая локальные уровни кортизола и предотвращая активацию 11-оксоредуктазы. [ 6 ] В тканях, которые не экспрессируют минералокортикоидные рецепторы, таких как плацента и семенники, он защищает клетки от ингибирующего рост и/или проапоптотического действия кортизола, особенно во время эмбрионального развития. Мутации в этом гене вызывают синдром выраженного избытка минералокортикоидов и гипертонию. [ 8 ]
Поскольку основные функции HSD-11β заключаются в регуляции глюкокортикоидов, эти два изозима связаны с различной чрезмерной стимуляцией или истощением запасов глюкокортикостероидов, что приводит к химическому дисбалансу в организме человека. Эффекты фермента, связанные с конкретными функциями организма и связанными с ним нарушениями, перечислены ниже.
Влияние гиперлипидемии на 11β-гидроксистероиддегидрогеназу
Гиперлипидемия оказывает большое влияние на 11β-гидроксистероиддегидрогеназу. [ 9 ] Уровень глюкокортикоидов зависит от концентрации глюкокортикоидов в плазме, экспрессии клеточных рецепторов глюкокортикоидов и метаболизма пререцепторных гормонов, который катализируется 11β-HSD. [ 9 ] Существует два типа 11β-гидроксистероиддегидрогеназ, которые контролируют концентрацию кортизола: HSD-11β типа 1 и HSD-11β типа 2. [ 9 ] HSD-11β типа 1 отвечает за преобразование кортизола в кортизол, действуя как оксо-редуктаза, поскольку он зависит от НАДФ (H), тогда как HSD-11β типа 2 инактивирует кортизол в кортизон посредством НАД. [ 9 ] 10-дневная гиперлипидемия увеличивает экспрессию HSD-11β типа 1 в висцеральной и подкожной жировой ткани. [ 9 ] Гиперлипидемия снижает экспрессию HSD-11β типа 2 в печени и жировой ткани. [ 9 ] Гиперлипидемия оказывает большое влияние на HSD-11β типа 1 и HSD-11β типа 2. [ 9 ] Это демонстрирует, что, вероятно, существует связь между гиперлипидемией и метаболизмом кортизола. [ 9 ] Болезнь Кушинга, синоним гиперкортизолизма, предполагает подавление кортизол-нейтрализующей способности 11β-HSD2 высокими концентрациями кортизола. [ 10 ] Это позволяет кортизолу превосходить альдостерон и связываться с минералокортикоидными рецепторами, что приводит к активации нескольких путей, повышающих кровяное давление. [ 11 ]
Активность HSD-11β в органах
[ редактировать ]HSD-11β активны в органах и надпочечниках. [ 12 ] Два изофермента берут на себя различные обязанности. [ 12 ] В активном состоянии HSD-11β способствует увеличению содержания глюкокортикоидов в гепатоцитах, а также усиливает глюконеогенез. [ 12 ] Изозим типа 2 превращает активные глюкокортикоидные гормоны в неактивные метаболиты в тканях-мишенях, таких как почки, слюнные железы, кишечник и т. д. [ 12 ] Активация двух изоферментов HSD-11β в почках и печени запускает вненадпочечниковое образование при аллоксановом диабете, что связано со снижением синтеза глюкокортикоидных гормонов в надпочечниках. [ 12 ] Вненадпочечниковое образование приводит к повышенному локальному образованию кортикостерона в печени и имеет высокую активность реакций с глюконеогенезом. [ 12 ] Эти реакции глюконеогенеза усугубляют продолжающиеся метаболические нарушения, подобные диабету. [ 12 ] Таким образом, HSD-11β типа 1 может служить потенциальным средством лечения диабета, ожирения и метаболического синдрома из-за повышения местного кортикостерона. [ 12 ]
Участие в мозге
[ редактировать ]HSD-11β экспрессируются в центральной нервной системе пожилых людей. [ 13 ] Это важно для функции гипоталамо-гипофизарно-надпочечниковой системы. [ 13 ] HSD-11βs также участвует в снижении сознательной интеллектуальной активности из-за старения. [ 13 ] Фермент также способствует центральным эффектам на стадиях развития. [ 13 ] Например, HSD-11βs типа 2 часто обнаруживается в тканях плода, таких как мозг новорожденного и плацента. [ 13 ] Если в тканях плода наблюдается отсутствие или снижение уровня HSD-11β типа 2, возникают негативные последствия для развития, такие как тревога. [ 13 ]
HSD-11β частично ответственны за внутриклеточный метаболизм, который определяет работу глюкокортикоидов внутри клеток. [ 13 ] Глюкокортикоиды влияют на развитие мозга и, в конечном итоге, на функцию центральной нервной системы. [ 13 ] Настолько, что если его избыток или скудное количество, последствиями являются уродства на протяжении всей жизни. [ 13 ] HSD-11β типа 1 отвечает за активацию глюкокортикоидов, а HSD-11β типа 2 отвечает за их деактивацию. [ 13 ] Последствиями активации глюкокортикоидов HSD-11β типа 1 является снижение когнитивных функций, особенно с возрастом. [ 13 ] Напротив, эффекты HSD-11β типа 2 проявляются во время развития. [ 13 ] Некоторыми последствиями высокой экспрессии HSD-11β типа 2 являются тревожность и кардиометаболические расстройства, оба из которых являются частью глюкокортикоидного программирования раннего возраста. [ 13 ]
Участие в преждевременных родах
[ редактировать ]Младенцы, рожденные с недостаточным весом, подвержены метаболическим заболеваниям на протяжении всей своей жизни. [ 14 ] Присутствие глюкокортикоидов способствовало относительно низкой массе тела ребенка при рождении. [ 14 ] Снижение HSD-11β типа 2 в плаценте может привести к ограничению роста ребенка, особенно в течение первых 12 месяцев жизни ребенка. [ 14 ] Причина этого в том, что HSD-11β типа 2 должен экспрессироваться в плаценте в больших количествах. Это происходит потому, что ферменты защищают плод от воздействия повышенных уровней глюкокортикоидов, которые связаны с недостаточным весом новорожденных. [ 14 ]
См. также
[ редактировать ]- Стероидогенный фермент
- 11β-гидроксистероиддегидрогеназа типа 1
- 11β-гидроксистероиддегидрогеназа типа 2
- Дефицит кортизонредуктазы
Ссылки
[ редактировать ]- ^ Секл-младший, Уокер Б.Р. (апрель 2001 г.). «Мини-обзор: 11бета-гидроксистероиддегидрогеназа 1 типа – тканеспецифический усилитель глюкокортикоидного действия» . Эндокринология . 142 (4): 1371–6. дои : 10.1210/en.142.4.1371 . ПМИД 11250914 .
- ^ Холл, Джон Э. (2021). Учебник Гайтона и Холла по медицинской физиологии . Майкл Э. Холл (14-е изд.). Филадельфия, Пенсильвания: Эльзевир. п. 958. ИСБН 978-0-323-59712-8 . OCLC 1129099861 .
- ^ Стюарт П.М., Крозовский З.С. (1999). «11 бета-гидроксистероиддегидрогеназа». Витамины и гормоны . 57 : 249–324. дои : 10.1016/S0083-6729(08)60646-9 . ISBN 978-0-12-709857-9 . ПМИД 10232052 .
- ^ Секл-младший (январь 1997 г.). «11бета-гидроксистероиддегидрогеназа в головном мозге: новый регулятор действия глюкокортикоидов?». Передний нейроэндокринол . 18 (1): 49–99. дои : 10.1006/frne.1996.0143 . ПМИД 9000459 . S2CID 46477930 .
- ^ Анагностис П., Атирос В.Г., Циомалос К., Карагианнис А., Михайлидис Д.П. (2009). «Клинический обзор: Патогенетическая роль кортизола при метаболическом синдроме: гипотеза» . Журнал клинической эндокринологии и метаболизма . 94 (8): 2692–2701. дои : 10.1210/jc.2009-0370 . ПМИД 19470627 .
- ^ Jump up to: а б Линдси, Кейтлин. «Кейтлин Линдси: медицинская и научная иллюстрация» . kaitlinlindsay.com . Архивировано из оригинала 22 апреля 2019 г.
- ^ Хьюз, Кэтрин А; Вебстер, Скотт П.; Уокер, Брайан Р. (25 марта 2008 г.). «Ингибиторы 11-бета-гидроксистероиддегидрогеназы 1-го типа (11β-HSD1) при сахарном диабете 2-го типа и ожирении». Экспертное заключение об исследуемых препаратах . 17 (4): 481–496. дои : 10.1517/13543784.17.4.481 . ISSN 1354-3784 . ПМИД 18363514 . S2CID 72573025 .
- ^ «Ген HSD11B2» . www.greencards.org .
- ^ Jump up to: а б с д и ж г час Зибер-Рукштуль, Надя С.; Зини, Эрик; Осто, Мелани; Франкини, Марко; Боретти, Фелиситас С.; Мели, Марина Л.; Сигрист, Бриджит; Лутц, Томас А.; Ройш, Клаудия Э. (ноябрь 2010 г.). «Влияние гиперлипидемии на 11β-гидроксистероиддегидрогеназу, рецептор глюкокортикоидов и экспрессию лептина в чувствительных к инсулину тканях кошек» (PDF) . Эндокринология домашних животных . 39 (4): 222–230. дои : 10.1016/j.domaniend.2010.06.003 . ISSN 0739-7240 . ПМИД 20688460 . Архивировано из оригинала (PDF) 19 июля 2018 г. Проверено 11 декабря 2019 г.
- ^ Чикала, Мария Верена; Мантеро, Франко (2010). «Гипертония при синдроме Кушинга: от патогенеза к лечению» . Нейроэндокринология . 92 (Приложение 1): 44–49. дои : 10.1159/000314315 . ISSN 0028-3835 . ПМИД 20829617 .
- ^ Фуллер Питер Дж.; Янг Мораг Дж. (1 декабря 2005 г.). «Механизмы действия минералокортикоидов» . Гипертония . 46 (6): 1227–1235. CiteSeerX 10.1.1.319.6620 . дои : 10.1161/01.HYP.0000193502.77417.17 . ПМИД 16286565 . S2CID 14749847 .
- ^ Jump up to: а б с д и ж г час Черкасова, ОП; Селятицкая В.Г.; Пальчикова, Н.А.; Кузнецова, Н.В. (29.11.2014). «Активность 11β-гидроксистероиддегидрогеназы в надпочечниках, печени и почках крыс с экспериментальным диабетом». Бюллетень экспериментальной биологии и медицины . 158 (2): 185–187. дои : 10.1007/s10517-014-2718-3 . ISSN 0007-4888 . ПМИД 25430643 . S2CID 24224772 .
- ^ Jump up to: а б с д и ж г час я дж к л м Уирволл, Кейтлин С.; Холмс, Меган С.; Секл, Джонатан Р. (август 2011 г.). «11β-гидроксистероиддегидрогеназы и мозг: от нуля до героя, десятилетие прогресса» . Границы нейроэндокринологии . 32 (3): 265–286. дои : 10.1016/j.yfrne.2010.12.001 . ISSN 0091-3022 . ПМК 3149101 . ПМИД 21144857 .
- ^ Jump up to: а б с д Роджерс, Саманта Л.; Хьюз, Беверли А.; Джонс, Кристофер А.; Фридман, Лорен; Умно, Кэтрин; Тейлор, Норман; Стюарт, Пол М.; Шеклтон, Седрик Х.Л.; Кроне, Нильс П. (май 2014 г.). «Снижение активности 11β-гидроксистероиддегидрогеназы типа 2 связано со снижением веса и его увеличением в течение первого года жизни» . Журнал клинической эндокринологии и метаболизма . 99 (5): Е821–Е831. дои : 10.1210/jc.2013-3254 . hdl : 2299/14902 . ISSN 0021-972X . ПМИД 24517145 .
- Агарвал А.К., Мондер С., Экстайн Б., Уайт ПК (1989). «Клонирование и экспрессия крысиной кДНК, кодирующей бета-дегидрогеназу кортикостероида 11» . Ж. Биол. Хим . 264 (32): 18939–43. дои : 10.1016/S0021-9258(19)47248-7 . ПМИД 2808402 .
- Буш И.Е., Хантер С.А., Мейгс Р.А. (1968). «Метаболизм 11-оксигенированных стероидов. Метаболизм in vitro препаратами печени» . Биохим. Дж . 107 (2): 239–58. дои : 10.1042/bj1070239 . ПМК 1198650 . ПМИД 4384445 .
- Лакшми В., Мондер С. (1988). «Очистка и характеристика кортикостероидного 11-бета-дегидрогеназного компонента комплекса 11-бета-гидроксистероиддегидрогеназы печени крысы». Эндокринология . 123 (5): 2390–8. дои : 10.1210/эндо-123-5-2390 . ПМИД 3139396 .
- Филлипс Д.М., Лакшми В., Мондер С. (1989). «Кортикостероид 11 бета-дегидрогеназа в семенниках крыс». Эндокринология . 125 (1): 209–16. дои : 10.1210/эндо-125-1-209 . ПМИД 2661206 .
Внешние ссылки
[ редактировать ]- 11-бета-гидроксистероид + дегидрогеназы Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)