Убиквитин-конъюгирующий фермент
| Убиквитин - протеинлигаза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 6.3.2.19 | ||
| Номер CAS. | 74812-49-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Убиквитин-конъюгирующий фермент, E2 | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | UBQ-сопряженное_E2 | ||
| Пфам | PF00179 | ||
| ИнтерПро | ИПР000608 | ||
| УМНЫЙ | SM00212 | ||
| PROSITE | PDOC00163 | ||
| Мембраном | 241 | ||
| |||
Ферменты, конъюгирующие убиквитин , также известные как ферменты Е2 и реже как ферменты-переносчики убиквитина , выполняют второй этап реакции убиквитинирования , направленной на деградацию белка через протеасому . Процесс убиквитинирования ковалентно присоединяет убиквитин , короткий белок из 76 аминокислот , к остатку лизина на целевом белке. После того, как белок помечен одной молекулой убиквитина, дополнительные раунды убиквитинирования образуют полиубиквитиновую цепь, которая распознается регуляторной частицей 19S протеасомы, запуская АТФ -зависимое разворачивание целевого белка, которое обеспечивает переход в центральную частицу 20S протеасомы, где протеазы расщепляют мишень на короткие пептидные фрагменты для переработки клеткой . [ 1 ]
Отношения
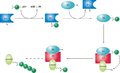
[ редактировать ]Фермент , активирующий убиквитин , или Е1, сначала активирует убиквитин, ковалентно прикрепляя молекулу к в ее активном центре остатку цистеина . Активированный убиквитин затем переносится на цистеин E2. После конъюгации с убиквитином молекула E2 связывается с одной из нескольких убиквитинлигаз или E3 через структурно консервативную область связывания . Молекула E3 отвечает за связывание субстрата целевого белка и перенос убиквитина из цистеина E2 на остаток лизина на целевом белке. [ 1 ]
-
Принципиальная схема системы убиквитилирования.
Конкретная клетка обычно содержит только несколько типов молекул E1, большее разнообразие E2 и очень большое разнообразие E3. У человека имеется около 30 E2, которые могут связываться с одним из более чем 600 E3. [ 2 ] Молекулы E3, ответственные за идентификацию и связывание субстрата, таким образом, являются механизмами субстратной специфичности при протеасомной деградации. Каждый тип E2 может ассоциироваться со многими E3. [ 3 ]
E2 также можно использовать для изучения механизмов сворачивания белков. Поскольку система убиквитилирования является общей для всех организмов, в исследованиях можно использовать модифицированные белки E2, чтобы понять общую систему того, как все организмы перерабатывают белки. [ 4 ] Существуют также некоторые белки, которые могут действовать как как E2, так и как домены, содержащие E3, которые охватывают как функциональность E2, так и E3. [ 5 ]
изоферменты
[ редактировать ]Следующие гены человека кодируют ферменты, конъюгирующие убиквитин:
- BE2A
- BE2B
- УБЕ2С
- UBE2D1 , UBE2D2 , UBE2D3 , UBE2D4 (последний предполагаемый)
- УБЭ2Е1 , УБЭ2Е2 , УБЭ2Е3
- UBE2F (предполагаемый)
- УБЭ2Г1 , УБЭ2Г2
- BE2H
- BE2I
- УБЕ2J1 , УБЭ2J2
- УБЭ2К
- УБЭ2Л3 , УБЭ2Л6 ; ( UBE2L1 , UBE2L2 , UBE2L4 — псевдогены)
- УБЭ2М
- УБЭ2Н
- BE2O
- БЕ2Q1 , БЕ2Q2
- УБЭ2Р1 (CDC34), УБЕ2Р2
- УБЭ2С
- УБЭ2Т (предположительно)
- УБЭ2У (предположительно)
- УБЭ2В1 , УБЭ2В2
- UBE2W (предполагаемый)
- BE2Z
- АТГ3
- BIRC6
- UFC1
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Нанди Д., Тахилиани П., Кумар А., Чанду Д. (март 2006 г.). «Убиквитин-протеасомная система». Журнал биологических наук . 31 (1): 137–155. дои : 10.1007/BF02705243 . ПМИД 16595883 . S2CID 21603835 .
- ^ Бердж Р.Дж., Дамиану А., Уилкинсон А.Дж., Роденко Б., Моттрам Дж.К. (октябрь 2020 г.). «Дифференциация Leishmania требует конъюгации убиквитина, опосредованной комплексом UBC2-UEV1 E2» . ПЛОС Патогены . 16 (10): e1008784. дои : 10.1371/journal.ppat.1008784 . ПМЦ 7647121 . ПМИД 33108402 .
- ^ Риссиев Е.П., Даскальчук Т.Е., Бэнкс Т.В., Лю Э., Котелесаж Дж., Хеллманн Х. и др. (июнь 2003 г.). «Анализ белкового взаимодействия субъединиц убиквитин E3-лигазы SCF из Arabidopsis». Заводской журнал . 34 (6): 753–767. дои : 10.1046/j.1365-313X.2003.01768.x . ПМИД 12795696 .
- ^ Хеннеберг Л.Т., Шульман Б.А. (июль 2021 г.). «Расшифровка сообщений убиквитиновой системы с использованием химических и белковых зондов» . Клеточная химическая биология . 28 (7): 889–902. doi : 10.1016/j.chembiol.2021.03.009 . ПМЦ 7611516 . ПМИД 33831368 .
- ^ Чанг С.К., Чжан Б.Х., Дин Дж.Л. (март 2022 г.). «Спаривание ферментов убиквитина E2-E3 - партнерство в провоцировании или смягчении рака» . Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1877 (2): 188679. doi : 10.1016/j.bbcan.2022.188679 . ПМИД 35074437 . S2CID 246224363 .
Внешние ссылки
[ редактировать ]- ресурса Eukaryotic Linear Motif Класс мотива MOD_SUMO
- Убиквитин-конъюгирующие + ферменты Национальной медицинской библиотеки США в медицинских предметных рубриках (MeSH)