Деубиквитинирующий фермент
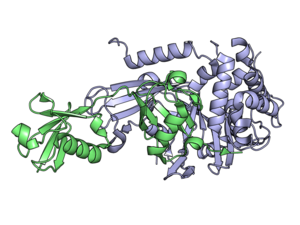

Деубиквитинирующие ферменты ( DUB ), также известные как деубиквитинирующие пептидазы , деубиквитинирующие изопептидазы , деубиквитиназы , убиквитинпротеазы , убиквитингидролазы или убиквитинизопептидазы , представляют собой большую группу протеаз. [ 1 ] которые отщепляют убиквитин от белков. [ 2 ] Убиквитин прикрепляется к белкам, чтобы регулировать деградацию белков через протеасому и лизосому ; координировать клеточную локализацию белков; активировать и инактивировать белки; и модулировать белок-белковые взаимодействия . [ 3 ] [ 4 ] [ 5 ] DUB могут обратить эти эффекты вспять, расщепляя пептидную или изопептидную связь между убиквитином и его белком-субстратом. У человека имеется около 100 генов DUB, которые можно разделить на два основных класса: цистеиновые протеазы и металлопротеазы . Цистеиновые протеазы включают убиквитин-специфичные протеазы (USP), убиквитин С-концевые гидролазы (UCH), протеазы домена Мачадо-Жозефина (MJD) и протеазы опухоли яичника (OTU). Группа металлопротеаз содержит только протеазы домена Jab1/Mov34/Mpr1 Pad1 N-концевого+ (MPN+) (JAMM). [ 2 ]
Классы
[ редактировать ]У человека имеется 102 предполагаемых гена DUB, которые можно разделить на два основных класса: цистеиновые протеазы и металлопротеазы , состоящие из 58 убиквитин-специфичных протеаз (USP), 4 убиквитиновых C-концевых гидролаз (UCH), 5 протеаз с доменом Мачадо-Жозефина. (MJDs), 14 протеаз опухоли яичников (OTU) и 14 генов, содержащих домен Jab1/Mov34/Mpr1 Pad1 N-концевой+ (MPN+) (JAMM). По прогнозам, 11 из этих белков окажутся нефункциональными, а 79 функциональных ферментов останутся. [ 6 ] У дрожжей USP известны как протеазы, специфичные для обработки убиквитина (UBP).
Цистеиновые протеазы
[ редактировать ]Существует шесть основных суперсемейств DUB цистеиновых протеаз: [ 7 ]
- суперсемейство убиквитин-специфичных протеаз (USP/UBP); ( USP1 , USP2 , USP3 , USP4 , USP5 , USP6 , USP7 , USP8 , USP9X , USP9Y , USP10 , USP11 , USP12 , USP13 , USP14 , USP15 , USP16 , USP17 , USP17L2 , USP17L3 , USP17L4 , USP17L7 , USP17L8 , USP18 USP17L5 , , USP19 , USP20 , USP21 , USP22 , USP23 , USP24 , USP25 , USP26 , USP27X , USP28 , USP29 , USP30 , USP34 , USP35 , USP33 , USP36 , USP37 , USP38 , USP39 , USP40 , USP41 , USP42 , , , USP32 USP43 USP31 , USP44 , USP45 , USP46 )
- суперсемейство опухолей яичников (OTU) ( OTUB1 , OTUB2 );
- и суперсемейство домена Мачадо-Жозефина (MJD). ( АТХН3 , АТХН3Л )
- суперсемейство убиквитин-С-концевых гидролаз (UCH); ( БАП1 , УХЛ1 , УХЛ3 , УХЛ5 )
- семейство деубиквитиназ, специфичных для K48, MINDY; ( МИНДИ1 , МИНДИ2 , МИНДИ3 , МИНДИ4 ) [ 8 ]
- недавно открытое семейство ZUFSP, в настоящее время представленное исключительно ZUP1. [ 9 ] [ 10 ]
| ТРИ | |||
|---|---|---|---|
 USP2 в комплексе с убиквитином. | |||
| Идентификаторы | |||
| Символ | ТРИ | ||
| Пфам | PF00443 | ||
| Пфам Клан | CL0125 | ||
| ИнтерПро | ИПР001394 | ||
| PROSITE | PDOC00750 | ||
| МЕРОПС | С19 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1нб8 / СКОПе / СУПФАМ | ||
| |||
Существует также малоизвестная предполагаемая группа DUB, называемая пермутированными пептидазами папаиновой складки суперсемейства вирусов дцДНК и эукариот (PPPDEs), которая, если будет доказано, что это настоящие DUB, станет седьмой в классе цистеиновых протеаз. [ 11 ]
Металлопротеазы
[ редактировать ]Белки суперсемейства домена Jab1/Mov34/Mpr1 Pad1 N-концевого+ (MPN+) (JAMM) связывают цинк и, следовательно, являются металлопротеазами. [ 7 ]
Роль деубиквитинирующих ферментов
[ редактировать ]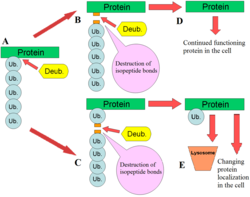
DUBs играют несколько ролей в пути убиквитина. Одной из наиболее изученных функций DUB является удаление моноубиквитиновых и полиубиквитиновых цепей из белков. Эти модификации представляют собой посттрансляционную модификацию (добавление к белку после его создания), при котором отдельные белки убиквитина или цепи убиквитина добавляются к лизинам белка-субстрата. Эти модификации убиквитина добавляются к белкам с помощью механизма убиквитинирования; убиквитин-активирующие ферменты (E1s), убиквитин-конъюгирующие ферменты (E2s) и убиквитинлигазы (E3s). В результате убиквитин связывается с остатками лизина посредством изопептидной связи . [ 12 ] Эти модификации влияют на белки по-разному: они регулируют деградацию белков через протеасому и лизосому ; координировать клеточную локализацию белков; активировать и инактивировать белки; и модулировать белок-белковые взаимодействия . [ 3 ] [ 4 ] [ 5 ] DUBs играют антагонистическую роль в этой оси, удаляя эти модификации, тем самым меняя судьбу белков. [ 2 ] Кроме того, менее понятная роль DUBs заключается в расщеплении убиквитиноподобных белков, таких как SUMO и NEDD8 . Некоторые DUB могут обладать способностью расщеплять изопептидные связи между этими белками и белками-субстратами. [ 13 ]
Они активируют убиквитин путем протеолиза (разрушения) неактивных экспрессируемых форм убиквитина. Убиквитин кодируется у млекопитающих четырьмя разными генами: UBA52 , RPS27A , UBB и UBC . Похожий набор генов обнаружен и у других эукариот, например у дрожжей. Гены UBA52 и RPS27A продуцируют убиквитин, который слит с рибосомальными белками, а гены UBB и UBC продуцируют полиубиквитин (цепь убиквитина, соединенную их C- и N-концами ). [ 14 ] [ 15 ] DUB отщепляют убиквитин от этих белков, образуя активные отдельные единицы убиквитина. [ 2 ]
которых могли быть DUB также расщепляют отдельные убиквитиновые белки, С-концевые хвосты случайно связаны с небольшими клеточными нуклеофилами . [ 2 ] Эти убиквитинамиды и убиквитинтиоэфиры могут образовываться в ходе стандартных реакций убиквитинирования по каскаду E1-E2-E3. Глутатион и полиамины — два нуклеофила, которые могут атаковать тиоэфирную связь между убиквитином и этими ферментами. Убиквитин С-концевая гидролаза является примером DUB, который гидролизует эти связи с широкой специфичностью. [ 13 ] [ 16 ]
Свободные полиубиквитиновые цепи расщепляются DUB с образованием моноубиквитина. Цепи могут быть получены с помощью механизма E1-E2-E3 в клетке, свободной от какого-либо белка-субстрата. Другим источником свободного полиубиквитина является продукт расщепления убиквитина-субстрата. Если DUB расщепляют основание полиубиквитиновой цепи, прикрепленной к белку, вся цепь становится свободной и должна быть переработана DUB. [ 2 ]
Домены
[ редактировать ]
DUB часто содержат каталитический домен, окруженный одним или несколькими дополнительными доменами, некоторые из которых способствуют распознаванию мишени. Эти дополнительные домены включают домен, присутствующий в домене убиквитин-специфических протеаз (DUSP); убиквитин-подобный (UBL) домен; домен гомологии меприна и TRAF (MATH); домен убиквитин-специфической протеазы с цинковыми пальцами (ZnF-UBP); миелоидный, нервный домен «цинковые пальцы» и домен DEAF1 (ZnF-MYND); убиквитин-ассоциированный (UBA) домен; домен CHORD-SGT1 (CS); домен взаимодействия и торговли микротрубочками (MIT); роденазоподобный домен; домен TBC/RABGAP; и домен B-box. [ 6 ] [ 17 ]
Каталитический домен
[ редактировать ]Каталитический домен DUB — это то, что разделяет их на определенные группы; USP, OTU, MJD, UCH и MPN+/JAMM. Первые 4 группы представляют собой цистеиновые протеазы , вторая — цинковые металлопротеазы . Цистеиновые протеазы DUB подобны папаину и, следовательно, имеют аналогичный механизм действия. Они используют либо каталитические диады, либо триады (две или три аминокислоты ) для катализа гидролиза амидных связей между убиквитином и субстратом. Остатки активного центра, которые способствуют каталитической активности DUB цистеиновых протеаз, представляют собой цистеин (диада/триада), гистидин (диада/триада) и аспартат или аспарагин (только триада). Гистидин поляризуется аспартатом или аспарагином в каталитических триадах или другими способами в диадах. Этот поляризованный остаток снижает рКа цистеина, позволяя ему осуществлять нуклеофильную атаку на изопептидную связь убиквитина между С-концом и субстратом лизином . Металлопротеазы координируют ионы цинка с гистидином, аспартатом и серином. остатки, которые активируют молекулы воды и позволяют им атаковать изопептидную связь. [ 18 ] [ 19 ]
УБЛ
[ редактировать ]Убиквитиноподобные (UBL) домены имеют структуру (складку), аналогичную убиквитину, за исключением того, что в них отсутствуют концевые остатки глицина. 18 USP предлагается иметь домены UBL. Только два других DUB имеют UBL вне группы USP: OTU1 и VCPIP1 . USP4, USP7, USP11, USP15, USP32, USP40 и USP47 имеют несколько доменов UBL. Иногда домены UBL расположены тандемно, например, в USP7, где 5 тандемных C-концевых присутствуют доменов UBL. USP4, USP6, USP11, USP15, USP19, USP31, USP32 и USP43 содержат домены UBL, встроенные в каталитический домен. Функции доменов UBL в разных USP различаются, но обычно они регулируют каталитическую активность USP. Они могут координировать локализацию на протеасоме (USP14); негативно регулировать USP, конкурируя за каталитический сайт USP (USP4), и вызывать конформационные изменения для увеличения каталитической активности (USP7). [ 17 ] [ 20 ] [ 21 ] Как и другие домены UBL, структура доменов USP UBL имеет складку β-захвата. [ 22 ] [ 23 ]
ДУСП
[ редактировать ]| ДУСП-домен | |||
|---|---|---|---|
 Структура решения домена DUSP HUSP15. | |||
| Идентификаторы | |||
| Символ | ДУСП | ||
| Пфам | PF06337 | ||
| ИнтерПро | ИПР006615 | ||
| МЕРОПС | С19 | ||
| |||
Одиночные или множественные тандемные домены DUSP длиной примерно 120 остатков обнаружены в шести USP. Функция домена DUSP в настоящее время неизвестна, но он может играть роль во взаимодействии белок-белок , в частности, в распознавании субстрата DUB. Это предсказано из-за гидрофобной щели, присутствующей в домене DUSP USP15, и того, что некоторые взаимодействия белков с USP, содержащими DUSP, не происходят без этих доменов. Домен DUSP представляет собой новую треножную складку, состоящую из трех спиралей и антипараллельного бета-листа, состоящего из трех нитей. Эта складка напоминает ножки (спирали) и сиденье (бета-лист) штатива. В большинстве доменов DUSP в USP имеется консервативная последовательность аминокислот, известная как мотив PGPI . Это последовательность из четырех аминокислот; пролин , глицин , пролин и изолейцин , который упаковывается в трехспиральный пучок и имеет высокую степень упорядоченности. [ 6 ] [ 24 ]
Роль в болезни
[ редактировать ]Полную степень роли DUB в заболеваниях еще предстоит выяснить. Их участие в заболевании прогнозируется благодаря известной роли в физиологических процессах, которые участвуют в болезненных состояниях; включая рак и неврологические расстройства. [ 25 ]
Фермент USP28 сверхэкспрессируется при различных типах рака, таких как рак толстой кишки или легких. Кроме того, USP28 деубиквитинирует и стабилизирует важные онкогены, такие как c-Myc , Notch1 , c-jun или ΔNp63 . [ 26 ] [ 27 ] [ 28 ] В плоскоклеточных опухолях USP28 регулирует устойчивость к химиотерапии, регулируя восстановление ДНК через ΔNp63 -Fanconia анемии. ось пути [ 29 ]
Деубиквитинирующие ферменты UCH-L3 и YUH1 способны гидролизовать мутантный убиквитин UBB+1, несмотря на то, что глицин в положении 76 мутирован. [ 30 ]
Уровни UCH-L1 высоки при различных типах злокачественных новообразований ( рака ). [ 31 ]
Роль в клеточном цикле
[ редактировать ]DUBs играют активную роль в модуляции клеточного цикла. Протеаза, специфичная для убиквитин-процессинга (USP), представляет собой семейство деубиквитинирующих ферментов, которые играют решающую роль в регуляции клеточного цикла. [ 32 ] Два таких фермента включают USP17 и USP44. USP17 регулирует пути, ответственные за продвижение клеток в клеточном цикле. [ 33 ] Его цели включают регуляторы Ras, CDK2 и Cyclin A. [ 34 ] USP44 играет важную роль в инициации анафазы. [ 35 ] Новое исследование митотической контрольной точки выявило новую роль USP44 в регуляции развития клеточного цикла. [ 35 ]
Регламент Фармакопеи США по Ras
[ редактировать ]Путь ERK позволяет трансдукцию внешних митогенных сигналов во внутриклеточные сигналы, способствующие клеточной пролиферации. Одним из ключевых регуляторов этого пути является Ras, ГТФаза, которая при активации связывает ГТФ, чтобы «включить» последующий сигнальный каскад. Ras-превращающий фермент 1 (RCE1) посттрансляционно расщепляет 3 остатка на C-конце Ras, позволяя Ras правильно локализоваться на плазматической мембране. [ 36 ]
USP17 деубиквитинирует домены K63-убиквитина на RCE1. [ 34 ] Такая стабилизация RCE1 обеспечивает правильную локализацию Ras, тем самым способствуя пролиферации при активации ранних рецепторов пути ERK. Гиперактивность Ras может привести к нарушению регуляции клеточного цикла. [ 37 ] Таким образом, регулирование Ras посредством USP17 действует как еще один момент регуляции Ras.
Регулирование USP перехода G1-S
[ редактировать ]Циклин-зависимые киназы (CDK) представляют собой семейство ферментов, которые фосфорилируют остатки серина и треонина, чтобы провести клетку через клеточный цикл. Активация CDK2 имеет решающее значение для перехода G1-S. Для активации CDK2 циклин А должен связываться с циклин-зависимым киназным комплексом (CDKC). Цикл клеточного деления 25А (CDC25A) представляет собой фосфатазу, которая удаляет ингибирующую фосфатную группу из CDK2. [ 38 ] В то время как убиквитинирование будет отмечать деубиквитинирование CDC25A, блокируя тем самым переход к S-фазе, USP17 деубиквитинирует CDC25A. [ 34 ] Увеличение стабильности CDC25A способствует активности CDKC, тем самым запуская клетку через переход G1-S.
USP17 также регулирует развитие клеточного цикла, воздействуя на SETD8, подавляя транскрипцию ингибитора циклин-зависимой киназы 1 (CDKN1A), также известного как p21. [ 34 ] CDKN1A связывается с CDK2 и ингибирует его, используя его N-концевой связывающий домен, тем самым блокируя переход G1-S. SETD8, метилтрансфераза, использует S-аденозилметионин для метилирования остатка Lys20 гистона 4, что приводит к конденсации хромосом. [ 39 ] Это уплотнение ДНК подавляет транскрипцию CDKN1A. USP17 деубиквитинирует SETD8, тем самым снижая его склонность к деградации и повышая его внутриклеточную стабильность. [ 34 ] Возникающее в результате подавление транскрипции CDKN1A способствует активности CDK2, позволяя клетке пройти переход G1-S. См. схему роли DUB в регуляции клеточного цикла. [ 34 ]

USP44 в начале анафазы
[ редактировать ]Контрольная точка веретена (также называемая митотической контрольной точкой) обеспечивает правильное разделение хромосом. В целом, митотическая контрольная точка способствует точности хромосомной сегрегации, увеличивая вероятность того, что каждая дочерняя клетка получит только одну дублированную хромосому. [ 40 ] Такой механизм имеет решающее значение, поскольку ошибки в разделении хромосом приводят к раку, врожденным дефектам и устойчивости патогенов к антибиотикам. [ 41 ] Одним из основных белков-регуляторов является комплекс, способствующий анафазе (APC/C). APC/C убиквитинирует секурин. [ 42 ] В результате происходит разрушение обеспечивающего высвобождения сепаразы, [ 40 ] который гидролизует слипчивость – белок, связывающий сестринские хроматиды вместе.
Новое исследование Стегмайера и его коллег [ 35 ] опубликованная в журнале Nature демонстрирует решающую роль USP44 в регулировании контрольной точки шпинделя. С помощью скрининга shRNA было обнаружено, что USP44 стабилизирует ингибирование APC/C. [ 35 ] Связывание CDC20 с APC/C необходимо для убиквитинирования секурина. [ 43 ] Белок hMAD2 может образовывать неактивный тример с APC и CDC20, образуя комплекс hMAD2-CDC-APC. [ 43 ] При убиквитинировании CDC20 с помощью UbcH10 hMAD2 диссоциирует и APC/C становится активным. [ 44 ] Важно отметить, что убиквитинирование CDC20 не сигнализирует о его деградации, а скорее способствует диссоциации hMAD2 от комплекса hMAD2-CDC-APC. USP44, протеаза, специфичная для процессинга убиквитина, может стабилизировать неактивный комплекс hMAD2-CDC-APC, противодействуя убиквитинированию UbcH10. Это блокирует диссоциацию hMAD2 и обеспечивает правильную регуляцию APC/C, сохраняя его неактивным до правильного прикрепления митотического веретена. При правильном подключении поведение переключателя позволяет активировать APC/C. [ 35 ] Это приводит к разрыву слипчивости, что позволяет разделить сестринские хроматиды.
Роль в репарации повреждений ДНК, опосредованных р53
[ редактировать ]Повреждение ДНК может оказаться катастрофическим для организма. Механизмы мутации ДНК включают окислительный стресс, ошибки репликации ДНК, экзогенные канцерогены, радиацию и спонтанную мутацию оснований. При повреждении ДНК прогрессирование клеточного цикла останавливается, чтобы предотвратить распространение мутации. Ген TP53 (также известный как p53) имеет решающее значение для обеспечения сохранения генома. [ 45 ] Деубиквитинирующие ферменты играют важную роль в поддержании функции р53.
В здоровых клетках p53 активирует убиквитинлигазу E3 MDM2, которая, в свою очередь, убиквитинирует p53. Это создает петлю отрицательной обратной связи , благодаря которой деградация р53 позволяет клеткам проходить клеточный цикл. При повреждении ДНК протеаза 7, специфично обрабатывающая убиквитин (USP7), стабилизирует р53, расщепляя убиквитин. [ 46 ] Чтобы USP7 деубиквитинировал p53, он должен локализоваться в ядре. Однако последовательность ядерной локализации (NLS) не обнаружена. [ 47 ] Несмотря на отсутствие известных NLS, одно исследование показало, что после удаления N-конца USP7 ядерной локализации не происходит. [ 47 ] Возможно, что другие белки облегчают проникновение USP7 в ядро.
После стабилизации р53 может осуществлять функцию подавления опухоли. Нижние пути р53 действуют либо на остановку прогрессирования клеточного цикла в фазах G1 или G2 клеточного цикла. [ 48 ] или способствуют гибели клеток, в зависимости от серьезности повреждения ДНК. [ 49 ] См. схему роли USP7 в p53-зависимом пути. [ 48 ] или способствуют гибели клеток, в зависимости от серьезности повреждения ДНК. [ 49 ] См. схему роли USP7 в p53-зависимом пути. [ 49 ]

Ссылки
[ редактировать ]- ^ Уилкинсон К.Д. (декабрь 1997 г.). «Регуляция убиквитинзависимых процессов деубиквитинирующими ферментами» . Журнал ФАСЭБ . 11 (14): 1245–56. дои : 10.1096/fasebj.11.14.9409543 . ПМИД 9409543 . S2CID 11788220 .
- ^ Перейти обратно: а б с д и ж Рейес-Турку Ф.Е., Вентий К.Х., Уилкинсон К.Д. (2009). «Регуляция и клеточная роль убиквитин-специфичных деубиквитинирующих ферментов» . Ежегодный обзор биохимии . 78 : 363–97. doi : 10.1146/annurev.biochem.78.082307.091526 . ПМК 2734102 . ПМИД 19489724 .
- ^ Перейти обратно: а б Гликман М.Х., Чехановер А. (апрель 2002 г.). «Убиквитин-протеасомный протеолитический путь: разрушение ради строительства». Физиологические обзоры . 82 (2): 373–428. doi : 10.1152/physrev.00027.2001 . ПМИД 11917093 .
- ^ Перейти обратно: а б Мухопадхьяй Д., Ризман Х. (январь 2007 г.). «Независимые от протеасом функции убиквитина в эндоцитозе и передаче сигналов». Наука . 315 (5809): 201–5. Бибкод : 2007Sci...315..201M . дои : 10.1126/science.1127085 . ПМИД 17218518 . S2CID 35434448 .
- ^ Перейти обратно: а б Шнелл Дж. Д., Хике Л. (сентябрь 2003 г.). «Нетрадиционные функции убиквитина и убиквитин-связывающих белков» . Журнал биологической химии . 278 (38): 35857–60. дои : 10.1074/jbc.R300018200 . ПМИД 12860974 .
- ^ Перейти обратно: а б с Нийман С.М., Луна-Варгас, член парламента, Вельдс А., Бруммелькамп Т.Р., Дирак А.М., Сиксма Т.К., Бернардс Р. (декабрь 2005 г.). «Геномный и функциональный перечень деубиквитинирующих ферментов». Клетка . 123 (5): 773–86. дои : 10.1016/j.cell.2005.11.007 . hdl : 1874/20959 . ПМИД 16325574 . S2CID 15575576 .
- ^ Перейти обратно: а б Америка А.Ю., Хохштрассер М. (ноябрь 2004 г.). «Механизм и функция деубиквитинирующих ферментов» . Биохимия и биофизика Acta (BBA) - Исследования молекулярных клеток . 1695 (1–3): 189–207. дои : 10.1016/j.bbamcr.2004.10.003 . ПМИД 15571815 .
- ^ Абдул Рехман С.А., Кристариянто Я.А., Чой С.Ю., Нкоси П.Дж., Вейдлих С., Лабиб К. и др. (июль 2016 г.). «MINDY-1 является членом эволюционно консервативного и структурно отличного нового семейства деубиквитинирующих ферментов» . Молекулярная клетка . 63 (1): 146–55. doi : 10.1016/j.molcel.2016.05.009 . ПМЦ 4942677 . ПМИД 27292798 .
- ^ Квасна Д., Абдул Рехман С.А., Натараджан Дж., Мэтьюз С., Мэдден Р., Де Чезаре В. и др. (апрель 2018 г.). «Открытие и характеристика ZUFSP/ZUP1, особого класса деубиквитиназы, важного для стабильности генома» . Молекулярная клетка . 70 (1): 150–164.e6. doi : 10.1016/j.molcel.2018.02.023 . ПМК 5896202 . ПМИД 29576527 .
- ^ Германнс, Томас; Пичло, Кристиан; Войводе, Илька; Клопффляйш, Карстен; Виттинг, Катарина Ф.; Оваа, Хуиб; Бауманн, Ульрих; Хофманн, Кей (23 февраля 2018 г.). «Семейство нетрадиционных деубиквитиназ с детерминантами специфичности модульной цепи» . Природные коммуникации . 9 (1): 799. Бибкод : 2018NatCo...9..799H . дои : 10.1038/s41467-018-03148-5 . ISSN 2041-1723 . ПМЦ 5824887 . ПМИД 29476094 .
- ^ Айер Л.М., Кунин Е.В., Аравинд Л. (ноябрь 2004 г.). «Новый предсказал, что пептидазы могут играть потенциальную роль в сигнальном пути убиквитина». Клеточный цикл . 3 (11): 1440–50. дои : 10.4161/cc.3.11.1206 . ПМИД 15483401 .
- ^ Кершер О., Фельбербаум Р., Хохштрассер М. (2006). «Модификация белков убиквитином и убиквитиноподобными белками». Ежегодный обзор клеточной биологии и биологии развития . 22 : 159–80. doi : 10.1146/annurev.cellbio.22.010605.093503 . ПМИД 16753028 . S2CID 17584645 .
- ^ Перейти обратно: а б Крыло СС (май 2003 г.). «Дебиквитинирующие ферменты - важность обратного движения по пути убиквитин-протеасома». Международный журнал биохимии и клеточной биологии . 35 (5): 590–605. дои : 10.1016/s1357-2725(02)00392-8 . ПМИД 12672452 .
- ^ Кимура Ю, Танака К (июнь 2010 г.). «Регуляторные механизмы, участвующие в контроле гомеостаза убиквитина» . Журнал биохимии . 147 (6): 793–8. дои : 10.1093/jb/mvq044 . ПМИД 20418328 .
- ^ Озкайнак Э., Финли Д., Соломон М.Дж., Варшавский А. (май 1987 г.). «Гены убиквитина дрожжей: семейство природных слияний генов» . Журнал ЭМБО . 6 (5): 1429–39. дои : 10.1002/j.1460-2075.1987.tb02384.x . ПМК 553949 . ПМИД 3038523 .
- ^ Пиккарт CM, Роуз И.А. (июль 1985 г.). «Гидролаза с карбоксильным концом убиквитина действует на амиды с карбоксильным концом убиквитина» . Журнал биологической химии . 260 (13): 7903–10. дои : 10.1016/S0021-9258(17)39538-8 . ПМИД 2989266 .
- ^ Перейти обратно: а б Командер Д., Клэг М.Дж., Урбе С. (август 2009 г.). «Разрыв цепей: структура и функция деубиквитиназ». Обзоры природы. Молекулярно-клеточная биология . 10 (8): 550–63. дои : 10.1038/nrm2731 . ПМИД 19626045 . S2CID 19149247 .
- ^ Командер Д (2010). «Механизм, специфичность и структура деубиквитиназ». Конъюгация и деконъюгация модификаторов семейства убиквитинов . Субклеточная биохимия. Том. 54. С. 69–87. дои : 10.1007/978-1-4419-6676-6_6 . ISBN 978-1-4419-6675-9 . ПМИД 21222274 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Чепмен Х.А., Ризе Р.Дж., Ши Г.П. (1997). «Новая роль цистеиновых протеаз в биологии человека». Ежегодный обзор физиологии . 59 : 63–88. doi : 10.1146/annurev.physiol.59.1.63 . ПМИД 9074757 .
- ^ Фаэсен AC, депутат Луна-Варгас, Sixma TK (июнь 2012 г.). «Роль доменов UBL в убиквитин-специфичных протеазах». Труды Биохимического общества . 40 (3): 539–45. дои : 10.1042/BST20120004 . ПМИД 22616864 .
- ^ Й., Шил Х., Хофманн К., Командер Д. (декабрь 2009 г.). «Вскрытие каталитических доменов USP выявило пять общих точек вставки». Молекулярные биосистемы . 5 (12): 1797–808. дои : 10.1039/b907669g . ПМИД 19734957 .
- ^ Эллиотт П.Р., Лю Х., Пасток М.В., Гроссманн Г.Дж., Ригден Дж.Д., Клэг М.Дж. и др. (ноябрь 2011 г.). «Структурная изменчивость двойных доменов убиквитинспецифической протеазы DUSP-UBL». Письма ФЭБС . 585 (21): 3385–90. дои : 10.1016/j.febslet.2011.09.040 . ПМИД 22001210 . S2CID 5312371 .
- ^ Харпер С., Бесонг ТМ, Эмсли Дж., Скотт DJ, Древени I (сентябрь 2011 г.). «Структура N-концевых доменов USP15: β-шпилька обеспечивает тесную связь между доменами DUSP и UBL». Биохимия . 50 (37): 7995–8004. дои : 10.1021/bi200726e . ПМИД 21848306 .
- ^ де Йонг Р.Н., Аб Э., Диркс Т., Трюффо В., Дэниелс М., Каптейн Р., Фолкерс Г.Е. (февраль 2006 г.). «Структура раствора домена DUSP убиквитин-специфической протеазы 15 человека» . Журнал биологической химии . 281 (8): 5026–31. дои : 10.1074/jbc.M510993200 . ПМИД 16298993 .
- ^ Сингхал С., Тейлор MC, Бейкер RT (октябрь 2008 г.). «Дебиквитилирующие ферменты и болезни» . БМК Биохимия . 9 (Приложение 1): S3. дои : 10.1186/1471-2091-9-S1-S3 . ПМЦ 2582804 . ПМИД 19007433 .
- ^ Дифенбахер М.Е., Попов Н., Блейк С.М., Шуляйн-Фёлк С., Най Е., Спенсер-Дин Б. и др. (август 2014 г.). «Дубиквитиназа USP28 контролирует гомеостаз кишечника и способствует развитию колоректального рака» . Журнал клинических исследований . 124 (8): 3407–18. дои : 10.1172/JCI73733 . ПМК 4109555 . ПМИД 24960159 .
- ^ Прието-Гарсия С., Хартманн О., Рейсланд М., Браун Ф., Фишер Т., Уолц С. и др. (июнь 2019 г.). «Ось USP28-∆Np63 представляет собой уязвимость плоскоклеточных опухолей». bioRxiv 10.1101/683508 .
- ^ Прието-Гарсия С., Хартманн О., Рейсланд М., Браун Ф., Фишер Т., Уолц С. и др. (апрель 2020 г.). «Поддержание стабильности белка ∆Np63 посредством USP28 необходимо клеткам плоскоклеточного рака» . ЭМБО Молекулярная медицина . 12 (4): е11101. дои : 10.15252/emmm.201911101 . ПМК 7136964 . ПМИД 32128997 .
- ^ Прието-Гарсия С., Хартманн О., Рейсланд М., Фишер Т., Майер С.Р., Розенфельдт М. и др. (сентябрь 2020 г.). «Ингибирование USP28 преодолевает устойчивость плоскоклеточных опухолей к цисплатину путем подавления пути анемии Фанкони». bioRxiv 10.1101/2020.09.10.291278 .
- ^ Денниссен Ф.Дж., Холод Н., Гермес Д.Д., Кеммерлинг Н., Стейнбуш Х.В., Дантума Н.П., ван Леувен Ф.В. (август 2011 г.). «Мутантный убиквитин (UBB+1), связанный с нейродегенеративными расстройствами, гидролизуется С-концевой гидролазой убиквитина L3 (UCH-L3)» . Письма ФЭБС . 585 (16): 2568–74. дои : 10.1016/j.febslet.2011.06.037 . ПМИД 21762696 . S2CID 28207136 .
- ^ Фан Ю, Фу Д, Шен XZ (август 2010 г.). «Потенциальная роль убиквитин С-концевых гидролаз в онкогенезе». Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1806 (1): 1–6. дои : 10.1016/j.bbcan.2010.03.001 . ПМИД 20302916 .
- ^ Валлес Г.Дж., Безсонова И., Вудгейт Р., Эштон Н.В. (август 2020 г.). «USP7 — главный регулятор стабильности генома» . Границы клеточной биологии и биологии развития . 8 (717): 717. doi : 10.3389/fcell.2020.00717 . ПМЦ 7419626 . ПМИД 32850836 .
- ^ Фукуура К., Иноуэ Ю., Миядзима С., Ватанабэ С., Токугава М., Моришита Д. и др. (ноябрь 2019 г.). «Убиквитин-специфичная протеаза USP17 предотвращает клеточное старение, стабилизируя метилтрансферазу SET8 и подавляя транскрипцию р21 » . Журнал биологической химии . 294 (44): 16429–16439. дои : 10.1074/jbc.RA119.009006 . ПМК 6827320 . ПМИД 31533987 .
- ^ Перейти обратно: а б с д и ж Дакер С., Шоу П.Е. (январь 2021 г.). «Дубиквитинирование, опосредованное USP17, и рак: клиенты группируются вокруг клеточного цикла» (PDF) . Международный журнал биохимии и клеточной биологии . 130 (130): 105886. doi : 10.1016/j.biocel.2020.105886 . ISSN 1357-2725 . ПМИД 33227393 . S2CID 227158810 .
- ^ Перейти обратно: а б с д и Стегмайер Ф., Рапе М., Дравиам В.М., Налепа Г., Сова М.Э., Анг XL и др. (апрель 2007 г.). «Начало анафазы регулируется антагонистической активностью убиквитинирования и деубиквитинирования». Природа . 446 (7138): 876–81. Бибкод : 2007Natur.446..876S . дои : 10.1038/nature05694 . ПМИД 17443180 . S2CID 4321083 .
- ^ Карлссон С., Акула М.К., Стаффас А., Цисовски Дж., Сайин В.И., Ибрагим М.Х. и др. (февраль 2021 г.). «Нокаут эндопротеазы RCE1 RAS ускоряет миелолейкоз за счет подавления GADD45b». Лейкемия . 35 (2): 606–609. дои : 10.1038/s41375-020-0859-0 . ПМИД 32398789 . S2CID 218605961 .
- ^ Браун Б.С., Шеннон К. (апрель 2008 г.). «Нацеливание на Ras при миелоидных лейкозах» . Клинические исследования рака . 14 (8): 2249–52. дои : 10.1158/1078-0432.CCR-07-1005 . ПМИД 18413813 .
- ^ Шен Т., Хуан С. (июль 2012 г.). «Роль Cdc25A в регуляции пролиферации клеток и апоптоза» . Противораковые агенты в медицинской химии . 12 (6): 631–9. дои : 10.2174/187152012800617678 . ПМЦ 3544488 . ПМИД 22263797 .
- ^ Дэвид Р. (декабрь 2010 г.). «Клеточный цикл: Утилизация SETD8» . Обзоры природы. Молекулярно-клеточная биология . 11 (12): 819. дои : 10.1038/nrm3020 . ПМИД 21102605 . S2CID 30122715 .
- ^ Перейти обратно: а б Лю С.Т., Чжан Х. (октябрь 2016 г.). «Митотический контрольно-пропускной комплекс (MCC): взгляд назад и вперед через 15 лет» . AIMS Молекулярная наука . 3 (4): 597–634. дои : 10.3934/molsci.2016.4.597 . ПМК 5597056 . ПМИД 28920074 .
- ^ Потапова Т., Горбский Г.Ю. (февраль 2017 г.). «Последствия ошибок разделения хромосом при митозе и мейозе» . Биология . 6 (1): 12. doi : 10.3390/biology6010012 . ПМК 5372005 . ПМИД 28208750 .
- ^ Вирт К.Г., Риччи Р., Хименес-Абиан Дж.Ф., Тагибеглу С., Кудо Н.Р., Йохум В. и др. (январь 2004 г.). «Потеря комплекса, способствующего анафазе, в покоящихся клетках вызывает незапланированную пролиферацию гепатоцитов» . Гены и развитие . 18 (1): 88–9 дои : 10.1101/gad.285404 . ПМК 314282 . ПМИД 14724179 .
- ^ Перейти обратно: а б Фанг Г., Ю Х., Киршнер М.В. (июнь 1998 г.). «Белок контрольной точки MAD2 и митотический регулятор CDC20 образуют тройной комплекс с комплексом, способствующим анафазе, для контроля инициации анафазы» . Гены и развитие . 12 (12): 1871–83. дои : 10.1101/гад.12.12.1871 . ПМК 316912 . ПМИД 9637688 .
- ^ Питерс Дж. М. (апрель 2007 г.). «Клеточная биология: тормоз на контрольно-пропускном пункте снят» . Природа . 446 (7138): 868–9. Бибкод : 2007Natur.446..868P . дои : 10.1038/446868a . ПМИД 17443175 .
- ^ «Ген TP53» . МедлайнПлюс . Национальная медицинская библиотека США . Проверено 18 мая 2021 г.
- ^ Ли М, Чен Д, Шайло А, Луо Дж, Николаев А.Ю., Цинь Дж, Гу В (апрель 2002 г.). «Дубиквитинирование p53 с помощью HAUSP является важным путем стабилизации p53». Природа . 416 (6881): 648–53. Бибкод : 2002Natur.416..648L . дои : 10.1038/nature737 . ПМИД 11923872 . S2CID 4389394 .
- ^ Перейти обратно: а б Фернандес-Монтальван А., Бауместер Т., Джоберти Г., Мадер Р., Манке М., Пьеррат Б. и др. (август 2007 г.). «Биохимическая характеристика USP7 выявляет сайты посттрансляционной модификации и структурные требования для обработки субстрата и субклеточной локализации» . Журнал ФЭБС . 274 (16): 4256–70. дои : 10.1111/j.1742-4658.2007.05952.x . ПМИД 17651432 .
- ^ Перейти обратно: а б Донхауэр, Лос-Анджелес (май 2014 г.). «Фосфатазы обращают вспять контрольные точки клеточного цикла, опосредованные р53» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (20): 7172–3. Бибкод : 2014PNAS..111.7172D . дои : 10.1073/pnas.1405663111 . ПМК 4034213 . ПМИД 24808140 .
- ^ Перейти обратно: а б с Чен Л., Лю С., Тао Ю (июнь 2020 г.). «Регуляция генов-супрессоров опухолей: посттрансляционные модификации» . Сигнальная трансдукция и таргетная терапия . 5 (1): 90. дои : 10.1038/s41392-020-0196-9 . ПМЦ 7293209 . ПМИД 32532965 .