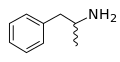
Скелетная формула
Скелетная формула , формула линии-угла , формула линии связи или сокращенная формула органического соединения — это тип молекулярной формулы , которая служит сокращенным представлением и связи молекулы структурной некоторых деталей ее молекулярной геометрии . Скелетная формула показывает скелетную структуру или скелет молекулы, который состоит из скелетных атомов , составляющих молекулу. [1] Он представлен в двух измерениях, как на листе бумаги. Он использует определенные условные обозначения для обозначения атомов углерода и водорода , которые наиболее распространены в органической химии.
Ранняя форма этого представления была впервые разработана химиком-органиком Августом Кекуле , в то время как современная форма тесно связана со структурой Льюиса молекул и их валентных электронов и находится под ее влиянием. Поэтому их иногда называют структурами Кекуле. [а] или структуры Льюиса-Кекуле . Скелетные формулы стали повсеместными в органической химии , отчасти потому, что их относительно быстро и просто нарисовать, а также потому, что обозначения изогнутыми стрелками, используемые для обсуждения механизмов реакций и делокализации электронов, можно легко наложить друг на друга.
В органической химии также широко используются несколько других способов изображения химических структур (хотя и реже, чем скелетные формулы). Например, конформационные структуры похожи на скелетные формулы и используются для изображения приблизительного положения атомов в трехмерном пространстве в виде перспективного рисунка. Другие типы представления, такие как проекция Ньюмана , проекция Хауорта или проекция Фишера , также чем-то похожи на скелетные формулы. Однако в используемых условных обозначениях есть небольшие различия, и читатель должен знать о них, чтобы понять структурные детали, закодированные в изображении. Хотя скелетные и конформационные структуры также используются в металлоорганической и неорганической химии , используемые соглашения также несколько различаются.
Скелет
[ редактировать ]Терминология
[ редактировать ]Скелетная структура органического соединения представляет собой ряд атомов, связанных вместе, которые образуют основную структуру соединения. Скелет может состоять из цепочек, ветвей и/или колец связанных атомов. Скелетные атомы, отличные от углерода и водорода, называются гетероатомами . [2]
Скелет содержит водород и/или различные заместители, связанные с его атомами. Водород — это наиболее распространенный неуглеродный атом, который связан с углеродом и для простоты не показан явно. Кроме того, атомы углерода обычно не обозначаются как таковые напрямую (т. е. буквой «C»), тогда как гетероатомы всегда явно обозначаются как таковые («N» для азота , «O» для кислорода и т. д.).
Гетероатомы и другие группы атомов, которые приводят к относительно высоким показателям химической активности или привносят специфические и интересные характеристики в спектры соединений, называются функциональными группами , поскольку они придают молекуле функцию. Гетероатомы и функциональные группы вместе называются «заместителями», поскольку они считаются заменителем атома водорода, который будет присутствовать в исходном углеводороде органического соединения.
Базовая структура
[ редактировать ]Как и в структурах Льюиса, ковалентные связи обозначаются сегментами линий, причем удвоенный или тройной сегмент линии указывает на двойную или тройную связь соответственно. Аналогично, скелетные формулы указывают формальные заряды, связанные с каждым атомом (хотя неподеленные пары обычно необязательны, см. ниже ). Фактически, скелетные формулы можно рассматривать как сокращенные структуры Льюиса, в которых наблюдаются следующие упрощения:
- Атомы углерода представлены вершинами (пересечениями или концами) отрезков линий. Для ясности метильные группы часто явно обозначаются как Me или CH 3 , тогда как (гетеро) кумуленовые атомы углерода часто обозначаются точкой с тяжелым центром .
- Подразумеваются атомы водорода, присоединенные к углероду. Под непомеченной вершиной понимается углерод, присоединенный к количеству атомов водорода, необходимому для удовлетворения правила октетов , тогда как вершина, помеченная формальным зарядом и/или несвязывающим электроном(ами), понимается как имеющая количество атомов водорода, необходимое для получения у атома углерода указанные свойства. Необязательно, для ясности, ацетиленовые и формильные атомы водорода могут быть показаны явно.
- Атомы водорода, присоединенные к гетероатому, показаны явно. Гетероатом и присоединенные к нему атомы водорода обычно изображаются как одна группа (например, OH, NH 2 ) без явного указания связи водород-гетероатом. Гетероатомы с простыми алкильными или арильными заместителями, например метокси (OMe) или диметиламино (NMe 2 ), иногда изображаются таким же образом, по аналогии.
- Неподеленные пары атомов углерода карбена должны быть указаны явно, тогда как неподеленные пары в других случаях не являются обязательными и показаны только для акцента. Напротив, формальные заряды и неспаренные электроны на элементах основной группы всегда явно показаны.
В стандартном изображении молекулы каноническая форма рисуется (резонансная структура) с наибольшим вкладом. Однако считается, что скелетная формула представляет собой «настоящую молекулу», то есть средневзвешенное значение всех участвующих канонических форм. Таким образом, в тех случаях, когда две или более канонические формы вносят равный вес (например, в бензоле или карбоксилат-анионе) и одна из канонических форм выбирается произвольно, считается, что скелетная формула отображает истинную структуру, содержащую эквивалентные связи дробного порядка, хотя делокализованные связи изображаются как неэквивалентные одинарные и двойные связи.
Современные графические соглашения
[ редактировать ]С момента появления скелетных структур во второй половине XIX века их внешний вид претерпел значительную эволюцию. Графические соглашения, используемые сегодня, относятся к 1980-м годам. Благодаря принятию пакета программного обеспечения ChemDraw в качестве фактического отраслевого стандарта ( Американского химического общества , Королевского химического общества и Gesellschaft Deutscher Chemiker например, публикациями ), эти соглашения стали почти универсальными в химической литературе с конца 1990-х годов. . Несколько незначительных традиционных вариаций, особенно в отношении использования стереосвязей, продолжают существовать в результате различий в практике США, Великобритании и Европы или в результате личных предпочтений. [3] Еще одно незначительное различие между авторами: формальные обвинения могут быть показаны со знаком плюс или минус в кружке (⊕, ⊖) или без кружка. Ниже приводится набор соглашений, которым следует большинство авторов, вместе с наглядными примерами.
- Облигации между сп 2 или сп 3 гибридизованный углерод или гетероатомы обычно изображаются с использованием углов 120°, когда это возможно, при этом самая длинная цепь атомов имеет зигзагообразную форму, если только она не прерывается двойной цис- связью. Если все четыре заместителя не указаны явно, это верно, даже если стереохимия изображается с использованием клиновидных или пунктирных связей ( см. Ниже ). [б]

- Если все четыре заместителя тетраэдрического углерода показаны явно, связи с двумя заместителями в плоскости все еще встречаются под углом 120 °; однако два других заместителя обычно изображаются с клиновидными и пунктирными связями (для изображения стереохимии) и образуют меньший угол 60–90 °.

- Линейная геометрия sp-гибридизированных атомов обычно изображается отрезками линий, пересекающимися под углом 180 °. Если это предполагает встречу двух двойных связей ( аллена или кумулена ), связи разделяются точкой.

- Карбо- и гетероциклы (3-8-членные) обычно представляют в виде правильных многоугольников; кольца большего размера обычно изображаются вогнутыми многоугольниками. [с]

- Атомы в группе упорядочены так, что связь исходит от атома, непосредственно прикрепленного к скелету. Например, нитрогруппа NO 2 обозначается -NO 2 или O 2 N- в зависимости от расположения связи. Напротив, изомерная нитритная группа обозначается -ONO или ONO- . [д]

Неявные атомы углерода и водорода
[ редактировать ]Например, скелетная формула гексана (вверху) показана ниже. Атом углерода, обозначенный C 1 , по-видимому, имеет только одну связь, поэтому с ним также должно быть связано три атома водорода, чтобы общее количество связей составило четыре. Атом углерода, обозначенный C 3, имеет две связи с другими атомами углерода и, следовательно, связан также с двумя атомами водорода. структура Льюиса (в центре) и шаростержневая модель (внизу) фактической молекулярной структуры гексана, определенной методом рентгеновской кристаллографии Для сравнения показаны .



Не имеет значения, с какого конца цепочки начинать нумерацию, главное, чтобы при рисовании диаграмм сохранялась последовательность. Сокращенная формула или название ИЮПАК подтвердят ориентацию. Некоторые молекулы станут знакомыми независимо от ориентации.
Явные гетероатомы и атомы водорода
[ редактировать ]Все атомы, которые не являются углеродом или водородом, обозначаются своим химическим символом , например Cl — хлор , O — кислород , Na — натрий и т. д. В контексте органической химии эти атомы обычно известны как гетероатомы ( приставка гетероатом происходит от греческого ἕτερος héteros, что означает «другой»).
Любые атомы водорода, связанные с гетероатомами, показаны явно. Например, в этаноле C 2 H 5 OH атом водорода, связанный с кислородом, обозначен символом H, тогда как атомы водорода, связанные с атомами углерода, непосредственно не показаны.
Линии, представляющие связи гетероатом-водород, обычно опускаются для ясности и компактности, поэтому функциональную группу, такую как гидроксильная группа, чаще всего пишут -OH вместо -O-H. Эти связи иногда вытягиваются полностью, чтобы подчеркнуть их присутствие при участии в механизмах реакции .
Ниже для сравнения показаны скелетная формула (вверху), ее структура Льюиса (в центре) и шаростержневая модель (внизу) фактической трехмерной структуры молекулы этанола в газовой фазе, определенной с помощью микроволновой спектроскопии .

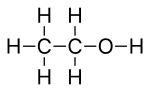

Символы псевдоэлементов
[ редактировать ]Существуют также символы, которые кажутся символами химических элементов , но представляют собой некоторые очень распространенные заместители или указывают на неопределенный член группы элементов. Их называют символами псевдоэлементов или органическими элементами, и в скелетных формулах они рассматриваются как одновалентные «элементы». [4] Список распространенных символов псевдоэлементов:
Общие символы
[ редактировать ]- X для любого ( псевдо ) атома галогена (в соответствующем обозначении MLXZ X представляет собой одноэлектронный донорный лиганд)
- L или L n для лиганда или лигандов (в соответствующем обозначении MLXZ L представляет собой двухэлектронный донорный лиганд)
- M или Met для любого атома металла ([M] используется для обозначения связанного металла, ML n , когда идентичность лигандов неизвестна или не имеет значения)
- E или El для любого электрофила (в некоторых контекстах E также используется для обозначения любого p-блока ) элемента
- Ну для любого нуклеофила
- Z для сопряжения электроноакцепторных групп (в соответствующем обозначении MLXZ Z представляет собой донорный лиганд с нулевым электронами; в несвязанном использовании Z также является аббревиатурой карбоксибензильной группы .)
- D для дейтерия ( 2 ЧАС)
- T для трития ( 3 ЧАС)
Алкильные группы
[ редактировать ]- R для любой алкильной группы или даже любой органильной группы (Alk может использоваться для однозначного обозначения алкильной группы)
- Я за метильную группу
- Et для этильной группы
- Пр, н -Пр, или н Pr для ( нормальной ) пропильной группы ( Pr также является символом элемента празеодима . Однако, поскольку пропильная группа одновалентна, а празеодим почти всегда трехвалентен, на практике двусмысленность возникает редко, если вообще когда-либо возникает ) .
- я -Пр или я Pr для изопропильной группы
- Все для аллильной группы (редко)
- Бу, н -Бу или н Но для ( нормальной ) бутильной группы
- я -Бу или я Bu ( я часто выделяю курсивом) для изобутильной группы
- с -Бу или с Bu для вторичной бутильной группы
- т -Бу или т Но для третичной бутильной группы
- Pn для пентильной группы ( или Am для синонима амильной группы, хотя Am также является символом америция . )
- Np или Neo для неопентильной группы ( Предупреждение: химики-металлорганики часто используют Np для обозначения родственной неофильной группы, PhMe 2 C–. Np также является символом элемента нептуния . )
- Cy или Chx для циклогексильной группы
- Реклама 1- адамантильной группы
- Tr или Trt для тритильной группы
Ароматические и ненасыщенные заместители
[ редактировать ]- Ar для любого ароматического заместителя (Ar также является символом элемента аргона . Однако аргон инертен во всех обычных условиях, встречающихся в органической химии, поэтому использование Ar для обозначения арильного заместителя никогда не вызывает путаницы.)
- Het для любого гетероароматического заместителя
- Bn или Bzl для обозначения бензильной группы ( не путать с Bz для бензоильной группы; однако в старой литературе может использоваться Bz для обозначения бензильной группы. )
- Дипп для 2,6-диизопропилфенильной группы
- Mes для мезитильной группы
- Ph, Φ или φ для фенильной группы ( использование фи для фенила сокращается )
- Tol для толильной группы, обычно пара- изомера.
- Is или Tipp для 2,4,6-триизопропилфенильной группы ( первый символ происходит от синонима изитил )
- An для анизильной группы, обычно пара -изомера ( An также является символом общего актиноидного элемента . Однако, поскольку анизильная группа является одновалентной, в то время как актиниды обычно двухвалентны, трехвалентны или даже с более высокой валентностью, двусмысленность возникает редко, если вообще когда-либо , возникает на практике ) .
- Cp для циклопентадиенильной группы ( Cp был символом кассиопея, прежнего названия лютеция )
- Cp* для пентаметилциклопентадиенильной группы
- Ви для виниловой группы (редко)
Функциональные группы
[ редактировать ]- Ac означает ацетильную группу (Ac также является символом элемента актиния . Однако актиний почти никогда не встречается в органической химии, поэтому использование Ac для обозначения ацетильной группы никогда не вызывает путаницы) ;
- Bz для бензоильной группы; OBz – бензоатная группа
- Piv для пивалильной ( т -бутилкарбонильной) группы; OPiv - это пиратская группа.
- Bt для 1-бензотриазолильной группы
- Я за 1-имидазолильную группу.
- NPhth для фталимид-1-ильной группы
Сульфонил/сульфонатные группы
[ редактировать ]Эфиры сульфокислот часто оставляют группы в реакциях нуклеофильного замещения. смотрите в статьях о сульфонильных и сульфонатных группах. Дополнительную информацию
- Bs для брозильной ( п- бромбензолсульфонильной) группы; OBs – это брозиловая группа.
- Ms для мезильной (метансульфонильной) группы; OMs - мезилатная группа
- Ns для нозильной ( п- нитробензолсульфонильной) группы (Ns был химическим символом нильсбория, но его переименовали в борий , Bh) ; ONs — нозилатная группа.
- Tf для трифлильной (трифторметансульфонильной) группы; OTf - трифлатная группа
- Nf для нонафлильной (нонафторбутансульфонильной) группы, CF
3 (КФ
2 )
33СО
2 ; ONf - нонафлатная группа - Ts означает тозильную ( п- толуолсульфонильную) группу (Ts также является символом элемента теннессина . Однако теннессин слишком нестабилен, чтобы когда-либо встречаться в органической химии, поэтому использование Ts для обозначения тозила никогда не вызывает путаницы) ; ОЦ – тозилатная группа
Защитные группы
[ редактировать ]или Защитная группа защитная группа вводится в молекулу путем химической модификации функциональной группы для достижения хемоселективности в последующей химической реакции, что облегчает многостадийный органический синтез.
- Boc для трет- бутоксикарбонильной группы
- Cbz или Z для карбоксибензильной группы
- Fmoc для флуоренилметоксикарбонильной группы
- Alloc для аллилоксикарбонильной группы
- Troc для трихлорэтоксикарбонильной группы
- TMS, TBDMS, TES, TBDPS, TIPS, ... для различных силилэфирных групп.
- ПМБ для 4-метоксибензильной группы
- МОМ для метоксиметильной группы
- THP для 2-тетрагидропиранильной группы
Множественные облигации
[ редактировать ]Два атома могут быть связаны, если у них имеется более одной пары электронов. Обычными связями с углеродом являются одинарные, двойные и тройные связи. Одинарные связи наиболее распространены и представлены одиночной сплошной линией между двумя атомами в скелетной формуле. Двойные связи обозначаются двумя параллельными линиями, а тройные – тремя параллельными линиями.
В более продвинутых теориях связи нецелочисленные значения порядка связи существуют . В этих случаях комбинация сплошных и пунктирных линий обозначает целую и нецелую части порядка связи соответственно.
- Гекс-3-ен имеет внутреннюю двойную связь углерод-углерод.
- Гекс-1-ен имеет концевую двойную связь.
- Гекс-3-ин имеет внутреннюю тройную связь углерод-углерод.
- Hex-1-yne имеет концевую тройную связь.
Бензольные кольца
[ редактировать ]В последние годы бензол обычно изображают в виде шестиугольника с чередующимися одинарными и двойными связями, очень похоже на структуру, первоначально предложенную Кекуле в 1872 году. Как упоминалось выше, понимаются чередующиеся одинарные и двойные связи «1,3,5-циклогексатриена». быть изображением одной из двух эквивалентных канонических форм бензола (той, которая явно показана, и той, которая имеет противоположный рисунок формальных одинарных и двойных связей), в которой все связи углерод-углерод имеют эквивалентную длину и порядок связи. ровно 1,5. Для арильных колец в целом две аналогичные канонические формы почти всегда вносят основной вклад в структуру, но они неэквивалентны, поэтому одна структура может вносить немного больший вклад, чем другая, а порядок связи может несколько отличаться от 1,5.
Альтернативное представление, подчеркивающее эту делокализацию, использует круг, нарисованный внутри шестиугольника одинарных связей, для обозначения делокализованной пи-орбитали . Этот стиль, основанный на стиле, предложенном Йоханнесом Тиле , раньше был очень распространен во вводных учебниках по органической химии и до сих пор часто используется в неформальной обстановке. Однако, поскольку это изображение не отслеживает электронные пары и не может показать точное движение электронов, оно в значительной степени было заменено изображением Кекулеана в педагогическом и формальном академическом контексте. [ф]
Стереохимия
[ редактировать ]
Стереохимию удобно обозначать скелетными формулами: [5]
- Шаровидная модель
( R )-2-хлор-2-фторпентан - Скелетная формула
( R )-2-хлор-2-фторпентан - Скелетная формула
( S )-2-хлор-2-фторпентан
Соответствующие химические связи можно изобразить несколькими способами:
- Сплошные линии представляют связи в плоскости бумаги или экрана.
- Сплошные клинья представляют собой связи, направленные из плоскости бумаги или экрана в сторону наблюдателя.
- Заштрихованные клинья или пунктирные линии (толстые или тонкие) обозначают связи, направленные в плоскость бумаги или экрана, в сторону от наблюдателя. [г]
- Волнистые линии представляют либо неизвестную стереохимию, либо смесь двух возможных стереоизомеров на данный момент.
- Устаревший [час] изображение стереохимии водорода, которое раньше было обычным явлением в химии стероидов , представляет собой использование закрашенного круга с центром в вершине (иногда называемого H-точкой/H-тире/H-кругом соответственно) для атома водорода, направленного вверх, и двух решёток. рядом с вершиной или полым кружком для атома водорода, направленного вниз.

Маленький закрашенный кружок представлял собой водород, направленный вверх, а две решётки обозначали водород, направленный вниз.
Раннее использование этих обозначений восходит к Ричарду Куну , который в 1932 году использовал в публикации сплошные толстые и пунктирные линии. Современные сплошные и решетчатые клинья были введены в 1940-х годах Джулио Наттой для представления структуры высоких полимеров и широко популяризированы в учебнике « Органическая химия» 1959 года Дональда Дж. Крама и Джорджа С. Хаммонда . [6]
Скелетные формулы могут отображать цис- и транс- изомеры алкенов. Волнистые одинарные связи — это стандартный способ представления неизвестной или неустановленной стереохимии или смеси изомеров (например, тетраэдрических стереоцентров). Иногда использовалась перекрестная двойная связь; он больше не считается приемлемым стилем для общего использования, но все еще может потребоваться компьютерному программному обеспечению. [5]

Водородные связи
[ редактировать ]
Водородные связи обычно обозначаются пунктирными или пунктирными линиями. В других контекстах пунктирные линии могут также обозначать частично сформированные или разорванные связи в переходном состоянии .
Примечания
[ редактировать ]- ^ Этот термин неоднозначен, поскольку «структура Кекуле» также относится к знаменитому предложению Кекуле о шестиугольнике чередующихся одинарных и двойных связей для структуры бензола.
- ^ Чтобы предотвратить появление «излома» и привести к тому, что структура займет слишком много вертикального пространства на странице, IUPAC (Brecher, 2008, стр. 352) делает исключение для длинноцепочечных цис -олефинов (таких как олеиновая кислота ). , что позволяет цис- двойную связь внутри них под углом 150 °, так что зигзаги по обе стороны от двойной связи могут распространяться горизонтально. изображать
- ^ Меньшие кольца также могут быть изображены вогнутыми, чтобы показать стереохимию (например, конформации циклогексана ) или полициклические молекулы, которые невозможно нарисовать «плоскими» без значительных искажений (например, тропан и адамантан ).
- ^ В тех случаях, когда атом имеет связи, идущие как слева, так и справа (например, вторичный амин NH в середине цепи), некоторые авторы допускают расположение формулы группы вертикально, тогда как другие рисуют явную вертикальную связь внутри группы. .
- ^ В этой галерее двойные связи показаны красным, а тройные — синим. Это было добавлено для ясности: в скелетных формулах множественные связи обычно не окрашиваются.
- ^ Например, в знаменитом учебнике Моррисона и Бойда 1959 года (6-е издание, 1992 г.) в качестве стандартного изображения арильного кольца используется обозначение Тиле, а в учебнике 2001 г. Клейдена, Гривза, Уоррена и Уотерса (2-е издание, 2012 г.) повсюду использует нотацию Кекуле и предупреждает студентов избегать использования нотации Тиле при написании механизмов (стр. 144, 2-е изд.).
- ^ Американские и европейские химики используют несколько разные соглашения для хешированной связи. В то время как большинство американских химиков рисуют решетчатые связи с короткими решетками вблизи стереоцентра и длинными решетками дальше (по аналогии с клиновидными связями), большинство европейских химиков начинают с длинных решеток вблизи стереоцентра, которые постепенно становятся короче по мере удаления (по аналогии перспективный рисунок). В прошлом ИЮПАК предлагал использовать хешированные облигации с хэш-метками одинаковой длины в качестве компромисса, но теперь отдает предпочтение хешированным облигациям американского типа (Brecher, 2006, стр. 1905).Некоторые химики используют толстую связь и пунктирную связь (или заштрихованную связь с хэшами одинаковой длины) для изображения относительной стереохимии , а клиновидную связь и заштрихованную связь с неравными хешами для изображения абсолютной стереохимии ; большинство других не делают этого различия.
- ^ ИЮПАК категорически отвергает это обозначение.
Ссылки
[ редактировать ]- ^ Стокер, Х. Стивен (2012). Общая, органическая и биологическая химия (6-е изд.). Сенгаге. ISBN 978-1133103943 . [ нужна страница ]
- ^ Рекомендации ИЮПАК 1999 г., пересмотренный раздел F: Замена скелетных атомов
- ^ Бречер, Джонатан (2008). «Стандарты графического представления диаграмм химической структуры (Рекомендации ИЮПАК 2008 г.)» . Чистая и прикладная химия . 80 (2): 277–410. дои : 10.1351/pac200880020277 . hdl : 10092/2052 . ISSN 1365-3075 .
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. п. 27. ISBN 978-0-19-850346-0 .
- ^ Перейти обратно: а б Бречер, Джонатан (2006). «Графическое представление стереохимической конфигурации (Рекомендации ИЮПАК 2006 г.)» (PDF) . Чистая и прикладная химия . 78 (10): 1897–1970. дои : 10.1351/pac200678101897 . S2CID 97528124 .
- ^ Дженсен, Уильям Б. (2013). «Историческое происхождение стереохимической линии и символизма клина». Журнал химического образования . 90 (5): 676–677. Бибкод : 2013JChEd..90..676J . дои : 10.1021/ed200177u .
Внешние ссылки
[ редактировать ]- Рисование органических молекул с сайта chemguide.co.uk