Ацетилирование и деацетилирование гистонов

Ацетилирование и деацетилирование гистонов — это процессы, посредством которых остатки лизина в N-концевом хвосте, выступающем из и деацетилируются как часть гистонового ядра нуклеосомы, ацетилируются регуляции генов .
Ацетилирование и деацетилирование гистонов являются важными частями регуляции генов . Эти реакции обычно катализируются ферментами с активностью « гистон-ацетилтрансферазы » (HAT) или « гистон-деацетилазы » (HDAC). Ацетилирование — это процесс, при котором ацетильная функциональная группа переносится от одной молекулы (в данном случае ацетилкофермента А ) к другой. Деацетилирование — это просто обратная реакция, при которой ацетильная группа удаляется из молекулы.
Ацетилированные гистоны , октамерные белки, которые организуют хроматин в нуклеосомы , основную структурную единицу хромосом и, в конечном итоге, в структуры более высокого порядка, представляют собой тип эпигенетического маркера внутри хроматина . Ацетилирование удаляет положительный заряд гистонов, тем самым уменьшая взаимодействие N-концев гистонов с отрицательно заряженными фосфатными группами ДНК . Как следствие, конденсированный хроматин трансформируется в более расслабленную структуру, что связано с более высокими уровнями транскрипции генов . Эту релаксацию можно обратить вспять деацетилированием, катализируемым активностью HDAC. Расслабленная, транскрипционно активная ДНК называется эухроматином . Более конденсированная (плотно упакованная) ДНК называется гетерохроматином . Конденсация может быть вызвана такими процессами, как деацетилирование и метилирование. [ 1 ]
Механизм действия
[ редактировать ]
Нуклеосомы — это участки двухцепочечной ДНК (дцДНК), которые обернуты вокруг белковых комплексов, называемых ядрами гистонов. Эти гистоновые ядра состоят из 8 субъединиц, по две из H2A , H2B , H3 и H4 гистонов . Этот белковый комплекс образует цилиндрическую форму, вокруг которой находится дцДНК, состоящая примерно из 147 пар оснований. Нуклеосомы формируются как начальный этап уплотнения ДНК, что также способствует структурной поддержке, а также выполняет функциональные роли. [ 2 ] Эти функциональные роли выполняются хвостами субъединиц гистонов. Гистоновые хвосты встраиваются в малые бороздки ДНК и проходят через двойную спираль. [ 1 ] что оставляет их открытыми для модификаций, участвующих в активации транскрипции. [ 3 ] Ацетилирование тесно связано с увеличением активации транскрипции, тогда как деацетилирование связано с деактивацией транскрипции. Эти реакции возникают после трансляции и являются обратимыми. [ 3 ]
Механизм ацетилирования и деацетилирования происходит на NH 3 + группы аминокислотных остатков лизина. Эти остатки расположены на хвостах гистонов, составляющих нуклеосому упакованной дцДНК. Этому процессу способствуют факторы, известные как гистон-ацетилтрансферазы (HAT). Молекулы HAT облегчают перенос ацетильной группы от молекулы ацетил-кофермента А (Ацетил-КоА) к NH 3 + группа по лизину. Когда лизин необходимо деацетилировать, факторы, известные как деацетилазы гистонов (HDAC), катализируют удаление ацетильной группы с помощью молекулы H 2 O. [ 3 ] [ 4 ]
Ацетилирование приводит к изменению общего заряда хвоста гистонов с положительного на нейтральный. Образование нуклеосом зависит от положительных зарядов гистонов H4 и отрицательного заряда на поверхности складчатых доменов гистонов H2A. Ацетилирование хвостов гистонов нарушает эту ассоциацию, что приводит к более слабому связыванию нуклеосомных компонентов. [ 1 ] Благодаря этому ДНК становится более доступной и приводит к тому, что больше транскрипционных факторов могут достичь ДНК. Таким образом, известно, что ацетилирование гистонов увеличивает экспрессию генов за счет активации транскрипции. Деацетилирование, осуществляемое молекулами HDAC, имеет противоположный эффект. Деацетилируя хвосты гистонов, ДНК становится более плотно обернутой вокруг ядер гистонов, что затрудняет связывание транскрипционных факторов с ДНК. Это приводит к снижению уровня экспрессии генов и известно как молчание генов. [ 5 ] [ 6 ] [ 7 ]
Ацетилированные гистоны, октомерные белковые ядра нуклеосом, представляют собой тип эпигенетического маркера внутри хроматина. Исследования показали, что одна модификация имеет тенденцию влиять на то, произойдет ли другая модификация. Модификации гистонов могут не только вызывать вторичные структурные изменения в их конкретных точках, но и вызывать множество структурных изменений в отдаленных местах, что неизбежно влияет на их функцию. [ 8 ] По мере репликации хромосомы модификации, существующие в родительских хромосомах, передаются дочерним хромосомам. Модификации, как часть их функции, могут рекрутировать ферменты для выполнения их конкретной функции и могут способствовать продолжению модификаций и их эффектов после того, как произошла репликация. [ 1 ] Было показано, что даже после одной репликации экспрессия генов может все еще подвергаться воздействию многих поколений клеток спустя. Исследование показало, что при ингибировании ферментов HDAC трихостатином А гены, встроенные рядом с центрическим гетерохроматином, демонстрируют повышенную экспрессию. Спустя много поколений клеток, в отсутствие ингибитора, повышенная экспрессия генов все еще сохранялась, показывая, что модификации могут осуществляться посредством многих процессов репликации, таких как митоз и мейоз. [ 8 ]
Ферменты ацетилирования/деацетилирования гистонов
[ редактировать ]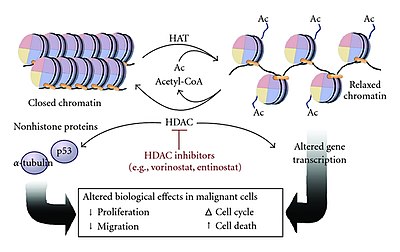
Гистонацетилтрансфераза (HAT)
[ редактировать ]Гистоновые ацетилтрансферазы, также известные как HAT, представляют собой семейство ферментов, которые ацетилируют гистоновые хвосты нуклеосомы. Эта и другие модификации выражаются в зависимости от различных состояний клеточной среды. [ 2 ] Многие белки, обладающие ацетилирующей способностью, были задокументированы и через некоторое время были классифицированы на основе сходства последовательностей между ними. Это сходство велико среди членов семьи, но члены разных семей имеют очень мало сходства. [ 9 ] Некоторые из основных семейств, выявленных на данный момент, следующие.
Семья ГНАТ
[ редактировать ]Общий контроль Недерепрессируемые 5 (Gcn5)-родственные N-ацетилтрансферазы (GNAT) являются одним из многих изученных семейств, обладающих способностями к ацетилированию. [ 10 ] Это суперсемейство включает факторы Gcn5, которые входят в комплексы SAGA, SLIK, STAGA, ADA и A2, Gcn5L, фактор, ассоциированный с белком p300/CREB (PCAF) , Elp3 , HPA2 и HAT1 . [ 10 ] [ 11 ] Основные особенности семейства GNAT включают домены HAT длиной около 160 остатков и консервативный бромодомен, который, как было обнаружено, является мотивом, нацеливающим ацетиллизин. [ 9 ] Было показано, что Gcn5 ацетилирует субстраты, когда он является частью комплекса. [ 11 ] Было обнаружено, что рекомбинантный Gcn5 участвует в ацетилировании гистонов H3 нуклеосомы. [ 2 ] [ 11 ] Было обнаружено, что в меньшей степени он также ацетилирует гистоны H2B и H4 при взаимодействии с другими комплексами. [ 2 ] [ 3 ] [ 11 ] PCAF обладает способностью действовать как белок HAT и ацетилировать гистоны, он может ацетилировать негистоновые белки, связанные с транскрипцией, а также действовать как коактиватор во многих процессах, включая миогенез , ядерными рецепторами активацию, опосредованную фактора роста. , и сигнализацию активация. Elp3 обладает способностью ацетилировать все субъединицы гистонов, а также участвует в голоферменте РНК-полимеразы II . [ 2 ]
Семья МИСТ
[ редактировать ]MOZ (белок цинковых пальцев моноцитарного лейкоза), Ybf2/Sas3, Sas2 и Tip60 (белок, взаимодействующий с Tat) составляют MYST, еще одно известное семейство, проявляющее ацетилирующие способности. В это семейство входят Sas3, незаменимая ацетилтрансфераза, связанная с SAS (Esa1), Sas2, Tip60, MOF, MOZ, MORF и HBO1. Члены этого семейства выполняют множество функций, не только активируя и подавляя гены, но также влияют на развитие и имеют значение при заболеваниях человека. [ 11 ] Sas2 и Sas3 участвуют в подавлении транскрипции, MOZ и TIF2 участвуют в образовании продуктов лейкемической транслокации, тогда как MOF участвует в дозовой компенсации у дрозофилы . MOF также влияет на сперматогенез у мышей, поскольку он участвует в расширении H2AX фосфорилирования во время от лептотены стадий мейоза до пахитены . [ 12 ] Домены HAT для этого семейства состоят примерно из 250 остатков, которые включают богатые цистеином цинксвязывающие домены, а также N-концевые хромодомены. Белки MYST Esa1, Sas2 и Sas3 обнаружены у дрожжей, MOF обнаружены у дрозофилы и мышей, а Tip60, MOZ, MORF и HBO1 обнаружены у людей. [ 9 ] Tip60 играет роль в регуляции транскрипции генов, было обнаружено, что HBO влияет на процесс репликации ДНК, MORF способен ацетилировать свободные гистоны (особенно H3 и H4), а также нуклеосомные гистоны. [ 2 ]
семейство p300/CBP
[ редактировать ]Аденовирусный E1A-ассоциированный белок массой 300 кДа (p300) и CREB-связывающий белок (CBP) составляют следующее семейство HAT. [ 10 ] Это семейство HAT содержит домены HAT длиной около 500 остатков и содержат бромодомены, а также три богатых цистеином и гистидином домена, которые помогают во взаимодействии белков. [ 9 ] Известно, что эти HAT ацетилируют все субъединицы гистонов в нуклеосоме. Они также обладают способностью ацетилировать и опосредовать негистоновые белки, участвующие в транскрипции, а также участвуют в клеточном цикле , дифференцировке и апоптозе . [ 2 ]
Другие шляпы
[ редактировать ]Существуют и другие белки, обладающие ацетилирующей способностью, но отличающиеся по структуре от ранее упомянутых семейств. Один HAT называется коактиватором стероидного рецептора 1 (SRC1) , который имеет домен HAT, расположенный на С-конце белка вместе с основной спиралью-петлей-спиралью доменами PAS A и PAS B с мотивом, взаимодействующим с рецептором LXXLL. , а также середина. Другим является ATF-2, который содержит домен активации транскрипции (ACT) и базовый ДНК-связывающий домен застежки-молнии (bZip) с доменом HAT между ними. Последним является TAFII250 , который имеет киназный домен в N-концевой области, два бромодомена , расположенные в С-концевой области, и домен HAT, расположенный между ними. [ 13 ]
Гистондеацетилаза (HDAC)
[ редактировать ]Всего существует четыре класса, которые классифицируют гистоновые деацетилазы (HDAC). Класс I включает HDAC 1 , 2 , 3 и 8 . Класс II делится на две подгруппы: класс IIA и класс IIB. Класс IIA включает HDAC 4 , 5 , 7 и 9 , а класс IIB включает HDAC 6 и 10 . Класс III содержит Sirtuins , а класс IV содержит только HDAC11 . [ 5 ] [ 6 ] Классы белков HDAC разделены и сгруппированы на основе сравнения гомологии последовательностей Rpd3, Hos1 и Hos2 для HDAC класса I, HDA1 и Hos3 для HDAC класса II и сиртуинов для HDAC класса III. [ 6 ]
HDAC класса I
[ редактировать ]HDAC1 и HDAC2
[ редактировать ]HDAC1 и HDAC2 относятся к первому классу HDAC и наиболее тесно связаны друг с другом. [ 5 ] [ 6 ] Анализируя общие последовательности обоих HDAC, было обнаружено, что их сходство составляет примерно 82%. [ 5 ] Было обнаружено, что эти ферменты неактивны при выделении, что привело к выводу, что они должны быть включены в состав кофакторов , чтобы активировать их деацетилазные способности. [ 5 ] Существует три основных белковых комплекса, в которые могут включаться HDAC 1 и 2. Эти комплексы включают Sin3 (названный в честь его характерного белка mSin3A ), комплекс ремоделирования и деацетилирования нуклеосом (NuRD) и Co-REST . [ 5 ] [ 6 ] Комплекс Sin3 и комплекс NuRD содержат HDAC 1 и 2, Rb-ассоциированный белок 48 (RbAp48) и RbAp46, которые составляют ядро каждого комплекса. [ 2 ] [ 6 ] Однако могут потребоваться и другие комплексы, чтобы инициировать максимально возможный объем доступной активности. HDAC 1 и 2 также могут напрямую связываться с ДНК-связывающими белками, такими как Yin и Yang 1 (YY1) , Rb-связывающий белок 1 и Sp1 . [ 5 ] Было обнаружено, что HDAC 1 и 2 выполняют регуляторную роль в ключевых генах клеточного цикла, включая p21 . [ 6 ]
На активность этих HDAC может влиять фосфорилирование . Повышенное фосфорилирование ( гиперфосфорилирование ) приводит к увеличению активности деацетилазы, но ухудшает образование комплексов между HDAC 1 и 2, а также между HDAC1 и mSin3A/YY1. Меньшая, чем обычно, степень фосфорилирования (гипофосфорилирование) приводит к снижению активности деацетилазы, но увеличивает количество комплексообразования. Исследования мутаций показали, что основное фосфорилирование происходит по остаткам Ser. 421 и Сер 423 . Действительно, когда эти остатки были мутированы, наблюдалось резкое снижение активности деацетилирования. [ 5 ] Эта разница в состоянии фосфорилирования является способом поддержания оптимального уровня фосфорилирования, чтобы гарантировать отсутствие чрезмерного или недостаточного проявления деацетилирования. HDACs 1 и 2 были обнаружены исключительно в ядре . [ 2 ] [ 6 ] Было обнаружено, что у мышей с нокаутом HDAC1 (KO) мыши умирали во время эмбриогенеза и демонстрировали резкое снижение продукции, но повышенную экспрессию циклин-зависимых киназных ингибиторов (CDKI) p21 и p27 . Даже усиление других HDAC класса I не могло компенсировать потерю HDAC1. Эта неспособность восстановиться после нокаута HDAC1 заставляет исследователей полагать, что существует как функциональная уникальность каждого HDAC, так и нормативное перекрестное взаимодействие между факторами. [ 6 ]
HDAC3
[ редактировать ]HDAC3 Было обнаружено, что наиболее тесно связан с HDAC8. HDAC3 содержит неконсервативную область в С-концевой области, которая, как было обнаружено, необходима для репрессии транскрипции, а также для ее деацетилазной активности. Он также содержит две области, одна из которых называется сигналом ядерной локализации (NLS) , а также сигналом ядерного экспорта (NES) . NLS функционирует как сигнал для ядерного действия, в то время как NES функционирует с помощью HDAC, которые выполняют работу вне ядра. Наличие обоих сигналов HDAC3 предполагает, что он перемещается между ядром и цитоплазмой . [ 5 ] Было обнаружено даже, что HDAC3 взаимодействует с плазматической мембраной . [ 6 ] Медиатор молчания рецепторов ретиноевой кислоты и гормона щитовидной железы (SMRT) и факторы ко-репрессора ядерных рецепторов (N-CoR) должны использоваться HDAC3, чтобы активировать его. [ 5 ] [ 6 ] При этом он приобретает способность соосаждаться с HDAC 4, 5 и 7. HDAC3 также можно обнаружить в комплексе с белком, родственным HDAC (HDRP). [ 5 ] Было обнаружено, что HDAC 1 и 3 опосредуют взаимодействия Rb-RbAp48, что позволяет предположить, что они участвуют в развитии клеточного цикла. [ 5 ] [ 6 ] HDAC3 также демонстрирует участие в самообновлении стволовых клеток и независимую от транскрипции роль в митозе . [ 6 ]
HDAC8
[ редактировать ]HDAC8 Было обнаружено, что наиболее похож на HDAC3. Его основной особенностью является каталитический домен, который содержит область NLS в центре. Были обнаружены два транскрипта этого HDAC, которые включают транскрипт размером 2,0 КБ и транскрипт 2,4 КБ. [ 5 ] В отличие от других молекул HDAC, после очистки этот HDAC оказался ферментативно активным. [ 6 ] На данный момент, в связи с его недавним открытием, еще неизвестно, регулируется ли он комплексами белков-корепрессоров. Нозерн-блоттинг показал, что разные типы тканей демонстрируют разную степень экспрессии HDAC8. [ 5 ] но наблюдался в гладких мышцах и, как полагают, способствует сократимости. [ 6 ]
HDAC класса II
[ редактировать ]Класс IIА
[ редактировать ]HDAC класса IIA включают HDAC4 , HDAC5 , HDAC7 и HDAC9 . Было обнаружено, что HDAC 4 и 5 наиболее похожи друг на друга, в то время как HDAC7 сохраняет сходство с ними обоими. Было обнаружено три варианта HDAC9, включая HDAC9a, HDAC9b и HDAC9c/HDRP, хотя подозреваются и другие. Было обнаружено, что варианты HDAC9 имеют сходство с остальными HDAC класса IIA. Для HDAC9 варианты сплайсинга можно рассматривать как способ создания «точно настроенного механизма» для дифференциации уровней экспрессии в клетке. Различные типы клеток могут использовать разные изоформы фермента HDAC9, обеспечивая разные формы регуляции. Каталитические домены HDAC 4, 5 и 7 расположены на С-конце вместе с областью NLS, тогда как каталитический домен HDAC9 расположен на N-конце. Однако вариант HDAC9 HDAC9c/HDRP не имеет каталитического домена, но имеет 50% сходство с N-концом HDAC 4 и 5. [ 5 ]
Для HDAC 4, 5 и 7 были обнаружены консервативные связывающие домены, которые связываются с C-концевым связывающим белком (CtBP) , фактором 2 энхансера миоцитов (MEF2) и 14-3-3 . [ 5 ] [ 6 ] Все три HDAC подавляют миогенный фактор транскрипции MEF2, который играет важную роль в дифференцировке мышц в качестве фактора транскрипции, связывающего ДНК. Связывание HDAC с MEF2 ингибирует дифференцировку мышц, которую можно обратить вспять под действием Ca. 2+ /кальмодулин-зависимая киназа (CaMK) , которая диссоциирует комплекс HDAC/MEF2 путем фосфорилирования части HDAC. [ 5 ] Было замечено, что они участвуют в клеточной гипертрофии при дифференцировке мышечного контроля, а также в клеточной гипертрофии в мышечной и хрящевой тканях. [ 6 ] Было показано, что HDAC 5 и 7 действуют против HDAC4 во время регуляции мышечной дифференцировки, чтобы поддерживать надлежащий уровень экспрессии. Имеются доказательства того, что эти HDAC также взаимодействуют с HDAC3 в качестве фактора, совместного с факторами SMRT/ N-CoR в ядре. Было показано, что отсутствие фермента HDAC3 приводит к неактивности, что заставляет исследователей полагать, что HDAC 4, 5 и 7 помогают включать ДНК-связывающие рекрутеры для HDAC3-содержащих комплексов HDAC, расположенных в ядре. [ 5 ] Когда у мышей нокаутируется HDAC4, они страдают от выраженной гипертрофии хондроцитов и умирают из-за чрезмерного окостенения . Было показано, что HDAC7 подавляет Nur77 -зависимый апоптоз . Это взаимодействие приводит к участию в клональной экспансии Т-клеток . Показано, что мыши HDAC9 KO страдают гипертрофией сердца, которая усугубляется у мышей, у которых наблюдается двойной нокаут HDAC 9 и 5. [ 6 ]
Класс IIВ
[ редактировать ]HDAC класса IIB включают HDAC6 и HDAC10 . Эти два HDAC наиболее тесно связаны друг с другом в общей последовательности. Однако каталитический домен HDAC6 наиболее похож на HDAC9. [ 5 ] Уникальной особенностью HDAC6 является то, что он содержит два каталитических домена, расположенных последовательно друг за другом. [ 5 ] [ 6 ] Еще одной уникальной особенностью HDAC6 является (HUB), связанный с HDAC6, SP3 и Brap2, домен мотива цинкового пальца на С-конце, который демонстрирует некоторые функции, связанные с убиквитинированием , что означает, что этот HDAC склонен к деградации. [ 5 ] HDAC10 также имеет два каталитических домена. Один активный домен расположен на N-конце, а предполагаемый каталитический домен расположен на С-конце. [ 5 ] [ 6 ] вместе с доменом NES. [ 5 ] Два предполагаемых Rb-связывающих домена также были обнаружены на HDAC10, что показывает, что он может играть роль в регуляции клеточного цикла. Были обнаружены два варианта HDAC10, оба имеют небольшие различия в длине. HDAC6 — единственный HDAC, который, как было показано, действует на тубулин , действуя как тубулиндеацетилаза, которая помогает в регуляции зависимой от микротрубочек подвижности клеток . В основном он обнаруживается в цитоплазме, но известно, что он обнаруживается в ядре в комплексе с HDAC11. Было замечено, что HDAC10 действует на HDAC 1, 2, 3 (или SMRT), 4, 5 и 7. Были показаны некоторые доказательства того, что он также может иметь небольшое взаимодействие с HDAC6. Это заставляет исследователей полагать, что HDAC10 может действовать скорее как рекрутер, а не как фактор деацетилирования. Однако эксперименты, проведенные с HDAC10, действительно показали активность деацетилирования. [ 5 ]
HDAC класса IV
[ редактировать ]HDAC11
[ редактировать ]Было показано, что HDAC11 связан с HDAC 3 и 8, но его общая последовательность сильно отличается от других HDAC, что позволяет отнести его к отдельной категории. [ 5 ] [ 6 ] HDAC11 имеет каталитический домен, расположенный на его N-конце. Он не был обнаружен в каких-либо комплексах HDAC, таких как Nurd или SMRT, что означает, что он может иметь особую, уникальную функцию. Было обнаружено, что HDAC11 остается преимущественно в ядре. [ 5 ]
Биологические функции
[ редактировать ]Регуляция транскрипции
[ редактировать ]Открытие ацетилирования гистонов, вызывающего изменения в транскрипционной активности, можно отнести к работе Висента Олфри и его коллег в 1964 году. [ 14 ] Группа выдвинула гипотезу, что белки-гистоны, модифицированные ацетильными группами, добавляют отрицательные заряды к положительным лизинам и, таким образом, уменьшают взаимодействие между ДНК и гистонами . [ 15 ] Модификация гистонов в настоящее время считается основным регуляторным механизмом, который участвует во многих различных стадиях генетических функций. [ 16 ] В настоящее время мы понимаем, что ацетилированные остатки лизина на хвостах гистонов связаны с активацией транскрипции. В свою очередь, деацетилированные гистоны связаны с репрессией транскрипции. Кроме того, отрицательные корреляции были обнаружены между несколькими метками ацетилирования гистонов. [ 17 ]
Считается, что механизм регулирования имеет двоякий характер. Лизин — это аминокислота с положительным зарядом в неизмененном виде. Лизины на аминоконцевых хвостах гистонов имеют тенденцию ослаблять общую структуру хроматина. Добавление ацетильной группы, несущей отрицательный заряд, эффективно удаляет положительный заряд и, следовательно, уменьшает взаимодействие между хвостом гистона и нуклеосомой . [ 18 ] Это открывает обычно плотно упакованную нуклеосому и позволяет транскрипционному аппарату вступить в контакт с матрицей ДНК, что приводит к транскрипции гена . [ 1 ] : 242 Репрессия транскрипции генов достигается за счет обратного этого механизма. Ацетильная группа удаляется одним из ферментов HDAC во время деацетилирования, что позволяет гистонам более тесно взаимодействовать с ДНК с образованием компактной сборки нуклеосом. Это увеличение жесткой структуры предотвращает включение транскрипционных механизмов, эффективно подавляя транскрипцию генов.
Другим следствием ацетилирования гистонов является создание платформы для связывания белков. В качестве посттрансляционной модификации ацетилирование гистонов может привлекать белки к удлиненному хроматину, отмеченному ацетильными группами. Была выдвинута гипотеза, что хвосты гистонов содержат сайты узнавания, которые привлекают белки, ответственные за активацию транскрипции. [ 19 ] В отличие от белков ядра гистонов, хвосты гистонов не являются частью ядра нуклеосомы и подвергаются взаимодействию с белками. Модель предположила, что ацетилирование гистонов H3 активирует транскрипцию генов за счет привлечения других комплексов, связанных с транскрипцией. Таким образом, ацетильная метка обеспечивает место для узнавания белка, где факторы транскрипции взаимодействуют с ацетилированными хвостами гистонов через их бромодомен . [ 20 ]
Гипотеза гистонового кода
[ редактировать ]Гипотеза гистонового кода предполагает идею о том, что паттерны посттрансляционных модификаций гистонов в совокупности могут управлять определенными клеточными функциями. [ 21 ] Химические модификации белков-гистонов часто происходят по определенным аминокислотам. Это специфическое добавление одиночных или множественных модификаций гистоновых ядер можно интерпретировать с помощью транскрипционных факторов и комплексов, что приводит к функциональным последствиям. Этому процессу способствуют такие ферменты, как HAT и HDAC, которые добавляют или удаляют модификации гистонов, а также факторы транскрипции, которые обрабатывают и «считывают» коды модификаций. Результатом может быть активация транскрипции или репрессия гена. Например, комбинация ацетилирования и фосфорилирования оказывает синергетический эффект на общий уровень структурной конденсации хромосом и, следовательно, индуцирует активацию транскрипции непосредственного раннего гена . [ 22 ]
Эксперименты по изучению паттернов ацетилирования гистонов H4 показали, что эти паттерны модификаций коллективно сохраняются в митозе и мейозе , чтобы модифицировать долгосрочную экспрессию генов. [ 8 ] Паттерн ацетилирования регулируется ферментами HAT и HADC и, в свою очередь, задает локальную структуру хроматина. Таким образом, паттерны ацетилирования передаются и взаимосвязаны со способностью связывания белков и их функциями в последующем поколении клеток.
Бромодомен
[ редактировать ]Бромодомен представляет собой мотив, который отвечает за распознавание ацетилированного лизина на гистонах белками ремоделирования нуклеосом. Посттрансляционные модификации N- и C-концевых хвостов гистонов привлекают различные факторы инициации транскрипции, которые содержат бромодомены, включая коактиватор транскрипции человека PCAF , TAF1 , GCN5 и CREB-связывающий белок к промотору (CBP), и имеют значение в регуляции экспрессии генов. [ 23 ] Структурный анализ факторов транскрипции показал, что высококонсервативные бромодомены необходимы для связывания белка с ацетилированным лизином. Это предполагает, что ацетилирование специфического сайта гистонов играет регуляторную роль в активации транскрипции генов. [ 24 ]
Болезни человека
[ редактировать ]Воспалительные заболевания
[ редактировать ]Экспрессия генов регулируется ацетилированием и деацетилированием гистонов, и эта регуляция также применима к генам воспаления. Воспалительные заболевания легких характеризуются экспрессией специфических воспалительных генов, таких как NF-κB и фактор транскрипции AP-1 . Лечение воспалительных заболеваний легких кортикостероидами и теофиллином влияет на активность HAT/HDAC, отключая воспалительные гены. [ 25 ]
В частности, данные по экспрессии генов продемонстрировали повышенную активность HAT и снижение уровня активности HDAC у пациентов с астмой . [ 26 ] У пациентов с хронической обструктивной болезнью легких выявлено общее снижение активности HDAC при неизмененном уровне активности HAT. [ 27 ] Результаты показали, что баланс активности HAT/HDAC играет важную роль при воспалительных заболеваниях легких, и дали представление о возможных терапевтических мишенях. [ 28 ]
Рак
[ редактировать ]Учитывая регуляторную роль эпигенетических модификаций генов во время транскрипции, неудивительно, что изменения эпигенетических маркеров, такие как ацетилирование, могут способствовать развитию рака. Экспрессия и активность HDAC в опухолевых клетках сильно отличаются от нормальных клеток. и сверхэкспрессия Было показано, что повышенная активность HDACs характерны для онкогенеза и метастазирования , что указывает на важную регуляторную роль деацетилирования гистонов в экспрессии генов-супрессоров опухолей. [ 29 ] Одним из примеров является регулирующая роль ацетилирования/деацетилирования гистонов в P300 и CBP, которые оба способствуют онкогенезу . [ 30 ]
Одобренный в 2006 году Управлением по контролю за продуктами и лекарствами США (FDA), Вориностат представляет собой новую категорию противораковых препаратов, находящихся в стадии разработки. Вориностат воздействует на механизмы ацетилирования гистонов и может эффективно ингибировать аномальное ремоделирование хроматина в раковых клетках. Целями Vorinostat являются HDAC1 , HDAC2 , HDAC3 и HDAC6 . [ 31 ] [ 32 ]
Доступность источника углерода отражается на ацетилировании гистонов при раке. Глюкоза и глутамин являются основными источниками углерода в большинстве клеток млекопитающих, а метаболизм глюкозы тесно связан с ацетилированием и деацетилированием гистонов. Доступность глюкозы влияет на внутриклеточный пул ацетил-КоА, центрального промежуточного продукта метаболизма, который также является донором ацетила при ацетилировании гистонов. Глюкоза превращается в ацетил-КоА с помощью комплекса пируватдегидрогеназы (PDC), который производит ацетил-КоА из пирувата, полученного из глюкозы; и аденозинтрифосфат-цитратлиазой (ACLY), которая генерирует ацетил-КоА из цитрата, полученного из глюкозы. Активность PDC и ACLY зависит от доступности глюкозы, которая тем самым влияет на ацетилирование гистонов и, следовательно, модулирует экспрессию генов и развитие клеточного цикла. Нарушение регуляции ACLY и PDC способствует метаболическому перепрограммированию и способствует развитию множественных видов рака. В то же время метаболизм глюкозы поддерживает соотношение НАД+/НАДН, а НАД+ участвует в SIRT-опосредованном деацетилировании гистонов. Активность фермента SIRT изменяется при различных злокачественных новообразованиях, а ингибирование SIRT6, деацетилазы гистонов, которая действует на ацетилированные H3K9 и H3K56, способствует онкогенезу. SIRT7, который деацетилирует H3K18 и тем самым подавляет транскрипцию генов-мишеней, активируется при раке для стабилизации клеток в трансформированном состоянии. Питательные вещества, по-видимому, модулируют активность SIRT. Например, длинноцепочечные жирные кислоты активируют деацетилазную функцию SIRT6, и это может влиять на ацетилирование гистонов. [ 33 ]
Зависимость
[ редактировать ]Эпигенетические модификации гистоновых хвостов в определенных областях мозга имеют центральное значение при зависимостях , и большая часть работ по зависимости сосредоточена на ацетилировании гистонов. [ 34 ] [ 35 ] [ 36 ] Как только происходят определенные эпигенетические изменения, они кажутся долговременными «молекулярными шрамами», которые могут быть причиной устойчивости зависимостей. [ 34 ] [ 37 ]
Курильщики (около 21% населения США) [ 38 ] ) обычно страдают никотиновой зависимостью . [ 39 ] После 7 дней лечения мышей никотином ацетилирование как гистона H3, так и гистона H4 увеличилось на FosB промоторе в прилежащем ядре головного мозга, что привело к увеличению экспрессии FosB на 61%. [ 40 ] Это также увеличит экспрессию сплайсингового варианта Delta FosB . В прилежащем ядре головного мозга Delta FosB действует как «устойчивый молекулярный переключатель» и «главный контрольный белок» при развитии зависимости . [ 41 ] [ 42 ]
Около 7% населения США пристрастились к алкоголю . У крыс, подвергавшихся воздействию алкоголя в течение 5 дней, наблюдалось увеличение ацетилирования гистона 3 лизина 9 в промоторе проноцицептина в комплексе миндалины головного мозга . Это ацетилирование является активирующим признаком проноцицептина. ноцицептин/ноцицептин Система опиоидных рецепторов участвует в усиливающем или кондиционирующем эффекте алкоголя. [ 43 ]
Кокаиновая зависимость встречается примерно у 0,5% населения США. Повторное введение кокаина мышам вызывает гиперацетилирование гистона 3 (H3) или гистона 4 (H4) мозга в 1696 генах в одной «наградной» области [ прилежащее ядро (NAc)] и деацетилирование в 206 генах. [ 44 ] [ 45 ] Было обнаружено , что по меньшей мере 45 генов, активация которых в предыдущих исследованиях повышалась в NAc мышей после хронического воздействия кокаина, были связаны с гиперацетилированием H3 или H4. Многие из этих отдельных генов напрямую связаны с аспектами зависимости, связанной с воздействием кокаина. [ 45 ] [ 46 ]
На моделях грызунов многие агенты, вызывающие зависимость, включая продукты табачного дыма, [ 47 ] алкоголь, [ 48 ] кокаин, [ 49 ] героин [ 50 ] и метамфетамин, [ 51 ] [ 52 ] вызывают повреждение ДНК в головном мозге. Во время восстановления повреждений ДНК некоторые отдельные события восстановления могут изменить ацетилирование гистонов в местах повреждения или вызвать другие эпигенетические изменения и, таким образом, оставить эпигенетический рубец на хроматине . [ 37 ] Такие эпигенетические шрамы, вероятно, способствуют стойким эпигенетическим изменениям, обнаруживаемым при зависимостях.
В 2013 году 22,7 миллиона человек в возрасте 12 лет и старше нуждались в лечении от проблем, связанных с употреблением запрещенных наркотиков или алкоголя (8,6 процента людей в возрасте 12 лет и старше). [ 38 ]
Другие расстройства
[ редактировать ]На основании идеи о том, что структура хроматина может быть изменена, чтобы разрешить или запретить доступ активаторов транскрипции , регуляторные функции ацетилирования и деацетилирования гистонов могут иметь значение для генов, вызывающих другие заболевания. Исследования модификаций гистонов могут выявить множество новых терапевтических целей.
На основе различных моделей гипертрофии сердца было продемонстрировано, что сердечный стресс может привести к изменениям экспрессии генов и изменению функции сердца. [ 53 ] Эти изменения опосредуются посредством передачи сигналов посттрансляционной модификации HAT/HDAC. ингибитор HDAC трихостатин А Сообщалось, что кардиомиоцитов снижает аутофагию , вызванную стрессом . [ 54 ] Исследования p300 и CREB-связывающего белка связали гипертрофию сердца с клеточной активностью HAT, что указывает на важную роль статуса ацетилирования гистонов с генами, чувствительными к гипертрофии, такими как GATA4 , SRF и MEF2 . [ 55 ] [ 56 ] [ 57 ] [ 58 ]
Эпигенетические модификации также играют роль в неврологических расстройствах. Установлено, что нарушение регуляции модификации гистонов ответственно за нарушение регуляции экспрессии генов и, следовательно, связано с неврологическими и психологическими расстройствами, такими как шизофрения. [ 59 ] и болезнь Гентингтона . [ 60 ] Текущие исследования показывают, что ингибиторы семейства HDAC обладают терапевтическим эффектом при широком спектре неврологических и психиатрических расстройств. [ 61 ] Многие неврологические расстройства затрагивают только определенные области мозга; поэтому понимание специфичности HDAC по-прежнему необходимо для дальнейших исследований по улучшению лечения.
См. также
[ редактировать ]- Гистон ацетилтрансфераза
- Гистоновая деацетилаза
- Метилирование гистонов
- Ацетилирование
- фосфорилирование
- Нуклеосома
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Уотсон Дж.Д., Бейкер Т.А., Ганн А., Левин М., Лосик Р. (2014). Молекулярная биология гена (Седьмое изд.). Бостон: Пирсон/CSH Press. ISBN 978-0-321-76243-6 .
- ^ Jump up to: а б с д и ж г час я Вердоне Л., Агрикола Э., Казерта М., Ди Мауро Э. (сентябрь 2006 г.). «Ацетилирование гистонов в регуляции генов» . Брифинги по функциональной геномике и протеомике . 5 (3): 209–21. дои : 10.1093/bfgp/ell028 . ПМИД 16877467 .
- ^ Jump up to: а б с д Куо М.Х., Эллис CD (август 1998 г.). «Роль гистон-ацетилтрансфераз и деацетилаз в регуляции генов». Биоэссе . 20 (8): 615–26. doi : 10.1002/(sici)1521-1878(199808)20:8<615::aid-bies4>3.0.co;2-h . ПМИД 9780836 . S2CID 35433573 .
- ^ Грунштейн М. (сентябрь 1997 г.). «Ацетилирование гистонов в структуре и транскрипции хроматина» (PDF) . Природа . 389 (6649): 349–52. Бибкод : 1997Natur.389..349G . дои : 10.1038/38664 . ПМИД 9311776 . S2CID 4419816 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С де Рюйтер А.Дж., ван Геннип А.Х., Кэрон Х.Н., Кемп С., ван Куиленбург А.Б. (март 2003 г.). «Гистоновые деацетилазы (HDAC): характеристика классического семейства HDAC» . Биохимический журнал . 370 (Часть 3): 737–49. дои : 10.1042/BJ20021321 . ПМЦ 1223209 . ПМИД 12429021 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в Галлинари П., Ди Марко С., Джонс П., Паллаоро М., Стейнкюлер С. (март 2007 г.). «HDAC, деацетилирование гистонов и транскрипция генов: от молекулярной биологии до лечения рака». Клеточные исследования . 17 (3): 195–211. дои : 10.1038/sj.cr.7310149 . ПМИД 17325692 . S2CID 30268983 .
- ^ Струл К. (март 1998 г.). «Ацетилирование гистонов и механизмы регуляции транскрипции» . Гены и развитие . 12 (5): 599–606. дои : 10.1101/gad.12.5.599 . ПМИД 9499396 .
- ^ Jump up to: а б с Тернер Б.М. (сентябрь 2000 г.). «Ацетилирование гистонов и эпигенетический код». Биоэссе . 22 (9): 836–45. doi : 10.1002/1521-1878(200009)22:9<836::AID-BIES9>3.0.CO;2-X . ПМИД 10944586 .
- ^ Jump up to: а б с д Марморштейн Р. (август 2001 г.). «Структура гистонов ацетилтрансфераз». Журнал молекулярной биологии . 311 (3): 433–44. дои : 10.1006/jmbi.2001.4859 . ПМИД 11492997 .
- ^ Jump up to: а б с Ян XJ, Сето Э (август 2007 г.). «HAT и HDAC: от структуры, функции и регуляции к новым стратегиям терапии и профилактики» . Онкоген . 26 (37): 5310–8. дои : 10.1038/sj.onc.1210599 . ПМИД 17694074 . S2CID 10662910 .
- ^ Jump up to: а б с д и Торок М.С., Грант П.А. (2004). «Белки гистон-ацетилтрансферазы способствуют транскрипционным процессам на нескольких уровнях». Достижения в области химии белков . 67 : 181–99. дои : 10.1016/S0065-3233(04)67007-0 . ISBN 9780120342679 . ПМИД 14969728 .
- ^ Цзян Х, Гао Ц, Чжэн В, Инь С, Ван Л, Чжун Л, Али А, Хан Т, Хао Ц, Фан Х, Сунь Х, Сюй П, Пандита ТК, Цзян Х, Ши Ц (май 2018 г.). «MOF влияет на мейотическое расширение фосфорилирования H2AX и сперматогенеза у мышей» . ПЛОС Генетика . 14 (5): е1007300. дои : 10.1371/journal.pgen.1007300 . ПМК 6019819 . ПМИД 29795555 .
- ^ Марморштейн Р., Рот С.Ю. (апрель 2001 г.). «Гистоны ацетилтрансферазы: функция, структура и катализ». Текущее мнение в области генетики и развития . 11 (2): 155–61. дои : 10.1016/S0959-437X(00)00173-8 . ПМИД 11250138 .
- ^ Олфри В.Г., Фолкнер Р., Мирский А.Е. (май 1964 г.). «Ацетилирование и метилирование гистонов и их возможная роль в регуляции синтеза РНК» . Труды Национальной академии наук Соединенных Штатов Америки . 51 (5): 786–94. Бибкод : 1964PNAS...51..786A . дои : 10.1073/pnas.51.5.786 . ПМК 300163 . ПМИД 14172992 .
- ^ Мухопадхьяй Р. (2012). «Работа Винсента Олфри по ацетилированию гистонов» . Журнал биологической химии . 287 (3): 2270–2271. дои : 10.1074/jbc.O112.000248 . ПМЦ 3265906 .
- ^ Центнер Г.Е., Хеникофф С. (март 2013 г.). «Регуляция динамики нуклеосом с помощью модификаций гистонов». Структурная и молекулярная биология природы . 20 (3): 259–66. дои : 10.1038/nsmb.2470 . ПМИД 23463310 . S2CID 23873925 .
- ^ Мадригал П., Краевский П. (июль 2015 г.). «Выявление коррелированной изменчивости в наборах эпигеномных данных с помощью преобразования Карунена-Лёве» . Добыча биоданных . 8:20 . doi : 10.1186/s13040-015-0051-7 . ПМЦ 4488123 . ПМИД 26140054 .
- ^ Спандж С., Вагнер Т., Хайнцель Т., Кремер О.Г. (январь 2009 г.). «Ацетилирование негистоновых белков модулирует клеточную передачу сигналов на нескольких уровнях». Международный журнал биохимии и клеточной биологии . 41 (1): 185–98. doi : 10.1016/j.biocel.2008.08.027 . ПМИД 18804549 .
- ^ Чунг П., Эллис К.Д., Сассон-Корси П. (октябрь 2000 г.). «Передача сигналов хроматину посредством модификаций гистонов» . Клетка . 103 (2): 263–71. дои : 10.1016/s0092-8674(00)00118-5 . ПМИД 11057899 . S2CID 16237908 .
- ^ Уинстон Ф., Эллис CD (июль 1999 г.). «Бромодомен: модуль, нацеленный на хроматин?». Структурная биология природы . 6 (7): 601–4. дои : 10.1038/10640 . ПМИД 10404206 . S2CID 22196542 .
- ^ Чи П., Эллис CD, Ван Г.Г. (июль 2010 г.). «Ковалентные модификации гистонов — неправильно написанные, неверно истолкованные и неверно стертые при раке человека» . Обзоры природы. Рак . 10 (7): 457–69. дои : 10.1038/nrc2876 . ПМЦ 3262678 . ПМИД 20574448 .
- ^ Барратт М.Дж., Хаззалин К.А., Кано Э., Махадеван Л.К. (май 1994 г.). «Митоген-стимулированное фосфорилирование гистона H3 направлено на небольшую фракцию, чувствительную к гиперацетилированию» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (11): 4781–5. Бибкод : 1994PNAS...91.4781B . дои : 10.1073/pnas.91.11.4781 . ПМК 43872 . ПМИД 8197135 .
- ^ Санчес Р., Чжоу М.М. (сентябрь 2009 г.). «Роль бромодоменов человека в биологии хроматина и транскрипции генов» . Текущее мнение об открытии и разработке лекарств . 12 (5): 659–65. ПМК 2921942 . ПМИД 19736624 .
- ^ Филиппакопулос П., Кнапп С. (май 2014 г.). «Нацеливание на бромодомены: эпигенетические считыватели ацетилирования лизина». Обзоры природы. Открытие наркотиков . 13 (5): 337–56. дои : 10.1038/nrd4286 . ПМИД 24751816 . S2CID 12172346 .
- ^ Барнс П.Дж., Адкок И.М., Ито К. (март 2005 г.). «Ацетилирование и деацетилирование гистонов: значение при воспалительных заболеваниях легких» . Европейский респираторный журнал . 25 (3): 552–63. дои : 10.1183/09031936.05.00117504 . ПМИД 15738302 .
- ^ Куо СН, Се СС, Ли М.С., Чанг КТ, Куо ХФ, Хунг СН (январь 2014 г.). «Эпигенетическая регуляция при аллергических заболеваниях и связанные с ними исследования» . Аллергия в Азиатско-Тихоокеанском регионе . 4 (1): 14–8. дои : 10.5415/apallergy.2014.4.1.14 . ПМЦ 3921865 . ПМИД 24527405 .
- ^ Мроз Р.М., Нопарлик Дж., Чичевска Е., Брашко Ю.Ю., Холовния А. (ноябрь 2007 г.). «Молекулярные основы хронического воспаления при заболеваниях легких: новый терапевтический подход». Журнал физиологии и фармакологии . 58 Приложение 5 (Часть 2): 453–60. ПМИД 18204158 .
- ^ Барнс П.Дж., Адкок И.М., Ито К. (март 2005 г.). «Ацетилирование и деацетилирование гистонов: значение при воспалительных заболеваниях легких» . Европейский респираторный журнал . 25 (3): 552–63. дои : 10.1183/09031936.05.00117504 . ПМИД 15738302 .
- ^ Глозак М.А., Сето Э (август 2007 г.). «Гистоновые деацетилазы и рак». Онкоген . 26 (37): 5420–32. дои : 10.1038/sj.onc.1210610 . ПМИД 17694083 . S2CID 2976852 .
- ^ Коэн И., Поремба Э., Камениарз К., Шнайдер Р. (июнь 2011 г.). «Модификаторы гистонов при раке: друзья или враги?» . Гены и рак . 2 (6): 631–47. дои : 10.1177/1947601911417176 . ПМК 3174261 . ПМИД 21941619 .
- ^ Дувик М., Талпур Р., Ни Х, Чжан С., Хазарика П., Келли С., Чиао Дж. Х., Рейли Дж. Ф., Рикер Дж. Л., Ричон В. М., Франкель С. Р. (январь 2007 г.). «Фаза 2 исследования перорального вориностата (субероиланилид гидроксамовой кислоты, SAHA) при рефрактерной кожной Т-клеточной лимфоме (CTCL)» . Кровь . 109 (1): 31–9. дои : 10.1182/кровь-2006-06-025999 . ПМК 1785068 . ПМИД 16960145 .
- ^ Грант С., Исли С., Киркпатрик П. (январь 2007 г.). «Вориностат». Обзоры природы. Открытие наркотиков . 6 (1): 21–2. дои : 10.1038/nrd2227 . ПМИД 17269160 . S2CID 262487540 .
- ^ Ван Ю.П., Лэй Цюй (май 2018 г.). «Метаболическое перекодирование эпигенетики рака» . Раковые коммуникации . 38 (1): 25. дои : 10.1186/s40880-018-0302-3 . ПМЦ 5993135 . ПМИД 29784032 .
- ^ Jump up to: а б Робисон А.Дж., Нестлер Э.Дж. (октябрь 2011 г.). «Транскрипционные и эпигенетические механизмы зависимости» . Обзоры природы. Нейронаука . 12 (11): 623–37. дои : 10.1038/nrn3111 . ПМЦ 3272277 . ПМИД 21989194 .
- ^ Хичкок Л.Н., Латтал К.М. (2014). «Гистон-опосредованная эпигенетика при зависимости». Эпигенетика и нейропластичность — данные и дебаты . Прогресс молекулярной биологии и трансляционной науки. Том. 128. стр. 51–87. дои : 10.1016/B978-0-12-800977-2.00003-6 . ISBN 9780128009772 . ПМЦ 5914502 . ПМИД 25410541 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Маккуон, Южная Каролина, Вуд, Массачусетс (апрель 2010 г.). «Эпигенетическая регуляция расстройств, связанных с употреблением психоактивных веществ» . Текущие отчеты психиатрии . 12 (2): 145–53. дои : 10.1007/s11920-010-0099-5 . ПМЦ 2847696 . ПМИД 20425300 .
- ^ Jump up to: а б Дабин Дж., Фортуни А., Polo SE (июнь 2016 г.). «Поддержание эпигенома в ответ на повреждение ДНК» . Молекулярная клетка . 62 (5): 712–27. doi : 10.1016/j.molcel.2016.04.006 . ПМК 5476208 . ПМИД 27259203 .
- ^ Jump up to: а б Управление служб по борьбе со злоупотреблением психоактивными веществами и психическим здоровьем, Результаты национального исследования по употреблению наркотиков и здоровью 2013 г.: Краткое изложение национальных результатов, серия NSDUH H-48, публикация HHS № (SMA) 14-4863. Роквилл, Мэриленд: Управление служб по борьбе со злоупотреблением психоактивными веществами и психическим здоровьем, 2014 г.
- ^ «Вызывает ли никотин привыкание?» .
- ^ Левин А., Хуанг Й., Дрисальди Б., Гриффин Э.А., Поллак Д.Д., Сюй С., Инь Д., Шаффран С., Кандел Д.Б., Кандель Э.Р. (ноябрь 2011 г.). «Молекулярный механизм шлюзового препарата: эпигенетические изменения, инициированные экспрессией гена никотина кокаином» . Наука трансляционной медицины . 3 (107): 107ра109. doi : 10.1126/scitranslmed.3003062 . ПМК 4042673 . ПМИД 22049069 .
- ^ Раффл Дж.К. (ноябрь 2014 г.). «Молекулярная нейробиология зависимости: о чем вообще (Δ)FosB?». Американский журнал о злоупотреблении наркотиками и алкоголем . 40 (6): 428–37. дои : 10.3109/00952990.2014.933840 . ПМИД 25083822 . S2CID 19157711 .
- ^ Нестлер Э.Дж., Баррот М., Селф Д.В. (сентябрь 2001 г.). «DeltaFosB: устойчивый молекулярный переключатель зависимости» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (20): 11042–6. Бибкод : 2001PNAS...9811042N . дои : 10.1073/pnas.191352698 . ПМК 58680 . ПМИД 11572966 .
- ^ Д'Аддарио К, Капути ФФ, Экстрем Т.Дж., Ди Бенедетто М., Маккарроне М., Ромуальди П., Канделетти С. (февраль 2013 г.). «Этанол индуцирует эпигенетическую модуляцию экспрессии генов продинорфина и проноцицептина в комплексе миндалевидного тела крысы». Журнал молекулярной нейронауки . 49 (2): 312–9. дои : 10.1007/s12031-012-9829-y . ПМИД 22684622 . S2CID 14013417 .
- ^ Уокер Д.М., Нестлер Э.Дж. (2018). «Нейроэпигенетика и зависимость». Нейрогенетика, Часть II . Справочник по клинической неврологии. Том. 148. стр. 747–765. дои : 10.1016/B978-0-444-64076-5.00048-X . ISBN 9780444640765 . ПМЦ 5868351 . ПМИД 29478612 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Jump up to: а б Рентал В, Кумар А, Сяо Г, Уилкинсон М, Ковингтон Х.Э., Мейз I, Сикдер Д., Робисон А.Дж., ЛаПлант К., Дитц Д.М., Руссо С.Дж., Виалоу В., Чакраварти С., Кодадек Т.Дж., Стэк А, Каббадж М., Нестлер Э.Дж. (май 2009 г.). «Полногеномный анализ регуляции хроматина кокаином показывает роль сиртуинов» . Нейрон . 62 (3): 335–48. дои : 10.1016/j.neuron.2009.03.026 . ПМЦ 2779727 . ПМИД 19447090 .
- ^ https://www.drugsandalcohol.ie/12728/1/NIDA_Cocaine.pdf [ только URL-адрес PDF ]
- ^ Адхами Н., Чен Ю., Мартинс-Грин М. (октябрь 2017 г.). «Биомаркеры заболевания могут быть обнаружены у мышей уже через 4 недели после начала воздействия табачного дыма от третьих рук, эквивалентного тем, которые обнаруживаются в домах курильщиков» . Клиническая наука . 131 (19): 2409–2426. дои : 10.1042/CS20171053 . ПМИД 28912356 .
- ^ Рултен С.Л., Ходдер Э., Рипли Т.Л., Стивенс Д.Н., Мейн Л.В. (июль 2008 г.). «Алкоголь вызывает повреждение ДНК и белок D2 анемии Фанкони, вовлекающий FANCD2 в пути реакции на повреждение ДНК в мозге» . Алкоголизм: клинические и экспериментальные исследования . 32 (7): 1186–96. дои : 10.1111/j.1530-0277.2008.00673.x . ПМИД 18482162 .
- ^ де Соуза М.Ф., Гонсалес Т.А., Стейнмец А., Моура Дж., Саффи Дж., Гомес Р., Баррос Х.М. (апрель 2014 г.). «Кокаин вызывает повреждение ДНК в различных областях мозга самок крыс при различных гормональных условиях». Клиническая и экспериментальная фармакология и физиология . 41 (4): 265–9. дои : 10.1111/1440-1681.12218 . ПМИД 24552452 . S2CID 20849951 .
- ^ Цюшэн З, Юньтао З, Жунлян З, Дин Г, Чанлин Л (июль 2005 г.). «Влияние вербаскозида и лютеолина на окислительное повреждение головного мозга мышей, получавших героин». Die Pharmazie . 60 (7): 539–43. ПМИД 16076083 .
- ^ Джонсон З., Вентерс Дж., Гуаррачи Ф.А., Зеваил-Фут М. (июнь 2015 г.). «Метамфетамин вызывает повреждение ДНК в определенных областях мозга самок крыс». Клиническая и экспериментальная фармакология и физиология . 42 (6): 570–5. дои : 10.1111/1440-1681.12404 . ПМИД 25867833 . S2CID 24182756 .
- ^ Токунага И., Исигами А., Кубо С., Готода Т., Китамура О. (август 2008 г.). «Пероксидативное повреждение ДНК и апоптоз в мозге крыс, обработанных метамфетамином» . Журнал медицинских расследований . 55 (3–4): 241–5. дои : 10.2152/jmi.55.241 . ПМИД 18797138 .
- ^ Мано Х (январь 2008 г.). «Эпигенетические нарушения при гипертрофии сердца и сердечной недостаточности» . Гигиена окружающей среды и профилактическая медицина . 13 (1): 25–9. Бибкод : 2008EHPM...13...25M . дои : 10.1007/s12199-007-0007-8 . ПМК 2698246 . ПМИД 19568876 .
- ^ Цао DJ, Ван З.В., Баттипролу П.К., Цзян Н., Моралес Ч.Р., Конг Й., Ротермель Б.А., Джилетт Т.Г., Хилл Дж.А. (март 2011 г.). «Ингибиторы гистондеацетилазы (HDAC) ослабляют гипертрофию сердца путем подавления аутофагии» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (10): 4123–8. Бибкод : 2011PNAS..108.4123C . дои : 10.1073/pnas.1015081108 . ПМК 3053983 . ПМИД 21367693 .
- ^ Чжан С.Л., McKinsey Т.А., Чанг С., Антос С.Л., Хилл Дж.А., Олсон Э.Н. (август 2002 г.). «Деацетилазы гистонов класса II действуют как реагирующие на сигналы репрессоры гипертрофии сердца» . Клетка . 110 (4): 479–88. дои : 10.1016/S0092-8674(02)00861-9 . ПМК 4459650 . ПМИД 12202037 .
- ^ Леманн Л.Х., Худший BC, Стэнмор Д.А., Бэкс Дж. (май 2014 г.). «Передача сигналов гистондеацетилазы в кардиопротекции» . Клеточные и молекулярные науки о жизни . 71 (9): 1673–90. дои : 10.1007/s00018-013-1516-9 . ПМЦ 3983897 . ПМИД 24310814 .
- ^ Ван Ю, Мяо Х, Лю Ю, Ли Ф, Лю Ц, Сунь Дж, Цай Л (2014). «Нарушение регуляции гистон-ацетилтрансфераз и деацетилаз при сердечно-сосудистых заболеваниях» . Окислительная медицина и клеточное долголетие . 2014 : 641979. doi : 10.1155/2014/641979 . ПМЦ 3945289 . ПМИД 24693336 .
- ^ Шикама Н., Лутц В., Кречмар Р., Заутер Н., Рот Дж.Ф., Марино С., Виттвер Дж., Шайдвайлер А., Экнер Р. (октябрь 2003 г.). «Основная функция активности ацетилтрансферазы p300 в формировании сердца, легких и тонкого кишечника» . Журнал ЭМБО . 22 (19): 5175–85. дои : 10.1093/emboj/cdg502 . ПМК 204485 . ПМИД 14517255 .
- ^ Тан Б., Дин Б., Томас Э.А. (декабрь 2011 г.). «Болезнетворные и возрастные изменения ацетилирования гистонов на промоторах генов при психических расстройствах» . Трансляционная психиатрия . 1 (12): е64. дои : 10.1038/tp.2011.61 . ПМЦ 3305989 . ПМИД 22832356 .
- ^ Ли Дж., Хван Ю.Дж., Ким К.Ю., Ковалл Н.В., Рю Х. (октябрь 2013 г.). «Эпигенетические механизмы нейродегенерации при болезни Хантингтона» . Нейротерапия . 10 (4): 664–76. дои : 10.1007/s13311-013-0206-5 . ПМЦ 3805871 . ПМИД 24006238 .
- ^ Грейсон Д.Р., Кундакович М., Шарма Р.П. (февраль 2010 г.). «Есть ли будущее у ингибиторов деацетилазы гистонов в фармакотерапии психических расстройств?». Молекулярная фармакология . 77 (2): 126–35. дои : 10.1124/моль.109.061333 . ПМИД 19917878 . S2CID 3112549 .
Внешние ссылки
[ редактировать ]- Анимация ацетилирования и деацетилирования хвоста гистонов: [1]