Ядерная медицина
| Ядерная медицина | |
|---|---|
 ядерной медицины Сканирование животных | |
| ICD-10-PCS | В |
| ICD-9 | 92 |
| Сетка | D009683 |
| Код OPS-301 | 3-70 - 3-72 , 8-53 |
Ядерная медицина или нуклеология , [ 1 ] является медицинской специальностью , включающей применение радиоактивных веществ в диагностике и лечении заболеваний . Ядерная визуализация, в некотором смысле, является радиологией, выполняемой внутренней , потому что она записывает излучение, испускаемое изнутри тела, а не излучение , которое передается через тело из внешних источников, таких как рентгеновские генераторы . Кроме того, сканирование ядерной медицины отличается от радиологии, так как акцент не делается не на анатомии визуализации, а на функции. По этой причине это называется физиологической визуализацией . Сканирование с одной фотонной эмиссионной компьютерной томографией (SPECT) и позитронной эмиссионной томографии (PET) - это два наиболее распространенных метода визуализации в ядерной медицине. [ 2 ]
Диагностическая медицинская визуализация
[ редактировать ]Диагностика
[ редактировать ]При визуализации ядерной медицины радиофармацевтические препараты принимаются внутри, например, посредством вдыхания, внутривенно или устно. Затем внешние детекторы ( гамма -камеры ) захватывают и образуют изображения из излучения, излучаемого радиофармацевтическими препаратами. Этот процесс не похож на диагностическую рентгеновский рост, где внешнее излучение проходит через тело, чтобы сформировать изображение. [ Цитация необходима ]
Есть несколько методов диагностической ядерной медицины.
- 2D: Сцинтиграфия («SCINT»)-это использование внутренних радионуклидов для создания двухмерных изображений. [ 3 ]
-
Сканирование костей ядерной медицины. Сканирование костей цельного тела ядерной медицины обычно используется при оценке различной патологии, связанной с костью, например, для боли в кости, стрессового перелома, незвуковых поражений костей, инфекций костей или распространения рака в кость.
-
Перфузионная перфузионная сканирование миокарда ядерной медицины с таллий-2011 для изображений остальных (нижних рядов) и TC-Sestamibi для изображений напряжений (верхние ряды). Сканирование перфузионной перфузии миокарда ядерной медицины играет ключевую роль в неинвазивной оценке заболевания коронарной артерии . Исследование не только идентифицирует пациентов с коронарной болезнью артерий; Он также предоставляет общую прогностическую информацию или общий риск неблагоприятных сердечных событий для пациента.
-
Сканирование паращитовидной железы ядерной медицины демонстрирует аденому околощитовидной железы, прилегающую к левому нижнему полюсу щитовидной железы. Приведенное выше исследование было выполнено с помощью одновременной визуализации Technetium-sestamibi (1-й столбец) и йода-123 (2-й столбец) и методики вычитания (3-й столбец).
-
Нормальное гепатобилиарное сканирование ( сканирование HIDA ). Гепатобилиарная сканирование ядерной медицины клинически полезно при обнаружении заболевания желчного пузыря.
-
Нормальная легочная вентиляция и сканирование перфузии (V/Q). Сканирование V/Q ядерной медицины полезно при оценке легочной эмболии .
-
Сканирование щитовидной железы с йодом-123 для оценки гипертиреоза.
- 3D: Spect - это трехмерная томографическая техника, которая использует данные гамма -камеры из многих проекций и может быть реконструирована в разных плоскостях. Позитронная эмиссионная томография (PET) использует обнаружение совпадений для функциональных процессов изображения.
-
Ядерная медицина охватывает сканирование печени с помощью технетиума-99M, обозначенного аутологичными эритроцитами. В центре внимания высокого поглощения (стрелка) в печени согласуется гемангиома .
-
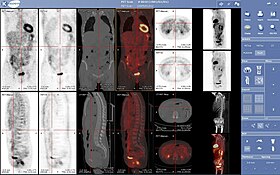
Максимальная проекция интенсивности (MIP) приобретения позитронной эмиссионной томографии (ПЭТ) цельной тела (ПЭТ) женского пола 79 кг после внутривенной инъекции 371 МБк 18F-FDG (один час до измерения).
Испытания на ядерную медицину отличаются от большинства других методов визуализации тем, что сканирование ядерной медицины в первую очередь показывает физиологическую функцию исследуемой системы, в отличие от традиционной анатомической визуализации, такой как КТ или МРТ. Исследования визуализации ядерной медицины, как правило, более специфичны для организма, ткани или заболевания (например, сканирование легких, сканирование сердца, сканирование костей, сканирование мозга, опухоль, инфекция, Паркинсон и т. Д.), чем на обычной радиологической визуализации, которые фокусируются на Особый участок тела (например, рентген грудной клетки, КТ-сканирование живота/таза, КТ-сканирование головы и т. Д.). Кроме того, существуют исследования ядерной медицины, которые позволяют визуализации всего тела на основе определенных клеточных рецепторов или функций. Примерами являются сканы с домашними животными или сканированием PET/CT , сканирование галлия , сканирование лейумных клеток индия , сканирование MIBG и Octreotide .
В то время как способность ядерного метаболизма обрабатывать процессы заболевания из -за различий в метаболизме непревзойденная, она не является уникальной. Некоторые методы, такие как ткани изображения МРТ (особенно церебральные ткани), с помощью кровотока и, таким образом, показывают метаболизм. Кроме того, методы контрастного усиления как в КТ, так и в МРТ показывают области ткани, которые по-разному обрабатывают фармацевтические препараты из-за воспалительного процесса.
Диагностические тесты в ядерной медицине используют то, как организм обрабатывает вещества по -разному, когда присутствует заболевание или патология. Радионуклид, введенный в организм, часто химически связан с комплексом, который характерно действует внутри организма; Это обычно известно как трассировщик . При наличии заболевания трассировщик часто распределяется вокруг тела и/или обрабатывается по -разному. Например, метилендифосфонат лиганда ( MDP ) может быть преимущественно поглощен костью. При химическом прикреплении технотиума-99 м к MDP, радиоактивность может быть транспортирована и прикреплена к кости через гидроксиапатит для визуализации. Любая повышенная физиологическая функция, например, из -за перелома в кости, обычно означает повышенную концентрацию трассера. Это часто приводит к появлению «горячей точки», которая представляет собой фокусное увеличение накопления радиосвязи или общее увеличение накопления радиосвязи по всей физиологической системе. Некоторые процессы заболевания приводят к исключению трассера, что приводит к появлению «холодного места». Многие индивидуальные комплексы были разработаны для обработки или лечения многих различных органов, желез и физиологических процессов.
Гибридные методы сканирования
[ редактировать ]В некоторых центрах можно наложить сканирование ядерной медицины, используя программные или гибридные камеры на изображениях из методов, таких как КТ или МРТ, для выделения части тела, в которой концентрируется радиофармацевтика. Эта практика часто называют слиянием изображения или совместной регистрации, например, SPECT/CT и PET/CT. Метод слияния визуализации в ядерной медицине предоставляет информацию об анатомии и функции, которая в противном случае была бы недоступна или потребует более инвазивной процедуры или хирургии.
-
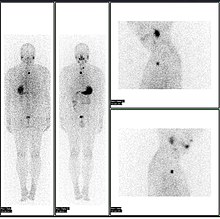
Нормальный питомец всего тела/CT с FDG -18. ВсЕ ПЭТ/CT-сканирование всего тела обычно используется при обнаружении, постановке и наблюдении за различными видами рака.
-
Ненормальный питомец для всего тела/КТ с множественными метастазами от рака. Всего питага для питомца/КТ стало важным инструментом в оценке рака.
Практические проблемы при ядерной визуализации
[ редактировать ]Хотя риски низкоуровневых радиационных воздействий недостаточно изучены, осторожный подход был повсеместно принят, что все человеческие радиационные воздействия должны быть столь же низкими, как разумно практично , «Alarp». (Первоначально это было известно как «столь же низко, как разумно достижимо» (Алара), но это изменилось в современных составах законодательства, чтобы добавить больше внимания «разумно» и меньше на «достижимого».)
Работая с принципом ALARP, прежде чем пациент подвергнут подверженности ядерной медицине, необходимо определить преимущество обследования. Это должно учитывать конкретные обстоятельства рассматриваемого пациента, где это необходимо. Например, если пациент вряд ли сможет переносить достаточное количество процедуры для достижения диагноза, то было бы неуместно продолжить инъекцию пациента с радиоактивным трассером.
Когда преимущество действительно оправдывает процедуру, то воздействие радиации (количество излучения, данного пациенту), также следует сохранять «alarp». Это означает, что изображения, полученные в ядерной медицине, никогда не должны быть лучше, чем требуются для уверенности в диагностике. Предоставление больших радиационных воздействий может уменьшить шум на изображении и сделать его более фотографически привлекательным, но если на клинический вопрос можно ответить без этого уровня детализации, то на это неуместно.
В результате доза радиации от визуализации ядерной медицины сильно варьируется в зависимости от типа исследования. Эффективная доза излучения может быть ниже, чем или сопоставима или может намного превышать общую ежедневную ежегодную дозу фонового излучения . Аналогичным образом, это также может быть меньше, чем в диапазоне или выше дозы радиации от КТ брюшной полости/таза.
Некоторые процедуры ядерной медицины требуют специального препарата пациента перед исследованием, чтобы получить наиболее точный результат. Предварительные приготовления могут включать в себя диетическую подготовку или удержание определенных лекарств. Пациентам рекомендуется проконсультироваться с отделом ядерной медицины до сканирования.
Анализ
[ редактировать ]Результатом процесса визуализации ядерной медицины является набор данных, содержащий одно или несколько изображений. В наборах данных с несколькими изображениями массив изображений может представлять собой временную последовательность (то есть цилиндр или фильм), часто называемый «динамическим» набором данных, сердечную последовательность времени, или пространственную последовательность, в которой перемещается гамма-камера по сравнению с пациентом. Spect (однократная компьютерная томография из эмиссии)-это процесс, посредством которого изображения, полученные из вращающейся гамма-камеры, реконструируются для получения изображения «среза» через пациента в определенной позиции. Коллекция параллельных срезов образует среза, трехмерное представление распределения радионуклида у пациента.
Компьютер ядерной медицины может потребовать, чтобы миллионы линий исходного кода для предоставления количественных пакетов анализа для каждого из конкретных методов визуализации, доступных в ядерной медицине. [ Цитация необходима ]
Временные последовательности могут быть дополнительно проанализированы с использованием кинетических моделей, таких как модели с несколькими компонентами или график Patlak .
Интервенционная ядерная медицина
[ редактировать ]Радионуклидная терапия может быть использована для лечения таких состояний, как гипертиреоз , рак щитовидной железы , рак кожи и нарушения крови.
При терапии ядерной медицины доза радиационной лечения вводится внутри (например, внутривенных или пероральных путей) или внешне выше области для лечения в форме соединения (например, в случае рака кожи).
Радиофармацевтические препараты, используемые при терапии ядерной медицины, испускают ионизирующее излучение, которое проходит только на короткое расстояние, тем самым сводя к минимуму нежелательные побочные эффекты и повреждение не взволнованных органов или близлежащих структур. Большинство методов лечения ядерной медицины могут быть выполнены в качестве амбулаторных процедур, поскольку из лечения мало побочных эффектов, и радиационное воздействие широкой публики может быть сохранено в пределах безопасного предела.
Обычная ядерная медицина (отпечатанный источник) терапия
| Вещество | Состояние |
|---|---|
| Йод -131 -йодид | гипертиреоз и рак щитовидной железы |
| Yttrium-90- ibritumomab tiuxetan (Zevalin) и йод-131- тозитумомаб (bexxar) | Рефрактерная лимфома |
| 131 I-mibg ( метаодобензилгуанидин ) | нейроэндокринные опухоли |
| Самарий-153 или стронций-89 | Паллиативная боли в костях лечение |
| Rhenium -188 | плоскоклеточная карцинома или базально -клеточная карцинома кожи |
В некоторых центрах отдел ядерной медицины может также использовать имплантированные капсулы изотопов ( брахитерапия ) для лечения рака.
Обычно используемые источники радиации (радионуклиды) для брахитерапии [ 4 ]
| Радионуклид | Тип | Период полураспада | Энергия |
|---|---|---|---|
| Цезий-137 ( 137 CS) | C-ray | 30,17 лет | 0,662 МэВ |
| Кобальт-60 ( 60 CO) | C-ray | 5,26 года | 1.17, 1,33 МэВ |
| Иридий-192 ( 192 И) | беременный − -Частицы | 73,8 дня | 0,38 МэВ (среднее) |
| Йод-125 ( 125 Я) | C-rays | 59,6 дня | 27,4, 31,4 и 35,5 кэВ |
| Palladium-103 ( 103 ПД) | C-ray | 17,0 дней | 21 позиция (среднее) |
| Рутениум-106 ( 106 Ру) | беременный − -Частицы | 1,02 года | 3.54 МэВ |
История
[ редактировать ]История ядерной медицины содержит вклад ученых по различным дисциплинам в области физики, химии, инженерии и медицины. Междисциплинарный характер ядерной медицины затрудняет медицинским историкам определить дату рождения ядерной медицины. Это, вероятно, может быть лучше всего размещено между обнаружением искусственной радиоактивности в 1934 году и производством радионуклидов Национальной лабораторией Оук-Ридж на Национальной лаборатории по использованию медицины в 1946 году. [ 5 ]
Происхождение этой медицинской идеи датируется до середины 1920-х годов в Фрайбурге , Германия, когда Джордж де Хивеси провел эксперименты с радионуклидами, вводимыми крысам, демонстрируя тем самым метаболические пути этих веществ и устанавливая принцип трассера . Возможно, генезис этой медицинской области состоялось в 1936 году, когда Джон Лоуренс , известный как «Отец ядерной медицины», получил отпуск на должность факультета в Йельской медицинской школе , чтобы посетить своего брата Эрнеста Лоуренса на его новом радиационная лаборатория (в настоящее время известная как Национальная лаборатория Лоуренса Беркли ) в Беркли , штат Калифорния . Позже Джон Лоуренс сделал первое применение у пациентов искусственного радионуклида, когда он использовал фосфор-32 для лечения лейкемии . [ 6 ] [ 7 ]
Многие историки считают открытие искусственно произведенных радионуклидов Фредериком Джолиотом-Кури и Иреном Джолиотом-Кури в 1934 году как наиболее значимой вехой в ядерной медицине. [ 5 ] В феврале 1934 года они сообщили о первом искусственном производстве радиоактивного материала в журнале Nature , после обнаружения радиоактивности в алюминиевой фольге, которая была облучена приготовлением полония. Их работа построена на более ранних открытиях Вильгельма Конрада Рентгена для рентгеновского роста, Анри Бекерель для радиоактивных урановых солей и Мари Кюри (Мать Ирэ Кюри) для радиоактивного тория, полоника и придумывания термина «радиоактивность». Таро Такеми изучил применение ядерной физики к медицине в 1930 -х годах. История ядерной медицины не будет полной без упоминания этих ранних пионеров.
Ядерная медицина получила публичное признание как потенциальную специальность, когда 11 мая 1946 года стала статья в журнале Американской медицинской ассоциации (JAMA) от Массачусетской больницы общего профиля доктора Саула Герца и Массачусетского технологического института доктора Артура Робертса, описал успешный Было опубликовано использование болезни Грейвса с помощью радиоактивного йода (RAI). [ 8 ] Кроме того, Сэм Сейдлин . [ 9 ] Получил дальнейшее развитие в этой области с описанием успешного лечения пациента с метастазами рака щитовидной железы с использованием радиоида ( I-131 ). Эти статьи рассматриваются многими историками как самые важные статьи, когда -либо опубликованные в ядерной медицине. [ 10 ] Хотя самое раннее использование I-131 было посвящено терапии рака щитовидной железы, его использование было позже расширено, чтобы включить визуализацию щитовидной железы, количественную оценку функции щитовидной железы и терапию гипертиреоза. Среди множества радионуклидов, которые были обнаружены для медицинского использования, ни один из них не был таким важным, как открытие и развитие Technetium-99M . Впервые он был обнаружен в 1937 году С. Перрером и Э. Сегром в качестве искусственного элемента для заполнения пространства № 43 в периодической таблице. Разработка системы генератора для производства Technetium-99M в 1960-х годах стала практическим методом для медицинского использования. Сегодня Technetium-99M является наиболее используемым элементом в ядерной медицине и используется в самых разных исследованиях визуализации ядерной медицины.
Широко распространенное клиническое использование ядерной медицины началось в начале 1950 -х годов, поскольку знания расширялись о радионуклидах, обнаружении радиоактивности и использовании определенных радионуклидов для отслеживания биохимических процессов. Новаторские работы Бенедикта Кассена по разработке первого прямолинейного сканера и ) Хэла О. Анге сцинтилляционной камеры ( камера гнева расширили молодую дисциплину ядерной медицины в полноценную специальность медицинской визуализации.
К началу 1960-х годов в Южной Нильс Скандинавии А. Лассен , Дэвид Х. Ингвар и Эрик Скинхей разработали методы, которые обеспечивали первые карты крови мозга, которые изначально включали в себя Ксенона-133 ; ингаляцию [ 11 ] Вскоре после этого был разработан внутриартериальный эквивалент, что позволило измерению локального распределения церебральной активности для пациентов с нейропсихиатрическими расстройствами, такими как шизофрения. [ 12 ] В более поздних версиях было бы 254 сцинтилляторов , чтобы на цветовом мониторе можно было создать двухмерное изображение. Это позволило им построить изображения, отражающие активацию мозга от разговора, чтения, визуального или слухового восприятия и добровольного движения. [ 13 ] Техника также использовалась для изучения, например, воображаемых последовательных движений, умственных расчетов и умственной пространственной навигации. [ 14 ] [ 15 ]
К 1970 -м годам большинство органов организма можно было визуализировать с использованием процедур ядерной медицины. В 1971 году Американская медицинская ассоциация официально признала ядерную медицину как медицинскую специальность. [ 16 ] В 1972 году был создан Американский совет по ядерной медицине , и в 1974 году был создан Американский остеопатический совет по ядерной медицине , укрепляя ядерную медицину как автономную медицинскую специальность.
В 1980 -х годах радиофармацевтические препараты были разработаны для использования при диагностике сердечных заболеваний. Разработка отдельной компьютерной томографии из эмиссии (SPECT) примерно в то же время привела к трехмерной реконструкции сердца и установлению области ядерной кардиологии.
Более поздние события в ядерной медицине включают изобретение первого сканера по позитронной эмиссионной томографии ( PET ). Концепция эмиссии и передачи томографии, позже превращенной в однократную компьютерную томографию из эмиссии (SPECT), была представлена Дэвидом Э. Куль и Роем Эдвардсом в конце 1950 -х годов. [ Цитация необходима ] Их работа привела к разработке и строительству нескольких томографических инструментов в Университете Пенсильвании. Методы томографической визуализации были дополнительно разработаны в Медицинской школе Вашингтонского университета . Эти инновации привели к тому, что Fusion Imaging с Spect и CT Брюс Хасегава из Калифорнийского университета, Сан -Франциско (UCSF) и первый прототип PET/CT от DW Townsend из Университета Питтсбурга в 1998 году. [ Цитация необходима ]
Pet и Pet/CT-визуализация испытывала более медленный рост в первые годы из-за стоимости модальности и требования к на месту или близлежащему циклотрону. Тем не менее, административное решение о утверждении медицинского возмещения заявлений о ограниченных животных и ПЭТ/КТ в онкологии привело к феноменальному росту и широко распространенному принятию в течение последних нескольких лет, что также было облегчено путем установления 18F-маркеров для стандартных процедур, позволяя работать Нециклотронные сайты. PET/CT -визуализация в настоящее время является неотъемлемой частью онкологии для диагностики, постановки и мониторинга лечения. Полностью интегрированный сканер МРТ/ПЭТ находится на рынке с начала 2011 года. [ Цитация необходима ]
Источники радионуклидов
[ редактировать ]99 м ТС обычно поставляется в больницы через гененуклид генератора, содержащего родительский радиолинклид молибдена-99 . 99 МО обычно получается как продукт деления 235 U в ядерных реакторах, однако глобальная нехватка поставок привела к изучению других методов производства . Около трети мировых поставок и большую часть предложения Европы медицинских изотопов производится в Petten Beslear Reactor в Нидерландах . Еще одна треть мирового запаса и большая часть запасов Северной Америки была произведена в лабораториях Чол -Ривер в Чолк -Ривер , Онтарио , Канада, до его постоянного отключения в 2018 году. [ 17 ]
Наиболее часто используемый радиоизотоп в домашнем животном, 18 F , не продуцируется в ядерном реакторе, а скорее в круглом ускорителе, называемом циклотроном . Циклотрон используется для ускорения протонов для бомбардировки стабильного тяжелого изотопа кислорода 18 О. А 18 O составляет около 0,20% обычного кислорода (в основном кислорода-16 ), из которого он извлечен. А 18 F затем обычно используется для изготовления FDG .
| изотоп | символ | С | T 1/2 | разлагаться | Гамма (дорога) | Максимальный β
энергия (KEV) / Избыток [ 21 ] |
|---|---|---|---|---|---|---|
| Визуализация: | ||||||
| фтор-18 | 18 Фон | 9 | 109,77 м | беременный + | 511 (193%) | 634 (97%) |
| Gallium-67 | 67 Для | 31 | 3.26 d | ЕС | 93 (39%), 185 (21%), 300 (17%) |
- |
| Криптон-81M | 81 м КР | 36 | 13,1 с | ЭТО | 190 (68%) | - |
| Рубидий-82 | 82 РБ | 37 | 1,27 м | беременный + | 511 (191%) | 3381 (81.8%)
2605 (13.1%) 1906 (0.14%) 1209 (0.32%) |
| азот-13 | 13 Не | 7 | 9,97 м | беременный + | 511 (200%) | 1198 (99.8%) |
| Technetium-99M | 99 м ТК | 43 | 6,01 ч | ЭТО | 140 (89%) | - |
| индий-111 | 111 В | 49 | 2,80 г | ЕС | 171 (90%), 245 (94%) |
- |
| йод-123 | 123 я | 53 | 13,3 ч | ЕС | 159 (83%) | - |
| Ксенон-133 | 133 Машина | 54 | 5,24 г | беременный − | 81 (31%) | 346 (99.1%)
267 (0.9%) |
| Таллий-201 | 201 TL | 81 | 3.04 D. | ЕС | 69–83 * (94%), 167 (10%) |
- |
| Терапия: | ||||||
| yttrium-90 | 90 И | 39 | 2,67 г | беременный − | - | 2279 (99.98%) |
| йод-131 | 131 я | 53 | 8,02 d | беременный − | 364 (81%) | 807 (0.4%)
606 (89.4%) 334 (7.2%) 248 (2.1%) |
| Lutetium-177 | 177 Лу | 71 | 6,65 г | беременный − | 113 (6.6%),
208 (11%) |
498 (79.3%)
385 (9.1%) 177 (11.6%) |
|
Z = атомное число, количество протонов; T 1/2 = период полураспада; распад = режим распада | ||||||
Типичное исследование ядерной медицины включает введение радионуклида в организм путем внутривенной инъекции в жидкости или агрегатной форме, проглатывающее в сочетании с пищевой пищей, вдыханием в качестве газа или аэрозоля, или редко, инъекции радионуклида, которая поднижена микро-инкапсуляцией . Некоторые исследования требуют маркировки собственных клеток крови пациента радионуклидом ( сцинтиграфия лейкоцитов и сцинтиграфия эритроцитов ). Большинство диагностических радионуклидов испускают гамма-лучи либо непосредственно из их распада, либо косвенно через электрон-позитроновое аннигиляцию , в то время как наносительные клеточные свойства бета-частиц используются в терапевтических применениях. Рафинированные радионуклиды для использования в ядерной медицине получены из деления процессов или слияния в ядерных реакторах , которые продуцируют радионуклиды с более длинными полураспадами или циклотронами , которые производят радионуклиды с более короткими периодами полураспада или используют естественные процессы распада в выделенных генераторах,, т.е. молибден/техник или стронций/рубидий.
Наиболее часто используемыми внутривенными радионуклидами являются Technetium-99M, йод-123, йод-131, Thallium-201, Gallium-67, фтор-18 фтородезоксиглюкоза и индий-111, меченные лейкоциты . [ Цитация необходима ] Наиболее часто используемыми газообразными/аэрозольными радионуклидами являются ксенон-133, Krypton-81M, ( аэрозолизированный ) Technetium-99M. [ 22 ]
Политики и процедуры
[ редактировать ]Радиационная доза
[ редактировать ]Пациент, перенесший процедуру ядерной медицины, получит радиационную дозу . В соответствии с нынешними международными руководящими принципами предполагается, что любая доза радиации, хотя и небольшая, представляет риск. Обоснованная доза, доставляемая пациенту, в результате исследования ядерной медицины, хотя и недоказанная, общепринята для того, чтобы представлять очень небольшой риск индукции рака. В этом отношении это аналогично риску исследований рентгеновских лучей, за исключением того, что доза доставляется внутри, а не из внешнего источника, такого как рентгеновский аппарат, а количество дозировки обычно значительно выше, чем у рентгеновских лучей.
Доза радиации от исследования ядерной медицины выражается в качестве эффективной дозы с единицами сивертов (обычно дается в Millisieverts, MSV). вызванная исследованием, зависит от количества радиоактивности, вводимой в Mega Becquerels (MBQ), физические свойства используемой радиофармацевтики Эффективная доза , , его распределение в организме и скорость его клиренса от организма.
варьироваться от 6 мкСВ (0,006 MSV) для 3 MBQ -51 уровня клубочковой фильтрации 11,200 мкв измерения Эффективные дозы могут ( . Обычное сканирование кости с 600 МБК MDP Technetium-99M имеет эффективную дозу приблизительно 2,9 мсВ (2900 мксВ). [ 23 ]
Раньше, единицы измерения были Curie (CI), составляя 3,7E10 BQ, а также 1,0 ( RA грамма радия - 226 ); RAD ( доза поглощенной радиацией), теперь замененная серой ; и REM ( эквивалент Röntgen ), теперь заменен Sievert . [ 24 ] RAD и REM по существу эквивалентны практически для всех процедур ядерной медицины, и только альфа -радиация будет привести к более высокого значения REM или SV из -за его гораздо более высокой относительной биологической эффективности (RBE). Альфа -эмиттеры в настоящее время редко используются в ядерной медицине, но широко использовались перед появлением ядерного реактора и ускорителя, продуцированных радионуклидами. Концепции, связанные с радиационным воздействием людей, охватываются области физики здоровья ; Разработка и практика безопасных и эффективных методов ядерных лекарств является ключевым направлением медицинской физики .
Нормативные рамки и руководящие принципы
[ редактировать ]Различные страны мира поддерживают нормативные рамки, которые отвечают за управление и использование радионуклидов в различных медицинских условиях. Например, в США Комиссия по ядерному регулированию (NRC) и Управление по контролю за продуктами и лекарствами (FDA) имеют руководящие принципы для последующих больниц. [ 25 ] С NRC, если радиоактивные материалы не задействованы, например, рентгеновские снимки, они не регулируются агентством и вместо этого регулируются отдельными государствами. [ 26 ] Международные организации, такие как Международное агентство по атомной энергетике (МАГАТЭ), регулярно публикуют различные статьи и руководящие принципы для лучших практик в области ядерной медицины, а также сообщают о новых технологиях в ядерной медицине. [ 27 ] [ 28 ] Другие факторы, которые рассматриваются в ядерной медицине, включают историю болезни пациента, а также лечение после лечения. Такие группы, как Международная комиссия по радиологической защите, опубликовали информацию о том, как управлять выпуском пациентов из больницы с раскрытыми радионуклидами. [ 29 ]
Смотрите также
[ редактировать ]- Исследование человеческого предмета
- Список общества ядерной медицины
- Врач ядерной медицины
- Ядерная аптека
- Ядерные технологии
- Рентгенограф
Ссылки
[ редактировать ]- ^ Что такое нуклеология?
- ^ «Ядерная медицина» . Архивировано с оригинала 27 февраля 2015 года . Получено 20 августа 2015 года .
- ^ Сцинтиграфия, цитируя: Медицинский словарь Дорланда для потребителей здоровья, 2007 г., от Сондерса; Saunders Complossure Veterinary Dictionary, 3 Ed. 2007; McGraw-Hill Краткий словарь современной медицины, 2002 г. компанией McGraw-Hill Companies
- ^ «Карты ядерного кошелька» . Получено 20 августа 2015 года .
- ^ Jump up to: а беременный Эдвардс, CL (1979). «Опухоли-локализующие радионуклиды в ретроспективе и перспективе». Семинары в ядерной медицине . 9 (3): 186–9. doi : 10.1016/s0001-2998 (79) 80030-6 . PMID 388628 .
- ^ Лаборатория Доннера: место рождения. Ядерная медицина
- ^ «Важные моменты в истории ядерной медицины» . Архивировано из оригинала 2013-12-14 . Получено 2012-01-03 .
- ^ Герц С, Робертс А (май 1946 г.). «Радиоактивный йод в изучении физиологии щитовидной железы; использование радиоактивной йодиной терапии при гипертиреозе». Журнал Американской медицинской ассоциации . 131 : 81–6. doi : 10.1001/Jama.1946.02870190005002 . PMID 21025609 .
- ^ Seidlin SM, Marinelli Ld, Oshry E (декабрь 1946 г.). «Радиоактивная йод -терапия; влияние на функционирующие метастазы аденокарциномы щитовидной железы». Журнал Американской медицинской ассоциации . 132 (14): 838–47. doi : 10.1001/Jama.1946.02870490016004 . PMID 20274882 .
- ^ Henkin R, et al. (1996). Ядерная медицина (первое изд.). Мосби. ISBN 978-0-8016-7701-4 .
- ^ Lassen NA , Ingvar DH [на шведском языке] (1961). «Количественное определение регионального потока головного мозга у человека». Lancet . 278 (7206): 806–807. doi : 10.1016/s0140-6736 (61) 91092-3 .
- ^ Английский [на шведском] , Франзен Дж (декабрь 1974 г.). «Распределение церебральной активности при хронической шизофрении » Лансет 2 (7895): 1484–6 Doi : 10.1016/s0140-6736 (74) 90221-9 4140398PMID
- ^ Лассен Н.А. , Ингвар Д.Х. [на шведском] , Скинхёдж Э [по -датские] (октябрь 1978 г.). «Функция мозга и кровоток». Scientific American . 239 (4): 62–71. Bibcode : 1978sciam.239d..62L . doi : 10.1038/scientificamerican1078-62 . PMID 705327 .
- ^ Roland PE [на шведском] , Ларсен Б., Лассен Н.А. , Скинхёй Э [на датском языке] (январь 1980). «Дополнительная моторная зона и другие корковые зоны в организации добровольных движений в человеке». Журнал нейрофизиологии . 43 (1): 118–36. doi : 10.1152/jn.1980.43.1.118 . PMID 7351547 .
- ^ Roland PE [на шведском] , Friberg L [на шведском] (1985). «Локализация областей коры, активированной мышлением» . Журнал нейрофизиологии . Тол. 53, нет. 5. С. 1219–1243.
- ^ «Что такое ядерная медицина» (PDF) . Общество ядерной медицины . Архивировано из оригинала (PDF) 2016-01-17 . Получено 2009-01-17 .
- ^ «Канада постоянно закрывает исследовательский реактор NRU» . Ядерная инженерия International . 6 апреля 2018 года.
- ^ Eckerman KF, Endo A: Mird: данные радионуклида и схемы распада. Общество ядерной медицины, 2008. ISBN 978-0-932004-80-2
- ^ Таблица радиоактивных изотопов архивировал 2004-12-04 на машине Wayback
- ^ Dash A, Pillai MR, Knapp FF (июнь 2015 г.). «Производство (177) LU для целевой радионуклидной терапии: доступные варианты» . Ядерная медицина и молекулярная визуализация . 49 (2): 85–107. doi : 10.1007/s13139-014-0315-z . PMC 4463871 . PMID 26085854 .
- ^ «Атомные и ядерные данные» . Национальная лаборатория Анри Беккерел . Получено 24 октября 2022 года .
- ^ Technegas Радиоаэрозол, изобретенный в Австралии доктором Биллом Берчем и доктором Ричардом Фодри
- ^ Администрация консультативного комитета радиоактивных веществ (19 февраля 2021 г.). «Примечания ARSAC для руководства» (PDF) . Gov.uk. Общественное здравоохранение Англия .
- ^ Чендлер, Дэвид (2011-03-28). "Объяснил: рад, Рем, Сивертс, Бекерелс" . MIT News | Массачусетский технологический институт . Получено 2021-04-25 .
- ^ Franklin Cl (ed.), «Обзор правил радиофармацевтических препаратов» , Radoinuclide Therapy: клинические и научные аспекты , Springer International Publish Le, Dao (2021), Wong , Locoregional 10.1007/978-3-030-56267-0_10 , ISBN 978-3-030-56267-0 , S2CID 230547683 , получен 2021-04-25
- ^ «Ядерная медицина: что это такое - и нет» . NRC Web . 2020-06-08 . Получено 2021-04-25 .
- ^ «Стандарты безопасности МАГАТЭ и медицинская экспозиция» . www.iaea.org . 2017-10-30 . Получено 2021-04-25 .
- ^ «Кампус здоровья человека - ядерная медицина» . HumanHealth.iaea.org . 21 февраля 2020 года . Получено 2021-04-25 .
- ^ Международная комиссия по радиологической защите (июнь 2004 г.). «Высвобождение пациентов после терапии от необычных радионуклидов» . Анналы ICRP . 34 (2): V - Vi. doi : 10.1016/j.icrp.2004.08.001 . ISSN 0146-6453 . PMID 15571759 . S2CID 43014655 .
Дальнейшее чтение
[ редактировать ]- MAS JC (2008). Руководство пациента по процедурам ядерной медицины: англо-испаниш . Общество ядерной медицины. ISBN 978-0-9726478-9-2 .
- Тейлор А., Шустер Д.М., Наоми Алазраки Н. (2000). Руководство клиницистов по ядерной медицине (2 -е изд.). Общество ядерной медицины. ISBN 978-0-932004-72-7 .
- Shumate MJ, Kooby DA, Alazraki NP (2007). Руководство клинициста по ядерной онкологии: практическая молекулярная визуализация и терапия радионуклида . Общество ядерной медицины. ISBN 978-0-9726478-8-5 .
- Ell P, Gambhir S (2004). Ядерная медицина при клинической диагностике и лечении . Черчилль Ливингстон. п. 1950. ISBN 978-0-443-07312-0 .
- Jones DW, Hogg P, Seeram E (2013). Практический Spect/CT в ядерной медицине . Спрингер. ISBN 978-1447147022 .
Внешние ссылки
[ редактировать ]- Ядерная медицина в Керли
- Решение слушания по кризису медицинского изотопного кризиса перед подкомитетом по энергетике и окружающей среде Комитета по энергетике и торговле, Палата представителей, сто одиннадцатый конгресс, первая сессия, 9 сентября 2009 г.









