Гидрид алюминия
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Гидрид алюминия | |
| Систематическое название ИЮПАК Алюмане | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.139 |
| 245 | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Аль Н 3 | |
| Молярная масса | 30.006 g·mol −1 |
| Появление | белое кристаллическое твердое вещество, нелетучие, высокополимеризованные, игольчатые кристаллы. |
| Плотность | 1,477 г/см 3 , твердый |
| Температура плавления | 150 ° C (302 ° F; 423 К) начинает разлагаться при 105 ° C (221 ° F) |
| реагирует | |
| Растворимость | растворим в эфире реагирует в этаноле |
| Термохимия | |
Теплоемкость ( С ) | 40,2 Дж/(моль·К) |
Стандартный моляр энтропия ( S ⦵ 298 ) | 30 Дж/(моль·К) |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −11,4 кДж/моль |
Свободная энергия Гиббса (Δ f G ⦵ ) | 46,4 кДж/моль |
| Родственные соединения | |
Родственные соединения | Литий-алюминийгидрид , диборан |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гидрид алюминия (также известный как алан и алюман ) представляет собой неорганическое соединение с формулой Аль Н 3 . Алан и его производные являются частью семейства обычных восстановителей в органическом синтезе, основанных на гидридах группы 13 . [1] В растворе — обычно в эфирных растворителях, таких как тетрагидрофуран или диэтиловый эфир — гидрид алюминия образует комплексы с основаниями Льюиса и селективно реагирует с определенными органическими функциональными группами (например, с карбоновыми кислотами и сложными эфирами по сравнению с органическими галогенидами и нитрогруппами ), и хотя это не так реагент выбора, он может реагировать с кратными углерод-углеродными связями (т.е. посредством гидроалюминирования ). Учитывая его плотность и содержание водорода порядка 10% по массе, [2] некоторые формы аланов, по состоянию на 2016 год, [3] активные кандидаты для хранения водорода и, следовательно, для производства электроэнергии в топливных элементах, включая электромобили. [ не проверено в теле ] По состоянию на 2006 год было отмечено, что необходимы дальнейшие исследования для определения эффективного и экономичного способа обратить вспять процесс регенерации аланов из отработанного алюминиевого продукта.
Твердый гидрид алюминия, или алан, бесцветен и нелетуч, и в своей наиболее распространенной реагентной форме он представляет собой высокополимеризованный вид (т. е. имеет несколько звенья AlH 3 , которые являются самоассоциированными); плавится с разложением при 110 °C. [4] Хотя алановые твердые вещества и растворы не являются самовозгорающимися, при их использовании необходимо соблюдать меры предосторожности, как и в случае с другими легковоспламеняющимися гидридами металлов , и с ними следует обращаться и хранить при активном исключении влаги. Алан разлагается на воздухе (в основном из-за примеси влаги), хотя пассивация — в данном случае позволяющая создать инертное поверхностное покрытие — значительно снижает скорость разложения препаратов аланов. [ не проверено в теле ]
Форма и структура [ править ]
Этот раздел нуждается в дополнительных цитатах для проверки . ( Июль 2022 г. ) |
Алан — бесцветное и нелетучее твердое вещество, плавящееся с разложением при 110 °C. [4] Однако твердая форма часто представляет собой белое твердое вещество, которое может иметь серый оттенок (при уменьшении размера частиц реагента или увеличении уровня примесей). [ нужна ссылка ] Эта окраска возникает из-за тонкого поверхностного пассивационного слоя оксида или гидроксида алюминия. [ нужна ссылка ]
В обычных лабораторных условиях алан структурно «высокополимерен». [4] Иногда это обозначается формулой (AlH 3 ) n , где n не указано. [5] [ нужен неосновной источник ] Препараты алан растворяют в тетрагидрофуране (ТГФ) или диэтиловом эфире (эфире), [4] из которого выпадают чистые аллотропы. [6] [ нужен неосновной источник ]
Структурно алан может принимать многочисленные полиморфные формы . К 2006 году «по крайней мере 7 несольватированных AlH 3 »: α-, α'-, β-, γ-, ε- и ζ-аланы; Известны фазы [2] Впоследствии были открыты δ- и θ-аланы. [ нужна ссылка ] Каждый из них имеет разную структуру, причем α-алан является наиболее термостабильной полиморфной модификацией. [ нужна ссылка ] Например, кристаллографически α-алан принимает кубическую или ромбоэдрическую морфологию, тогда как α’-алан образует игольчатые кристаллы, а γ-алан образует пучки сросшихся иголок. [ нужна ссылка ] Была определена кристаллическая структура α-алана, в которой атомы алюминия окружены шестью октаэдрически ориентированными атомами водорода, которые соединяются с шестью другими атомами алюминия (см. таблицу), где все расстояния Al-H эквивалентны (172 пм), а Al Угол -H-Al составляет 141°. [7]
| Кристаллографическая структура α- АлХ 3 [8] | |||||
|---|---|---|---|---|---|
| α- AlH 3 элементарная ячейка | Алюминиевая координация | Координация водорода | |||
 |  |  | |||
Когда β- и γ-аланы производятся совместно, они при нагревании превращаются в α-аланы, тогда как δ-, ε- и θ-аланы образуются в других условиях кристаллизации; полиморфы δ-, ε- и θ-аланов, хотя они менее термически стабильны, не превращаются в α-аланы при нагревании. [6] [ нужен лучший источник ]
В особых условиях можно получить и изучить неполимерные аланы (т.е. их молекулярные формы). Мономерный AlH 3 был выделен при низкой температуре в твердой матрице благородного газа , где было показано, что он является плоским. [9] Димерная форма, Al 2 H 6 выделен в твердом водороде изоструктурен диборану и ( B 2 H 6 ) и дигаллан ( Ga2H6 H ) . [10] [11] [12]
Обработка [ править ]
Алан не является самовозгорающимся. [13] Несмотря на это, «подобное обращение и меры предосторожности, как... Рекомендуется использовать Li[AlH 4 ] » (химический реагент, литий-алюминийгидрид ), поскольку его «реакционная способность [сравнима]» с этим родственным восстанавливающим реагентом. [4] Для этих реагентов как препараты в растворах, так и изолированные твердые вещества «легковоспламеняемы и должны храниться в условиях отсутствия влаги». [14] Лабораторные руководства рекомендуют использовать алане в вытяжном шкафу . [4] [ почему? ] С твердыми веществами этого типа реагентов рекомендовано обращаться «в перчаточном мешке или сухом боксе ». [14] После использования контейнеры с раствором обычно плотно запечатывают с одновременной промывкой инертным газом, чтобы исключить попадание кислорода и влаги из окружающего воздуха. [14]
Пассивация [ нужны разъяснения ] значительно снижает скорость разложения, связанную с алановыми препаратами. [ нужна ссылка ] Тем не менее, пассивированный аланы сохраняет класс опасности 4.3 (химические вещества, которые при контакте с водой выделяют легковоспламеняющиеся газы). [15]
Зарегистрированные несчастные случаи [ править ]
Этот раздел необходимо расширить за счет: тщательного, основанного на источниках представления несчастных случаев, о которых известно, что они связаны с использованием этого агента, в малых и крупных масштабах. Вы можете помочь, добавив к нему . ( июль 2022 г. ) |
Считается, что восстановление аланов происходит через промежуточный координационный комплекс , в котором алюминий присоединен к частично восстановленной функциональной группе и высвобождается, когда реакция подвергается протонному тушению . Если подложка также фторирована , промежуточное соединение может вместо этого взорваться при воздействии горячей точки выше 60°C. [16]
Подготовка [ править ]
Гидриды алюминия и различные их комплексы известны давно. [17] Его первый синтез был опубликован в 1947 году, а патент на синтез был получен в 1999 году. [18] [19] Гидрид алюминия получают обработкой алюмогидрида лития трихлоридом алюминия . [20] Процедура сложная: необходимо уделить внимание удалению хлорида лития .
- 3 Li[AlH 4 ] + AlCl 3 → 4 AlH 3 + 3 LiCl
Эфирный раствор алан требует немедленного использования, поскольку полимерный материал быстро выпадает в осадок в виде твердого вещества. Известно, что растворы гидрида алюминия разлагаются через 3 дня. Гидрид алюминия более реакционноспособен, чем Li[AlH 4 ] . [6]
Существует несколько других методов получения гидрида алюминия:
- 2 Li[AlH 4 ] + BeCl 2 → 2 AlH 3 + Li 2 [BeH 2 Cl 2 ]
- 2 Li[AlH 4 ] + H 2 SO 4 → 2 AlH 3 + Li 2 SO 4 + 2 H 2
- 2 Li[AlH 4 ] + ZnCl 2 → 2 AlH 3 + 2 LiCl + ZnH 2
- 2 Li[AlH 4 ] + I 2 → 2 AlH 3 + 2 LiI + H 2
Электрохимический синтез [ править ]
Несколько групп показали, что аланы можно получать электрохимически . [21] [22] [23] [24] [25] Запатентованы различные электрохимические способы получения аланов. [26] [27] Электрохимическое получение аланов позволяет избежать примесей хлоридов. Обсуждаются два возможных механизма образования алан в электрохимической ячейке Класена, содержащей ТГФ в качестве растворителя, алюмогидрид натрия в качестве электролита, алюминиевый анод и железную (Fe) проволоку, погруженную в ртуть (Hg) в качестве катода. Натрий образует амальгаму с ртутным катодом, предотвращая побочные реакции, а водород, образующийся в первой реакции, можно улавливать и подвергать обратной реакции с амальгамой натрия и ртути с образованием гидрида натрия. Система Clasen не приводит к потере исходного материала. Для нерастворимых анодов протекает реакция 1, а для растворимых анодов ожидается анодное растворение по реакции 2:
- [АлХ 4 ] − − и − + н ТГФ → AlH 3 · н ТГФ + 1/ 2 H 2
- 3 [АлН 4 ] − + Ал − 3 и − + 4 н ТГФ → 4 AlH 3 · н ТГФ
В реакции 2 алюминиевый анод расходуется, что ограничивает производство гидрида алюминия для данной электрохимической ячейки.
Показана кристаллизация и восстановление гидрида алюминия из аланов, генерируемых электрохимическим путем. [24] [25]
Гидрирование алюминия под высоким давлением [ править ]
а- AlH 3 можно получить гидрированием алюминия при давлении 10 ГПа и 600 °C (1112 °F). Реакция между сжиженным водородом приводит к образованию α- AlH 3 , который может быть восстановлен в условиях окружающей среды. [28]
Реакция [ править ]
аддуктов с Льюиса основаниями Образование
AlH 3 легко образует аддукты с сильными основаниями Льюиса . Например, с триметиламином образуются комплексы как 1:1, так и 1:2 . Комплекс 1:1 в газовой фазе тетраэдрический, [29] но в твердой фазе он димерен с мостиковыми водородными центрами, (N(CH 3 ) 3 Al(μ-H)) 2 . [30] Комплекс 1:2 имеет тригонально-бипирамидальную структуру . [29] Некоторые аддукты (например, диметилэтиламин алан, (CH 3 CH 2 )(CH 3 ) 2 N·AlH 3 ) термически разлагается с образованием алюминия и может найти применение в приложениях MOCVD . [31]
Его комплекс с диэтиловым эфиром образуется согласно следующей стехиометрии:
- AlH 3 + (CH 3 CH 2 ) 2 O → (CH 3 CH 2 ) 2 O·AlH 3
Реакция с гидридом лития в эфире дает алюмогидрид лития (аланат лития, тетрагидридоалюминат лития):
- AlH 3 + LiH → Li[AlH 4 ]
Аналогичные аланаты (например, Na
33AlH
6 , Са(AlH
4) )
2 , СрАлХ
5 ) существуют с другими щелочно-щелочноземельными и некоторыми другими металлами. [32] Что
33AlH
6 исследуется как материал анода литий-ионного элемента.
Сокращение функциональных групп [ править ]
В органической химии гидрид алюминия в основном используется для восстановления функциональных групп. [33] Во многих отношениях реакционная способность гидрида алюминия аналогична реакционной способности алюмогидрида лития . Гидрид алюминия восстанавливает альдегиды , кетоны , карбоновые кислоты , ангидриды , хлорангидриды , сложные эфиры и лактоны до соответствующих спиртов . Амиды , нитрилы и оксимы восстанавливаются до соответствующих аминов .
По селективности функциональных групп алан отличается от других гидридных реагентов. Например, при следующем восстановлении циклогексанона алюмогидрид лития дает соотношение транс:цис 1,9:1, тогда как гидрид алюминия дает соотношение транс:цис 7,3:1. [34]

Алан обеспечивает гидроксиметилирование некоторых кетонов (то есть замену C−H по C-CH 2 OH в альфа-положении ). [35] Сам кетон не восстанавливается, поскольку он «защищен» как его енолят.
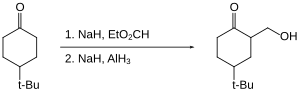
Галогенорганические соединения восстанавливаются гидридом алюминия медленно или не восстанавливаются вообще. Следовательно, реакционноспособные функциональные группы, такие как карбоновые кислоты, могут быть восстановлены в присутствии галогенидов. [36]
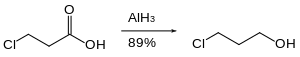
Нитрогруппы не восстанавливаются гидридом алюминия. Аналогичным образом, гидрид алюминия может восстанавливать сложный эфир в присутствии нитрогрупп. [37]

Гидрид алюминия можно использовать для восстановления ацеталей до полузащищенных диолов. [38]

Гидрид алюминия также можно использовать в реакции раскрытия эпоксидного кольца, как показано ниже. [39]

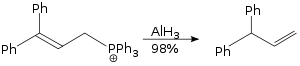
Реакция аллильной перегруппировки, проводимая с использованием гидрида алюминия, является реакцией S N 2 и не требует стерических требований. [40]
восстанавливает углекислый газ до метана : Гидрид алюминия при нагревании [ нужна ссылка ]
- 4 AlH 3 + 3 CO 2 → 3 CH 4 + 2 Al 2 O 3
Гидроалюминирование [ править ]
Этот раздел нуждается в расширении . Вы можете помочь, добавив к нему . ( июль 2022 г. ) |
Подобно гидроборированию , гидрид алюминия в присутствии тетрахлорида титана может присоединяться по множественным связям . [41] [42] Когда рассматриваемая кратная связь представляет собой пропаргиловые спирты , в результате получаются соединения алкенилалюминия . [43]

Топливо [ править ]
Этот раздел необходимо обновить . ( июль 2022 г. ) |
В пассивированной форме алан является активным кандидатом для хранения водорода и может использоваться для эффективного производства электроэнергии с помощью топливных элементов, включая топливные элементы и электромобили, а также других легких энергетических установок. [ нужна ссылка ] AlH 3 содержит до 10,1% водорода по массе (при плотности 1,48 грамма на миллилитр), [2] или удвоенная плотность водорода в жидкости Н 2 . [ нужна ссылка ] По состоянию на 2006 год AlH 3 описывался как кандидат, для которого «потребуются дальнейшие исследования для разработки эффективного и экономичного процесса регенерации [его] из отработанного порошка Al». [2] [ нужно обновить ]
Алан также является потенциальной добавкой к ракетному топливу , взрывчатым и пиротехническим составам. [ нужна ссылка ] В непассивированной форме алан также является многообещающей добавкой к ракетному топливу , способной обеспечить повышение импульсной эффективности до 10%. [44]
Ссылки [ править ]
- ^ Браун, ХК; Кришнамурти, С. (1979). «Сорок лет сокращения гидридов». Тетраэдр . 35 (5): 567–607. дои : 10.1016/0040-4020(79)87003-9 .
- ^ Jump up to: Перейти обратно: а б с д Грец, Дж ..; Рейли, Дж..; Сандрок, Г..; Джонсон, Дж..; Чжоу, В.-М.; Вегжин, Дж. (2006). Гидрид алюминия, A1H3, как соединение для хранения водорода (отчет). Вашингтон, округ Колумбия: Управление науки и технической информации [OSTI]. дои : 10.2172/899889 . ОСТИ 899889 . Проверено 28 июля 2022 г.
- ^ Линь-Лин Ван; Адити Хервадкар; Джейсон М. Райх; Дуэйн Д. Джонсон; Стивен Д. Хаус; Памела Пенья-Мартин; Ангус А. Рокетт; Ян М. Робертсон; Шалаб Гупта; Виталий Константинович Печарский (2016). «На пути к прямому синтезу Алана: предсказанный путь, опосредованный дефектами, подтвержденный экспериментально» . ChemSusChem . 9 (17): 2358–2364. Бибкод : 2016ЧСЧ...9,2358В . дои : 10.1002/cssc.201600338 . ПМИД 27535100 .
- ^ Jump up to: Перейти обратно: а б с д и ж Галацис, П; Синтим, Герман О.; Ван Дж. (15 сентября 2008 г.). «Алюминий гидрид». Энциклопедия реагентов для органического синтеза (онлайн-изд.). Нью-Йорк, штат Нью-Йорк: Джон Уайли и сыновья. дои : 10.1002/047084289X.ra082.pub2 . ISBN 978-0471936237 . Проверено 28 июля 2022 г.
- ^ См., например, Эндрюс и Ван, 2003 .
- ^ Jump up to: Перейти обратно: а б с заявка США 2007066839 , Лунд, Греция; Хэнкс, Дж. М.; Джонстон, HE, «Метод получения α-алана».
- ^ Терли и Ринн 1969 . (Аннотация) «Конечное расстояние Al⋯H, равное 1,72 Å, участие каждого Al в шести мостиках и эквивалентность всех расстояний Al⋯H позволяют предположить, что происходит связь 3c-2e». Угол обозначен как «Al(6)-H(5)-Al(4)» в Таблице IV.
- ^ Терли, JW; Ринн, HW (1969). «Кристаллическая структура гидрида алюминия». Неорганическая химия . 8 (1): 18–22. дои : 10.1021/ic50071a005 .
- ^ Курт, ФА; Эберлейн, РА; Шнёкель, Х.-Г.; Даунс, Эй Джей; Пулхэм, ЧР (1993). «Молекулярный тригидрид алюминия, AlH 3 : генерация в твердой матрице благородного газа и характеристика по его инфракрасному спектру и расчеты ab initio ». Журнал Химического общества, Химические коммуникации . 1993 (16): 1302–1304. дои : 10.1039/C39930001302 . (Аннотация) Широкополосный фотолиз твердой матрицы благородного газа, содержащей атомы Al и H 2 , приводит к образованию плоской мономерной молекулы AlH 3 .
- ^ Эндрюс, Лестер; Ван Сюэфэн (2003). «Инфракрасный спектр Al 2 H 6 в твердом водороде». Наука . 299 (5615): 2049–2052. Бибкод : 2003Sci...299.2049A . дои : 10.1126/science.1082456 . JSTOR 3833717 . ПМИД 12663923 . S2CID 45856199 . См. также поправки на дои : 10.1126/science.300.5620.741a .
- ^ Пулхэм, Чехия; Даунс, Эй Джей; Гуд, MJ; Рэнкин СХД; Робертсон, HE (1991). «Галлан: синтез, физические и химические свойства и структура газовой молекулы Ga 2 H 6 , определенные методом дифракции электронов». Журнал Американского химического общества . 113 (14): 5149–5162. дои : 10.1021/ja00014a003 .
- ^ Хаускрофт, Кэтрин (2018). Неорганическая химия (5-е изд.). Пирсон. п. 397. ИСБН 978-1-292-13414-7 .
- ^ Галацис, Синтим и Ван 2008 , в котором это явление описывается с использованием синонима «легковоспламеняющийся» .
- ^ Jump up to: Перейти обратно: а б с Пакетт, Лос-Анджелес; Оллевье, Т.; Дезируа, В. (15 октября 2004 г.). «Литий-алюминийгидрид». Энциклопедия реагентов для органического синтеза (онлайн-изд.). Нью-Йорк, штат Нью-Йорк: Джон Уайли и сыновья. дои : 10.1002/047084289X.rl036.pub2 . ISBN 0471936235 . Проверено 28 июля 2022 г.
- ^ CFR 2013, раздел 29, том 6, раздел 1900.1200, приложение B.12.
- ^ Тайдаков, Илья В. (08.07.2020). «Серьезный взрыв во время крупномасштабного получения амина восстановлением аланами (AlH3) нитрила, содержащего группу CF 3 ». ACS Химическое здоровье и безопасность . 27 (4). Американское химическое общество (ACS): 235–239. дои : 10.1021/acs.chas.0c00045 . ISSN 1871-5532 . S2CID 225542103 .
- ^ Брауэр, FM; Мацек, штат Невада; Рейглер, П.Ф.; Ринн, HW; Шмидт, Д.Л.; Сновер, Дж.А.; Терада, К. (1976). «Получение и свойства гидрида алюминия». Журнал Американского химического общества . 98 (9): 2450–2454. дои : 10.1021/ja00425a011 .
- ^ Финхольт, А.Е.; Бонд, AC младший; Шлезингер, Гавайи (1947). «Литий-алюминийгидрид, гидрид алюминия и гидрид лития-галлия и некоторые их применения в органической и неорганической химии». Журнал Американского химического общества . 69 (5): 1199–1203. дои : 10.1021/ja01197a061 .
- ^ патент США 6228338 , Петри, Массачусетс; Боттаро, Джей Си; Шмитт, Р.Дж.; Пенвелл, ЧП; Бомбергер, округ Колумбия, «Получение полиморфов гидрида алюминия, особенно стабилизированного α-AlH 3 », выпущено 8 мая 2001 г.
- ^ Шмидт, Д.Л.; Робертс, CB; Рейглер, П.Ф.; Лемански, М.Ф. младший; Шрам, EP (1973). «Тригидрид-диэтилэфират алюминия ( эфирный алан )». Неорганические синтезы . Том. 14. С. 47–52. дои : 10.1002/9780470132456.ch10 . ISBN 9780470132456 .
- ^ Алпатова, Н.М.; Дымова, Т.Н.; Кесслер, Ю. М.; Осипов О. Р. (1968). «Физико-химические свойства и строение комплексных соединений гидрида алюминия». Российское химическое обозрение . 37 (2): 99–114. Бибкод : 1968RuCRv..37...99А . дои : 10.1070/RC1968v037n02ABEH001617 . S2CID 250839118 .
- ^ Семененко, К.Н.; Булычев Б.М.; Шевлягина, Е.А. (1966). «Алюминий гидрид». Российское химическое обозрение . 35 (9): 649–658. Бибкод : 1966RuCRv..35..649S . дои : 10.1070/RC1966v035n09ABEH001513 . S2CID 250889877 .
- ^ Osipov, O. R.; Alpatova, N. M.; Kessler, Yu. M. (1966). Elektrokhimiya . 2 : 984.
{{cite journal}}: CS1 maint: периодическое издание без названия ( ссылка ) - ^ Jump up to: Перейти обратно: а б Зидан, Р.; Гарсия-Диас, БЛ; Фьюокс, CS; Стоу, AC; Грей, младший; Хартер, АГ (2009). «Гидрид алюминия: обратимый материал для хранения водорода» . Химические коммуникации (25): 3717–3719. дои : 10.1039/B901878F . ПМИД 19557259 . S2CID 21479330 .
- ^ Jump up to: Перейти обратно: а б Мартинес-Родригес, MJ; Гарсия-Диас, БЛ; Тепрович, Ю.А.; Найт, Д.А.; Зидан, Р. (2012). «Достижения в области электрохимической регенерации гидрида алюминия». Прикладная физика A: Материаловедение и обработка . 106 (25): 545–550. Бибкод : 2012АпФА.106..545М . дои : 10.1007/s00339-011-6647-y . S2CID 93879202 .
- ^ Патент DE 1141623 , Клазен, Х., «Способ производства гидрида алюминия или комплексных гидридов, богатых водородом алюминия», выдан 27 декабря 1962 г., передан Metallgesellschaft.
- ^ Патент США 8470156 , Зидан Р., «Электрохимический процесс и производство новых сложных гидридов», выдан 25 июня 2013 г., передан Savannah River Nuclear Solutions, LLC.
- ^ Сайто, Х; Сакурай, Ю; Мачида, А; Катаяма, Ю; Аоки, К. (2010). «Рентгеноструктурное измерение гидрирования и дегидрирования алюминия in situ и характеристика извлеченного AlH3» . Физический журнал: серия конференций . 215 (1): 012127. Бибкод : 2010JPhCS.215a2127S . дои : 10.1088/1742-6596/215/1/012127 . ISSN 1742-6596 .
- ^ Jump up to: Перейти обратно: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Этвуд, Дж. Л.; Беннетт, Франция; Элмс, FM; Джонс, К.; Растон, CL ; Робинсон, К.Д. (1991). «Диалан, стабилизированный третичным амином». Журнал Американского химического общества . 113 (21): 8183–8185. дои : 10.1021/ja00021a063 .
- ^ Юн, Ж.-Х.; Ким, Б.-Ю.; Ри, С.-В. (1998). «Металло-органическое химическое осаждение алюминия из диметилэтиламин-алана». Тонкие твердые пленки . 312 (1–2): 259–263. Бибкод : 1998TSF...312..259Y . дои : 10.1016/S0040-6090(97)00333-7 .
- ^ Суарес-Алькантара, Карина; Тена-Гарсия, Хуан Рохелио; Герреро-Ортис, Рикардо (2019). «Аланаты, комплексный обзор» . Материалы . 12 (17): 2724. Бибкод : 2019Mate...12.2724S . дои : 10.3390/ma12172724 . ПМЦ 6747775 . ПМИД 31450714 .
- ^ Галацис, П. (2001). «Диизобутилалюминийгидрид». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rd245 . ISBN 978-0-470-84289-8 .
- ^ Эйрс, округ Колумбия; Саудай, Р. (1967). «Стереоселективное восстановление кетонов гидридом алюминия». Журнал Химического общества Б. 1967 : 581–583. дои : 10.1039/J29670000581 .
- ^ Кори, Э.Дж.; Кейн, Делавэр (1971). «Контролируемое гидроксиметилирование кетонов». Журнал органической химии . 36 (20): 3070. doi : 10.1021/jo00819a047 .
- ^ Йоргенсон, Маргарет Дж. (июль 1962 г.). «Селективное восстановление гидридом алюминия». Буквы тетраэдра . 3 (13): 559–562. дои : 10.1016/S0040-4039(00)76929-2 .
- ^ Такано, С.; Акияма, М.; Сато, С.; Огасавара, К. (1983). «Легкое расщепление бензилиденацеталей диизобутилалюминийгидридом» (pdf) . Химические письма . 12 (10): 1593–1596. дои : 10.1246/кл.1983.1593 . [ постоянная мертвая ссылка ]
- ^ Рихтер, WJ (1981). «Асимметричный синтез в прохиральных центрах: замещенные 1,3-диоксоланы». Журнал органической химии . 46 (25): 5119–5124. дои : 10.1021/jo00338a011 .
- ^ Маруока, К.; Сайто, С.; Оой, Т.; Ямамото, Х. (1991). «Селективное восстановление метиленциклоалканоксидов 4-замещенными диизобутилалюминий-2,6-ди- трет -бутилфеноксидами». Синлетт . 1991 (4): 255–256. дои : 10.1055/s-1991-20698 . S2CID 196795254 .
- ^ Классон, А.; Олссон, Л.-И. (1979). «Аллены и ацетилены. 22. Механистические аспекты алленообразующего восстановления (SN2'-реакция) хиральных производных пропаргилов с гидридными реагентами». Журнал Американского химического общества . 101 (24): 7302–7311. дои : 10.1021/ja00518a028 .
- ^ Сато, Ф.; Сато, С.; Кодама, Х.; Сато, М. (1977). «Реакции литий-алюминийгидрида или аланов с олефинами, катализируемые тетрахлоридом титана или тетрахлоридом циркония. Удобный путь к алканам, 1-галогеналканам и терминальным спиртам из алкенов». Журнал металлоорганической химии . 142 (1): 71–79. дои : 10.1016/S0022-328X(00)91817-5 .
- ^ Смит (2020), Продвинутая органическая химия марта , rxn. 15-12.
- ^ Кори, Э.Дж.; Каценелленбоген, Дж. А.; Познер, GH (1967). «Новый стереоспецифический синтез тризамещенных олефинов. Стереоспецифический синтез фарнезола». Журнал Американского химического общества . 89 (16): 4245–4247. дои : 10.1021/ja00992a065 .
- ^ Калабро, М. (2011). «Обзор гибридных силовых установок» . Прогресс в физике движения . 2 : 353–374. Бибкод : 2011EUCAS...2..353C . дои : 10.1051/eucass/201102353 . ISBN 978-2-7598-0673-7 .
Внешние ссылки [ править ]
- Гидрид алюминия в химической базе данных EnvironmentalChemistry.com
- Хранение водорода в Брукхейвенской национальной лаборатории
- Тригидрид алюминия на WebElements