Тирозин -аминотрансфераза
| Тирозин -трансаминаза | |||
|---|---|---|---|
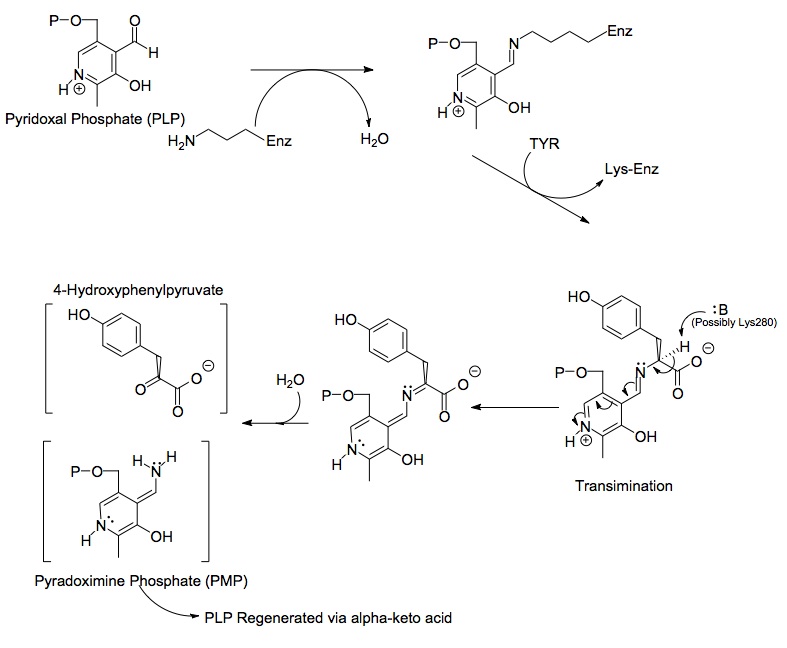
 Тирозин-аминотрансфераза человека (радужная цветная, N-конце = синий, C-конце = красный), в комплекте с помощью пиридоксального фосфата ( модель космического заполнения ). [ 1 ] | |||
| Идентификаторы | |||
| ЕС №. | 2.6.1.5 | ||
| CAS №. | 9014-55-5 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| Джин Онтология | Друг / Quickgo | ||
| |||
| Давать | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | Тат , тат, тирозин -аминотрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Омим : 613018 ; MGI : 98487 ; Гомологен : 37293 ; Genecards : Tat ; OMA : TAT - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ЕС номер | 2.6.1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викидид | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Тирозин-аминотрансфераза (или тирозин-трансаминаза ) представляет собой фермент, присутствующий в печени, и катализирует превращение тирозина в 4-гидроксифенилпируват . [ 6 ]

У людей белок тирозин -аминотрансферазы кодируется TAT геном . [ 7 ] Дефицит фермента у людей может привести к тому, что так называется тирозинемия типа II , в которой существует изобилие тирозина в результате того, что тирозин не подвергается реакции аминотрансферазы для образования 4-гидроксифенилпирувата. [ 8 ]
Механизм
[ редактировать ]Структуры трех основных молекул, участвующих в химической реакции, катализируемых ферментом тирозин-аминотрансферазы, приведены ниже: аминокислотный тирозин (слева), протезная группа пиридоксаль фосфат (справа) и полученный продукт 4-гидроксифенилпируват (центр).
Каждая сторона димерного белка включает пиридоксаль фосфат (PLP), связанный с остатками Lys280 молекулы тирозин -аминотрансферазы. Аминская группа тирозина атакует альфа-углерод имина, связанного с Lys280, образуя тетраэдрический комплекс, а затем начинает Lys-enz. Этот процесс известен как транзиминация в результате переключения группы имин, связанной с PLP. Недавно сформированная молекула PLP-Tyr затем атакована базой.
Возможным кандидатом на основание в механизме может быть Lys280, который был только что оттолкнут от PLP, который секвестирует недавно образованную аминогруппу молекулы PLP-типа. В аналогичном механизме аспартат -трансаминазы лизин, который образует начальный имин для PLP, впоследствии действует как основание, которое атакует тирозин при транмитировании. Электроны, оставленные позади потери протона движения вниз, чтобы сформировать новую двойную связь с имином, что, в свою очередь, проталкивает и без того двойные связи через PLP и в конечном итоге в качестве одинокой пары на положительно заряженном азоте в шести членах. Кольцо молекулы. Вода атакует альфа-углерод имина PLP-тира и посредством замены ацила начинается с азота PLP и образуя пиридоксамин фосфат (PMP) и 4-гидроксифенилпируват.
Затем PMP восстанавливается в PLP путем передачи своей группы амина в альфа-кетоглутарат, реформируя свою функциональную группу альдегида. За этим следует еще одна реакция замещения с остатком Lys280, чтобы реформировать его иминскую связь с ферментом, образуя Enz-PLP.
Активный сайт
[ редактировать ]
Тирозин -аминотрансфераза в качестве димера имеет два идентичных активных сайтов. Lys280 прикреплен к PLP, который удерживается на месте с помощью двух неполярных аминокислотных боковых цепей; Фенилаланин и изолейцин (см. Миниатюру справа). PLP также удерживается на месте водородными связями с окружающими молекулами в основном ее фосфатной группой.
Ниже показан один активный сайт при трех разных увеличениях:

Патология
[ редактировать ]Тирозинемия является наиболее распространенным метаболическим заболеванием, связанным с тирозин -аминотрансферазой. Заболевание является результатом дефицита печеночной тирозин -аминотрансферазы. [ 10 ] Тирозинемия типа II (синдром Ричнер-Ханхарт, RHS) представляет собой болезнь аутосомно-рецессивного наследования, характеризующегося кератитом, гиперкератозом пальмопланта, умственной отсталости и повышенных уровней тирозина в крови. [ 10 ] Кератит у пациентов с тирозинемией типа II вызвано осаждением кристаллов тирозина в роговице и приводит к воспалению роговицы. [ 11 ] Ген TAT расположен на человеческой хромосоме 16Q22-24 и простирается более 10,9 килобаз (KB), содержащих 12 экзонов, и его мРНК 3,0 КБ коды для белка 454-аминокислот 50,4 кДа. [ 12 ] Сообщалось о двенадцати разных мутациях гена TAT. [ 12 ]
Ссылки
[ редактировать ]- ^ Jump up to: а беременный ВВП : 3Dyd ; Karlberg T, Moche M, Andersson J, et al. (2008). «Человеческий тирозин аминотрансфераза». Банк белка . doi : 10.2210/pdb3dyd/pdb .
- ^ Jump up to: а беременный в GRCH38: Ensembl Release 89: ENSG00000198650 - Ensembl , май 2017 г.
- ^ Jump up to: а беременный в GRCM38: Ensembl Release 89: Ensmusg00000001670 - Ensembl , май 2017 г.
- ^ «Человеческая PubMed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ «Мышь Pubmed ссылка:» . Национальный центр информации о биотехнологии, Национальная медицина США .
- ^ Дитрих Дж.Б. (апрель 1992). «Тирозин -аминотрансфераза: трансаминаза среди других?». Клеточная и молекулярная биология . 38 (2): 95–114. PMID 1349265 .
- ^ 2017 (27 ноября) Частота " Скрининг 5 : DOI : 2364098174423. 5
- ^ Rettenmeier R, Natt E, Zentgraf H, Scherer G (июль 1990 г.). «Выделение и характеристика гена тирозин -аминотрансферазы человека» . Нуклеиновые кислоты Res . 18 (13): 3853–61. doi : 10.1093/nar/18.13.3853 . PMC 331086 . PMID 1973834 .
- ^ Pettersen, EF, Goddard, TD, Huang, CC, Couch, GS, Greenblatt, DM, Meng, EC, Ferrin, TE (2004). «UCSF Химера - система визуализации для исследовательских исследований и анализа». Журнал вычислительной химии . 25 (13): 1605–1612. Citeseerx 10.1.1.456.9442 . doi : 10.1002/jcc.20084 . PMID 15264254 . S2CID 8747218 .
- ^ Jump up to: а беременный Natt E, Kida K, Odievre M, Di Rocco M, Scherer G (октябрь 1992). «Точечные мутации в гене тирозин -аминотрансферазы при тирозинемии типа II» . Прокурор Нат. Академический Наука США . 89 (19): 9297–301. Bibcode : 1992pnas ... 89.9297n . doi : 10.1073/pnas.89.19.9297 . PMC 50113 . PMID 1357662 .
- ^ Al-Hemidan AI, Al-Hazzaa SA (март 1995 г.). «Синдром Ричнер-Ханхарта (тирозинемия типа II). Отчет о случаях и обзор литературы». Офтальмологический Genet . 16 (1): 21–6. doi : 10.3109/13816819509057850 . PMID 7648039 .
- ^ Jump up to: а беременный Минами-Хори М., Ишида-Ямамото А., Като Н., Такахаши Х., Ийзука Х (январь 2006 г.). «Синдром Ричнера-Ханхарта: доклад о случае с новой мутацией тирозин-аминотрансферазы». J. Dermatol. Наука 41 (1): 82–4. doi : 10.1016/j.jdermsci.2005.10.007 . PMID 16318910 .
Молекулярные графические изображения были получены с использованием пакета химеры UCSF из ресурса для биокомпьютирования, визуализации и информатики в Калифорнийском университете, Сан-Франциско (поддерживается NIH P41 RR-01081).
Внешние ссылки
[ редактировать ]- Тирозин+аминотрансфераза библиотеки США в Национальной библиотеке Медицинской (Mesh)
- PDBE-KB предоставляет обзор всей информации о структуре, доступной в PDB для человеческого тирозин-аминотрансферазы