Сульфат железа(II) аммония
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Сульфат железа(II) аммония | |
| Другие имена Сульфат железа аммония Сульфат железа аммония соль Мора | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| ЧЭБИ |
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.125 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ |
|
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Fe(SO 4 )(NH 4 ) 2 (SO 4 ) (безводный) Fe(SO 4 )(NH 4 ) 2 (SO 4 )·6H 2 O (гексагидрат) | |
| Молярная масса | 284.05 g mol −1 (безводный) 392.14 g mol −1 (гексагидрат) |
| Появление | Сине-зеленое твердое вещество |
| Плотность | 1,86 г/см 3 |
| Температура плавления | От 100 до 110 ° C (от 212 до 230 ° F; от 373 до 383 К) |
| Точка кипения | Непригодный |
| 269 г/л (гексагидрат) | |
| Опасности | |
| СГС Маркировка : | |
 | |
| Предупреждение | |
| Х315 , Х319 , Х335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313, P337+P313 P362 , P403 , P301 , P403+P233 , P405, P5013 +P233, P405, P501, P501, P501 , , P362 , P403+P233, P3 | |
| NFPA 704 (огненный алмаз) | |
| Паспорт безопасности (SDS) | Паспорт безопасности Фишера |
| Родственные соединения | |
Родственные соединения | Сульфат железа(III) аммония |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
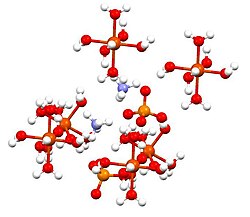
Сульфат железа(II) аммония , или соль Мора , представляет собой неорганическое соединение с формулой (NH 4 ) 2 SO 4 .Fe(SO 4 ).6H 2 O. Содержит два разных катиона Fe. 2+ и NH + 4 , его классифицируют как двойную соль сульфата железа и сульфата аммония . Это обычный лабораторный реагент, поскольку он легко кристаллизуется, а кристаллы устойчивы к окислению воздухом. Как и другие соли сульфата железа, сульфат железа и аммония растворяется в воде с образованием аквакомплекса [ Fe(H 2 O) 6 ] 2+ , который имеет октаэдрическую молекулярную геометрию . [1] Его минеральная форма — мохрит .
Структура
[ редактировать ]Это соединение является членом группы двойных сульфатов, называемых солями Шёнита или солями Туттона . Соли Туттона образуют моноклинные кристаллы и имеют формулу M 2 N(SO 4 ) 2 ·6H 2 O (M = различные монокатионы). Что касается связи, то кристаллы состоят из октаэдров [Fe(H 2 O) 6 ] 2+ центры, которые связаны водородными связями с сульфатом и аммонием. [2]
Соль Мора названа в честь немецкого химика Карла Фридриха Мора , который сделал много важных достижений в методологии титрования в 19 веке.
Приложения
[ редактировать ]В аналитической химии эта соль является предпочтительным источником ионов двухвалентного железа, поскольку твердое вещество имеет длительный срок хранения и устойчиво к окислению. Эта стабильность в некоторой степени распространяется и на растворы, отражая влияние pH на окислительно-восстановительную пару железо-железо. Это окисление происходит легче при высоком pH. Ионы аммония делают растворы соли Мора слегка кислыми, что замедляет процесс окисления. [1] [3] Серную кислоту обычно добавляют в растворы для уменьшения окисления до трехвалентного железа.
Он используется в дозиметре Фрике для измерения высоких доз гамма-лучей. [4]
Подготовка
[ редактировать ]Соль Мора образуется при выпаривании эквимолярной смеси водного сернокислого железа и сернокислого аммония . [5]
Загрязняющие вещества
[ редактировать ]Обычные примеси включают магний , никель , марганец , свинец и цинк , многие из которых образуют изоморфные соли . [6]
Ссылки
[ редактировать ]- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Ефрем, Фриц (1926). Неорганическая химия . tr PCL Торн. Лондон: Герни и Джексон. стр. 484–485.
- ^ «Сульфат железа аммония 100 г (соль Мора)» . 2012 . Проверено 13 июня 2013 г.
- ^ Хикман, К.; Лоррен, С.; Барт, младший; Портал, Г. (1986). «Использование соли Мора для гамма-дозиметрии высокого уровня (до 10 8 Гр)". Дозиметрия радиационной защиты . 17 (1–4). Oxford Journals: 255–257. doi : 10.1093/oxfordjournals.rpd.a079818 .
- ^ Вильдермут, Эгон; Старк, Ганс; Фридрих, Габриэле; Эбенхёх, Франц Людвиг; Кюборт, Бриджит; Сильвер, Джек; Ритупер, Рафаэль (2000). «Соединения железа». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a14_591 . ISBN 978-3-527-30385-4 .
- ^ Фогель, Артур И. (1961). Учебник количественного неорганического анализа, включая элементарный инструментальный анализ (3-е изд.). Лонгманс. стр. 281–282.
