PLECKSTRIN Гомологическая область
 PH домен тирозин-белкокиназы Btk | |||
| Идентификаторы | |||
|---|---|---|---|
| Символ | PH | ||
| Pfam | PF00169 | ||
| PFAM клан | CL0266 | ||
| Эко | 220.1.1 | ||
| InterPro | IPR001849 | ||
| УМНЫЙ | PH | ||
| PROSITE | PDOC50003 | ||
| SCOP2 | 1dyn / SCOPe / SUPFAM | ||
| OPM superfamily | 49 | ||
| OPM protein | 1pls | ||
| CDD | cd00821 | ||
| |||
Домен гомологии PLECKSTRIN ( PH -домен ) или ( PHIP ) представляет собой белковый домен из приблизительно 120 аминокислот , которые встречаются в широком диапазоне белков, участвующих во внутриклеточной передаче сигналов или в качестве составляющих цитоскелета . [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ] [ 6 ] [ 7 ]
Этот домен может связывать фосфатидилинозитол липидов в биологических мембранах (таких как фосфатидилинозитол (3,4,5) -трисфосфат и фосфатидилинозитол (4,5) -бисфосфат ),), [ 8 ] и белки, такие как βγ-субъединицы гетеротримерных G-белков , [ 9 ] и протеинкиназа c . [ 10 ] Благодаря этим взаимодействиям домены pH играют роль в рекрутировании белков в разные мембраны , таким образом нацеливая их на соответствующие клеточные компартменты или позволяя им взаимодействовать с другими компонентами путей передачи сигнала .
Специфичность липидного связывания
[ редактировать ]Отдельные домены pH обладают специфичностью для фосфоинозитидов, фосфорилированных в различных местах внутри кольца инозитола , например, некоторые связывают фосфатидилинозитол (4,5) -бисфосфат , но не фосфатидилинозитол (3,4,5) -трисфосфат или фосфатидилинозитол (3,4) -Bisposphate , в то время как другие могут обладать необходимой близостью. Это важно, потому что он делает рекрутирование различных доменов pH, содержащих белки, чувствительные к активности ферментов, которые либо фосфорилируют, либо дефосфорилируют эти участки на кольце инозитола, таких как фосфоинозитид 3-киназа или PTEN , соответственно. Таким образом, такие ферменты оказывают часть их влияния на функцию клеток, модулируя локализацию нижестоящих сигнальных белков, которые обладают доменом pH, которые способны связывать свои фосфолипидные продукты.
Structure
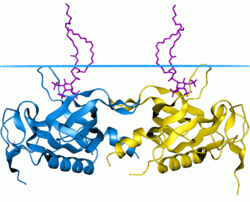
[edit]The 3D structure of several PH domains has been determined.[11] All known cases have a common structure consisting of two perpendicular anti-parallel beta sheets, followed by a C-terminal amphipathic helix. The loops connecting the beta-strands differ greatly in length, making the PH domain relatively difficult to detect while providing the source of the domain's specificity. The only conserved residue among PH domains is a single tryptophan located within the alpha helix that serves to nucleate the core of the domain.
Proteins containing PH domain
[edit]PH domains can be found in many different proteins, such as OSBP or ARF. Recruitment to the Golgi apparatus in this case is dependent on both PtdIns and ARF. A large number of PH domains have poor affinity for phosphoinositides and are hypothesized to function as protein binding domains. A Genome-wide look in Saccharomyces cerevisiae showed that most of the 33 yeast PH domains are indeed promiscuous in binding to phosphoinositides, while only one (Num1-PH) behaved highly specific .[12] Proteins reported to contain PH domains belong to the following families:
- Pleckstrin, the protein where this domain was first detected, is the major substrate of protein kinase C in platelets. Pleckstrin contains two PH domains. ARAP proteins contain five PH domains.
- Serine/threonine-specific protein kinases such as the Akt/Rac family, protein kinase D1, and the trypanosomal NrkA family.
- Non-receptor tyrosine kinases belonging to the Btk/Itk/Tec subfamily.
- Insulin receptor substrate 1 (IRS-1).
- Regulators of small G-proteins: 64 RhoGEFs of the Dbl-like family.,[13] and several GTPase activating proteins like ABR, BCR or ARAP proteins.
- Cytoskeletal proteins such as dynamin (see InterPro: IPR001401), Caenorhabditis elegans kinesin-like protein unc-104 (see InterPro: IPR001752), spectrin beta-chain, syntrophin (2 PH domains), and S. cerevisiae nuclear migration protein NUM1.
- Oxysterol-binding proteins OSBP, S. cerevisiae OSH1 and YHR073w.
- Ceramide kinase, a lipid kinase that phosphorylates ceramides to ceramide-1-phosphate.[14]
- G protein receptor kinases (GRK) of GRK2 subfamily (beta-adrenergic receptor kinases): GRK2 and GRK3.[15]
Subfamilies
[edit]Examples
[edit]Human genes encoding proteins containing this domain include:
- ABR, ADRBK1, ADRBK2, AFAP, AFAP1, AFAP1L1, AFAP1L2, AKAP13, AKT1, AKT2, AKT3, ANLN, APBB1IP, APPL1, APPL2, ARHGAP10, ARHGAP12, ARHGAP15, ARHGAP21, ARHGAP22, ARHGAP23, ARHGAP24, ARHGAP25, ARHGAP26, ARHGAP27, ARHGAP9, ARHGEF16, ARHGEF18, ARHGEF19, ARHGEF2, ARHGEF3, ARHGEF4, ARHGEF5, ARHGEF6, ARHGEF7, ARHGEF9, ASEF2,
- BMX, BTK,
- C20orf42, C9orf100, CADPS, CADPS2, CDC42BPA, CDC42BPB, CDC42BPG, CENTA1, CENTA2, CENTB1, CENTB2, CENTB5, CENTD1, CENTD2, CENTD3, CENTG1, CENTG2, CENTG3, CERK, CIT, CNKSR1, CNKSR2, COL4A3BP, CTGLF1, CTGLF2, CTGLF3, * CTGLF4, CTGLF5, CTGLF6,
- DAB2IP, DAPP1, DDEF1, DDEF2, DDEFL1, DEF6, DEPDC2, DGKD, DGKH, DGKK, DNM1, DNM2, DNM3, DOCK10, DOCK11, DOCK9, DOK1, DOK2, DOK3, DOK4, DOK5, DOK6, DTGCU2,
- EXOC8,
- FAM109A, FAM109B, FARP1, FARP2, FGD1, FGD2, FGD3, FGD4, FGD5, FGD6,
- GAB1, GAB2, GAB3, GAB4, GRB10, GRB14, GRB7,
- IRS1, IRS2, IRS4, ITK, ITSN1, ITSN2,
- Калрн , KIF1A , KIF1B , KIF1BBETA ,
- McF2 , MCF2L , MCF2L2 , MRIP , MYO10 ,
- Net1 , ngef ,
- OBH1 , неяс , OPHN1 , OSBP , OSBP2 , OSBPL10 , OSBPL11 , OSBPL3 , OSBPL5 , OSBPL6 , OSBPL7 , OSBPL8 , OSBPL9 ,
- PHLDA2 , PHLA3 , PHLDB1 , PHLDB2 , PHLPP , - , PLCD1 , PLCD4 , PLCG1 , PLCG2 , PLCH1 , PLCH2 , PLCL1 , PLCL2 , PLD2 , E местоположение , PIP3 , Placeha1 , Placeha3 , PLEKHA3 , PLEKHA4, Placeha6 , PLEKHA6 местоположение2 Plekha7 , Placeha8 , PlaceHB1 , PlaceHB2 , PlaceHC1 , PlaceHF1 , PlaceHF2 , PlaceHG1 , Placehg5 , PlaceHG4 , PlaceHG2 , PlaceHG3 , PlaceH1 , Placehh2 , , PlaceHG6 , Placehh3 , Placehk1 , PlaceHM1 , Placehm2 , PlaceHM2 , Placehq1 Pref Prex1 , Prex1 , Prex1 Prex1 , , , PRKD2 , PRKD3 , PSCD1 , PSCD2 , PSCD3 , PSCD4 , PSD , PSD2 , PSD3 , PSD4 , RALGPS1 , RALGPS2 , RAPH1 ,
- RASA1 , RASA2 , RASA3 , RASA4 , RASAL1 , RASGRF1 , RGNEF , ROCK1 , ROCK2 , RTKN ,
- SBF1 , SBF2 , SCAP2 , SGEF , SH2B , SH2B1 , SH2B2 , SH2B3 , SH3BP2 , SKAP1 , SKAP2 , SNTA1 , SNTB1 , SNTB2 , SOS1 , SOS2 , SPATA13 , SPNB4 , SPTBN1 , SPTBN2 , SPTBN4 , SPTBN5 , STAP1 , SWAP70 , SYNGAP1 ,
- TC1D2 , TEC , TIAM1 , Trio , Triobp , Tyl ,
- Urp1 , urp2 ,
- Vav1 , Vav2 , Vav3 , Veph1
Смотрите также
[ редактировать ]- Плектрин
- Несвязанный домен Fyve связывает фосфатидилинозитол 3-фосфат и был обнаружен в более чем 60 белках.
- Грам -домен является структурно связанным белковым доменом.
Ссылки
[ редактировать ]- ^ Mayer BJ, Ren R, Clark KL, Baltimore D (май 1993). «Предполагаемый модульный домен, присутствующий в разнообразных сигнальных белках». Клетка . 73 (4): 629–30. doi : 10.1016/0092-8674 (93) 90244-K . PMID 8500161 . S2CID 44282241 .
- ^ Haslam RJ, Koide HB, Hemmings BA (май 1993). «Гомология домена PLECKSTRIN». Природа . 363 (6427): 309–10. Bibcode : 1993natur.363..309h . doi : 10.1038/363309b0 . PMID 8497315 . S2CID 4334376 .
- ^ Musacchio A, Gibson T, Rice P, Thompson J, Saraste M (сентябрь 1993 г.). «Домен рН: общий кусок в структурной лоскутной обработке сигнальных белков». Тенденции в биохимических науках . 18 (9): 343–8. doi : 10.1016/0968-0004 (93) 90071-t . PMID 8236453 .
- ^ Гибсон Т.Дж., Хивонен М., Мусаккио А., Сарасте М., Бирни Е (сентябрь 1994 г.). «Домен PH: первая годовщина» . Тенденции в биохимических науках . 19 (9): 349–53. doi : 10.1016/0968-0004 (94) 90108-2 . PMID 7985225 .
- ^ Поусон Т (февраль 1995 г.). «Протеиновые модули и сигнальные сети». Природа . 373 (6515): 573–80. Bibcode : 1995natur.373..573p . doi : 10.1038/373573A0 . PMID 7531822 . S2CID 4324726 .
- ^ Ингли Э., Хеммингс Б.А. (декабрь 1994 г.). «Домены гомологии PLECKSTRIN (PH) в передаче сигнала». Журнал сотовой биохимии . 56 (4): 436–43. doi : 10.1002/jcb.240560403 . PMID 7890802 . S2CID 23154429 .
- ^ Saraste M, Hyvönen M (июнь 1995 г.). «Плектрин гомологических доменов: файл фактов». Современное мнение в структурной биологии . 5 (3): 403–8. doi : 10.1016/0959-440x (95) 80104-9 . PMID 7583640 .
- ^ Wang DS, Shaw G (декабрь 1995 г.). «Ассоциация С-концевой области спектрина Beta I Sigma II с мембранами мозга опосредуется доменом pH, не требует мембранных белков и совпадает с сайтом связывания трифосфата иннозитола-1,4,5». Биохимическая и биофизическая исследовательская коммуникация . 217 (2): 608–15. doi : 10.1006/bbrc.1995.2818 . PMID 7503742 .
- ^ Wang DS, Shaw R, Winkelmann JC, Shaw G (август 1994 г.). «Связывание pH-доменов бета-адренергической рецепторной киназы и бета-спектрина с WD40/бета-трансдуцином повторения, содержащих области бета-субъединицы тримерных G-белков». Биохимическая и биофизическая исследовательская коммуникация . 203 (1): 29–35. doi : 10.1006/bbrc.1994.2144 . PMID 8074669 .
- ^ Яо Л., Каваками Ю., Кавакам Т (сентябрь 1994 г.). «Домен гомологии Pleckstrin брутон -тирозинкиназы взаимодействует с протеинкиназой C» . Труды Национальной академии наук Соединенных Штатов Америки . 91 (19): 9175–9. Bibcode : 1994pnas ... 91.9175y . doi : 10.1073/pnas.91.19.9175 . PMC 44770 . PMID 7522330 .
- ^ Riddihough G (ноябрь 1994). «Больше извилистых и бутербродов». Природа структурная биология . 1 (11): 755–7. doi : 10.1038/nsb1194-755 . PMID 7634082 . S2CID 5410578 .
- ^ Ю Дж.В., Мендрола Дж.М., Айоя А., Сингх С., Келети Д., Дьюльд Д.Б., Мюррей Д., Эмр С.Д., Леммон М.А. (март 2004 г.). «Обще геном анализ мембранного нацеливания с помощью гомологических доменов S. cerevisiae pleckstrin» . Молекулярная клетка . 13 (5): 677–88. doi : 10.1016/s1097-2765 (04) 00083-8 . PMID 15023338 .
- ^ Форт П, Бланги А (июнь 2017 г.). «Эволюционный ландшафт семейств Rhogef, подобных DBL: адаптация эукариотических клеток к сигналам окружающей среды» . Genome Biol Evol . 9 (6): 1471–1486. doi : 10.1093/gbe/evx100 . PMC 5499878 . PMID 28541439 .
- ^ Sugiura M, Kono K, Liu H, Shimizugawa T, Minekura H, Spiegel S, Kohama T (июнь 2002 г.). «Церамидная киназа, новая липидная киназа. Молекулярное клонирование и функциональная характеристика» . Журнал биологической химии . 277 (26): 23294–300. doi : 10.1074/jbc.m201535200 . PMID 11956206 .
- ^ Комолов К.Е., Бенович Дж.Л. (январь 2018 г.). «G-белковые рецепторные киназы: прошлое, настоящее и будущее» . Клеточная передача сигналов . 41 : 17–24. doi : 10.1016/j.cellsig.2017.07.004 . PMC 5722692 . PMID 28711719 .
Внешние ссылки
[ редактировать ]- Nash Lab Protein Domains - Описание домена pH [ Постоянная мертвая ссылка ]
- Ориентация белков Umich в мембранах /суперсемейство -51 - рассчитанная ориентация доменов pH в мембранах