Ксантогенат



Ксантогенат соль представляет собой или эфир ксантиновой кислоты. Формула соли ксантиновой кислоты: [R-O-CS 2 ] − М + (где R представляет собой органильную группу, а М обычно представляет собой Na или K ). [ 1 ] Ксантогенат также относится к аниону [R-O-CS 2 ] − . Формула ксантиновой кислоты : R-O-C(=S)-S-H , например этилксантовая кислота , тогда как формула сложного эфира ксантиновой кислоты имеет вид R-O-C(=S)-S-R' , где R и R' представляют собой органильные группы. Соли ксантогенатов еще называют О -органилдитиоатами. Эфиры ксантиновой кислоты называют также О , S -диорганиловыми эфирами дитиокарбоновой кислоты . Название ксантогенат происходит от древнегреческого ξανθός ( ксантос ), что означает «желтоватый» или «золотой», и действительно, большинство солей ксантогената имеют желтый цвет. Они были открыты и названы в 1823 году датским химиком Уильямом Кристофером Зейзе . Эти сероорганические соединения важны в двух областях: производстве целлофана и родственных полимеров из целлюлозы и (в горнодобывающей промышленности) для добычи некоторых сульфидсодержащих руд. [ 2 ] Они также являются универсальными промежуточными продуктами органического синтеза .
Формирование и структура
[ редактировать ]Ксантогенаты щелочных металлов получают обработкой спирта , щелочи и сероуглерода . Этот процесс называется ксантированием . [ 2 ] В химической терминологии щелочь реагирует со спиртом с образованием алкоксида , который является нуклеофилом , присоединяющимся к электрофильному атому углерода в CS 2 . [ 3 ] Часто алкоксид образуется на месте путем обработки спирта гидроксидом натрия или гидроксидом калия :
- ROH + CS 2 + КОН → ROCS 2 K + H 2 O
Например, этоксид натрия дает этилксантогенат натрия . В этой реакции можно использовать многие спирты. Ксантогенатные соли технического качества обычно имеют чистоту 90–95%. Примеси включают щелочных металлов сульфиды , сульфаты , тритиокарбонаты , тиосульфаты , сульфиты или карбонаты , а также остаточное сырье, такое как спирт и гидроксид щелочного металла . Эти соли коммерчески доступны в виде порошка, гранул, хлопьев, палочек и растворов.
Некоторые коммерчески или иным образом полезные ксантогенатные соли включают:
- этилксантогенат натрия CH 3 CH 2 OCS 2 Na
- этилксантогенат калия , CH 3 CH 2 OCS 2 K
- изопропиловый ксантогенат калия, (CH 3 ) 2 CHOCS 2 K [ 4 ]
- изобутилксантогенат натрия, (CH 3 ) 2 CHCH 2 OCS 2 Na
- амилксантогенат калия , CH 3 (CH 2 ) 4 OCS 2 K
Ядро OCS 2 ксантогенатных солей, как и ядро карбонатов и сложных эфиров, имеет тригональную плоскую молекулярную геометрию . Центральный углерода атом – sp 2 -гибридизированный .
Реакции
[ редактировать ]Кислотно-основные свойства
[ редактировать ]Ксантотовые кислоты формулы ROC(S)SH можно получить обработкой ксантогенатов щелочных металлов, например этилксантогената калия , соляной кислотой при низких температурах. Метиловая и этилксантовая кислоты представляют собой масла, растворимые в органических растворителях. Бензилксантовая кислота представляет собой твердое вещество. У них pKas около 2. [ 5 ] Эти соединения термически разлагаются в присутствии оснований на спирт и сероуглерод. [ 6 ]
Ксантиновые кислоты характерно разлагают:
- ROCS 2 K + HCl → ROH + CS 2 + KCl
Эта реакция обратна методу получения ксантогенатных солей. Промежуточным продуктом разложения является ксантиновая кислота ROC(S)SH, которую в некоторых случаях удается выделить.
Другие реакции
[ редактировать ]Ксантогенат-анионы также подвергаются алкилированию с образованием ксантогенатных эфиров, которые обычно стабильны: [ 7 ]
- ROCS 2 K + R′X → ROC(S)SR′ + KX
Связь CO в этих соединениях подвержена расщеплению в результате дезоксигенации Бартона-МакКомби , что обеспечивает возможность дезоксигенации спиртов.
Они могут окисляться до диксантогендисульфидов :
- 2 ROCS 2 Na + I 2 → ROC(S)S 2 C(S)OR + 2 NaI
Ацилирование ксантогенатов дает алкиловые эфиры ксантогена (ROC(S)SC(O)R') и родственные ангидриды. [ 2 ]
Ксантогенаты связываются с катионами переходных металлов как бидентатные лиганды . Зарядно-нейтральные комплексы растворимы в органических растворителях. [ 8 ]
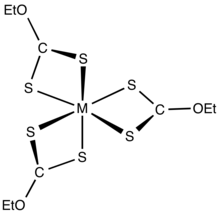
Ксантанаты являются промежуточными продуктами процесса элиминации Чугаева . Их можно использовать для контроля радикальной полимеризации в рамках процесса RAFT , также называемого MADIX (макромолекулярный дизайн посредством обмена ксантогенатами).
Промышленное применение
[ редактировать ]
Целлюлоза реагирует с сероуглеродом (CS 2 ) в присутствии гидроксида натрия (NaOH) с образованием ксантогената целлюлозы натрия, который при нейтрализации серной кислотой (H 2 SO 4 ) дает вискозную вискозу или целлофановую бумагу ( Sellotape или Scotch Tape ).
Соли ксантогенатов (например, алкилксантогенаты натрия, диксантоген ) широко используются в качестве флотореагентов при переработке полезных ископаемых.
Родственные соединения
[ редактировать ]Редко встречающиеся тиоксантогенаты возникают при реакции CS 2 с тиолатными солями. Например, этилтиоксантогенат натрия имеет формулу C 2 H 5 SCS 2 Na. Дитиокарбаматы также являются родственными соединениями. Они возникают в результате реакции вторичного амина с CS 2 . Например, диэтилдитиокарбамат натрия имеет формулу (C 2 H 5 ) 2 NCS 2 Na.
Воздействие на окружающую среду
[ редактировать ]Хотя этот класс химикатов биоразлагаем, он может быть токсичным для жизни в воде при концентрации менее 1 мг/л. [ 11 ] Вода после горнодобывающих предприятий часто загрязнена ксантогенатами. [ 12 ]
Ссылки
[ редактировать ]- ^ ИЮПАК не рекомендует использовать термин «ксантогенат», хотя в настоящее время он используется в научной литературе: ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Ксантогенат ». дои : 10.1351/goldbook.X06696
- ^ Jump up to: а б с Рой, Кэтрин-Мария. «Ксанфат». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a28_423 . ISBN 978-3527306732 .
- ^ В этом отчете представлена подробная процедура для этилксантогената калия : Прайс, Чарльз К.; Стейси, Гарднер В. (1948). « п -Нитрофенилсульфид». Органические синтезы . 28 : 82. дои : 10.15227/orgsyn.028.0082 .
- ^ Перумалредди Чандрасекаран, Джеймс П. Донахью (2009). «Синтез 4,5-диметил-1,3-дитиол-2-она» . Органические синтезы . 86 : 333. дои : 10.15227/orgsyn.086.0333 .
- ^ Милликан, Роберт Дж.; Зауэрс, Кэрол К. (1979). «Общее кислотно-катализируемое разложение алкилксантогенатов». Журнал органической химии . 44 (10): 1664–1669. дои : 10.1021/jo01324a018 .
- ^ Гаттов, Герхард; Берендт, Вернер (1977). Сульфиды углерода и их неорганическая и сложная химия . Штутгарт: Георг Тиме. ISBN 3135262014 .
- ^ Гагош, Фабьен; Зард, Самир З. (2007). «Подход с переносом ксантогената к α-трифторметиламинам» . Органические синтезы . 84:32 ; Сборник томов , т. 11, с. 212 .
- ^ Хайдук, И. (2004). «1,1-Дитиолато-лиганды». В Макклеверте, Дж.А.; Мейер, Ти Джей (ред.). Комплексная координационная химия II . Том. 1. С. 349–376.
- ^ Галсбёль, Ф.; Шеффер, CE (1967). Трис (О-этилдитиокарбонат) комплексы триположительных хрома, индия и кобальта . Неорганические синтезы . Том. 10. С. 42–49. дои : 10.1002/9780470132418.ch6 . ISBN 9780470132418 .
- ^ Зигфрид Гауптман: Органическая химия , 2-е исправленное издание, VEB Deutscher Verlag für Grundstoffindustrie, Лейпциг, 1985, стр. 652, ISBN 3-342-00280-8 .
- ^ Бессер, Дж.; Брамбо, В.; Аллерт, А.; Поултон, Б.; Шмитт, К.; Ингерсолл, К. (2009). «Экологическое воздействие добычи свинца на ручьи Озарк: токсичность отложений и поровой воды» . Экотоксикология и экологическая безопасность . 72 (2): 516–526. дои : 10.1016/j.ecoenv.2008.05.013 . ПМИД 18603298 .
- ^ Сюй, Ю.; Лэй, JP; Корте, Ф. (1988). «Судьба и влияние ксантогенатов в лабораторных системах пресной воды». Бюллетень загрязнения окружающей среды и токсикологии . 41 (5): 683–689. дои : 10.1007/BF02021019 . ПМИД 3233367 . S2CID 2696850 .