Титрование

Титрование (также известное как титриметрия) [ 1 ] и объемный анализ ) — распространенный лабораторный метод количественного химического анализа для определения концентрации идентифицированного аналита (вещества, подлежащего анализу). Реагент , называемый титрантом или титратором , [ 2 ] готовят в виде стандартного раствора известной концентрации и объема . Титрант реагирует с раствором аналита . (который также можно назвать титрантом) [ 3 ] ) для определения концентрации аналита. Объем титранта, прореагировавшего с аналитом, называется титровальным объемом .
История и этимология
[ редактировать ]Слово «титрование» происходит от французского слова titrer (1543 г.), означающего долю золота или серебра в монетах или в изделиях из золота или серебра; т.е. мера крупности или чистоты. Тильтре стало титром , [ 4 ] что, таким образом, стало означать «пробность легированного золота», [ 5 ] а затем «концентрация вещества в данном образце». [ 6 ] В 1828 году французский химик Жозеф Луи Гей-Люссак впервые употребил титр как глагол ( titrer ), означающий «определять концентрацию вещества в данном образце». [ 7 ]
Объемный анализ зародился во Франции в конце 18 века. Французский химик Франсуа-Антуан-Анри Декруазиль ( фр .) разработал первую бюретку (которая была похожа на градуированный цилиндр) в 1791 году. [ 8 ] [ 9 ] [ 10 ] Гей-Люссак разработал улучшенную версию бюретки с боковым штуцером и изобрел термины « пипетка » и « бюретка » в статье 1824 года о стандартизации растворов индиго. [ 11 ] Первая настоящая бюретка была изобретена в 1845 году французским химиком Этьеном Оссианом Анри (1798–1873). [ 12 ] [ 13 ] [ 14 ] [ 15 ] Серьезное усовершенствование метода и популяризация объемного анализа произошли благодаря Карлу Фридриху Мору , который перепроектировал бюретку в простую и удобную форму и написал первый учебник по этой теме Lehrbuch der Chemisch-analytischen Titrirmethode ( Учебник аналитической химии). Методы титрования ), опубликованный в 1855 году. [ 16 ] [ 17 ]
Процедура
[ редактировать ]
Типичное титрование начинается с стакана или колбы Эрленмейера , содержащего очень точное количество аналита и небольшого количества индикатора (например, фенолфталеина ), помещаемого под калиброванную бюретку или шприц для химического пипетирования, содержащий титрант. [ 18 ] Затем к аналиту и индикатору добавляют небольшие объемы титранта до тех пор, пока индикатор не изменит цвет в ответ на порог насыщения титранта, что означает достижение конечной точки титрования, что означает, что количество титранта уравновешивает количество присутствующего аналита в соответствии с реакция между ними. В зависимости от желаемой конечной точки, одна капля или менее одной капли титранта может иметь значение между постоянным и временным изменением индикатора. [ нужны дальнейшие объяснения ]
Техники подготовки
[ редактировать ]Типичные титрования требуют, чтобы титрант и аналит находились в жидкой форме (растворе). Хотя твердые вещества обычно растворяются в водном растворе, и другие растворители, такие как ледяная уксусная кислота или этанол для специальных целей используются (например, в нефтехимии , которая специализируется на нефти). [ 19 ] Концентрированные аналиты часто разбавляют для повышения точности.
Многие некислотно-основные титрования требуют постоянного pH во время реакции. Поэтому в камеру титрования можно добавлять буферный раствор для поддержания pH. [ 20 ]
В тех случаях, когда два реагента в образце могут реагировать с титрантом и только один является желаемым аналитом, в реакционную камеру можно добавить отдельный маскирующий раствор , который устраняет влияние нежелательного иона. [ 21 ]
Некоторые окислительно-восстановительные ( окислительно-восстановительные ) реакции могут потребовать нагрева раствора пробы и титрования, пока раствор еще горячий, чтобы увеличить скорость реакции . Например, окисление некоторых растворов оксалатов требует нагревания до 60 °C (140 °F) для поддержания разумной скорости реакции. [ 22 ]
Кривые титрования
[ редактировать ]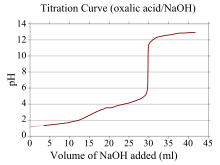
Кривая титрования – это кривая на графике, координата x которой представляет собой объем титранта, добавленного с начала титрования, а координата y которой представляет собой концентрацию аналита на соответствующей стадии титрования (в кислотно-основное титрование, координата y обычно соответствует pH раствора). [ 23 ]
При кислотно - основном титровании кривая титрования отражает силу соответствующих кислоты и основания. Для сильной кислоты и сильного основания кривая будет относительно гладкой и очень крутой вблизи точки эквивалентности. По этой причине небольшое изменение объема титранта вблизи точки эквивалентности приводит к значительному изменению pH, и многие индикаторы могут быть подходящими (например, лакмус , фенолфталеин или бромтимоловый синий ).
Если один реагент представляет собой слабую кислоту или основание, а другой — сильную кислоту или основание, кривая титрования становится нерегулярной и pH смещается меньше при небольших добавках титранта вблизи точки эквивалентности . кривая титрования щавелевой кислоты (слабая кислота) и гидроксида натрия Например, изображена (сильное основание). Точка эквивалентности возникает в диапазоне pH 8–10, что указывает на то, что раствор является основным в точке эквивалентности, и фенолфталеин подходящим индикатором является . Кривые титрования, соответствующие слабым основаниям и сильным кислотам, ведут себя аналогичным образом, при этом раствор является кислым в точке эквивалентности и такие индикаторы, как метилоранж и бромтимоловый синий наиболее подходящими являются .
Кривые титрования слабой кислотой и слабым основанием имеют очень нерегулярную форму. По этой причине определенный индикатор не может быть подходящим, и pH-метр . для наблюдения за реакцией часто используют [ 24 ]
Тип функции, которую можно использовать для описания кривой, называется сигмовидной функцией .
Виды титрования
[ редактировать ]Существует множество типов титрования с разными процедурами и целями. Наиболее распространенными видами качественного титрования являются кислотно-основное и окислительно-восстановительное титрование .
Кислотно-основное титрование
[ редактировать ]
| Индикатор | Цвет на кислой стороне | Диапазон изменения цвета (рН) |
Цвет основной стороны |
|---|---|---|---|
| Метиловый фиолетовый | Желтый | 0.0—1.6 | Фиолетовый |
| Бромфеноловый синий | Желтый | 3.0—4.6 | Синий |
| Метиловый оранжевый | Красный | 3.1—4.4 | Желтый |
| Метиловый красный | Красный | 4.4—6.3 | Желтый |
| лакмусовая бумажка | Красный | 5.0—8.0 | Синий |
| Бромтимоловый синий | Желтый | 6.0—7.6 | Синий |
| фенолфталеин | Бесцветный | 8.3—10.0 | Розовый |
| Ализарин желтый | Желтый | 10.1—12.0 | Красный |
Кислотно-основное титрование зависит от нейтрализации кислоты и основания при смешивании в растворе. Помимо пробы в камеру титрования добавляется соответствующий индикатор pH , представляющий диапазон pH точки эквивалентности. Кислотно-основной индикатор указывает на конечную точку титрования изменением цвета. Конечная точка и точка эквивалентности не совсем совпадают, поскольку точка эквивалентности определяется стехиометрией реакции, а конечная точка - это просто изменение цвета индикатора. Таким образом, тщательный выбор индикатора уменьшит погрешность индикатора. Например, если точка эквивалентности находится при pH 8,4, то вместо индикатора Ализарин желтый будет использоваться индикатор фенолфталеин, поскольку фенолфталеин уменьшит погрешность индикатора. Общие индикаторы, их цвета и диапазон pH, в котором они меняют цвет, приведены в таблице выше. [ 25 ] Когда требуются более точные результаты или когда реагентами являются слабая кислота и слабое основание, используются pH-метр или кондуктометр.
Для очень сильных оснований, таких как литийорганические реагенты , амиды металлов и гидриды , вода обычно не является подходящим растворителем, а индикаторы, pKa которых находятся в диапазоне изменения pH водной среды, малопригодны. Вместо этого в качестве титранта и индикатора гораздо более слабые кислоты и безводные растворители, такие как ТГФ . используются [ 26 ] [ 27 ]

Приблизительное значение pH во время титрования можно определить с помощью трех видов расчетов. Перед началом титрования концентрацию рассчитывается в водном растворе слабой кислоты до добавления какого-либо основания. Когда количество добавленных молей оснований равно числу молей исходной кислоты или так называемой точке эквивалентности , один из гидролиза и pH рассчитывается таким же образом, как рассчитывались сопряженные основания титруемой кислоты. Между начальной и конечной точками, получают по уравнению Хендерсона-Хассельбаха , а смесь для титрования рассматривают как буфер. В уравнении Хендерсона-Хассельбаха говорится, что [кислота] и [основание] представляют собой молярные количества, которые присутствовали бы даже при диссоциации или гидролизе. В буфере, можно точно рассчитать, но диссоциация ГК , гидролиз необходимо учитывать самоионизацию воды. [ 28 ] Необходимо использовать четыре независимых уравнения: [ 29 ]
В уравнениях и — моли кислоты ( HA ) и соли ( XA где X — катион), соответственно, использованных в буфере, а объем раствора — V. , Закон действующих масс был применен к ионизации воды и диссоциации кислоты для получения первого и второго уравнений. Баланс масс используется в третьем уравнении, где сумма и должно равняться количеству молей растворенной кислоты и основания соответственно. Баланс зарядов используется в четвертом уравнении, где левая часть представляет общий заряд катионов, а правая часть представляет общий заряд анионов: – молярность катиона (например, натрия, если при изготовлении буфера используется натриевая соль кислоты или гидроксид натрия). [ 30 ]
Редокс-титрование
[ редактировать ]Окислительно-восстановительное титрование основано на реакции восстановления-окисления между окислителем и восстановителем. Для определения конечной точки титрования обычно используется потенциометр , например, когда одним из или окислительно-восстановительный индикатор компонентов является окислитель дихромат калия . Изменение цвета раствора с оранжевого на зеленый не является определенным, поэтому используют такой индикатор, как дифениламин натрия. [ 31 ] Для анализа вин на диоксид серы требуется йод в качестве окислителя. В этом случае в качестве индикатора используется крахмал; В присутствии избытка йода образуется синий комплекс крахмал-йод, сигнализирующий о конечной точке. [ 32 ]
Некоторые окислительно-восстановительные титрования не требуют индикатора из-за интенсивного цвета компонентов. Например, при перманганометрии легкий сохраняющийся розовый цвет сигнализирует о конечной точке титрования из-за цвета избытка окислителя перманганата калия . [ 33 ] В йодометрии при достаточно больших концентрациях исчезновение темно-красно-коричневого трииодид- иона само по себе может быть использовано в качестве конечной точки, хотя при более низких концентрациях чувствительность улучшается за счет добавления индикатора крахмала , который образует интенсивно синий комплекс с трииодидом.

Титрование газовой фазы
[ редактировать ]Газофазное титрование — это титрование, проводимое в газовой фазе , в частности, как методы определения химически активных веществ путем реакции с избытком какого-либо другого газа , действующего в качестве титранта. При обычном газофазном титровании газообразный озон титруется оксидом азота по реакции
После завершения реакции количественно определяют оставшийся титрант и продукт (например, с помощью спектроскопии с преобразованием Фурье ) (ИК-Фурье); это используется для определения количества аналита в исходном образце.
Газофазное титрование имеет ряд преимуществ перед простой спектрофотометрией . Во-первых, измерение не зависит от длины пути, поскольку одна и та же длина пути используется для измерения как избытка титранта, так и продукта. Во-вторых, измерение не зависит от линейного изменения оптической плотности в зависимости от концентрации аналита, как это определяется законом Бера-Ламберта . В-третьих, это полезно для образцов, содержащих вещества, которые интерферируют на длинах волн, обычно используемых для аналита. [ 36 ]
Комплексометрическое титрование
[ редактировать ]Комплексометрическое титрование основано на образовании комплекса аналита и титранта. Как правило, для них требуются специализированные комплексометрические индикаторы , образующие слабые комплексы с аналитом. Наиболее распространенным примером является использование индикатора крахмала для повышения чувствительности йодометрического титрования: темно-синий комплекс крахмала с йодом и йодидом более заметен, чем один йод. Другими комплексометрическими индикаторами являются Eriochrome Black T для титрования ионов кальция и магния , а также хелатирующий агент ЭДТА, используемый для титрования ионов металлов в растворе. [ 37 ]
Дзета-потенциал титрование
[ редактировать ]Дзета-потенциальное титрование — это титрование, при котором завершение контролируется по дзета-потенциалу , а не по индикатору , чтобы охарактеризовать гетерогенные системы, такие как коллоиды . [ 38 ] Одним из применений является определение изоэлектрической точки , когда поверхностный заряд становится нулевым, что достигается путем изменения pH или добавления поверхностно-активного вещества . Другое применение – определение оптимальной дозы для флокуляции или стабилизации . [ 39 ]
анализ
[ редактировать ]Анализ — это тип биологического титрования, используемый для определения концентрации вируса или бактерии . Серийные разведения образца выполняются в фиксированном соотношении (например, 1:1, 1:2, 1:4, 1:8 и т. д.) до тех пор, пока последнее разведение не даст положительного результата теста на наличие вируса. Положительное или отрицательное значение можно определить путем визуального осмотра инфицированных клеток под микроскопом или с помощью иммуноферментного метода, такого как иммуноферментный анализ (ELISA). Это значение известно как титр . [ 40 ]
Измерение конечной точки титрования
[ редактировать ]Различные методы определения конечной точки включают в себя: [ 41 ]
- Индикатор: вещество, меняющее цвет в ответ на химическое изменение. Кислотно -основной индикатор (например, фенолфталеин ) меняет цвет в зависимости от pH. индикаторы Redox Также используются . В начале титрования добавляют каплю индикаторного раствора; конечная точка достигается при изменении цвета.
- Потенциометр : прибор, измеряющий электродный потенциал раствора. Они используются для окислительно-восстановительного титрования; потенциал рабочего электрода внезапно изменится по мере достижения конечной точки.

- pH-метр : потенциометр с электродом, потенциал которого зависит от количества H. + ион присутствует в растворе. (Это пример ионоселективного электрода .) pH раствора измеряется на протяжении всего титрования точнее, чем с помощью индикатора; в конечной точке произойдет внезапное изменение измеренного pH.
- Проводимость : измерение количества ионов в растворе. Концентрация ионов может значительно меняться при титровании, что приводит к изменению проводимости. (Например, при кислотно-основном титровании H + и ох − ионы реагируют с образованием нейтральной H 2 O.) Поскольку общая проводимость зависит от всех ионов, присутствующих в растворе, и не все ионы вносят одинаковый вклад (из-за подвижности и ионной силы ), предсказать изменение проводимости сложнее, чем измерить его.
- Изменение цвета. В некоторых реакциях раствор меняет цвет без добавления индикатора. Это часто наблюдается при окислительно-восстановительном титровании, когда разные степени окисления продукта и реагента дают разные цвета.
- Осаждение : Если в результате реакции образуется твердое вещество, во время титрования образуется осадок. Классическим примером является реакция между Ag + и Cl − с образованием нерастворимой соли AgCl. Мутные осадки обычно затрудняют точное определение конечной точки. Чтобы компенсировать это, титрование осадка часто приходится проводить «обратным» титрованием (см. ниже).
- Изотермический титровальный калориметр : прибор, измеряющий тепло, выделяемое или потребляемое в ходе реакции, для определения конечной точки. Используется в биохимическом титровании, например, для определения того, как субстраты связываются с ферментами .
- Термометрическая титриметрия : отличается от калориметрической титриметрии, поскольку теплота реакции (на что указывает повышение или понижение температуры) не используется для определения количества аналита в растворе пробы. Вместо этого конечная точка определяется скоростью изменения температуры .
- Спектроскопия : используется для измерения поглощения света раствором во время титрования, если известен спектр реагента, титранта или продукта. Концентрацию материала можно определить по закону Бера .
- Амперометрия : измеряет ток, возникающий в результате реакции титрования в результате окисления или восстановления аналита. Конечная точка определяется как изменение тока. Этот метод наиболее полезен, когда можно уменьшить избыток титранта, как при титровании галогенидов Ag . + .
Конечная точка и точка эквивалентности
[ редактировать ]Хотя термины «точка эквивалентности» и «конечная точка» часто используются как взаимозаменяемые, это разные термины. Точка эквивалентности — это теоретическое завершение реакции: объем добавленного титранта, при котором количество молей титранта равно количеству молей аналита или некоторому его кратному числу (как в полипротонных кислотах). Конечная точка — это то, что на самом деле измеряется: физическое изменение решения, определяемое индикатором или инструментом, упомянутым выше. [ 42 ]
Существует небольшая разница между конечной точкой и точкой эквивалентности титрования. Эта ошибка называется ошибкой индикатора и является неопределенной. [ 43 ] [ самостоятельно опубликованный источник? ]
Обратное титрование
[ редактировать ]Обратное титрование – это обратное титрование; вместо титрования исходного образца к раствору добавляют известный избыток стандартного реагента и титруют избыток. Обратное титрование полезно, если конечную точку обратного титрования легче определить, чем конечную точку нормального титрования, как в случае осаждения реакций . Обратное титрование также полезно, если реакция между аналитом и титрантом протекает очень медленно или когда аналит находится в нерастворимом твердом состоянии. [ 44 ]
Графические методы
[ редактировать ]В процессе титрования создаются растворы с составом от чистой кислоты до чистого основания. Определение pH, связанного с любой стадией процесса титрования, относительно просто для монопротонных кислот и оснований. Наличие более чем одной кислотной или основной группы усложняет эти вычисления. графические методы, [ 45 ] например эквилиграф, [ 46 ] уже давно используются для объяснения взаимодействия связанных равновесий.
Особое использование
[ редактировать ]
Кислотно-основное титрование
[ редактировать ]- Для биодизельного топлива: отработанное растительное масло (WVO) должно быть нейтрализовано перед обработкой партии. Часть WVO титруется основанием для определения кислотности, чтобы остальную часть партии можно было должным образом нейтрализовать. Это удаляет свободные жирные кислоты из WVO, которые обычно реагируют с образованием мыла вместо биодизельного топлива. [ 47 ]
- Метод Кьельдаля : измерение содержания азота в образце. Органический азот переваривается до аммиака и серной кислотой сернокислым калием . Наконец, аммиак снова титруют борной кислотой , а затем карбонатом натрия . [ 48 ]
- Кислотное число : масса гидроксида калия (КОН) в миллиграммах, необходимая для полного титрования кислоты в одном грамме образца. Примером является определение содержания свободных жирных кислот .
- Число омыления : масса КОН, необходимая для омыления жирной кислоты в одном грамме образца, в миллиграммах. Омыление используется для определения средней длины цепи жирных кислот в жире.
- Эфирное значение (или эфирный индекс): расчетный индекс. Эфирное число = число омыления – кислотное число.
- Аминное число: масса КОН в миллиграммах, равная содержанию амина в одном грамме образца.
- Гидроксильное число : масса КОН, соответствующая гидроксильным группам в одном грамме образца, в миллиграммах. Аналит ацетилируют уксусным ангидридом , затем титруют КОН.
Редокс-титрование
[ редактировать ]- Тест Винклера на растворенный кислород : используется для определения концентрации кислорода в воде. Содержание кислорода в пробах воды снижается с помощью сульфата марганца(II) , который реагирует с йодидом калия с образованием йода . Йод выделяется пропорционально количеству кислорода в пробе, поэтому концентрацию кислорода определяют окислительно-восстановительным титрованием йода тиосульфатом с использованием крахмального индикатора. [ 49 ]
- Витамин С. Также известный как аскорбиновая кислота, витамин С является мощным восстановителем. Его концентрацию можно легко определить при титровании синим красителем дихлорфенолиндофенолом ( DCPIP ), который становится бесцветным при восстановлении витамином. [ 50 ]
- Реактив Бенедикта : Избыток глюкозы в моче может указывать на диабет у пациента. Метод Бенедикта — это традиционный метод количественного определения глюкозы в моче с использованием подготовленного реагента. Во время этого типа титрования глюкоза восстанавливает ионы меди до ионов меди, которые реагируют с тиоцианатом калия с образованием белого осадка, что указывает на конечную точку. [ 51 ]
- Бромное число : мера ненасыщенности аналита, выраженная в миллиграммах брома, поглощенного 100 граммами образца.
- Йодное число : мера ненасыщенности аналита, выраженная в граммах йода, поглощенного 100 граммами образца.
Разнообразный
[ редактировать ]- Титрование по Карлу Фишеру : потенциометрический метод анализа следовых количеств воды в веществе. Пробу растворяют в метаноле и титруют реактивом Карла Фишера (состоит из йода , диоксида серы , основания и растворителя, например спирта ). Реагент содержит йод, который пропорционально реагирует с водой. Таким образом, содержание воды можно определить путем мониторинга электрического потенциала избытка йода. [ 52 ]
См. также
[ редактировать ]- Первичные стандарты — это соединения с постоянными и надежными свойствами, используемые для приготовления стандартных растворов для титрования.
Ссылки
[ редактировать ]- ^ Уитни, штат Вашингтон; Смит, Б.Э. (1911). «Титриметрия». Словарь и циклопедия Century . Компания Century Co., с. 6504.
- ^ Сборник базовой практики по биохимии . Орхусский университет. 2008.
- ^ «Титранд» . Словарь науки и технологий . МакГроу-Хилл . Проверено 30 сентября 2011 г.
- ^ Ортоланг: «титул» (на французском языке) : «4. а) 1543 г. тильтр «доля золота или серебра в монетах, в изделиях из золота и серебра» » ( тильтр : пропорция золота или серебра в деньгах, в изделиях из золота) или серебро)
- ^ «Этимология онлайн: титровать» .
- ^ «WordReference: титр и титр» .
- ^ Гей-Люссак (1828 г.). «Опыты товарного калия» . Анналы химии и физики . 2-я серия (на французском языке). 39 : 337–368. В сноске (1) стр. 340, Гей-Люссак впервые употребляет титул как глагол: «Им было бы легче титровать нормальную серную кислоту, используя чистую соду или углекислый поташ;...» ([При определении концентрации серной кислоты] было бы легче их титровать нормальную серную кислоту чистым карбонатом натрия или калия...)
- ^ Сабадвари, Ференц (1993). История аналитической химии . Тейлор и Фрэнсис . стр. 208–209. ISBN 2-88124-569-2 .
- ^ Декруазиль (1795 г.). «Описание и использование бертоллиметра, ...» [Описание и использование бертоллиметра, ...]. Journal des Arts et Manufactures (на французском языке). 1 : 256–276.
- ^ Вишняк, Хайме (2014). «Франсуа Антуан Анри Декруазиль» . CENIC Журнал химических наук . 45 (1): 184–193.
- ^ Гей-Люссак (1824 г.). «Инструкция по пробе хлорной извести» . Анналы химии и физики . 2-я серия (на французском языке). 26 : 162–175. Мы пп. 170–171, Гей-Люссак описывает различные фигуры, изображенные на табличке (иллюстрации), сопровождающей статью. Из стр. 170: « F» , маленькая мерка или пипетка 2 + 1/2 ( F кубика сантиметра, ...» маленькая мерка или « пипетка , » 2 + 1/2 . см ., ... ) Со стр 171: « I , burette destinée à mesurer la teinture d'épreuve: ...» ( Я , «бюретка», предназначалась для измерения тестового красителя: ...)
- ^ Генри, О. (1845). «Новые опыты по анализу товарного поташа и аппарат под названием «калийметр» для его проведения . Журнал фармации и химии . 3-я серия (на французском языке). 7 : 214–222. Эскиз графика Генри представлен на стр. 218.
- ^ Сабадвари, Ференц (1986). «История химического лабораторного оборудования» . Периодика Политехнического химического машиностроения . 30 (1–2): 77–95. См. стр. 87.
- ^ Сабадвары, Ференц (1966). История аналитической химии . Перевод Дьюлы Свехлы. Оксфорд, Англия: Пермагон Пресс. п. 237. ИСБН 9781483157122 .
- ^ Кристоф, Р. (1971). «Объемный анализ с 1790 по 1860 годы. Характеристика и промышленное значение. Эволюция инструментов» [Объемный анализ с 1790 по 1860 годы. Характеристика и промышленное значение. Эволюция инструментов.]. Revue d'histoire des Sciences (на французском языке). 24 (1): 25–44. дои : 10.3406/rhs.1971.3172 . Из стр. 38: «... она [т. е. бюретка Генри] хорошо предвещает его современных потомков...»
- ^ Розенфельд, Л. (1999). Четыре века клинической химии . ЦРК Пресс . стр. 72–75. ISBN 90-5699-645-2 .
- ^ Мор, Карл Фридрих (1855). Учебник аналитической химии, методы титрования..., часть 1 [ Учебник аналитической химии, методы титрования... ] (на немецком языке). Брауншвейг (Германия): Фридрих Видег и сын. стр. 2–20. На странице 3 изображена бюретка Мора; На странице 12 изображена бюретка со стеклянным краном .
- ^ Гайао, Эдвальдо да Нобрега; МАРТИНС, Вальдомиро Ласерда; ЛИРА, Веллингтон-да-Сильва; АЛМЕЙДА, Лучано Фариас де; СИЛЬВА, Эдван Чирино да; Араужо, Марио Сезар Угулино (2006). «Титрование на основе цифровых изображений». Аналитика Химика Акта . 570 (2): 283–290. дои : 10.1016/j.aca.2006.04.048 . ПМИД 17723410 .
- ^ Матар, С.; Л. Ф. Хэтч (2001). Химия нефтехимических процессов (2-е изд.). Профессиональное издательство Персидского залива. ISBN 0-88415-315-0 .
- ^ Верма, доктор НК; СК Ханна; Доктор Б. Капила. Комплексная химия XI . Нью-Дели: Публикации Лакшми. стр. 642–645. ISBN 81-7008-596-9 .
- ^ Патнаик, П. (2004). Справочник декана по аналитической химии (2-е изд.). МакГроу-Хилл Профессор Мед/Техн. стр. 2.11–2.16. ISBN 0-07-141060-0 .
- ^ Вальтер, СП (2005). Основы геохимии . Джонс и Бартлетт Обучение. стр. 515–520. ISBN 0-7637-2642-7 .
- ^ Регер, Д.Л.; С.Р. Гуд; Д. У. Болл (2009). Химия: принципы и практика (3-е изд.). Cengage Обучение. ISBN 978-0-534-42012-3 .
- ^ Бьюик, С.; Дж. Эдж; Т. Форсайт; Р. Парсонс (2009). СК12 Химия . Фонд СК-12. стр. 794–797.
- ^ «Измерения pH индикаторами» . Проверено 29 сентября 2011 г.
- ^ «Титрование растворимых реагентов RM, R 2 NM и ROM» (PDF) . shenvilab.org/education .
- ^ «Методы стандартизации алкиллитиевых реагентов (литература до 2006 г.)» (PDF) . Проверено 4 июня 2014 г.
- ^ Харрис, Дэниел К. (2007). Количественный химический анализ (Седьмое изд.). Фримен и компания. ISBN 978-0-7167-7041-1 .
- ^ Скуг, Д.А.; Уэст, DM; Холлер, Ф.Дж. (2000). Аналитическая химия: Введение, седьмое издание . Эмили Барросс. стр. 265-305 . ISBN 0-03-020293-0 .
- ^ Генри, Н.; М.М.Сенозон (2001). Уравнение Хендерсона-Хассельбаха: его история и ограничения . Журнал химического образования. стр. 1499–1503.
- ^ Фогель, А.И.; Дж. Мендхэм (2000). Учебник Фогеля по количественному химическому анализу (6-е изд.). Прентис Холл. п. 423. ИСБН 0-582-22628-7 .
- ^ Америн, Массачусетс; М. А. Джослин (1970). Столовые вина: технология их производства . Том. 2 (2-е изд.). Издательство Калифорнийского университета. стр. 751–753. ISBN 0-520-01657-2 .
- ^ Немецкое химическое общество. Отдел аналитической химии (1959). Журнал аналитической химии Фрезениуса (на немецком языке). Том. 166–167. Мичиганский университет: Дж. Ф. Бергманн. п. 1.
- ^ Хэнш, Т.В. (2007). Метрология и фундаментальные константы . ИОС Пресс. п. 568. ИСБН 978-1-58603-784-0 .
- ^ «Титрование газовой фазы» . Международное бюро мер и весов . Проверено 29 сентября 2001 г.
- ^ ДеМор, Всемирный банк; М. Патапов (сентябрь 1976 г.). «Сравнение определений озона с помощью ультрафиолетовой фотометрии и газофазного титрования». Экологические науки и технологии . 10 (9): 897–899. Бибкод : 1976EnST...10..897D . дои : 10.1021/es60120a012 .
- ^ Хопкар, С.М. (1998). Основные понятия аналитической химии (2-е изд.). Нью Эйдж Интернэшнл. стр. 63–76. ISBN 81-224-1159-2 .
- ^ Сомасундаран, П. (2006). «Расчет дзета-потенциалов по электрокинетическим данным». Энциклопедия поверхностных и коллоидных наук . 2 (2-е изд.). CRC Press: 1097. ISBN. 0-8493-9607-7 .
- ^ Духин А.С. и Гетц П.Дж. Характеристика жидкостей, нано- и микрочастиц и пористых тел с помощью ультразвука , Elsevier, 2017. ISBN 978-0-444-63908-0
- ^ Декер, Дж. М. (2000). Введение в иммунологию . Одиннадцатый час (3-е изд.). Уайли-Блэквелл. стр. 18–20. ISBN 0-632-04415-2 .
- ^ «Титрование» . Энциклопедия науки и технологий . МакГроу-Хилл . Проверено 30 сентября 2011 г.
- ^ Харрис, округ Колумбия (2003). Количественный химический анализ (6-е изд.). Макмиллан. п. 129. ИСБН 0-7167-4464-3 .
- ^ Ханнан, HJ (2007). Справочник технического специалиста по составу промышленных и бытовых чистящих средств . Лулу.com. п. 103. ИСБН 978-0-615-15601-9 . [ самостоятельный источник ]
- ^ Кенкель, Дж. (2003). Аналитическая химия для технических специалистов . Том. 1 (3-е изд.). ЦРК Пресс. стр. 108–109.
- ^ Хэтфилд, Д. Брук (2015). «Эквлиграф: возвращение к старому инструменту» . tahosa.us .
- ^ Фрейзер, Х. (1963). Ионные равновесия в аналитической химии . Крейгер. ISBN 0-88275-955-8 .
- ^ Перселла, Г. (2007). Руководство по биодизелю «Сделай сам: альтернативное топливо для экономии денег, снижения зависимости от нефти и помощи планете» . Улисс Пресс. стр. 81–96 . ISBN 978-1-56975-624-9 .
- ^ Ремингтон: наука и фармацевтическая практика . Том. 1 (21 изд.). Липпинкотт Уильямс и Уилкинс. 2005. с. 501. ИСБН 0-7817-4673-6 .
- ^ Спеллман, Франция (2009). Справочник по эксплуатации водоочистных сооружений (2-е изд.). ЦРК Пресс. стр. 545 . ISBN 978-1-4200-7530-4 .
- ^ Биология . Том. 3. Лондон: Тейлор и Фрэнсис. 1967. с. 52.
- ^ Нигам (2007). Лабораторное руководство по биохимии . Тата МакГроу-Хилл Образование. п. 149. ИСБН 978-0-07-061767-4 .
- ^ Джексон, МЛ; П. Барак (2005). Химический анализ почвы: продвинутый курс . Параллельная пресса библиотек UW-Мэдисона. стр. 305–309. ISBN 1-893311-47-3 .
Внешние ссылки
[ редактировать ]- Wikihow: выполните титрование
- Интерактивное руководство по титрованию
- Научная помощь: простое объяснение титрования, включая примеры расчетов.
- Бесплатное ПО для титрования — моделирование любой кривой зависимости pH от объема, диаграммы распределения и анализ реальных данных.
- Графический метод решения кислотно-основных задач, включая титрование
- Графический и численный решатель общих кислотно-щелочных задач - Программа для телефона и планшета
![{\displaystyle {\что {[H+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{\displaystyle [{\what {H+}}][{\what {OH-}}]=10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{\displaystyle [{\ce {H+}}]=K_{a}{\ce {{\frac {[HA]}{[A^{-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{\displaystyle [{\ce {HA}}]+[{\ce {A-}}]={\frac {(n_ {{\ce {A}}}+n_ {{\ce {B}}} )}{V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{\displaystyle [{\ce {H+}}]+{\frac {n_ {{\ce {B}}}}{V}}=[{\ce {A-}}]+[{\ce {OH -}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)


![{\displaystyle V[{\ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{\displaystyle V[{\ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)
