Свободная энергия Гиббса
| Термодинамика |
|---|
 |
В термодинамике ( свободная энергия Гиббса или энергия Гиббса в качестве рекомендуемого названия; символ ) — это термодинамический потенциал , который можно использовать для расчета максимального количества работы , отличной от работы давление-объем , которую может выполнить термодинамически замкнутая система при постоянных температуре и давлении . Это также обеспечивает необходимое условие для таких процессов, как химические реакции , которые могут происходить в этих условиях. Свободная энергия Гиббса выражается как Где:
- это внутренняя энергия системы
- это энтальпия системы
- это энтропия системы
- это температура системы
- это объем системы
- - давление системы (которое должно быть равно давлению окружающей среды для механического равновесия).
Изменение свободной энергии Гиббса ( , измеряется в джоулях в системе СИ ) — это максимальное количество работы необъемного расширения, которую можно извлечь из закрытой системы (той, которая может обмениваться теплом и работать с окружающей средой, но не с веществом) при фиксированной температуре и давлении. Этот максимум может быть достигнут только в ходе вполне обратимого процесса . Когда в этих условиях система обратимо переходит из начального состояния в конечное, уменьшение свободной энергии Гиббса равно работе, совершаемой системой с окружающей средой, за вычетом работы сил давления . [1]
Энергия Гиббса — это термодинамический потенциал, который минимизируется, когда система достигает химического равновесия при постоянном давлении и температуре, когда она не приводится в действие приложенным электролитическим напряжением. Тогда ее производная по координате реакции системы обращается в нуль в точке равновесия. Таким образом, сокращение необходимо, чтобы реакция протекала самопроизвольно в этих условиях .
Концепция свободной энергии Гиббса, первоначально называвшаяся доступной энергией , была разработана в 1870-х годах американским учёным Джозайей Уиллардом Гиббсом . В 1873 году Гиббс описал эту «доступную энергию» как [2] : 400
наибольшая сумма механической работы, которую можно получить от данного количества определенного вещества в данном исходном состоянии, не увеличивая его общий объем и не допуская перехода тепла к внешним телам или от них, за исключением случаев, когда процессы завершаются остались в исходном состоянии.
Начальное состояние тела, по мнению Гиббса, должно быть таким, что «тело можно заставить перейти из него в состояния рассеянной энергии путем обратимых процессов ». В своем выдающемся труде 1876 года «О равновесии гетерогенных веществ» , графическом анализе многофазных химических систем, он полностью изложил свои мысли о безхимической энергии.
Если все реагенты и продукты находятся в своих термодинамических стандартных состояниях , то определяющее уравнение записывается как , где это энтальпия , – абсолютная температура , а это энтропия .
Обзор
[ редактировать ]
Согласно второму закону термодинамики , для систем, реагирующих при фиксированных температуре и давлении без вклада , не связанной с давлением и объемом (пВ) работы , существует общая естественная тенденция к достижению минимума свободной энергии Гиббса.
Количественной мерой благоприятности данной реакции в этих условиях является изменение Δ G (иногда обозначаемое «дельта G » или «d G ») свободной энергии Гиббса, которое вызвано (или могло бы быть) реакцией. В качестве необходимого условия для того, чтобы реакция протекала при постоянной температуре и давлении, ΔG должно быть меньше работы без давления-объема (не- pV , например, электрической), которая часто равна нулю (тогда ΔG должна быть отрицательной). ). Δ G равна максимальному количеству не- PV работы, которое может быть совершено в результате химической реакции для случая обратимого процесса. Если анализ указывает на положительную величину ΔG для энергию в форме электрической или другой не -PV реакции, то к реагирующей системе необходимо будет добавить работы, чтобы ΔG было меньше, чем не -PV -работа, и сделать ее меньше. возможно возникновение реакции. [3] : 298–299
Можно думать о ∆G как о количестве «свободной» или «полезной» энергии, доступной для выполнения не- PV работы при постоянной температуре и давлении. Уравнение можно также рассматривать с точки зрения системы вместе с ее окружением (остальной Вселенной). Во-первых, предполагается, что данная реакция при постоянных температуре и давлении является единственной, которая протекает. Тогда энтропия , выделяемая или поглощаемая системой, равна энтропии, которую должна поглотить или высвободить окружающая среда соответственно. Реакция будет разрешена только в том случае, если общее изменение энтропии Вселенной будет равно нулю или положительно. Это отражается в отрицательном ΔG , и реакция называется экзергоническим процессом .
Если две химические реакции связаны, то эндергоническая реакция (с положительным ΔG ) может возникнуть . Ввод тепла в эндергоническую реакцию по своей сути, такую как отщепление циклогексанола циклогексена до изменяется , можно рассматривать как соединение неблагоприятной реакции (элиминирования) с благоприятной (сжигание угля или другое получение тепла), так что общая энтропия Вселенной больше или равно нулю, что делает полное изменение свободной энергии Гиббса связанных реакций отрицательным.
В традиционном использовании термин «бесплатная» был включен в «свободную энергию Гиббса» и означает «доступную в форме полезной работы». [1] Характеристика станет более точной, если мы добавим уточнение, что это энергия, доступная для работы без давления и объема. [4] (Аналогичное, но немного другое значение слова «свободный» применяется в сочетании со свободной энергией Гельмгольца для систем с постоянной температурой). Однако все большее количество книг и журнальных статей не содержат приставки «бесплатно», называя G просто «энергией Гиббса». Это результат встречи ИЮПАК 1988 года по установлению единой терминологии для международного научного сообщества, на которой было рекомендовано удалить прилагательное «свободный». [5] [6] [7] Однако этот стандарт еще не получил всеобщего признания.
название «свободная энтальпия ». также использовалось для обозначения G В прошлом [6]
История
[ редактировать ]Величина, называемая «свободной энергией», является более продвинутой и точной заменой устаревшего термина « сродство », который использовался химиками в ранние годы физической химии для описания силы , вызывающей химические реакции .
В 1873 году Джозайя Уиллард Гиббс опубликовал «Метод геометрического представления термодинамических свойств веществ с помощью поверхностей» , в котором он обрисовал принципы своего нового уравнения, которое было способно предсказать или оценить тенденции различных естественных процессов, которые происходят, когда тела или системы вступают в контакт. Изучая взаимодействия однородных веществ, находящихся в контакте, то есть тел, состоящих частично из твердого тела, частично из жидкости и частично из пара, и используя трехмерный график объем - энтропия - внутренняя энергия , Гиббс смог определить три состояния равновесия: т. е. «обязательно стабильный», «нейтральный» и «нестабильный», и последуют ли изменения. Далее Гиббс заявил: [2]
Если мы хотим выразить в одном уравнении необходимое и достаточное условие термодинамического равновесия вещества, окруженного средой с постоянным давлением р и температурой Т , то это уравнение можно записать:
δ ( ε - Tη + pν ) знак равно 0когда δ относится к изменению, вызванному любыми изменениями в состоянии частей тела, и (когда разные части тела находятся в разных состояниях) к пропорции, в которой тело разделено между различными состояниями. Условием устойчивого равновесия является то, что значение выражения в скобках должно быть минимальным.
В этом описании, используемом Гиббсом, ε относится к внутренней энергии тела, η относится к энтропии тела, а ν — к объему тела...
Впоследствии, в 1882 году, немецкий учёный Герман фон Гельмгольц охарактеризовал сродство как наибольшее количество работы, которое можно получить, если реакция осуществляется обратимым образом, например электрическая работа в обратимой ячейке. Таким образом, максимальная работа рассматривается как уменьшение свободной или доступной энергии системы ( свободная энергия Гиббса G при T = константа, P = константа или свободная энергия Гельмгольца F при T = константа, V = константа), в то время как Выделяемое тепло обычно является мерой уменьшения полной энергии системы ( внутренней энергии ). Таким образом, G или F — это количество энергии, «свободной» для работы в данных условиях.
До этого момента общая точка зрения была такова: «все химические реакции приводят систему к состоянию равновесия, в котором сходство реакций исчезает». В течение следующих 60 лет термин «родство» был заменен термином «свободная энергия». По словам историка химии Генри Лестера, влиятельный учебник Гилберта Н. Льюиса и Мерла Рэндалла «Термодинамика и свободная энергия химических веществ» 1923 года « привел к замене термина сродство» термином «свободная энергия» в большей части английского языка. говорящий мир. [8] : 206
Определения
[ редактировать ]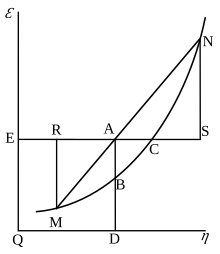
Свободная энергия Гиббса определяется как
что то же самое, что
где:
- U — внутренняя энергия (единица СИ: джоуль ),
- p — давление (единица СИ: паскаль ),
- V is volume (SI unit: m 3 ),
- T — температура (единица СИ: кельвин ),
- S — энтропия (единица СИ: джоуль на кельвин),
- H — энтальпия (единица СИ: джоуль).
Выражение бесконечно малого обратимого изменения свободной энергии Гиббса как функции ее «естественных переменных» p и T для открытой системы , подверженной действию внешних сил (например, электрических или магнитных) X i , которые вызывают Если внешние параметры системы a i изменятся на величину d a i , можно получить из первого закона для обратимых процессов следующим образом:
где:
- µ i – химический потенциал го i - химического компонента . (Единица СИ: джоули на частицу [9] или джоули на моль [1] )
- N i — количество частиц (или количество молей), составляющих i -й химический компонент.
Это одна из форм фундаментального уравнения Гиббса . [10] В бесконечно малом выражении термин, включающий химический потенциал, учитывает изменения свободной энергии Гиббса в результате притока или оттока частиц. Другими словами, это справедливо для открытой системы или для закрытой химически реагирующей системы, где N i изменяются. Для закрытой, нереагирующей системы этот термин можно опустить.
В зависимости от конкретной рассматриваемой системы может быть добавлено любое количество дополнительных терминов. Помимо механической работы , система может выполнять множество других видов работы. Например, в бесконечно малом выражении энергия работы сокращения, связанная с термодинамической системой, которая представляет собой сократительное волокно, которое укорачивается на величину -d l под действием силы f, приведет к члена f d l добавлению . Если некоторое количество заряда −d e приобретается системой при электрическом потенциале Ψ, связанная с этим электрическая работа равна −Ψ d e , которая будет включена в бесконечно малое выражение. Остальные условия работы добавляются согласно системным требованиям. [11]
Каждую величину в приведенных выше уравнениях можно разделить на количество вещества, измеренное в молях , чтобы образовать молярную свободную энергию Гиббса . Свободная энергия Гиббса — одна из наиболее важных термодинамических функций для характеристики системы. Это фактор, определяющий такие результаты, как напряжение и электрохимической ячейки константа равновесия реакции обратимой . В изотермических изобарических системах свободную энергию Гиббса можно рассматривать как «динамическую» величину, поскольку она является репрезентативной мерой конкурирующих эффектов энтальпийной энергии. [ нужны разъяснения ] и энтропийные движущие силы, участвующие в термодинамическом процессе.
Температурная зависимость энергии Гиббса для идеального газа дается уравнением Гиббса–Гельмгольца , а ее зависимость от давления – формулой [12]
или, что более удобно, его химический потенциал :
В неидеальных системах летучесть в игру вступает .
Вывод
[ редактировать ]свободной энергии Гиббса Полный дифференциал относительно натуральных переменных может быть получен с помощью преобразований Лежандра внутренней энергии .
Определение G сверху:
- .
Беря полный дифференциал, имеем
Замена d U результатом первого закона дает [13]
естественными переменными группы G Тогда будут p , T и { N i }.
Гомогенные системы
[ редактировать ]Поскольку S , V и Ni : являются обширными переменными , соотношение Эйлера d U позволяет легко интегрировать [13]
Поскольку некоторые из естественных переменных G являются интенсивными, d G нельзя интегрировать с использованием соотношений Эйлера, как в случае с внутренней энергией. Однако простая подстановка приведенного выше интегрированного результата для U в определение G дает стандартное выражение для G : [13]
Этот результат показывает, что химический потенциал вещества - его (парциальная) молярная свободная энергия Гиббса. Это применимо к однородным макроскопическим системам, но не ко всем термодинамическим системам. [14]
Свободная энергия реакций Гиббса.
[ редактировать ]Рассматриваемая система поддерживается при постоянной температуре и давлении и является закрытой (вещество не может войти или выйти). Энергия Гиббса любой системы равна и бесконечно малое изменение G при постоянной температуре и давлении дает
- .
По первому закону термодинамики изменение внутренней энергии U определяется выражением
где δQ — энергия, добавленная в виде тепла, а δW — энергия, добавленная в виде работы. Работу, совершаемую над системой, можно записать как δW = − pdV + δW x , где − pdV — механическая работа сжатия/расширения, совершаемая системой или системой, а δW x — все другие формы работы, которые могут включать в себя электрическую, магнитный и т. д. Тогда
и бесконечно малое изменение в G равно
- .
Второй закон термодинамики гласит, что для закрытой системы при постоянной температуре (в тепловой бане) , и отсюда следует, что
Если предположить, что совершается только механическая работа, то это упрощается.
Это означает, что для такой системы, когда она не находится в равновесии, энергия Гиббса всегда будет убывать, а в равновесии бесконечно малое изменение dG будет равно нулю. В частности, это будет верно, если на пути к равновесию система испытывает любое количество внутренних химических реакций.
В электрохимической термодинамике
[ редактировать ]При прохождении электрического заряда dQ ele между электродами электрохимической ячейки возникает ЭДС , в выражении для изменения энергии Гиббса появляется член электрической работы: где S — энтропия , V — объем системы, p — ее давление, а T — ее абсолютная температура .
Комбинация ( , Q ele ) является примером сопряженной пары переменных . При постоянном давлении приведенное выше уравнение дает соотношение Максвелла , которое связывает изменение напряжения открытой ячейки с температурой T (измеримая величина) с изменением энтропии S прохождении заряда при изотермическом и изобарном . Последнее тесно связано с реакционной энтропией электрохимической реакции, которая придает батарее энергию. Это соотношение Максвелла: [15]
Если моль ионов переходит в раствор (например, в ячейке Даниэля, как обсуждается ниже), заряд во внешней цепи равен
где n 0 — число электронов на ион, а F 0 — постоянная Фарадея , а знак минус указывает на разряд ячейки. Предполагая постоянные давление и объем, термодинамические свойства ячейки строго связаны с поведением ее ЭДС соотношением
где ΔH – энтальпия реакции . Все величины справа поддаются непосредственному измерению.
Полезные тождества для вывода уравнения Нернста
[ редактировать ]Этот раздел может сбивать с толку или быть неясным для читателей . В частности, не объясняется физическая ситуация. Кроме того, обозначение круга недостаточно объяснено (даже в том случае, когда оно было предпринято). Это просто голые уравнения. ( Март 2015 г. ) |
Во время обратимой электрохимической реакции при постоянной температуре и давлении выполняются следующие уравнения, включающие свободную энергию Гиббса:
- (см. химическое равновесие ),
- (для системы, находящейся в химическом равновесии),
- (для обратимого электрохимического процесса при постоянной температуре и давлении),
- (определение ),
и перестановка дает
которое связывает потенциал клетки, возникающий в результате реакции, с константой равновесия и коэффициентом реакции для этой реакции ( уравнение Нернста ),
где
- Δ r G , изменение свободной энергии Гиббса на моль реакции,
- Δ r G° , изменение свободной энергии Гиббса на моль реакции для несмешанных реагентов и продуктов в стандартных условиях (т. е. 298 К, 100 кПа, 1 М каждого реагента и продукта),
- R , газовая постоянная ,
- Т , абсолютная температура ,
- ln , натуральный логарифм ,
- Q r , коэффициент реакции (безразмерный),
- K eq , константа равновесия (безразмерная),
- w elec,rev , электрическая работа в обратимом процессе (химическое соглашение о знаках),
- n , число молей электронов , перешедших в реакции,
- F = N A e ≈ 96485 Кл/моль , постоянная Фарадея (заряд на моль электронов),
- , клеточный потенциал ,
- , стандартный клеточный потенциал .
Более того, у нас также есть
которое связывает константу равновесия со свободной энергией Гиббса. Это означает, что в равновесии и
Стандартное изменение энергии Гиббса в формации
[ редактировать ]| Вещество (состояние) | Δ f G° | |
|---|---|---|
| ( кДж / моль ) | ( ккал / моль ) | |
| НЕТ(г) | 87.6 | 20.9 |
| НЕТ 2 (г) | 51.3 | 12.3 |
| Н 2 О(г) | 103.7 | 24.78 |
| Н 2 О(г) | −228.6 | −54.64 |
| Н 2 О(л) | −237.1 | −56.67 |
| СО 2 (г) | −394.4 | −94.26 |
| CO(г) | −137.2 | −32.79 |
| СН 4 (г) | −50.5 | −12.1 |
| С 2 Н 6 (г) | −32.0 | −7.65 |
| С 3 Н 8 (г) | −23.4 | −5.59 |
| С 6 Н 6 (г) | 129.7 | 29.76 |
| С 6 Н 6 (л) | 124.5 | 31.00 |
Стандартная свободная энергия Гиббса образования соединения — это изменение свободной энергии Гиббса, сопровождающее образование 1 моля этого вещества из составляющих его элементов в их стандартных состояниях (наиболее стабильная форма элемента при 25 °С и 100 °С). кПа ). Его символ — Δ f G ˚.
Все элементы в своих стандартных состояниях (двухатомный кислород , графит и т. д.) имеют стандартное изменение свободной энергии Гиббса, равное нулю, поскольку никаких изменений не происходит.
- Δ f G = Δ f G ˚ + RT ln Q f ,
где Q f – коэффициент реакции .
В состоянии равновесия Δ f G = 0 и Q f = K , поэтому уравнение принимает вид
- Δ ж G ˚ знак равно - RT ln K ,
где К — константа равновесия реакции образования вещества из элементов в их стандартных состояниях.
Графическая интерпретация Гиббса
[ редактировать ]Свободная энергия Гиббса первоначально определялась графически. В 1873 году американский учёный Уиллард Гиббс опубликовал свою первую статью по термодинамике «Графические методы в термодинамике жидкостей», в которой Гиббс использовал две координаты: энтропию и объём для представления состояния тела. В своей второй последующей статье «Метод геометрического представления термодинамических свойств веществ с помощью поверхностей», опубликованной позже в том же году, Гиббс добавил третью координату энергии тела, определенную на трех фигурах. В 1874 году шотландский физик Джеймс Клерк Максвелл использовал фигуры Гиббса, чтобы создать трехмерную термодинамическую поверхность энергии-энтропии-объема вымышленного водоподобного вещества. [17] Таким образом, чтобы понять концепцию свободной энергии Гиббса, может быть полезно понять ее интерпретацию Гиббсом как сечения AB на его рисунке 3 и то, как Максвелл вылепил это сечение на своей трехмерной поверхности .
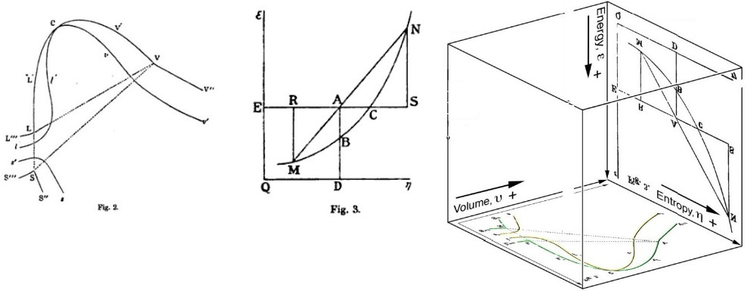
См. также
[ редактировать ]- Биоэнергетика
- Кальфад (РАСЧЕТ ФАЗНЫХ диаграмм)
- Критическая точка (термодинамика)
- Электронный эквивалент
- Энтальпийно-энтропийная компенсация
- Свободная энтропия
- Уравнение Гиббса – Гельмгольца
- Большой потенциал
- Неслучайная модель двух жидкостей (модель NRTL) - расчет энергии Гиббса избытка и смешивания, а также коэффициенты активности.
- Спинодаль – Спинодальные кривые (матрица Гессе)
- Стандартная молярная энтропия
- Термодинамическая свободная энергия
- Модель UNIQUAC – расчет энергии избытка Гиббса и смешивания, а также коэффициенты активности
Примечания и ссылки
[ редактировать ]- ^ Jump up to: а б с Перро, Пьер (1998). Термодинамика от А до Я. Издательство Оксфордского университета. ISBN 0-19-856552-6 .
- ^ Jump up to: а б Гиббс, Джозайя Уиллард (декабрь 1873 г.). «Метод геометрического представления термодинамических свойств веществ с помощью поверхностей» (PDF) . Труды Академии искусств и наук Коннектикута . 2 : 382–404.
- ^ Питер Аткинс; Лоретта Джонс (1 августа 2007 г.). Химические принципы: В поисках понимания . У. Х. Фриман. ISBN 978-1-4292-0965-6 .
- ^ Рейсс, Ховард (1965). Методы термодинамики . Дуврские публикации. ISBN 0-486-69445-3 .
- ^ Калверт, Дж. Г. (1 января 1990 г.). «Глоссарий терминов по химии атмосферы (Рекомендации 1990 г.)» . Чистая и прикладная химия . 62 (11): 2167–2219. дои : 10.1351/pac199062112167 .
- ^ Jump up to: а б «Энергия (функция) Гиббса, Г» . Золотая книга ИЮПАК (Сборник химических технологий) . ИЮПАК (Международный союз теоретической и прикладной химии). 2008. doi : 10.1351/goldbook.G02629 . Проверено 24 декабря 2020 г.
Раньше ее называли свободной энергией или свободной энтальпией.
- ^ Леманн, HP; Фуэнтес-Ардериу, X.; Бертелло, LF (1 января 1996 г.). «Глоссарий терминов в количествах и единицах клинической химии (Рекомендации IUPAC-IFCC 1996)» . Чистая и прикладная химия . 68 (4): 957–1000. дои : 10.1351/pac199668040957 . S2CID 95196393 .
- ^ Генри Маршалл Лестер (1971). Историческая основа химии . Курьерская компания. ISBN 978-0-486-61053-5 .
- ^ Химический потенциал , Золотая книга ИЮПАК.
- ^ Мюллер, Инго (2007). История термодинамики – учение об энергии и энтропии . Спрингер. ISBN 978-3-540-46226-2 .
- ^ Качальский А.; Карран, Питер Ф. (1965). Неравновесная термодинамика в биофизике . Издательство Гарвардского университета . КСН 65-22045.
- ^ Аткинс, Питер; де Паула, Хулио (2006). Физическая химия Аткинса (8-е изд.). У. Х. Фриман. п. 109. ИСБН 0-7167-8759-8 .
- ^ Jump up to: а б с Зальцман, Уильям Р. (21 августа 2001 г.). «Открытые системы» . Химическая термодинамика . Университет Аризоны . Архивировано из оригинала 7 июля 2007 г. Проверено 11 октября 2007 г.
- ^ Брахман, МК (1954). «Уровень Ферми, химический потенциал и свободная энергия Гиббса». Журнал химической физики . 22 (6): 1152. Бибкод : 1954ЖЧФ..22.1152Б . дои : 10.1063/1.1740312 .
- ^ Х.С. Харнед, Б.Б. Оуэн, Физическая химия электролитических растворов, третье издание, Reinhold Publishing Corporation, Нью-Йорк, 1958, стр. 2-6
- ^ Справочник CRC по химии и физике, 2009, стр. 5-4–5-42, 90-е изд., Lide.
- ^ Джеймс Клерк Максвелл, Элизабет Гарбер , Стивен Г. Браш и К.В. Фрэнсис Эверитт (1995), Максвелл о теплоте и статистической механике: о «избежании всех личных вопросов» о молекулах , Lehigh University Press, ISBN 0-934223-34-3 , с. 248.
Внешние ссылки
[ редактировать ]- Определение ИЮПАК (энергия Гиббса)
- Свободная энергия Гиббса – Университет штата Джорджия




























































