Фостемсавир
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Рукобия |
| Другие имена | БМС-663068, ГСК3684934 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а620046 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
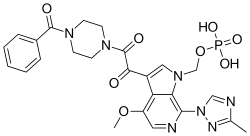
| Формула | С 25 Ч 26 Н 7 О 8 П |
| Молярная масса | 583.498 g·mol −1 |
| 3D model ( JSmol ) | |
Фостемсавир , продаваемый под торговой маркой Рукобия , представляет собой антиретровирусный препарат для взрослых, живущих с ВИЧ/СПИДом, которые пробовали несколько лекарств от ВИЧ и чья ВИЧ-инфекция не может быть успешно вылечена другими методами лечения из-за резистентности, непереносимости или соображений безопасности. [ 4 ] [ 7 ]
Наиболее распространенной побочной реакцией является тошнота. [ 4 ] [ 7 ] [ 8 ] Серьезные побочные реакции включали повышение уровня ферментов печени у участников, также инфицированных вирусом гепатита B или C, а также изменения в иммунной системе (синдром восстановления иммунитета). [ 7 ]
Фостемсавир является ВИЧ ингибитором проникновения и пролекарством темсавира (BMS-626529). [ 9 ] Фостемсавир представляет собой ингибитор прикрепления gp120, направленный на вирус иммунодефицита человека типа 1 (ВИЧ-1). [ 10 ]
Он был одобрен для медицинского использования в США в июле 2020 года. [ 7 ] [ 8 ] [ 10 ] и в Европейском Союзе в феврале 2021 года. [ 5 ] США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) считает его первым в своем классе лекарством . [ 11 ]
Медицинское использование
[ редактировать ]Фостемсавир в сочетании с другими антиретровирусными препаратами показан для лечения инфекции ВИЧ-1 у взрослых с большим опытом лечения и ВИЧ-1 с множественной лекарственной устойчивостью, которым текущий режим антиретровирусной терапии оказался неэффективным из-за резистентности, непереносимости или соображений безопасности. [ 10 ]
Побочные эффекты
[ редактировать ]Фостемсавир может вызвать серьезное состояние, называемое синдромом восстановления иммунитета, аналогично другим одобренным препаратам для лечения инфекции ВИЧ-1. [ 8 ] Это состояние может возникнуть в начале лечения ВИЧ-1, когда иммунная система может окрепнуть и начать бороться с инфекциями, которые долгое время были скрыты в организме. [ 8 ] Другие серьезные побочные эффекты включают проблемы с сердечным ритмом из-за удлинения электрической активности сердца (удлинение интервала QT) и повышение уровня ферментов печени у пациентов с коинфекцией вируса гепатита B или C. [ 8 ]
История
[ редактировать ]Он находился в разработке ViiV Healthcare / GlaxoSmithKline для использования при лечении ВИЧ-инфекции. Когда активная форма фостемсавира связывается с gp120 белком вируса , она предотвращает первоначальное прикрепление вируса к CD4+ Т-клетке хозяина и проникновение в иммунную клетку хозяина; его метод действия является первым среди лекарств от ВИЧ. [ 12 ] Поскольку он нацелен на другой этап жизненного цикла вируса, он открывает перспективы для людей с вирусом, который приобрел высокую устойчивость к другим препаратам против ВИЧ . [ 13 ] Поскольку функция gp120, которую ингибирует этот препарат, высоко консервативна, препарат вряд ли будет способствовать развитию устойчивости к самому себе. [ 14 ] Исследователи обнаружили, что устойчивые к энфувиртиду и ибализумабу оболочки ВИЧ остаются чувствительными к фостемсавиру. И наоборот, ВИЧ, устойчивый к фостемсавиру, оставался чувствительным ко всем ингибиторам проникновения. Более того, изоляты ВИЧ, которым не требуется рецептор CD4 для проникновения в клетку, также были чувствительны к фостемсавиру, и вирус не избежал ингибитора прикрепления, став CD4-независимым. Предыдущие исследования in vitro показали, что фостемсавир ингибирует как CCR5 -тропный, так и CXCR4 -тропный ВИЧ. [ 12 ]

Фостемсавир был одобрен для медицинского применения в США в июле 2020 года. [ 7 ] [ 8 ] [ 10 ]
Безопасность и эффективность фостемсавира, принимаемого перорально два раза в день, оценивались в клиническом исследовании с участием 371 взрослого участника с большим опытом лечения, у которых продолжали сохраняться высокие уровни вируса (РНК ВИЧ) в крови, несмотря на прием антиретровирусных препаратов. [ 7 ] Двести семьдесят два участника получали лечение в основной группе исследования, а еще 99 участников получали фостемсавир в другой группе исследования. [ 7 ] [ 8 ] Большинство участников лечились от ВИЧ более 15 лет (71 процент), подвергались пяти или более различным схемам лечения ВИЧ до включения в исследование (85 процентов) и/или имели историю СПИДа (86 процентов). [ 7 ] Участники основной группы исследования получали либо фостемсавир, либо плацебо два раза в день в течение восьми дней в дополнение к неэффективному антиретровирусному режиму. [ 7 ] [ 8 ] На восьмой день у участников, принимавших фостемсавир, наблюдалось значительно большее снижение уровня РНК ВИЧ в крови по сравнению с теми, кто принимал плацебо. [ 7 ] После восьмого дня все участники получали фостемсавир вместе с другими антиретровирусными препаратами. [ 7 ] [ 8 ] После 24 недель приема фостемсавира и других антиретровирусных препаратов 53 процента участников достигли подавления РНК ВИЧ, при этом уровни ВИЧ были достаточно низкими, чтобы считаться неопределяемыми. [ 7 ] Через 96 недель у 60 процентов участников продолжалось подавление РНК ВИЧ. [ 7 ]
Клиническое исследование (NCT02362503) проводилось в 108 центрах в 23 странах Северной Америки, Южной Америки, Европы, Австралии, Тайваня и Южной Африки. [ 8 ]
США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) удовлетворило заявку на ускоренное рассмотрение , приоритетное рассмотрение и статус революционной терапии для фостемсавира . [ 7 ] FDA предоставило ViiV Healthcare одобрение препарата Рукобия. [ 7 ]
10 декабря 2020 года Комитет по лекарственным средствам для применения человеком (CHMP) Европейского агентства по лекарственным средствам (EMA) принял положительное заключение, рекомендуя выдать регистрационное удостоверение на лекарственный препарат Рукобия, предназначенный для лечения множественной лекарственной терапии. устойчивая инфекция ВИЧ-1. [ 15 ] Заявителем этого лекарственного препарата является компания ViiV Healthcare BV. Фостемсавир был одобрен для медицинского применения в Европейском Союзе в феврале 2021 года. [ 5 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б «Рукобия» . Управление терапевтических товаров (TGA) . 23 июля 2021 г. Проверено 5 сентября 2021 г.
- ^ «Уведомление: многочисленные дополнения к списку рецептурных препаратов (PDL) [24 января 2022 г.]» . Здоровье Канады . 24 января 2022 г. Проверено 28 мая 2022 г.
- ^ «Краткая основа решения (SBD) для Рукобии» . Здоровье Канады . 23 октября 2014 года . Проверено 29 мая 2022 г.
- ^ Jump up to: а б с «Рукобия-фостемсавир трометамин таблетка, покрытая пленочной оболочкой, пролонгированного действия» . ДейлиМед . 2 июля 2020 г. Проверено 14 июля 2020 г.
- ^ Jump up to: а б с «Рукобия ЭПАР» . Европейское агентство лекарственных средств (EMA) . 9 декабря 2020 г. Проверено 12 февраля 2021 г.
- ^ «Информация о продукте Рукобия» . Союзный реестр лекарственных средств . Проверено 3 марта 2023 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот «FDA одобрило новое лечение ВИЧ для пациентов с ограниченными возможностями лечения» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 2 июля 2020 г. Проверено 2 июля 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с д и ж г час я дж «Снимки испытаний наркотиков: Рукобия» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 2 июля 2020 г. Проверено 14 июля 2020 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Лай Ю.Т., Ван Т., О'Делл С., Лаудер М.К., Шон А., Чунг К.С. и др. (январь 2019 г.). «Решётчатая инженерия позволяет определить молекулярные особенности, позволяющие эффективно ингибировать проникновение малых молекул ВИЧ-1» . Природные коммуникации . 10 (1): 47. Бибкод : 2019NatCo..10...47L . дои : 10.1038/s41467-018-07851-1 . ПМК 6318274 . ПМИД 30604750 .
- ^ Jump up to: а б с д «ViiV Healthcare объявляет об одобрении FDA США препарата Рукобия (фостемсавир), первого в своем классе средства для лечения ВИЧ у взрослых с ограниченным количеством доступных вариантов лечения» (пресс-релиз). ViiV Healthcare. 2 июля 2020 г. Проверено 2 июля 2020 г. - через Business Wire.
- ^ «Новые разрешения на лекарственную терапию 2020» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 31 декабря 2020 г. Проверено 17 января 2021 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б Хайлиман Л. (4 сентября 2012 г.). «Ингибитор прикрепления ВИЧ BMS-663068 выглядит хорошо в ранних исследованиях» . ВИЧandHepatitis.com . Архивировано из оригинала 2 июня 2021 года . Проверено 28 мая 2014 г.
- ^ Хайлиман Л. (6 марта 2014 г.). «Ингибитор прикрепления ВИЧ BMS-663068 демонстрирует хорошую безопасность и эффективность в исследовании фазы 2b» . Карта СПИДа . НАМ.
- ^ Ли З, Чжоу Н, Сунь Ю, Рэй Н, Латайлад М, Ханна Г.Дж., Кристал М. (сентябрь 2013 г.). «Активность ингибитора прикрепления ВИЧ-1 BMS-626529, активного компонента пролекарства BMS-663068, против CD4-независимых вирусов и оболочек ВИЧ-1, устойчивых к другим ингибиторам проникновения» . Антимикробные средства и химиотерапия . 57 (9): 4172–80. дои : 10.1128/AAC.00513-13 . ПМЦ 3754311 . ПМИД 23774428 .
- ^ «Рукобия: Ожидается решение ЕС» . Европейское агентство лекарственных средств (EMA) . 11 декабря 2020 года. Архивировано из оригинала 12 декабря 2020 года . Проверено 11 декабря 2020 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
Дальнейшее чтение
[ редактировать ]- Козал М., Аберг Дж., Пиалу Дж., Кан П., Томпсон М., Молина Дж.М. и др. (март 2020 г.). «Фостемсавир у взрослых с множественной лекарственной устойчивостью ВИЧ-1» . Медицинский журнал Новой Англии . 382 (13): 1232–1243. дои : 10.1056/NEJMoa1902493 . ПМИД 32212519 .
Внешние ссылки
[ редактировать ]- Номер клинического исследования NCT02362503 «Сравнение ингибиторов прикрепления у пациентов, прошедших интенсивное лечение» на сайте ClinicalTrials.gov.