Дрозофила меланогастер
| Дрозофила меланогастер | |
|---|---|

| |
| Плодовая мушка, питающаяся бананом | |
| Научная классификация | |
| Домен: | Эукариоты |
| Королевство: | животное |
| Тип: | Членистоногие |
| Сорт: | Насекомое |
| Заказ: | двукрылые |
| Семья: | Дрозофилиды |
| Род: | Дрозофила |
| Подрод: | Софофора |
| Видовая группа : | меланогастр |
| Видовая подгруппа : | меланогастр |
| Видовой комплекс : | меланогастр |
| Разновидность: | Д. меланогастер
|
| Биномиальное имя | |
| Дрозофила меланогастер | |
| Синонимы [2] | |
|
Список | |


Drosophila melanogaster — вид мух ( насекомое отряда двукрылых ) семейства Drosophilaidae . Этот вид часто называют плодовой мухой или малой плодовой мухой , реже — « уксусной мухой», « выжимочной мухой». [а] [5] или « банановая муха». [6] В дикой природе D. melanogaster привлекают гниющие фрукты и бродящие напитки, их часто можно встретить в садах, на кухнях и пабах.
Начиная с предложения Чарльза В. Вудворта в 1901 году об использовании этого вида в качестве модельного организма , [7] [8] D. melanogaster продолжает широко использоваться для биологических исследований в области генетики , физиологии , микробного патогенеза и эволюции жизненного цикла . По состоянию на 2017 год шесть Нобелевских премий были присуждены дрозофилистам за работу по использованию этого насекомого. [9] [10]
Drosophila melanogaster обычно используется в исследованиях из-за ее быстрого жизненного цикла, относительно простой генетики (всего четыре пары хромосом ) и большого количества потомков на поколение. [11] Первоначально это был африканский вид, причем все неафриканские линии имели общее происхождение. [12] Его географический ареал включает все континенты, включая острова. [13] D. melanogaster — распространенный вредитель в домах, ресторанах и других местах, где подают еду. [14]
Мух, принадлежащих к семейству Tephritidae, еще называют «дрозофилами». Это может вызвать путаницу, особенно в странах Средиземноморья, Австралии и Южной Африки , где средиземноморская плодовая мушка Ceratitis capitata является экономическим вредителем.
Этимология
[ редактировать ]Термин « дрозофила », означающий «любящий росу», представляет собой современную научную латинскую адаптацию греческих слов δρόσος , drósos , « роса », и φιλία , philia , «любовник». Термин « меланогастер », означающий «чернобрюх», происходит от древнегреческого μέλας , mélas , «черный», и γᾰστήρ , gastḗr , «живот».
Внешний вид
[ редактировать ]
Плодовые мушки дикого типа желто-коричневые, с кирпично-красными глазами и поперечными черными кольцами на брюшке. Черные части брюшка послужили источником названия вида ( melanogaster = «чернобрюхий» ). Кирпично-красный цвет глаз мухи дикого типа обусловлен двумя пигментами: [15] ксантомматин коричневого цвета, полученный из триптофана , и дрозоптерины красного цвета, полученные из гуанозинтрифосфата . [15] Они проявляют половой диморфизм ; самки имеют длину около 2,5 мм (0,10 дюйма); самцы немного меньше, с более темной спиной. Самцов легко отличить от самок по цветовым различиям, по отчетливому черному пятну на брюшке, менее заметному у недавно вылупившихся мух, и по половым гребням (ряду темных щетинок на лапке первой ноги). Кроме того, у самцов есть пучок колючих волосков (застежек), окружающих воспроизводящие части, которые используются для прикрепления к самке во время спаривания. Обширные изображения можно найти на сайте FlyBase . [16]
Drosophila melanogaster можно отличить от родственных видов по следующему сочетанию признаков: щеки ~1/10 диаметра глаза на наибольшей вертикальной высоте; крыло прозрачное, с реберным индексом 2,4; передне предплюсна самца с одним рядом из ~12 щетинок, образующих половой гребешок; задняя лопасть эпандрия самца маленькая и почти треугольная; брюшка самки 6-й тергит с темной полосой, доходящей до его вентрального края; самки яйцеклетка маленькая, светлая, без дорсодистального вдавления и с 12-13 колышковыми наружными овисенсиллами. [17] [18]
Мухи Drosophila melanogaster могут чувствовать воздушные потоки волосками на спине. Их глаза чувствительны к небольшим различиям в интенсивности света и инстинктивно улетают при обнаружении тени или другого движения. [19]
Жизненный цикл и воспроизводство
[ редактировать ]
В оптимальных условиях роста при температуре 25 ° C (77 ° F) продолжительность жизни D. melanogaster от яйца до гибели составляет около 50 дней. [20] Период развития D. melanogaster зависит от температуры, как и у многих экзотермных видов. Кратчайшее время развития (от яйца до взрослой особи), 7 дней, достигается при температуре 28 °C (82 °F). [21] [22] Время проявления увеличивается при более высоких температурах (11 дней при 30 °C или 86 °F) из-за теплового стресса. В идеальных условиях время развития при 25 °C (77 °F) составляет 8,5 дней. [21] [22] [23] при 18 °C (64 °F) это занимает 19 дней. [21] [22] а при 12 ° C (54 ° F) это занимает более 50 дней. [21] [22] В условиях скученности время разработки увеличивается, [24] в то время как появившиеся мухи меньше. [24] [25] Самки откладывают около 400 яиц (эмбрионов), по пять за раз, в гниющие фрукты или другой подходящий материал, например, гниющие грибы и сокосодержащие потоки . Drosophila melanogaster — насекомое с голометаболическим метаболизмом , поэтому оно подвергается полному метаморфозу. Их жизненный цикл разбит на 4 стадии: эмбрион, личинка, куколка, взрослая особь. [26] Яйца длиной около 0,5 мм вылупляются через 12–15 часов (при 25 ° C или 77 ° F). [21] [22] Полученные личинки растут около 4 дней (при 25 ° C), дважды линяя (на личинок второго и третьего возрастов), примерно через 24 и 48 часов после вылупления. [21] [22] В это время они питаются микроорганизмами , разлагающими плоды, а также сахаром самого плода. Мать помещает фекалии в яйцевые мешочки, чтобы установить в кишечнике личинок тот же микробный состав, который положительно подействовал на нее. [27] Затем личинки инкапсулируются в куколке и подвергаются четырехдневному метаморфозу (при 25 °С), после чего имаго закрываются (выходят наружу). [21] [22]
Drosophila melanogaster, широко известная как плодовая мушка, является важным модельным организмом в исследованиях эмбрионального развития. Многие из его генов, регулирующих эмбриональное развитие, и механизмы их действия сыграли решающую роль в понимании фундаментальных принципов регуляции эмбрионального развития у многих многоклеточных организмов, включая человека. Вот некоторые важные гены, регулирующие эмбриональное развитие Drosophila melanogaster, и способы их действия:
Материнские гены: Эти гены закодированы у самок плодовой мухи и присутствуют на ранних стадиях развития эмбриона. Они определяют основные особенности эмбриона и раннее развитие. Например, ген Bicoid регулирует формирование переднего конца эмбриона, а его отсутствие приводит к отсутствию головы у эмбриона.
Зиготические гены: эти гены активируются на более поздних стадиях развития эмбриона, когда эмбрион плодовой мухи начинает производить свои собственные генетические продукты. Например, ген горбуна регулирует формирование сегментов у эмбриона.
Гомеозисные гены: это семейство генов регулирует сегментацию и формирование осевого паттерна в процессе развития. Они действуют как регуляторные факторы, определяющие судьбу клеток в эмбриональном развитии. Например, ген Antennapedia регулирует формирование передних конечностей у эмбриона.
Морфогены: это молекулы, которые образуют градиенты эмбрионального развития и регулируют судьбу клеток в зависимости от их положения в градиенте. Например, морфоген Hedgehog регулирует дифференцировку сегментов и идентичность сегментов у эмбрионов плодовых мух.
Эти гены и способы их действия образуют сложную регуляторную сеть, которая управляет эмбриональным развитием Drosophila melanogaster. Они влияют на дифференцировку клеток, формирование сегментов и формирование осевого рисунка у эмбриона, что в конечном итоге приводит к развитию полностью сформированной взрослой плодовой мухи.
Самцы демонстрируют последовательность из пяти поведенческих моделей, чтобы ухаживать за самками. Во-первых, во время исполнения брачной песни самцы ориентируются, горизонтально вытягивая и вибрируя крыльями. Вскоре после этого самец занимает низкую позу в задней части живота самки, чтобы постукивать и лизать женские гениталии. Наконец, самец скручивает живот и пытается совокупиться. Самки могут отвергать самцов, отходя, пиная и выдавливая яйцеклад. [28] Копуляция длится около 15–20 минут. [29] несколько сотен очень длинных (1,76 мм) сперматозоидов в семенной жидкости. во время которого самцы передают самке [30] Самки хранят сперму в трубчатом сосуде и в двух грибовидных сперматеках ; сперматозоиды от нескольких спариваний конкурируют за оплодотворение. Считается, что существует последний мужской приоритет; последний самец, спаривающийся с самкой, дает около 80% ее потомства. Было обнаружено, что этот приоритет возникает как в результате перемещения, так и в результате потери трудоспособности. [31] Смещение объясняется обращением со спермой самкой мухи во время многократного спаривания и наиболее значительным в течение первых 1–2 дней после совокупления. Смещение из семеприемника более значимо, чем смещение из сперматек. [31] Выведение из строя первого мужского спермия вторым мужским сперматозоидом становится значительным через 2–7 дней после совокупления. Считается, что за этот механизм выведения из строя (без удаления спермы первого самца) ответственна семенная жидкость второго самца, который вступает в силу до того, как происходит оплодотворение . [31] Считается, что задержка в эффективности механизма выведения из строя является защитным механизмом, который не позволяет самцу мухи вывести из строя свою собственную сперму, если он неоднократно спаривается с одной и той же самкой мухи. Сенсорные нейроны в матке самки D. melanogaster реагируют на мужской белок, половой пептид , который содержится в сперме. [32] Этот белок заставляет самку неохотно совокупляться в течение примерно 10 дней после оплодотворения . Определен сигнальный путь, приводящий к такому изменению поведения. Сигнал отправляется в область мозга, которая является гомологом гипоталамуса , а затем гипоталамус контролирует сексуальное поведение и желание. [32] Гонадотропные гормоны у дрозофилы поддерживают гомеостаз и управляют репродуктивной деятельностью посредством циклических взаимосвязей, мало чем отличающихся от эстрального цикла млекопитающих . [33] Половой пептид нарушает этот гомеостаз и резко меняет эндокринное состояние женщины, индуцируя синтез ювенильных гормонов в аллатуме тела. [34]
D. melanogaster часто используется для исследований по продлению жизни , например, для идентификации генов, которые предположительно увеличивают продолжительность жизни при мутации . [35] D. melanogaster также используется в исследованиях старения . Синдром Вернера – это состояние человека, характеризующееся ускоренным старением. Это вызвано мутациями в гене WRN , который кодирует белок, играющий важную роль в восстановлении повреждений ДНК. Мутации в D. melanogaster гомологе WRN также вызывают усиление физиологических признаков старения, таких как короткая продолжительность жизни, более высокая заболеваемость опухолями, дегенерация мышц, снижение способности к лазанию, изменение поведения и снижение двигательной активности. [36]
Мейоз
[ редактировать ]Мейотическая рекомбинация у D. melanogaster, по-видимому, используется для восстановления повреждений ДНК зародышевой линии, о чем свидетельствуют данные о том, что мейотическая рекомбинация индуцируется агентами, повреждающими ДНК, ультрафиолетовым светом. [37] и митомицин С. [38]
Женщины
[ редактировать ]
Самки становятся восприимчивыми к ухаживающим самцам примерно через 8–12 часов после вылета. [39] определенные группы нейронов Было обнаружено, что у самок влияют на поведение копуляции и выбор партнера. Одна из таких групп брюшного нервного канатика позволяет самке мухи приостанавливать движения тела для совокупления. [32] Активация этих нейронов побуждает самку прекратить движение и ориентироваться на самца, чтобы можно было сесть на него. Если группа инактивирована, самка продолжает двигаться и не совокупляется. Различные химические сигналы, такие как мужские феромоны , часто способны активировать группу. [32]
Кроме того, самки демонстрируют копирование выбора партнера . Когда девственным самкам показывают, как другие самки совокупляются с самцами определенного типа, они, как правило, впоследствии чаще совокупляются с самцами этого типа, чем наивные самки (которые не наблюдали совокупления других). Такое поведение чувствительно к условиям окружающей среды, и самки меньше совокупляются в плохих погодных условиях. [40]
Мужчины
[ редактировать ]Этот раздел нуждается в дополнительных цитатах для проверки . ( Октябрь 2015 г. ) |
Самцы D. melanogaster демонстрируют сильную кривую репродуктивного обучения. То есть, приобретая сексуальный опыт, эти мухи имеют тенденцию изменять свое будущее брачное поведение разными способами. Эти изменения включают повышенную избирательность ухаживания только внутри вида, а также сокращение времени ухаживания .
Известно, что сексуально наивные самцы D. melanogaster тратят значительное время на межвидовые ухаживания, например, за D. simulans мухами . Наивный D. melanogaster также будет пытаться ухаживать за еще не половозрелыми самками и другими самцами. Самцы D. melanogaster практически не отдают предпочтение самкам D. melanogaster перед самками других видов или даже другими самцами мух. Однако после того, как D. simulans или другие мухи, неспособные к совокуплению, отвергли ухаживания самцов, самцы D. melanogaster с гораздо меньшей вероятностью будут тратить время на неспецифические ухаживания в будущем. Эта очевидная приобретенная модификация поведения кажется эволюционно значимой, поскольку позволяет самцам избегать траты энергии на бесполезные сексуальные контакты. [41]
Кроме того, самцы с предыдущим сексуальным опытом меняют свой танец ухаживания при попытке спариваться с новыми самками: опытные самцы тратят меньше времени на ухаживание, поэтому у них более низкие задержки спаривания, а это означает, что они могут размножаться быстрее. Эта уменьшенная задержка спаривания приводит к большей эффективности спаривания для опытных самцов по сравнению с наивными самцами. [42] Эта модификация также имеет очевидные эволюционные преимущества, поскольку повышенная эффективность спаривания чрезвычайно важна с точки зрения естественного отбора .
Полигамия
[ редактировать ]И самцы, и самки мух D. melanogaster ведут себя полигамно (имеют одновременно несколько половых партнеров). [43] Как у самцов, так и у самок полигамия приводит к снижению вечерней активности по сравнению с девственными мухами, причем в большей степени у самцов, чем у самок. [43] Вечерняя деятельность состоит из тех, в которых мухи участвуют помимо спаривания и поиска партнеров, например, в поиске пищи. [44] Репродуктивный успех самцов и самок различается, поскольку самке нужно спариться только один раз, чтобы достичь максимальной плодовитости. [44] Спаривание с несколькими партнерами не дает преимуществ перед спариванием с одним партнером, поэтому у самок нет разницы в вечерней активности между полигамными и моногамными особями. [44] Однако для самцов спаривание с несколькими партнерами увеличивает их репродуктивный успех за счет увеличения генетического разнообразия их потомства. [44] Это преимущество генетического разнообразия является эволюционным преимуществом, поскольку оно увеличивает вероятность того, что у некоторых потомков будут черты, которые улучшат их приспособленность к окружающей среде.
Разницу в вечерней активности полигамных и моногамных самцов можно объяснить ухаживанием. Репродуктивный успех полигамных мух увеличивается за счет рождения потомства от нескольких партнеров, и поэтому они тратят больше времени и энергии на ухаживание за несколькими самками. [44] С другой стороны, моногамные мухи ухаживают только за одной самкой и затрачивают на это меньше энергии. [44] Хотя самцам мух требуется больше энергии, чтобы ухаживать за несколькими самками, общие репродуктивные преимущества, которые это дает, позволяют полигамии оставаться предпочтительным сексуальным выбором. [44]
Механизм влияния на ухаживающее поведение у дрозофилы контролируется осцилляторными нейронами DN1s и LNDs. [45] Было обнаружено, что на колебания нейронов DN1 влияют социально-сексуальные взаимодействия и связано со снижением вечерней активности, связанным со спариванием. [45]
Модельный организм в генетике
[ редактировать ]D. melanogaster остается одним из наиболее изученных организмов в биологических исследованиях, особенно в генетике и биологии развития. Он также используется в исследованиях мутагенеза окружающей среды.
История использования в генетическом анализе
[ редактировать ]
D. melanogaster был одним из первых организмов, использованных для генетического анализа , и сегодня он является одним из наиболее широко используемых и генетически наиболее известных из всех эукариотических организмов. Все организмы используют общие генетические системы; следовательно, понимание таких процессов, как транскрипция и репликация у плодовых мух, помогает понять эти процессы у других эукариот, включая человека . [46]
Томас Хант Морган начал использовать плодовых мушек в экспериментальных исследованиях наследственности в Колумбийском университете в 1910 году в лаборатории, известной как «Комната мух». Летная комната была тесной и состояла из восьми столов, каждый из которых был занят студентами и их экспериментами. Они начали эксперименты с использованием молочных бутылок для выращивания плодовых мух и портативных объективов для наблюдения за их особенностями. Позже линзы были заменены микроскопами, что улучшило их наблюдения. Морган и его ученики в конечном итоге разъяснили многие основные принципы наследственности, включая наследование, сцепленное с полом, эпистаз , множественные аллели и картирование генов . [46]
D. melanogaster исторически использовался в лабораториях для изучения генетики и особенностей наследования. Тем не менее, D. melanogaster также играет важную роль в исследованиях мутагенеза окружающей среды, что позволяет исследователям изучать воздействие конкретных мутагенов окружающей среды. [47]
Причины использования в лабораториях
[ редактировать ]
Есть много причин, по которым плодовая мушка является популярным выбором в качестве модельного организма:
- Ее уход и культура требуют мало оборудования, места и затрат даже при использовании крупных культур.
- Его можно безопасно и легко анестезировать (обычно эфиром , углекислым газом, охлаждением или такими продуктами, как FlyNap ).
- Его морфологию легко идентифицировать после наркоза.
- Он имеет короткое время генерации (около 10 дней при комнатной температуре), поэтому несколько поколений можно изучить в течение нескольких недель.
- Имеет высокую плодовитость (самки откладывают до 100 яиц в день, а за жизнь - возможно 2000). [11]
- Самцов и самок легко отличить, а девственных самок можно легко идентифицировать по светлому полупрозрачному брюшку, что облегчает генетическое скрещивание.
- У зрелой личинки в слюнных железах имеются гигантские хромосомы, называемые политенными хромосомами , «затяжками», которые указывают на области транскрипции и, следовательно, активности генов. Происходит недостаточная репликация рДНК, в результате чего образуется только 20% ДНК по сравнению с мозгом. По сравнению с 47% меньше рДНК в яичниках Sarcophaga barbata .
- У него всего четыре пары хромосом – три аутосомы и одна пара половых хромосом .
- У самцов не наблюдается мейотической рекомбинации , что облегчает генетические исследования.
- Рецессивные летальные « балансирующие хромосомы », несущие видимые генетические маркеры, могут использоваться для сохранения запасов летальных аллелей в гетерозиготном состоянии без рекомбинации из-за множественных инверсий балансера.
- Развитие этого организма – от оплодотворенной яйцеклетки до зрелой взрослой особи – хорошо изучено.
- Методы генетической трансформации доступны с 1987 года. Один из подходов к вставке чужеродных генов в геном дрозофилы включает P-элементы. Мобильные P-элементы, также известные как транспозоны , представляют собой сегменты бактериальной ДНК, которые переносятся в геном мухи. Трансгенные мухи уже внесли вклад во многие научные достижения, например, в моделирование таких заболеваний человека, как болезнь Паркинсона , неоплазия , ожирение и диабет .
- Его полный геном был секвенирован и впервые опубликован в 2000 году. [48]
- Можно легко создать половую мозаику, что станет дополнительным инструментом для изучения развития и поведения этих мух. [49]
Генетические маркеры
[ редактировать ]
Генетические маркеры обычно используются в исследованиях дрозофилы , например, в балансирующих хромосомах или вставках P-элементов, и большинство фенотипов легко идентифицировать невооруженным глазом или под микроскопом. В приведенном ниже списке нескольких распространенных маркеров за символом аллеля следует название затронутого гена и описание его фенотипа. (Примечание: рецессивные аллели пишутся строчными буквами, а доминантные — с заглавной буквы.)
- Сай 1 : Кудрявый; крылья отклоняются от тела, полет может быть несколько затруднен
- и 1 : Черное дерево; черное тело и крылья (гетерозиготы также заметно темнее дикого типа)
- Сб 1 : Щетина; щетина короче и толще, чем у дикого типа.
- В 1 : Белый ; глаза лишены пигментации и кажутся белыми.
- чб: Коричневый; цвет глаз определяется сочетанием различных пигментов.
- и 1 : Желтый; пигментация тела и крылья кажутся желтыми, аналог альбинизма у мух.
Классические генетические мутации
[ редактировать ]Гены дрозофилы традиционно называются в честь фенотипа , который они вызывают при мутации. Например, отсутствие определенного гена у дрозофилы приведет к появлению мутантного эмбриона, у которого не разовьется сердце. Ученые назвали этот ген жестянщиком в честь страны Оз одноименного персонажа из . [51] Аналогичным образом изменения в гене Shavenbaby вызывают потерю дорсальных волосков кутикулы у личинок Drosophila sechellia . [52] Эта система номенклатуры приводит к более широкому диапазону названий генов, чем у других организмов.
- b: черный — Черная мутация была открыта в 1910 году Томасом Хантом Морганом . [53] Черная мутация приводит к более темному цвету тела, крыльев, жилок и сегментов ножки плодовой мухи. [54] Это происходит из-за неспособности мухи вырабатывать бета-аланин , бета-аминокислоту. [53] Фенотипическое выражение этой мутации варьируется в зависимости от генотипа человека; например, независимо от того, является ли образец гомозиготным или гетерозиготным, он становится более темным или менее темным. [54] Эта генетическая мутация является рецессивной, сцепленной с Х-хромосомой . [55]
- bw: коричневый . Мутация карих глаз возникает в результате неспособности производить или синтезировать птеридиновые (красные) пигменты из-за точечной мутации на хромосоме II. [56] Когда мутация является гомозиготной, птеридиновые пигменты не могут синтезироваться, поскольку в начале пути птеридина дефектный фермент кодируется гомозиготными рецессивными генами. [57] [ ненадежный источник? ] В целом мутации птеридинового пути приводят к более темному цвету глаз, следовательно, цвет биохимического дефекта птеридинового пути становится коричневым.
- m: миниатюра . Одна из первых записей о миниатюрной мутации крыльев была также сделана Томасом Хантом Морганом в 1911 году. Он описал крылья как имеющие форму, аналогичную фенотипу дикого типа. Однако их миниатюрное обозначение относится к длине их крыльев, которые не выходят за пределы тела и, таким образом, значительно короче длины дикого типа. Он также отметил, что его наследование связано с полом мухи и может сочетаться с наследованием других признаков, определяемых полом, таких как белые глаза. [58] Крылья могут также демонстрировать другие характеристики, отличающиеся от крыльев дикого типа, такие как более тусклый и облачный цвет. [59] Миниатюрные крылья в 1,5 раза короче, чем у дикого типа, но, как полагают, содержат такое же количество клеток. Это связано с отсутствием полного уплощения этих клеток, из-за чего общая структура крыла по сравнению с ним кажется короче. Путь расширения крыльев регулируется сигнально-рецепторным путем, где нейрогормон бурсикон взаимодействует с комплементарным ему рецептором, связанным с G-белком; этот рецептор заставляет одну из субъединиц G-белка сигнализировать о дальнейшей активности фермента и приводит к развитию крыла, такому как апоптоз и рост. [60]
- se: сепия — цвет глаз мутанта сепии — сепия , красновато-коричневый цвет. У мух дикого типа оммохромы (коричневые) и дрозоптерины (красные) придают глазам типичный красный цвет. [61] [62] Дрозоптерины синтезируются посредством пиримидодиазепинсинтазы . [63] который кодируется хромосомой 3L. Этот ген имеет преждевременный стоп-кодон у сепических мух, поэтому мухи не могут производить пиримидодиазепинсинтазу и, следовательно, не имеют красного пигмента, так что глаза остаются сепическими. [61] сепии Аллель является рецессивным , поэтому потомство мух-сепий и гомозиготных мух дикого типа имеет красные глаза. сепии Фенотип не зависит от пола мухи. [64]
- v: киноварь . Мутанты киновари не могут производить коричневые оммохромы, оставляя красные дрозоптерины, поэтому глаза имеют ярко-красный дикого типа цвет (сияющий красный) по сравнению с D. melanogaster . Мутация вермилиона сцеплена с полом и рецессивна. Ген, вызывающий дефект, находится в Х-хромосоме. [65] Коричневые оммохромы синтезируются из кинуренина, который производится из триптофана. Мухи-кинери не могут превращать триптофан в кинуренин и, следовательно, не могут производить оммохромы. [65] Мутанты Vermilion живут дольше, чем мухи дикого типа. Такая более продолжительная продолжительность жизни может быть связана с уменьшением количества триптофана, превращающегося в кинуренин у киноварных мух. [66]

- vg: рудиментарный — спонтанная мутация, открытая в 1919 году Томасом Морганом и Кэлвином Бриджесом. Рудиментарные крылья – это те, которые не полностью развиты и потеряли функцию. С момента открытия рудиментарного гена у Drosophila melanogaster было сделано множество открытий рудиментарного гена у других позвоночных и их функций внутри позвоночных. [67] Рудиментарный ген считается одним из наиболее важных генов формирования крыльев, но когда он становится более выраженным, начинают формироваться эктопические крылья. [68] Рудиментарный ген регулирует экспрессию имагинальных дисков крыльев у эмбриона и вместе с другими генами регулирует развитие крыльев. Мутировавший рудиментарный аллель удаляет важную последовательность ДНК, необходимую для правильного развития крыльев. [69]
- w: белый — дикий тип Drosophila melanogaster обычно имеет кирпично-красный цвет глаз. Мутация белого глаза у плодовых мух вызвана отсутствием двух пигментов, связанных с красным и коричневым цветом глаз; перидины (красные) и оммохромы (коричневые). [62] В январе 1910 года Томас Хант Морган впервые обнаружил ген белого цвета и обозначил его как w . Открытие Морганом мутации белого глаза положило начало генетическим экспериментам и анализу Drosophila melanogaster. В конце концов Хант обнаружил, что этот ген наследуется по аналогичной схеме, связанной с мейотической сегрегацией Х-хромосомы. Он обнаружил, что ген с этой информацией расположен на Х-хромосоме. Это привело к открытию генов, сцепленных с полом, а также к открытию других мутаций у Drosophila melanogaster. [70] Мутация белоглазки приводит к ряду недостатков у мух, таких как снижение способности к лазанию, сокращение продолжительности жизни и снижение устойчивости к стрессу по сравнению с мухами дикого типа. [71] У дрозофилы melanogaster есть ряд способов спаривания, которые позволяют им совокупляться в определенной среде и, следовательно, способствуют их приспособленности. После открытия Морганом связи мутации белых глаз с полом исследование, проведенное Стертевантом (1915), пришло к выводу, что белоглазые самцы менее успешны, чем самцы дикого типа, с точки зрения спаривания с самками. [72] Было обнаружено, что чем больше плотность пигментации глаз, тем больший успех в спаривании у самцов Dr osophila melanogaster. [72]
- y: желтый . Ген желтого цвета представляет собой генетическую мутацию , известную как Dmel\y в широко используемой базе данных FlyBase . Эту мутацию легко определить по атипичному желтому пигменту, наблюдаемому в кутикуле взрослых мух и ротовых частях личинки. [73] Мутация y включает следующие фенотипические классы: мутанты, которые демонстрируют полную потерю пигментации кутикулы (y-тип), и другие мутанты, которые демонстрируют мозаичный рисунок пигмента в некоторых областях кутикулы (дикий тип, y2-тип). [74] Роль желтого гена разнообразна и отвечает за изменения в поведении , половое репродуктивное созревание и эпигенетическое перепрограммирование. [75] Ген y — идеальный ген для изучения, поскольку сразу видно, когда в организме есть этот ген, что облегчает понимание передачи ДНК потомству. [75]

Геном
[ редактировать ] Хромосомы D. melanogaster в масштабе с использованием ссылок на пары мегаоснований, ориентированных, как в базе данных Национального центра биотехнологической информации , сантиморганные расстояния являются приблизительными и оцениваются на основе местоположения выбранных картированных локусов. | |
| NCBI Идентификатор генома | 47 |
|---|---|
| Плоидность | диплоидный |
| Количество хромосом | 8 |
| Год завершения | 2015 |
Геном . ( D. melanogaster секвенирован в 2000 году и хранится в FlyBase) базе данных [48] ) содержит четыре пары хромосом – пару X/Y и три аутосомы, обозначенные цифрами 2, 3 и 4. Четвертая хромосома относительно очень мала и поэтому ее часто игнорируют, за исключением ее важного безглазого гена. оснований . Аннотирован секвенированный геном D. melanogaster, состоящий из 139,5 миллионов пар [76] и содержит около 15 682 генов согласно версии Ensemble 73. Более 60% генома представляет собой функциональную, не кодирующую белок ДНК. [77] участвует в контроле экспрессии генов. Определение пола у дрозофилы происходит за счет соотношения X:A X-хромосом и аутосом, а не из-за присутствия Y-хромосомы, как при определении пола у человека. Хотя Y-хромосома полностью гетерохроматична , она содержит по меньшей мере 16 генов, многие из которых, как полагают, имеют мужские функции. [78]
Существует три ортолога трансферрина , каждый из которых резко отличается от ортологов, известных в моделях хордовых . [79]
Сходство с человеком
[ редактировать ]Исследование, проведенное в июне 2001 года Национальным научно-исследовательским институтом генома человека, сравнивающее геном плодовой мухи и человека, показало, что около 60% генов консервативны между этими двумя видами. [80] Около 75% известных генов болезней человека имеют узнаваемые совпадения с геномом плодовых мух. [81] и 50% последовательностей белков мух имеют гомологи млекопитающих. [ нужна ссылка ] . Доступна онлайн-база данных под названием Homophila для поиска гомологов генов заболеваний человека у мух и наоборот. [82]
Дрозофила используется в качестве генетической модели нескольких заболеваний человека, включая нейродегенеративные расстройства Паркинсона , Хантингтона , спиноцеребеллярную атаксию и болезнь Альцгеймера . [83] Муха также используется для изучения механизмов, лежащих в основе старения и окислительного стресса , иммунитета , диабета и рака , а также злоупотребления наркотиками . [84] [85] [86]
Разработка
[ редактировать ]Жизненный цикл этого насекомого имеет четыре стадии: оплодотворенное яйцо, личинка, куколка и взрослая особь. [13]
Эмбриогенез у дрозофилы широко изучен, поскольку его небольшой размер, короткое время генерации и большой размер выводка делают его идеальным для генетических исследований. Он также уникален среди модельных организмов тем, что расщепление происходит в синцитии .

Во время оогенеза цитоплазматические мостики, называемые «кольцевыми каналами», соединяют формирующийся ооцит с питающими клетками. Питательные вещества и молекулы, контролирующие развитие, перемещаются из питающих клеток в ооцит. На рисунке слева видно, что формирующийся ооцит покрыт фолликулярными опорными клетками.
После оплодотворения ооцита ранний эмбрион (или синцитиальный эмбрион ) подвергается быстрой репликации ДНК и 13 делениям ядра до тех пор, пока в неразделенной цитоплазме эмбриона не накопится от 5000 до 6000 ядер. К концу восьмого деления большая часть ядер мигрирует на поверхность, окружая желточный мешок (оставив после себя лишь несколько ядер, которые станут ядрами желтка). После 10-го деления на заднем конце зародыша образуются полюсные клетки, отделяющие зародышевую линию от синцития. Наконец, после 13-го деления клеточные мембраны медленно инвагинируют, разделяя синцитий на отдельные соматические клетки. После завершения этого процесса начинается гаструляция . [87]
Деление ядра у ранних эмбрионов дрозофилы происходит настолько быстро, что надлежащих контрольных точек не существует, поэтому при делении ДНК могут быть допущены ошибки. Чтобы обойти эту проблему, допустившие ошибку ядра отделяются от своих центросом и попадают в центр зародыша (желточный мешок), который не будет составлять часть мухи.
Генная сеть (транскрипционные и белковые взаимодействия), управляющая ранним развитием эмбриона плодовой мухи, является одной из наиболее изученных генных сетей на сегодняшний день, особенно формирование паттерна вдоль переднезадней (AP) и дорсовентральной (DV) осей (см. раздел « Морфогенез» ). [87]
Эмбрион претерпевает хорошо охарактеризованные морфогенетические движения во время гаструляции и раннего развития, включая удлинение зародышевых полосок , образование нескольких борозд, вентральную инвагинацию мезодермы , а также заднюю и переднюю инвагинацию энтодермы (кишечника), а также обширную сегментацию тела до тех пор, пока, наконец, вылупляются из окружающей кутикулы в личинку первого возраста.
Во время личиночного развития ткани, известные как имагинальные диски внутри личинки растут . Имагинальные диски развиваются и формируют большинство структур тела взрослого человека, таких как голова, ноги, крылья, грудная клетка и гениталии. Клетки имагинальных дисков откладываются во время эмбриогенеза и продолжают расти и делиться на личиночных стадиях — в отличие от большинства других клеток личинки, которые дифференцировались для выполнения специализированных функций и растут без дальнейшего клеточного деления. При метаморфозе личинка образует куколку , внутри которой ткани личинки реабсорбируются, а имагинальные ткани подвергаются обширным морфогенетическим движениям с образованием взрослых структур.
Пластичность развития
[ редактировать ]Биотические и абиотические факторы, возникающие во время развития, будут влиять на распределение ресурсов развития, что приводит к фенотипическим вариациям , также называемым пластичностью развития. [88] [89] Как и все насекомые, [89] Факторы окружающей среды могут влиять на некоторые аспекты развития Drosophila melanogaster . [90] [91] У плодовых мух, выращенных в условиях гипоксии , длина грудной клетки уменьшается, а при гипероксии образуются меньшие летательные мышцы, что указывает на негативное влияние на развитие экстремальных уровней кислорода. [92] Циркадные ритмы также подвержены пластичности развития. Условия освещенности во время развития влияют на повседневную активность Drosophila melanogaster , где мухи, выращенные в условиях постоянной темноты или света, во взрослом состоянии менее активны, чем те, которые выращены в условиях 12-часового цикла свет/темнота. [93]
Температура является одним из наиболее распространенных факторов, влияющих на развитие членистоногих . У Drosophila melanogaster пластичность развития, вызванная температурой, может быть полезной и/или вредной. [94] [95] Чаще всего более низкие температуры развития снижают скорость роста, что влияет на многие другие физиологические факторы. [96] Например, развитие при 25 °C увеличивает скорость ходьбы, широту тепловых характеристик и территориальный успех, а развитие при 18 °C увеличивает массу тела и размер крыльев, и все это связано с приспособленностью. [91] [94] Более того, развитие при определенных низких температурах дает пропорционально большие крылья, которые улучшают летные и репродуктивные характеристики при столь же низких температурах ( см. Акклиматизация ). [97]
необратимы Хотя некоторые эффекты температуры развития, такие как размер тела, у эктотермных животных , другие могут быть обратимыми. [89] [98] Когда Drosophila melanogaster развивается при низких температурах, они будут иметь большую холодоустойчивость, но если выращенных в холодных условиях мух содержать при более высоких температурах, их холодоустойчивость снижается, а жароустойчивость со временем увеличивается. [98] [99] Поскольку насекомые обычно спариваются только в определенном диапазоне температур, их устойчивость к холоду и жаре является важной чертой для максимизации репродуктивной способности. [100]
Хотя ожидается, что описанные выше черты будут проявляться одинаково у разных полов, температура развития также может оказывать влияние на пол, специфичное для взрослых особей D. melanogaster .
- Самки. На количество овариол существенно влияет температура развития D. melanogaster. [101] На размер яйца также влияет температура развития, и ситуация усугубляется, когда оба родителя развиваются при высоких температурах ( см. Материнский эффект ). [94] При стрессовых температурах эти структуры будут развиваться до меньших конечных размеров и снижать репродуктивную способность самки. [101] [94] Ранняя плодовитость (общее количество яиц, отложенных в первые 10 дней после вылупления ) максимизируется при выращивании при температуре 25 °C (по сравнению с 17 °C и 29 °C), независимо от температуры взрослых особей. [102] В широком диапазоне температур развития самки, как правило, обладают большей жароустойчивостью, чем самцы. [103]
- Самцы. Стрессовые температуры развития вызывают бесплодие самцов D. melanogaster ; хотя верхний температурный предел можно повысить, поддерживая штаммы при высоких температурах ( см. акклиматизация ). [95] Мужское бесплодие может быть обратимым, если вернуть взрослым особям оптимальную температуру после развития при стрессовых температурах. [104] Самцы мух меньше по размеру и более успешно защищают места добычи/откладки яиц, если их выращивать при температуре 25 °C по сравнению с 18 °C; таким образом, более мелкие самцы будут иметь больший успех спаривания и репродуктивную продуктивность. [91]
Определение пола
[ редактировать ]Мухи -дрозофилы имеют как X-, так и Y-хромосомы, а также аутосомы . В отличие от людей, Y-хромосома не придает мужественности; скорее, он кодирует гены, необходимые для производства спермы. Вместо этого пол определяется соотношением Х-хромосом и аутосом. [105] Более того, каждая клетка «решает», быть ли ей мужской или женской, независимо от остального организма, что приводит к периодическому появлению гинандроморфов .
| Х-хромосомы | Аутосомы | Соотношение X:A | Секс |
|---|---|---|---|
| ХХХХ | АААА | 1 | Нормальная женщина |
| ХХХ | ААА | 1 | Нормальная женщина |
| ХХ | АА | 1 | Нормальная женщина |
| XXYY | АА | 1 | Нормальная женщина |
| ХХ | АА | 1 | Нормальная женщина |
| XY | АА | 0.50 | Нормальный мужчина |
| Х | АА | 0.50 | Нормальный мужчина (стерильный) |
| ХХХ | АА | 1.50 | Метаженщина |
| ХХХХ | ААА | 1.33 | Метаженщина |
| ХХ | ААА | 0.66 | Интерсекс |
| Х | ААА | 0.33 | Метамале |
Три основных гена участвуют в определении пола дрозофилы . Они смертельны для секса , не имеют сестер и невозмутимы . Невозмутимость — это аутосомный ген, который подавляет летальность при сексе , в то время как сестричество переносится на Х-хромосоме и подавляет действие невозмутимости . Клетка AAX имеет в два раза больше невозмутимости, чем клетка без сестры , поэтому смертность от секса будет подавлена, что приведет к созданию самца. Тем не менее, клетка AAXX будет производить достаточно бессестринских клеток , чтобы подавить действие невозмутимости , что позволит летальный для секса, транскрибировать ген, и создать самку.
Позже контроль невозмутимости и сиротства исчезает, и что становится важным, так это форма гена , летального к сексу . Вторичный промотор вызывает транскрипцию как у мужчин, так и у женщин. Анализ кДНК показал , что у мужчин и женщин экспрессируются разные формы. секс-летальный агент Было показано, что влияет на сплайсинг собственной мРНК . третий экзон У мужчин включен , который кодирует стоп-кодон , что приводит к образованию усеченной формы. В женской версии наличие летального для секса экзона приводит к пропуску этого экзона; остальные семь аминокислот производятся в виде полной пептидной цепи, что опять-таки дает разницу между мужчинами и женщинами. [106]
Наличие или отсутствие функциональных белков, летальных к сексу, теперь влияет на транскрипцию другого белка, известного как двойной секс. В отсутствие летального для секса двойного пола будет удален четвертый экзон и транслироваться до экзона 6 включительно (DSX-M[ale]), в то время как в его присутствии четвертый экзон, кодирующий стоп-кодон, будет производить усеченную версию. белка (DSX-F[мужской]). DSX-F вызывает транскрипцию белков желтка 1 и 2 в соматических клетках, которые будут перекачиваться в ооцит при его производстве.
Иммунитет
[ редактировать ]Иммунную систему D. melanogaster можно разделить на два ответа: гуморальный и клеточно-опосредованный. Первый представляет собой системный ответ, опосредованный в значительной степени через пути toll и Imd , которые представляют собой параллельные системы обнаружения микробов. Другие пути, включая пути реакции на стресс JAK-STAT и P38 , передачу сигналов о питании через FOXO и передачу сигналов о гибели клеток JNK, участвуют в ключевых физиологических реакциях на инфекцию. У D. melanogaster есть орган, называемый « жировым телом », аналогичный печени человека. Жировое тело является основным секреторным органом и при инфекции вырабатывает ключевые иммунные молекулы, такие как сериновые протеазы и антимикробные пептиды (АМП). АМФ секретируются в гемолимфу и связывают инфекционные бактерии и грибы, убивая их, образуя поры в клеточных стенках или ингибируя внутриклеточные процессы. Вместо этого клеточный иммунный ответ относится к непосредственной активности клеток крови (гемоцитов) у дрозофилы , которые аналогичны моноцитам/макрофагам млекопитающих. Гемоциты также играют важную роль в обеспечении гуморальных иммунных реакций, таких как реакция меланизации . [107]
Иммунный ответ на инфекцию может включать до 2423 генов, или 13,7% генома. Хотя транскрипционная реакция мухи на микробное воздействие очень специфична для отдельных патогенов, дрозофила по-разному экспрессирует основную группу из 252 генов при заражении большинством бактерий. Эта основная группа генов связана с такими категориями онтологии генов, как антимикробная реакция, реакция на стресс, секреция, нейроноподобность, репродукция и метаболизм, среди других. [108] [109] Дрозофила также обладает несколькими иммунными механизмами, позволяющими формировать микробиоту и предотвращать чрезмерные иммунные реакции при обнаружении микробных раздражителей. Например, секретируемые PGRP с амидазной активностью удаляют и разрушают иммуностимулирующий PGN DAP-типа, чтобы блокировать активацию Imd. [110]
В отличие от млекопитающих, дрозофилы обладают врожденным иммунитетом , но лишены адаптивного иммунного ответа. Однако основные элементы этого врожденного иммунного ответа сохраняются у людей и плодовых мух. В результате плодовая мушка предлагает полезную модель врожденного иммунитета для распутывания генетических взаимодействий сигнальной и эффекторной функции, поскольку мухам не приходится бороться с вмешательством адаптивных иммунных механизмов, которое может исказить результаты. Различные генетические инструменты, протоколы и анализы делают дрозофилу классической моделью для изучения врожденной иммунной системы . [111] включая даже иммунные исследования на международной космической станции. [112]
JAK-STAT сигнализация
[ редактировать ]Множественные элементы сигнального пути JAK-STAT дрозофилы имеют прямую гомологию с генами пути JAK-STAT человека . Передача сигналов JAK-STAT индуцируется при различных стрессах организма, таких как тепловой стресс, обезвоживание или инфекция. Индукция JAK-STAT приводит к выработке ряда белков реакции на стресс, включая тиоэфирсодержащие белки (TEP), [113] Турандот, [114] и предполагаемый противомикробный пептид Листерицин. [115] Механизмы действия многих из этих белков все еще изучаются. Например, TEP, по-видимому, способствуют фагоцитозу грамположительных бактерий и индукции платного пути. Как следствие, мухи, у которых нет TEP, восприимчивы к заражению через платные пути. [113]
Клеточный ответ на инфекцию
[ редактировать ]Циркулирующие гемоциты являются ключевыми регуляторами инфекции. Это было продемонстрировано как с помощью генетических инструментов для создания мух, лишенных гемоцитов, так и с помощью инъекций микростеклянных шариков или липидных капель, которые насыщают способность гемоцитов фагоцитировать вторичную инфекцию. [116] [117] Мухи, обработанные таким образом, не способны фагоцитировать бактерии при заражении и, соответственно, восприимчивы к инфекции. [118] Эти гемоциты возникают в результате двух волн кроветворения : одна происходит у раннего эмбриона, а другая - во время развития от личинки до взрослой особи. [119] Однако гемоциты дрозофилы не обновляются в течение жизни взрослой особи, поэтому у мухи имеется ограниченное количество гемоцитов, количество которых уменьшается с течением жизни. [120] Гемоциты также участвуют в регуляции событий клеточного цикла и апоптоза аберрантных тканей (например, раковых клеток), продуцируя Эйгер, сигнальную молекулу фактора некроза опухоли , которая способствует передаче сигналов JNK и, в конечном итоге, гибели клеток и апоптозу. [121]
Поведенческая генетика и нейробиология
[ редактировать ]В 1971 году Рон Конопка и Сеймур Бензер опубликовали «Часовые мутанты Drosophila melanogaster », статью, описывающую первые мутации , повлиявшие на поведение животного. У мух дикого типа наблюдается ритм активности с периодичностью около суток (24 часа). Они нашли мутантов с более быстрыми и медленными ритмами, а также с нарушенными ритмами — мух, которые двигаются и отдыхают случайными рывками. Работа последующих 30 лет показала, что эти мутации (и другие подобные им) влияют на группу генов и их продуктов, которые формируют биохимические или биологические часы . Эти часы обнаружены во многих клетках мух, но клетками-носителями часов, которые контролируют активность, являются несколько десятков нейронов в центральном мозге мух.
С тех пор Бензер и другие использовали поведенческий анализ для выделения генов, участвующих в зрении, обонянии, слухе, обучении/памяти, ухаживании, боли и других процессах, таких как долголетие.
По новаторской работе Альфреда Генри Стертеванта [122] и другие, Бензер и коллеги. [49] использовали сексуальную мозаику для разработки новой техники картирования судьбы . Эта методика позволила присвоить определенную характеристику определенному анатомическому месту. Например, этот метод показал, что ухаживание самцов контролируется мозгом. [49] Мозаичное картирование судеб также дало первое указание на существование феромонов у этого вида. [123] самки Самцы различают самцов и самок своего вида и направляют постоянное ухаживание преимущественно в сторону самок благодаря специфичному для самок половому феромону, который в основном вырабатывается тергитами .
Первые мутанты обучения и памяти ( болван , брюква и т. д.) были выделены Уильямом «Чипом» Куинном в лаборатории Бензера, и в конечном итоге было показано, что они кодируют компоненты внутриклеточного сигнального пути, включающего циклический АМФ , протеинкиназу А и транскрипционную систему. фактор, известный как CREB. Было показано, что эти молекулы также участвуют в синаптической пластичности у аплизий и млекопитающих. [124]
Нобелевская премия по физиологии и медицине за 2017 год была присуждена Джеффри К. Холлу, Майклу Росбашу, Майклу У. Янгу за их работы с использованием плодовых мух в понимании «молекулярных механизмов, контролирующих циркадный ритм ». [125]
Самцы мух поют самкам во время ухаживания, используя свои крылья для создания звука, и были охарактеризованы некоторые генетики полового поведения. В частности, бесплодный ген имеет несколько различных форм сплайсинга, а самцы мух, экспрессирующие женские формы сплайсинга, имеют поведение, подобное самкам, и наоборот. Каналы TRP nompC , nanchung и inactive экспрессируются в звукочувствительных нейронах органа Джонстона и участвуют в передаче звука. [126] [127] Мутация гена «гендерной слепоты» , также известного как CG6070, меняет сексуальное поведение дрозофилы , делая мух бисексуальными . [128]
Мухи используют модифицированную версию фильтров Блума для обнаружения новизны запахов с дополнительными функциями, включая сходство нового запаха с ранее испытанными образцами, а также время, прошедшее с момента предыдущего ощущения того же запаха. [129]
Агрессия
[ редактировать ]Как и у большинства насекомых, агрессивное поведение самцов мух обычно происходит при ухаживании за самкой и при конкуренции за ресурсы. Такое поведение часто предполагает поднятие крыльев и ног в сторону противника и атаку всем телом. [130] Таким образом, это часто вызывает повреждение крыльев, что снижает их приспособленность, лишая их способности летать и спариваться. [131]
Акустическая связь
[ редактировать ]Чтобы возникла агрессия, самцы мух издают звуки, чтобы сообщить о своих намерениях. Исследование 2017 года показало, что песни, пропагандирующие агрессию, содержат импульсы, происходящие через более длительные интервалы. [132] Секвенирование РНК мутантов мух, демонстрирующих чрезмерно агрессивное поведение, выявило более 50 генов, связанных со слухом (важных для временных рецепторных потенциалов , Ca 2+ передача сигналов и потенциалы механорецепторов ) для активации в нейронах AB, расположенных в органе Джонстона . [132] Кроме того, уровень агрессии снижался, когда эти гены были выведены из строя посредством РНК-интерференции . [132] Это означает важную роль слуха как сенсорной модальности в передаче агрессии.
Передача сигналов феромонов
[ редактировать ]Помимо слуха, еще одной сенсорной модальностью, регулирующей агрессию, является передача сигналов феромонов , которая действует либо через обонятельную систему , либо через вкусовую систему, в зависимости от феромона. [133] Примером является cVA , антиафродизиакальный феромон, используемый самцами для маркировки самок после совокупления и для удержания других самцов от спаривания. [134] Этот специфичный для мужчин феромон вызывает усиление агрессии между мужчинами при обнаружении вкусовой системой другого мужчины . [133] Однако после введения мутации, которая делает мух невосприимчивыми к cVA, агрессивного поведения не наблюдалось. [135] Это показывает, что существует множество способов развития агрессии у мух.
Конкуренция за еду
[ редактировать ]В частности, при конкуренции за еду агрессия возникает в зависимости от количества доступной еды и не зависит от каких-либо социальных взаимодействий между самцами. [136] В частности, было обнаружено, что сахароза стимулирует нейроны вкусовых рецепторов, что необходимо для стимуляции агрессии. [136] Однако, как только количество еды становится больше определенного количества, конкуренция между самцами снижается. [136] Возможно, это связано с переизбытком пищевых ресурсов. В более широком масштабе было обнаружено, что еда определяет границы территории, поскольку мухи были более агрессивны по физическому периметру еды.
Эффект лишения сна
[ редактировать ]Однако, как и большинство видов поведения, требующих пробуждения и бодрствования, агрессия ослаблялась из-за лишения сна . В частности, это происходит из-за нарушения передачи сигналов октопамина и дофамина , которые являются важными путями регуляции возбуждения у насекомых. [137] [138] Было обнаружено, что из-за пониженной агрессии самцы мух, лишенные сна, оказываются в невыгодном положении при спаривании по сравнению с обычными мухами. [138] Однако когда этим лишенным сна мухам вводили агонисты октопамина, уровень агрессии повышался, а сексуальная активность впоследствии восстанавливалась. [138] Таким образом, это открытие указывает на важность сна при агрессии между самцами мух.
Зрение
[ редактировать ]
Сложный глаз плодовой мухи содержит 760 единиц глаз или омматидий и является одним из самых развитых среди насекомых. Каждый омматидий содержит восемь фоторецепторных клеток (R1-8), опорные клетки, пигментные клетки и роговицу. У мух дикого типа есть красноватые пигментные клетки, которые поглощают излишек синего света, поэтому муха не ослепляется окружающим светом. Гены цвета глаз регулируют клеточный везикулярный транспорт. Ферменты, необходимые для синтеза пигмента, затем транспортируются в пигментные гранулы клетки, которые содержат молекулы-предшественники пигмента. [62]
Каждая фоторецепторная клетка состоит из двух основных отделов: тела клетки и рабдомера . Тело клетки содержит ядро , а рабдомер длиной 100 мкм состоит из стопок мембран, похожих на зубную щетку, называемых микроворсинками . Каждая микроворсинка имеет длину 1–2 мкм и около 60 нм . диаметр [139] Мембрана рабдомера заполнена примерно 100 миллионами молекул опсина — зрительного белка, поглощающего свет. Другие зрительные белки также плотно упакованы в микроворсинки, оставляя мало места для цитоплазмы .
Опсины и спектральная чувствительность
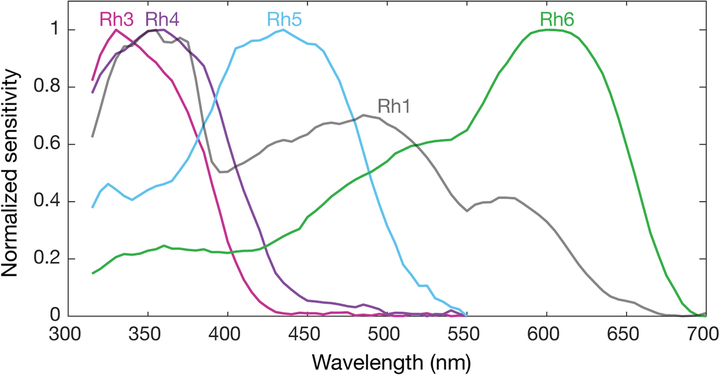
[ редактировать ]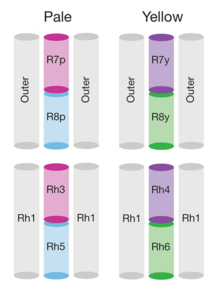
Геном дрозофилы кодирует семь опсинов: [141] пять из них экспрессируются в оматидиях глаза. Фоторецепторные клетки R1-R6 экспрессируют опсин Rh1. [142] который максимально поглощает синий свет (около 480 нм), [143] [144] [145] однако клетки R1-R6 охватывают более широкий диапазон спектра, чем мог бы позволить опсин, из-за сенсибилизирующего пигмента. [146] [147] что добавляет два максимума чувствительности в УФ-диапазоне (355 и 370 нм). [145] Клетки R7 бывают двух типов с желтыми и бледными рабдомерами (R7y и R7p). [148] [149] Бледные клетки R7p экспрессируют опсин Rh3, [150] [151] который максимально поглощает УФ-свет (345 нм). [152] Клетки R7p строго спарены с клетками R8p, экспрессирующими Rh5. [151] который максимально поглощает фиолетовый свет (437 нм). [145] Другие, желтые клетки R7y, экспрессируют экранирующий пигмент, поглощающий синий цвет. [148] и опсин Rh4, [153] который максимально поглощает УФ-свет (375 нм). [152] Клетки R7y строго спарены с клетками R8y, экспрессирующими Rh6. [154] который максимально поглощает УФ-свет (508 нм). [145] В подмножестве оматидий клетки R7 и R8 экспрессируют опсин Rh3. [151]
Однако эти максимумы поглощения опсинов были измерены у белоглазых мух без экранирующих пигментов (Rh3-Rh6), [152] [145] или напрямую из выделенного опсина (Rh1). [143] Эти пигменты уменьшают свет, попадающий на опсины, в зависимости от длины волны. Таким образом, у полностью пигментированных мух различны эффективные максимумы поглощения опсинов, а, следовательно, и чувствительность их фоторецепторных клеток. С экранирующим пигментом опсин Rh3 имеет коротковолновую длину, смещенную от 345 нм. [б] до 330 нм и Rh4 от 375 до 355 нм. Наличие экранирующего пигмента не имеет практического значения для опсина Rh5 (435 нм и 437 нм), тогда как опсин R6 имеет длинноволновое смещение на 92 нм с 508 нм до 600 нм. [140]
Помимо опсинов глаза, у дрозофилы есть еще два опсина: глазки экспрессируют опсин Rh2, [155] [156] который максимально поглощает фиолетовый свет (~420 нм). [156] И опсин Rh7, который максимально поглощает УФ-свет (350 нм) с необычайно длинноволновым хвостом — до 500 нм. Длинный хвост исчезает, если лизин в положении 90 заменить глутаминовой кислотой . Затем этот мутант поглощает максимально фиолетовый свет (450 нм). [157] Опсин Rh7 с помощью криптохрома увлекает циркадный ритм дрозофилы . цикл день-ночь в центральных пейсмекерных нейронах в [158]
Каждый опсин дрозофилы связывает каротиноидный хромофор 11-цис-3-гидроксиретиналь через лизин. [159] [160] Этот лизин консервативен почти во всех опсинах, лишь немногие опсины утратили его в ходе эволюции . [161] Опсины без него не светочувствительны. [162] [163] [164] В частности, опсины Rh1, Rh4 и Rh7 дрозофилы функционируют не только как фоторецепторы , но и как хеморецепторы аристолохиевой кислоты . Эти опсины, как и другие опсины, все еще содержат лизин. Однако если в Rh1 его заменить на аргинин , то Rh1 теряет светочувствительность, но все равно реагирует на аристолохиевую кислоту. Таким образом, лизин не требуется для того, чтобы Rh1 функционировал как хеморецептор. [163]
-
Спектральная чувствительность опсинов Drosophila melanogaster у белоглазых мух. Чувствительность Rh3–R6 моделируется с использованием матриц опсина и оценок чувствительности Salcedo et al. (1999). [145] Опсин Rh1 (взято из Salcedo et al. [145] ) имеет характерную форму, поскольку соединен с пигментом, чувствительным к УФ-излучению.
-
Кривые нормализованной средней спектральной чувствительности опсинов Rh1, Rh3, Rh4, Rh5 и Rh6 дрозофилы melanogaster, измеренные в их нативных фоторецепторных клетках у красноглазых мух с экранирующим пигментом. Каждая спектральная кривая представляет собой среднее значение шести мух.
Фототрансдукция
[ редактировать ]Как и в случае со зрением позвоночных , зрительная трансдукция у беспозвоночных происходит по пути, связанному с G-белком. Однако у позвоночных G -белком является трансдуцин , тогда как у беспозвоночных Gq-белок (dgq у дрозофилы ). Когда родопсин (Rh) поглощает фотон света, его хромофор 11-цис-3-гидроксиретиналь изомеризуется в полностью-транс-3-гидроксиретиналь. Rh претерпевает конформационные изменения в свою активную форму — метародопсин. Метародопсин активирует Gq, который, в свою очередь, активирует фосфолипазу Cβ (PLCβ), известную как NorpA. [165]
PLCβ гидролизует фосфатидилинозитол (4,5)-бисфосфат (PIP 2 ), фосфолипид, обнаруженный в клеточной мембране , до растворимого инозитолтрифосфата (IP 3 ) и диацилглицерина (DAG), который остается в клеточной мембране. DAG, производное DAG, или истощение PIP 2 вызывают кальций -селективного ионного канала , известного как переходный рецепторный потенциал открытие (TRP), и кальций и натрий поступают в клетку. [166] IP 3 Считается, что IP 3 связывается с рецепторами в субрабдомерных цистернах, являющихся продолжением эндоплазматической сети , и вызывает высвобождение кальция, но этот процесс, по-видимому, не является существенным для нормального зрения. [165]
Кальций связывается с такими белками, как кальмодулин (CaM) и специфической для глаз протеинкиназой C (PKC), известной как InaC. Эти белки взаимодействуют с другими белками и, как было показано, необходимы для отключения светового ответа. Кроме того, белки, называемые аррестинами, связывают метародопсин и не позволяют ему активировать больше Gq. Натриево -кальциевый обменник , известный как CalX, выкачивает кальций из клетки. Он использует внутренний градиент натрия для экспорта кальция со стехиометрией 3 Na. + / 1 Калифорния ++ . [167]
TRP, InaC и PLC образуют сигнальный комплекс, связывая каркасный белок InaD. InaD содержит пять связывающих доменов, называемых белками домена PDZ , которые специфически связывают C-концы белков-мишеней. Разрушение комплекса мутациями либо в доменах PDZ, либо в целевых белках снижает эффективность передачи сигналов. Например, нарушение взаимодействия между InaC, протеинкиназой C и InaD приводит к задержке инактивации светового ответа .
В отличие от метародопсина позвоночных, метародопсин беспозвоночных может превращаться обратно в родопсин путем поглощения фотона оранжевого света (580 нм).
Около двух третей мозга дрозофилы отвечает за обработку зрительной информации. [168] Хотя пространственное разрешение их зрения значительно хуже, чем у людей, их временное разрешение примерно в 10 раз лучше.
Уход
[ редактировать ]Известно, что дрозофилы демонстрируют предсказуемое поведение по уходу. Дрозофила последовательно начинает процедуру ухода, используя передние ноги для очистки глаз, затем головы и усиков. Используя задние ноги, дрозофилы приступают к уходу за брюшком, а затем за крыльями и грудной клеткой. На протяжении всей этой процедуры дрозофилы периодически трутся ногами, чтобы избавиться от лишней пыли и мусора, которые накапливаются в процессе ухода. [169]
Было показано, что уходовое поведение реализуется в иерархии подавления. Это означает, что поведение ухода, которое происходит в начале последовательности, предотвращает одновременное возникновение поведения, которое происходит позже в последовательности, поскольку последовательность ухода состоит из взаимоисключающих действий. [170] [171] Эта иерархия не мешает дрозофиле вернуться к поведению по уходу, которое уже использовалось в последовательности ухода. [170] Считается, что порядок ухода за собой в иерархии подавления связан с приоритетом очистки определенной части тела. Например, глаза и усики, вероятно, создаются на ранних этапах процедуры ухода, чтобы предотвратить вмешательство мусора в работу органов чувств D. melanogaster . [170] [171]
Прогулка
[ редактировать ]
Как и многие другие шестиногие насекомые, дрозофила обычно ходит на треноге . [173] Это означает, что три ноги качаются вместе, а остальные три остаются неподвижными или в стойке. В частности, средняя нога движется синхронно с контралатеральными передними и задними ногами. Однако изменчивость конфигурации штатива существует в континууме, а это означает, что у мух не наблюдается четких переходов между разными походками. [174] При высоких скоростях ходьбы конфигурация ходьбы в основном представляет собой штатив (3 ноги в стойке), но при более медленных скоростях ходьбы мухи, скорее всего, будут иметь четыре (тетрапод) или пять ног в стойке (волна). [175] [176] Эти переходы могут помочь оптимизировать статическую стабильность . [177] Поскольку мухи очень малы, силы инерции ничтожны по сравнению с силами упругости их мышц и суставов или силами вязкости окружающего воздуха. [178]
Полет
[ редактировать ]Мухи летают, совершая прямые последовательности движений, чередующиеся с быстрыми поворотами, называемыми саккадами. [179] Во время этих поворотов муха способна повернуть на 90° менее чем за 50 миллисекунд. [179]
В характеристиках полета дрозофилы может преобладать вязкость воздуха , а не инерция тела мухи, но может произойти и противоположный случай, когда инерция является доминирующей силой. [179] Однако последующие работы показали, что, хотя вязкое воздействие на тело насекомого во время полета может быть незначительным, аэродинамические силы на самих крыльях фактически вызывают вязкое демпфирование поворотов плодовых мух. [180]
Коннектом
[ редактировать ]Дрозофила — одно из немногих животных ( в том числе C. elegans подробные нейронные цепи ( коннектом ), у которых имеются ).
Для полноценного мозга мухи существует коннектом высокого уровня на уровне отделов мозга и соединяющихся участков нейронов. [181] Версия этого доступна в Интернете. [182]
существуют подробные коннектомы на уровне схемы. Для пластинки [183] [184] и мозговое вещество [185] столбик, как в зрительной системе плодовой мушки, так и в альфа-доле тела гриба. [186]
В мае 2017 года в статье, опубликованной в bioRxiv, была представлена стопка изображений электронной микроскопии всего мозга взрослой женщины с синаптическим разрешением. Том доступен для разреженного отслеживания выбранных цепей. [187] [188] С тех пор было собрано несколько наборов данных, включая плотный коннектом половины центрального мозга дрозофилы в 2020 году. [189] [190] и плотный коннектом всей нервной цепочки взрослой женщины в 2021 году. [191] Обычно эти наборы данных получают путем разделения ткани (например, мозга) на тонкие срезы (порядка десяти или сотен нанометров). Затем каждый срез визуализируется с помощью электронного микроскопа, и эти изображения сшиваются и выравниваются вместе, чтобы создать объем трехмерного изображения. Ниже приведены методы, использованные при реконструкции и первоначальном анализе таких наборов данных. [192] Благодаря достижениям в области глубокого обучения автоматизированные методы сегментации изображений позволили провести крупномасштабную реконструкцию, обеспечивающую плотную реконструкцию всех нейритов в объеме. [193] Кроме того, разрешение электронной микроскопии выявляет ультраструктурные различия между нейронами, а также расположение отдельных синапсов, тем самым обеспечивая схему соединений синаптических связей между всеми нейритами в данном наборе данных.
В 2023 году была опубликована полная карта мозга личинки дрозофилы на уровне синапсов и анализ его архитектуры. Личиночный мозг состоит из 3016 нейронов и 548 000 синаптических участков. [194] тогда как мозг взрослого человека имеет около 150 000 нейронов и 150 миллионов синапсов.
Заблуждения
[ редактировать ]Дрозофилу иногда называют вредителем из-за ее склонности жить в населенных пунктах, где встречаются бродящие фрукты. Мухи могут собираться в домах, ресторанах, магазинах и других местах. [14] Название и поведение этого вида мух привели к ошибочному представлению о том, что он представляет угрозу биологической безопасности в Австралии и других странах. В то время как другие виды «плодовых мушек» действительно представляют риск, D. melanogaster привлекают уже гниющие фрукты, а не вызывают их гниение. [195] [196]
См. также
[ редактировать ]- Испытания на животных на беспозвоночных
- Пищевое поведение насекомых (Измерение)
- Фруктовые мушки в космосе
- Генетически модифицированное насекомое
- Гинандроморфизм
- Ген JET LAG
- Список баз данных дрозофилы
- Шпецле (ген)
- Время летит, как стрела; фруктовые мушки, как банан
- Трансгенезис
- Рыбка данио - еще один широко используемый модельный организм в научных исследованиях.
Примечания
[ редактировать ]- ^ Несколько недавних публикаций предпочитают «уксусную мушку» как более точное описание, чем «дрозофила». [3] [4] [5]
- ^ Шарки и др. [140] в разделе результатов укажите максимум поглощения Rh3 как 334 нм. Однако во введении и в разделе «Материалы и методы» она указана как 345 нм. Для обоих значений они цитируют Фейлера и др., которые сообщили только о длине волны 345 нм. [152] Поэтому похоже это ошибка и там наверное тоже имели в виду 345 нм.
Ссылки
[ редактировать ]- ^ Мейген Дж. В. (1830). Систематическое описание известных европейских двукрылых насекомых. (Том 6) (PDF) (на немецком языке). Чудо-человек Шульц. Архивировано из оригинала (PDF) 9 февраля 2012 г.
- ^ «Дрозофила (Sophophora) melanogaster Meigen, 1830» . Каталог жизни . Вид 2000 г .: Лейден, Нидерланды . Проверено 2 мая 2024 г.
- ^ «Дрозофила | род насекомых» . Британская энциклопедия . Проверено 30 октября 2021 г.
- ^ «Уксусные мухи» . Расширение штата Пенсильвания . Проверено 30 октября 2021 г.
- ^ Перейти обратно: а б Грин ММ (сентябрь 2002 г.). «Это действительно не плодовая мушка» . Генетика . 162 (1): 1–3. дои : 10.1093/генетика/162.1.1 . ПМЦ 1462251 . ПМИД 12242218 .
- ^ Шильтуизен, Менно (28 апреля 2015 г.). «Химический коктейль из спермы может захватить мозг партнера» . Обнаружить . Проверено 11 сентября 2023 г.
Даже в эякуляте скромной банановой мухи Drosophila melanogaster исследователи выявили не менее 133 различных видов белков.
- ^ Биография Т.Х. Моргана, получившая Нобелевскую премию, с упоминанием К.В. Вудворта
- ^ Холден Б. (1 января 2015 г.). Чарльз В. Вудворт: Замечательная жизнь первого энтомолога Калифорнийского университета (1-е изд.). Издательство Брайана Холдена. стр. 135–137. ISBN 978-0-9864105-3-6 .
- ^ «Нобелевские премии» . Хранитель . 7 октября 2017 г.
- ^ «FruitFly-ResearchGate» .
- ^ Перейти обратно: а б Санг Дж. Х., Рив EC (23 июня 2001 г.). «Drosophila melanogaster: плодовая мушка» . Энциклопедия генетики . США: Fitzroy Dearborn Publishers, I.p. 157. ИСБН 978-1-884964-34-3 . Проверено 1 июля 2009 г.
- ^ Бодри Э., Вижинье Б., Вей М. (август 2004 г.). «Неафриканские популяции Drosophila melanogaster имеют уникальное происхождение» . Молекулярная биология и эволюция . 21 (8): 1482–91. дои : 10.1093/molbev/msh089 . ПМИД 15014160 .
- ^ Перейти обратно: а б Марков Т.А. (июнь 2015 г.). «Тайная жизнь мух-дрозофил» . электронная жизнь . 4 . doi : 10.7554/eLife.06793 . ПМЦ 4454838 . ПМИД 26041333 .
- ^ Перейти обратно: а б «Уксусные мухи, виды дрозофилы , семейство: Drosophilaidae » . Кафедра энтомологии Колледжа сельскохозяйственных наук Университета штата Пенсильвания. 2017 . Проверено 20 июля 2017 г.
- ^ Перейти обратно: а б Юарт Г.Д., Хауэллс А.Дж. (1 января 1998 г.). «Транспортеры ABC, участвующие в транспортировке предшественников глазного пигмента у Drosophila melanogaster». Транспортеры ABC: биохимические, клеточные и молекулярные аспекты . Методы энзимологии. Том. 292. Академик Пресс. стр. 213–24. дои : 10.1016/S0076-6879(98)92017-1 . ISBN 978-0-12-182193-7 . ПМИД 9711556 .
- ^ «FlyBase: база данных генов и геномов дрозофилы» . Генетическое общество Америки. 2009. Архивировано из оригинала 15 августа 2009 года . Проверено 11 августа 2009 г.
- ^ Юзуки, Кевин; Тидон, Роуз (2020). «Ключ для идентификации видов дрозофилид (Diptera, Drosophilidae), экзотических для Неотропического региона и встречающихся в Бразилии» . Бразильский журнал энтомологии . 64 (1). doi : 10.1590/1806-9665-rbent-2019-100 . ISSN 1806-9665 . S2CID 211570766 .
- ^ Миллер, Мэн; Маршалл, ЮАР; Гримальди, Д.А. (2017). «Обзор видов дрозофил (Diptera: Drosophilidae) и родов дрозофилид северо-востока Северной Америки» . Канадский журнал идентификации членистоногих . 31 . дои : 10.3752/cjai.2017.31 .
- ^ «Дрозофила Меланогастер» . Сеть разнообразия животных. 2000. Архивировано из оригинала 30 ноября 2014 года . Проверено 11 августа 2009 г.
- ^ Линфорд, штат Нью-Джерси, Билгир С., Ро Джей, Плетчер С.Д. (январь 2013 г.). «Измерение продолжительности жизни Drosophila melanogaster» . Журнал визуализированных экспериментов (71). дои : 10.3791/50068 . ПМЦ 3582515 . ПМИД 23328955 .
- ^ Перейти обратно: а б с д и ж г Эшбернер М. , Томпсон Дж. Н. (1978). «Лабораторная культура дрозофилы ». В Эшбернер М., Райт TRF (ред.). Генетика и биология дрозофилы . Том. 2А. Академическая пресса. 1–81.
- ^ Перейти обратно: а б с д и ж г Эшбернер М. , Голич К.Г., Хоули Р.С. (2005). Дрозофила: Лабораторный справочник (2-е изд.). Лабораторный пресс Колд-Спринг-Харбор. стр. 162–4. ISBN 978-0-87969-706-8 .
- ^ в Блумингтоне дрозофил Центр запасов при Университете Индианы : Основные методы культивирования дрозофил. Архивировано 1 сентября 2006 г. в Wayback Machine.
- ^ Перейти обратно: а б Чианг ХК, Ходсон AC (1950). «Аналитическое исследование роста популяции Drosophila melanogaster ». Экологические монографии . 20 (3): 173–206. Бибкод : 1950ЭкоМ...20..173С . дои : 10.2307/1948580 . JSTOR 1948580 .
- ^ Баккер К. (1961). «Анализ факторов, определяющих успех в борьбе за пищу личинок Drosophila melanogaster ». Архивы Néerlandaises de Zoologie . 14 (2): 200–281. дои : 10.1163/036551661X00061 . S2CID 85129022 .
- ^ Фернандес-Морено М.А., Фарр К.Л., Кагуни Л.С., Гаресс Р. (2007). «Drosophila melanogaster как модельная система для изучения митохондриальной биологии». Митохондрии . Методы молекулярной биологии. Том. 372. стр. 33–49. дои : 10.1007/978-1-59745-365-3_3 . ISBN 978-1-58829-667-2 . ПМК 4876951 . ПМИД 18314716 .
- ^ Блюм Дж. Э., Фишер К. Н., Майлз Дж., Хандельсман Дж. (ноябрь 2013 г.). «Частое пополнение поддерживает полезный микробиом Drosophila melanogaster» . мБио . 4 (6): e00860-13. дои : 10.1128/mBio.00860-13 . ПМЦ 3892787 . ПМИД 24194543 .
- ^ Кук Р., Коннолли К. (1973). «Реакция отторжения самок Drosophila melanogaster: их онтогенез, причинно-следственная связь и влияние на поведение ухаживающего самца». Поведение . 44 (1/2): 142–166. дои : 10.1163/156853973x00364 . JSTOR 4533484 . S2CID 85393769 .
- ^ Хоуот Б., Светец Н., Годой-Эррера Р., Фервер Дж.Ф. (июль 2010 г.). «Влияние лабораторной акклиматизации на изменение признаков, связанных с размножением Drosophila melanogaster» . Журнал экспериментальной биологии . 213 (Часть 13): 2322–31. дои : 10.1242/jeb.041566 . ПМИД 20543131 .
- ^ Гилберт С.Ф. (2006). «9: Оплодотворение дрозофилы» . Биология развития (8-е изд.). Синауэр Ассошиэйтс. ISBN 978-0-87893-250-4 . Архивировано из оригинала 7 февраля 2007 года.
- ^ Перейти обратно: а б с Прайс К.С., Дайер К.А., Койн Дж.А. (июль 1999 г.). «Конкуренция сперматозоидов между самцами дрозофилы включает как смещение, так и выведение из строя». Природа . 400 (6743): 449–52. Бибкод : 1999Natur.400..449P . дои : 10.1038/22755 . ПМИД 10440373 . S2CID 4393369 .
- ^ Перейти обратно: а б с д «Исследования плодовых мух могут показать, что происходит в мозгу самок во время ухаживания и спаривания» . Проверено 5 октября 2014 г.
- ^ Мейзельман М., Ли С.С., Тран Р.Т., Дай Х., Дин Ю., Ривера-Перес С. и др. (май 2017 г.). «Дрозофила меланогастер» . Труды Национальной академии наук Соединенных Штатов Америки . 114 (19): E3849–E3858. дои : 10.1073/pnas.1620760114 . ПМЦ 5441734 . ПМИД 28439025 .
- ^ Мошицкий П., Флейшманн И., Хаимов Н., Саудан П., Клаузер С., Кубли Э., Эпплбаум С.В. (1996). «Секс-пептид активирует биосинтез ювенильных гормонов у Drosophila melanogaster corpus allatum». Архив биохимии и физиологии насекомых . 32 (3–4): 363–74. doi : 10.1002/(SICI)1520-6327(1996)32:3/4<363::AID-ARCH9>3.0.CO;2-T . ПМИД 8756302 .
- ^ Карнс М.Ю., Кэмпбелл Т., Хуанг В., Батлер Д.Г., Карбон М.А., Дункан Л.Х. и др. (2015). «Геномная основа отсроченного старения у Drosophila melanogaster» . ПЛОС ОДИН . 10 (9): e0138569. Бибкод : 2015PLoSO..1038569C . дои : 10.1371/journal.pone.0138569 . ПМЦ 4574564 . ПМИД 26378456 .
- ^ Кэссиди Д., Эпини Д.Г., Саламе С., Чжоу Л.Т., Саломон Р.Н., Ширмер А.Е. и др. (ноябрь 2019 г.). «Доказательства преждевременного старения на модели синдрома Вернера у дрозофилы» . Экспериментальная геронтология . 127 : 110733. doi : 10.1016/j.exger.2019.110733 . ПМЦ 6935377 . ПМИД 31518666 .
- ^ Прюдоммо С., Пруст Дж. УФ-облучение клеток тополя эмбрионов Drosophila melanogaster. V. Исследование мейотической рекомбинации у самок с хромосомами разного строения. Мутат Рес. 23 апреля 1974 г. (1): 63-6. ПМИД 4209047
- ^ Шеве М.Дж., Сузуки Д.Т., Эразмус У. Генетические эффекты митомицина С у Drosophila melanogaster. II. Индуцированная мейотическая рекомбинация. Мутат Рес. Июль 1971 г.; 12 (3): 269–79. дои: 10.1016/0027-5107(71)90015-7. ПМИД 5563942
- ^ Питник С. (1996). «Инвестиции в семенники и стоимость получения длинных сперматозоидов у дрозофилы ». Американский натуралист . 148 : 57–80. дои : 10.1086/285911 . S2CID 83654824 .
- ^ Дагаефф А.С., Пошевиль А., Нобель С., Лойау А., Изабель Г., Данчин Э. (2016). «Копирование партнера дрозофилы коррелирует с атмосферным давлением в ситуации быстрого обучения» . Поведение животных . 121 : 163–174. дои : 10.1016/j.anbehav.2016.08.022 .
- ^ Дукас Р. (2004). «Самцы дрозофил учатся избегать межвидового ухаживания» . Поведенческая экология . 15 (4): 695–698. дои : 10.1093/beheco/arh068 .
- ^ Салим С., Рагглс П.Х., Эбботт В.К., Карни Дж.Е. (2014). «Сексуальный опыт улучшает поведение и успех самцов Drosophila melanogaster» . ПЛОС ОДИН . 9 (5): е96639. Бибкод : 2014PLoSO...996639S . дои : 10.1371/journal.pone.0096639 . ПМК 4013029 . ПМИД 24805129 .
- ^ Перейти обратно: а б фон Хаартман Л. (1951). «Последовательная полигамия». Поведение . 3 (1): 256–273. дои : 10.1163/156853951x00296 .
- ^ Перейти обратно: а б с д и ж г Вартак В.Р., Варма В., Шарма В.К. (февраль 2015 г.). «Влияние полигамии на ритм активности/отдыха самцов плодовых мух Drosophila melanogaster». Die Naturwissenschaften . 102 (1–2): 1252. Бибкод : 2015SciNa.102....3V . дои : 10.1007/s00114-014-1252-5 . ПМИД 25604736 . S2CID 7529509 .
- ^ Перейти обратно: а б Бейтман Эй Джей (декабрь 1948 г.). «Внутриполовой отбор у дрозофилы» . Наследственность . 2 (Часть 3): 349–68. дои : 10.1038/hdy.1948.21 . ПМИД 18103134 .
- ^ Перейти обратно: а б Пирс Б.А. (2004). Генетика: концептуальный подход (2-е изд.). У. Х. Фриман . ISBN 978-0-7167-8881-2 .
- ^ Килби Б.Дж., Макдональд DJ, Ауэрбах С., Собельс Ф.Х., Фогель Э.В. (июнь 1981 г.). «Использование Drosophila melanogaster в тестах на мутагены окружающей среды». Мутационные исследования . 85 (3): 141–6. дои : 10.1016/0165-1161(81)90029-7 . ПМИД 6790982 .
- ^ Перейти обратно: а б Адамс, доктор медицинских наук; Цельникер SE ; Холт Р.А.; Эванс, Калифорния ; [ PubMed ] Гокейн Джей Ди; Аманатидес ПГ; и др. (март 2000 г.). «Последовательность генома Drosophila melanogaster». Наука 287 (5461): 2185–95. Бибкод : 2000Sci...287.2185. . CiteSeerX 10.1.1.549.8639 . дои : 10.1126/science.287.5461.2185 . ПМИД 10731132 .
- ^ Перейти обратно: а б с Хотта Ю., Бензер С. (декабрь 1972 г.). «Картирование поведения мозаики дрозофилы». Природа . 240 (5383): 527–35. Бибкод : 1972Natur.240..527H . дои : 10.1038/240527a0 . ПМИД 4568399 . S2CID 4181921 .
- ^ Мейерс С. (2018). «Использование новых технологий секвенирования ДНК для изучения геномных перестроек» . archive.ub.uni-heidelberg.de . дои : 10.11588/heidok.00024506 . Проверено 28 июня 2021 г.
- ^ Аспиазу Н., Фраш М. (июль 1993 г.). «Жестянщик и волынка: два гена гомеобокса, которые определяют судьбу клеток в дорсальной мезодерме дрозофилы» . Гены и развитие . 7 (7Б): 1325–40. дои : 10.1101/gad.7.7b.1325 . ПМИД 8101173 .
- ^ Стерн Д.Л., Франкель Н. (декабрь 2013 г.). «Структура и эволюция цис-регуляторных регионов: история бритого ребенка» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 368 : 20130028.doi : (1632 ) 10.1098/rstb.2013.0028 . ПМЦ 3826501 . ПМИД 24218640 .
- ^ Перейти обратно: а б Филлипс А.М., Смарт Р., Штраус Р., Брембс Б., Келли Л.Е. (май 2005 г.). «Загадка черной дрозофилы: молекулярная и поведенческая характеристика мутантного аллеля black1» (PDF) . Джин . 351 : 131–42. дои : 10.1016/j.gene.2005.03.013 . ПМИД 15878647 .
- ^ Перейти обратно: а б «Отчет о генах FlyBase: Dmel\b» . www.flybase.org . Проверено 26 марта 2019 г.
- ^ Шеральд А.Ф. (сентябрь 1981 г.). «Межгенное подавление черной мутации Drosophila melanogaster». Молекулярная и общая генетика . 183 (1): 102–6. дои : 10.1007/bf00270146 . ПМИД 6799739 . S2CID 1210971 .
- ^ Шуп-младший (май 1966 г.). «Развитие пигментных гранул в глазах дикого типа и мутанта Drosophila melanogaster» . Журнал клеточной биологии . 29 (2): 223–49. дои : 10.1083/jcb.29.2.223 . ПМК 2106902 . ПМИД 5961338 .
- ^ «СПРАВОЧНЫЕ СТРАНИЦЫ ДЛЯ УЧИТЕЛЕЙ – ЛАБОРАТОРИЯ ПИГМЕНТОВ FLY EYE PIGMENTS» (PDF) . Архивировано из оригинала (PDF) 26 марта 2019 года . Проверено 26 марта 2019 г.
- ^ Морган Т.Х. (март 1911 г.). «Происхождение мутаций девяти крыльев у дрозофилы». Наука . 33 (848): 496–9. Бибкод : 1911Sci....33..496M . дои : 10.1126/science.33.848.496 . JSTOR 1638587 . ПМИД 17774436 .
- ^ «Отчет о генах FlyBase: Dmel\m» . www.flybase.org . Проверено 26 марта 2019 г.
- ^ Белоусов О.О., Катанаев В.Л., Демидов С.В., Козерецкая И.А. (март–апрель 2013 г.). «Подавление миниатюрного гена не в полной мере воспроизводит миниатюрные фенотипы потери функции в крыле Drosophila melanogaster». Цитология и генетика . 47 (2): 77–81. ПМИД 23745366 .
- ^ Перейти обратно: а б Ким Дж, Су Х, Ким С, Ким К, Ан С, Йим Дж (сентябрь 2006 г.). «Идентификация и характеристики структурного гена мутантной окраски глаз дрозофилы сепия, кодирующего PDA-синтазу, члена глутатион-S-трансфераз класса омега» . Биохимический журнал . 398 (3): 451–60. дои : 10.1042/BJ20060424 . ПМЦ 1559464 . ПМИД 16712527 .
- ^ Перейти обратно: а б с Грант П., Мага Т., Лошаков А., Сингхал Р., Вали А., Нванкво Дж. и др. (октябрь 2016 г.). «Взгляд на торговлю генами: идентификация четырех мутаций цвета глаз у дрозофилы» . Г3 . 6 (10): 3185–3196. дои : 10.1534/g3.116.032508 . ПМК 5068940 . ПМИД 27558665 .
- ^ Видеррехт Г.Дж., Браун Г.М. (1984). «Очистка и свойства ферментов Drosophila melanogaster, которые катализируют превращение трифосфата дигидронеоптерина в пиримидодиазепиновый предшественник дрозоптеринов» . Ж. Биол. Хим . 259 (22): 14121–7. дои : 10.1016/S0021-9258(18)89865-9 . ПМИД 6438092 .
- ^ «Особенности наследования у Drosophila Melanogaster» . Проверено 26 марта 2019 г.
- ^ Перейти обратно: а б Грин ММ (апрель 1952 г.). «Мутантные изоаллели в локусе Vermilion у Drosophila Melanogaster» . Труды Национальной академии наук Соединенных Штатов Америки . 38 (4): 300–5. Бибкод : 1952ПНАС...38..300Г . дои : 10.1073/pnas.38.4.300 . ПМЦ 1063551 . ПМИД 16589094 .
- ^ Оксенкруг Г.Ф. (январь 2010 г.). «Увеличенная продолжительность жизни мутантов цвета глаз Drosophila melanogaster (белых и ярко-красных) с нарушением образования кинуренина» . Журнал нейронной передачи . 117 (1): 23–26. дои : 10.1007/s00702-009-0341-7 . ПМК 3013506 . ПМИД 19941150 .
- ^ Саймон Э., Фошо С., Зидер А., Тезе Н., Тибо П. (июль 2016 г.). «От рудиментарного к рудиментарному: раскрывшийся ген дрозофилы». Гены развития и эволюция . 226 (4): 297–315. дои : 10.1007/s00427-016-0546-3 . ПМИД 27116603 . S2CID 16651247 .
- ^ Томоясу Ю., Оде Т., Кларк-Хахтел С. (14 марта 2017 г.). «Какие серийные гомологи могут рассказать нам о происхождении крыльев насекомых» . F1000Исследования . 6 : 268. дои : 10.12688/f1000research.10285.1 . ПМК 5357031 . ПМИД 28357056 .
- ^ Уильямс Дж. А., Белл Дж. Б., Кэрролл С.Б. (декабрь 1991 г.). «Контроль над развитием крыльев и жужжальца дрозофилы с помощью продукта ядерного рудиментарного гена» . Гены и развитие . 5 (12Б): 2481–95. дои : 10.1101/gad.5.12b.2481 . ПМИД 1752439 .
- ^ Грин ММ (январь 2010 г.). «2010: Столетие генетики дрозофилы сквозь призму белого гена» . Генетика . 184 (1): 3–7. дои : 10.1534/genetics.109.110015 . ПМК 2815926 . ПМИД 20061564 .
- ^ Феррейро М.Дж., Перес С., Маркесано М., Руис С., Капути А., Агилера П. и др. (2018). «rosophila melanogaster White Mutant w1118 подвергается дегенерации сетчатки» . Границы в неврологии . 11 : 732. дои : 10.3389/fnins.2017.00732 . ПМЦ 5758589 . ПМИД 29354028 .
- ^ Перейти обратно: а б Сяо С., Цю С., Робертсон Р.М. (август 2017 г.). «Белый ген контролирует успех совокупления у Drosophila melanogaster» . Научные отчеты . 7 (1): 7712. Бибкод : 2017NatSR...7.7712X . дои : 10.1038/s41598-017-08155-y . ПМЦ 5550479 . ПМИД 28794482 .
- ^ "Джин:Dmel\y" . Flybase.org . Консорциум FlyBase . Проверено 26 марта 2019 г.
- ^ Витткопп П.Дж., Тру-младший, Кэрролл С.Б. (апрель 2002 г.). «Взаимные функции белков желтого и черного дерева дрозофилы в развитии и эволюции пигментных рисунков». Разработка . 129 (8): 1849–58. дои : 10.1242/dev.129.8.1849 . ПМИД 11934851 .
- ^ Перейти обратно: а б Биссманн Х (ноябрь 1985 г.). «Молекулярный анализ области желтого гена (y) Drosophila melanogaster» . Труды Национальной академии наук Соединенных Штатов Америки . 82 (21): 7369–73. Бибкод : 1985PNAS...82.7369B . дои : 10.1073/pnas.82.21.7369 . ПМЦ 391346 . ПМИД 3933004 .
- ^ «База данных геномов NCBI (Национальный центр биотехнологической информации)» . Проверено 30 ноября 2011 г.
- ^ Халлиган Д.Л., Кейтли П.Д. (июль 2006 г.). «Повсеместные селективные ограничения в геноме дрозофилы, выявленные путем межвидового сравнения всего генома» . Геномные исследования . 16 (7): 875–84. дои : 10.1101/гр.5022906 . ПМЦ 1484454 . ПМИД 16751341 .
- ^ Карвальо AB (декабрь 2002 г.). «Происхождение и эволюция Y-хромосомы дрозофилы». Текущее мнение в области генетики и развития . 12 (6): 664–8. дои : 10.1016/S0959-437X(02)00356-8 . ПМИД 12433579 .
- ^ Габальдон Т., Кунин Е.В. (май 2013 г.). «Функциональные и эволюционные последствия ортологии генов» . Обзоры природы. Генетика . 14 (5). Портфолио природы : 360–366. дои : 10.1038/nrg3456 . ПМЦ 5877793 . ПМИД 23552219 .
- ^ «Основы сравнительного геномного анализа» . Национальный институт исследования генома человека США. Декабрь 2002 года.
- ^ Рейтер Л.Т., Потоцкий Л., Чиен С., Грибсков М., Бир Э. (июнь 2001 г.). «Систематический анализ последовательностей генов, связанных с заболеваниями человека, у Drosophila melanogaster» . Геномные исследования . 11 (6): 1114–25. дои : 10.1101/гр.169101 . ПМК 311089 . ПМИД 11381037 .
- ^ Чиен С., Райтер Л.Т., Бир Э., Грибсков М. (январь 2002 г.). «Гомофила: гены болезней человека, родственные дрозофиле» . Исследования нуклеиновых кислот . 30 (1): 149–51. дои : 10.1093/нар/30.1.149 . ПМК 99119 . ПМИД 11752278 .
- ^ Джайсвал М., Сандовал Х., Чжан К., Баят В., Беллен Х.Дж. (2012). «Изучение механизмов, лежащих в основе нейродегенеративных заболеваний человека у дрозофилы» . Ежегодный обзор генетики . 46 : 371–96. doi : 10.1146/annurev-genet-110711-155456 . ПМЦ 3663445 . ПМИД 22974305 .
- ^ Пик Л (2017). Летающие модели болезней человека. Том 121 текущих тем биологии развития . Академическая пресса. ISBN 978-0-12-802905-3 .
- ^ Бушон Н., Сильверман Н., Черри С. (декабрь 2014 г.). «Иммунитет Drosophila melanogaster - от микробного распознавания до физиологии всего организма» . Обзоры природы. Иммунология . 14 (12): 796–810. дои : 10.1038/nri3763 . ПМК 6190593 . ПМИД 25421701 .
- ^ Каун К.Р., Девинени А.В., Хеберляйн У (июнь 2012 г.). «Drosophila melanogaster как модель изучения наркозависимости» . Генетика человека . 131 (6): 959–75. дои : 10.1007/s00439-012-1146-6 . ПМК 3351628 . ПМИД 22350798 .
- ^ Перейти обратно: а б Вейгманн К., Клаппер Р., Штрассер Т., Рикерт С., Технау Г., Джекле Х. и др. (июнь 2003 г.). «FlyMove — новый взгляд на развитие дрозофилы». Тенденции в генетике . 19 (6): 310–1. дои : 10.1016/S0168-9525(03)00050-7 . ПМИД 12801722 .
- ^ Вест-Эберхард MJ (май 2005 г.). «Пластичность развития и происхождение видовых различий» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (приложение 1): 6543–9. Бибкод : 2005PNAS..102.6543W . дои : 10.1073/pnas.0501844102 . ПМЦ 1131862 . ПМИД 15851679 .
- ^ Перейти обратно: а б с Абрам П.К., Бойвен Дж., Муру Дж., Бродер Дж. (ноябрь 2017 г.). «Поведенческое воздействие температуры на экзотермических животных: объединение тепловой физиологии и поведенческой пластичности». Биологические обзоры Кембриджского философского общества . 92 (4): 1859–1876. дои : 10.1111/brv.12312 . ПМИД 28980433 . S2CID 9099834 .
- ^ Гиберт П., Хьюи Р.Б., Гилкрист Г.В. (январь 2001 г.). «Локомоторные характеристики Drosophila melanogaster: взаимодействие температуры развития и взрослой особи, возраста и географии» . Эволюция; Международный журнал органической эволюции . 55 (1): 205–9. дои : 10.1111/j.0014-3820.2001.tb01286.x . ПМИД 11263741 . S2CID 2991855 .
- ^ Перейти обратно: а б с Замудио КР, Хьюи РБ, Крилл ВД (1995). «Больше не всегда лучше: размер тела, температура развития и родительская температура, а также территориальный успех самцов Drosophila melanogaster». Поведение животных . 49 (3): 671–677. дои : 10.1016/0003-3472(95)80200-2 . ISSN 0003-3472 . S2CID 9124942 .
- ^ Харрисон Дж. Ф., Уотерс Дж. С., Биддульф Т. А., Ковачевич А., Клок С. Дж., Соча Дж. Дж. (апрель 2018 г.). «Пластичность развития и стабильность сетей трахеи, снабжающих летательные мышцы дрозофилы, в ответ на повышение уровня кислорода» . Журнал физиологии насекомых . Границы дыхательной функции: внешние и внутренние ограничения газообмена насекомых. 106 (Часть 3): 189–198. Бибкод : 2018JInsP.106..189H . дои : 10.1016/j.jinsphys.2017.09.006 . ПМИД 28927826 .
- ^ Шиба В., Чандрашекаран М.К., Джоши А., Шарма В.К. (январь 2002 г.). «Пластичность развития ритма двигательной активности Drosophila melanogaster». Журнал физиологии насекомых . 48 (1): 25–32. Бибкод : 2002JInsP..48...25S . дои : 10.1016/S0022-1910(01)00139-1 . ПМИД 12770129 .
- ^ Перейти обратно: а б с д Крилл В.Д., Хьюи Р.Б., Гилкрист Г.В. (июнь 1996 г.). «Влияние температуры внутри и между поколениями на морфологию и физиологию Drosophila Melanogaster». Эволюция; Международный журнал органической эволюции . 50 (3): 1205–1218. дои : 10.2307/2410661 . JSTOR 2410661 . ПМИД 28565273 .
- ^ Перейти обратно: а б Дэвид Дж.Р., Арарипе Л.О., Чакир М., Легут Х., Лемос Б., Петави Г. и др. (июль 2005 г.). «Мужская стерильность при экстремальных температурах: важный, но игнорируемый феномен для понимания климатической адаптации дрозофилы» . Журнал эволюционной биологии . 18 (4): 838–46. дои : 10.1111/j.1420-9101.2005.00914.x . ПМИД 16033555 . S2CID 23847613 .
- ^ Френч В., Фист М., Куропатка Л. (ноябрь 1998 г.). «Размер тела и размер клеток у дрозофилы: реакция развития на температуру». Журнал физиологии насекомых . 44 (11): 1081–1089. Бибкод : 1998JInsP..44.1081F . дои : 10.1016/S0022-1910(98)00061-4 . ПМИД 12770407 .
- ^ Фрейзер М.Р., Харрисон Дж.Ф., Кирктон С.Д., Робертс С.П. (июль 2008 г.). «Выращивание в холоде улучшает способность дрозофилы к холодному полету за счет изменений в морфологии крыльев» . Журнал экспериментальной биологии . 211 (Часть 13): 2116–22. дои : 10.1242/jeb.019422 . ПМИД 18552301 .
- ^ Перейти обратно: а б Слотсбо С., Шу М.Ф., Кристенсен Т.Н., Лешке В., Сёренсен Дж.Г. (сентябрь 2016 г.). «Обратимость развития тепло- и холодо-пластичности асимметрична и имеет долгосрочные последствия для термической толерантности взрослых» . Журнал экспериментальной биологии . 219 (Часть 17): 2726–32. дои : 10.1242/jeb.143750 . ПМИД 27353229 .
- ^ Гилкрист Г.В., Хьюи Р.Б. (январь 2001 г.). «Влияние родительской температуры и температуры развития на термическую зависимость приспособленности Drosophila melanogaster» . Эволюция; Международный журнал органической эволюции . 55 (1): 209–14. дои : 10.1111/j.0014-3820.2001.tb01287.x . ПМИД 11263742 . S2CID 1329035 .
- ^ Остин Си Джей, Меринг Эй Джей (май 2013 г.). «Оптимальный температурный диапазон пластикового вида Drosophila simulans» . Журнал экологии животных . 82 (3): 663–72. Бибкод : 2013JAnEc..82..663A . дои : 10.1111/1365-2656.12041 . ПМИД 23360477 .
- ^ Перейти обратно: а б Ходин Дж., Риддифорд Л.М. (октябрь 2000 г.). «Различные механизмы лежат в основе фенотипической пластичности и межвидовой изменчивости репродуктивных признаков у дрозофилид (Insecta: Diptera)» . Эволюция; Международный журнал органической эволюции . 54 (5): 1638–53. дои : 10.1111/j.0014-3820.2000.tb00708.x . ПМИД 11108591 . S2CID 6875815 .
- ^ Клепсатель П., Гириш Т.Н., Дирксен Х., Галикова М. (май 2019 г.). «Дрозофила максимизируется при оптимальной температуре развития» . Журнал экспериментальной биологии . 222 (Часть 10): jeb202184. дои : 10.1242/jeb.202184 . ПМИД 31064855 .
- ^ Шу М.Ф., Кристенсен Т.Н., Педерсен А., Карлссон Б.Г., Лешке В., Мальмендал А. (февраль 2017 г.). «Метаболическая и функциональная характеристика влияния температуры развития Drosophila melanogaster» . Американский журнал физиологии. Регуляторная, интегративная и сравнительная физиология . 312 (2): Р211–Р222. дои : 10.1152/ajpregu.00268.2016 . ПМЦ 5336569 . ПМИД 27927623 .
- ^ Кохет Ю., Дэвид Дж. (январь 1978 г.). «Контроль репродуктивного потенциала взрослых с помощью преимагинальных тепловых условий: исследование на Drosophila melanogaster». Экология . 36 (3): 295–306. Бибкод : 1978Oecol..36..295C . дои : 10.1007/BF00348055 . ПМИД 28309916 . S2CID 12465060 .
- ^ Rideout EJ, Нарсайя М.С., Гревал СС (декабрь 2015 г.). «Ген-трансформатор определения пола регулирует различия между мужчинами и женщинами в размерах тела дрозофилы» . ПЛОС Генетика . 11 (12): e1005683. дои : 10.1371/journal.pgen.1005683 . ПМК 4692505 . ПМИД 26710087 .
- ^ Гилберт С.Ф. (2000). Биология развития (6-е изд.). Сандерленд (Массачусетс): Sinauer Associates; 2000. ISBN 978-0-87893-243-6 .
- ^ Леметр Б., Хоффманн Дж. (2007). «Защита хозяина Drosophila melanogaster» (PDF) . Ежегодный обзор иммунологии . 25 : 697–743. doi : 10.1146/annurev.immunol.25.022106.141615 . ПМИД 17201680 .
- ^ Троха К., Им Дж. Х., Рева Дж., Лаззаро Б. П., Бушон Н. (февраль 2018 г.). «Сравнительная транскриптомика показывает, что CrebA является новым регулятором толерантности к инфекциям у D. melanogaster» . ПЛОС Патогены . 14 (2): e1006847. дои : 10.1371/journal.ppat.1006847 . ПМЦ 5812652 . ПМИД 29394281 .
- ^ Де Грегорио Э., Спеллман П.Т., Цзоу П., Рубин Г.М., Леметр Б. (июнь 2002 г.). «Пути Toll и Imd являются основными регуляторами иммунного ответа у дрозофилы» . Журнал ЭМБО . 21 (11): 2568–79. дои : 10.1093/emboj/21.11.2568 . ПМК 126042 . ПМИД 12032070 .
- ^ Паредес Х.К., Уэлчман Д.П., Пойдевин М., Леметр Б. (ноябрь 2011 г.). «Негативная регуляция амидазой PGRP формирует антибактериальный ответ дрозофилы и защищает муху от безобидной инфекции» (PDF) . Иммунитет . 35 (5): 770–9. doi : 10.1016/j.immuni.2011.09.018 . ПМИД 22118526 .
- ^ Троха К., Пучон Н. (сентябрь 2019 г.). «Методы изучения врожденного иммунитета Drosophila melanogaster». Междисциплинарные обзоры Wiley. Биология развития . 8 (5): е344. дои : 10.1002/wdev.344 . ПМИД 30993906 . S2CID 119527642 .
- ^ Гилберт Р., Торрес М., Клеменс Р., Хэйтли С., Хосамани Р., Уэйд В., Бхаттачарья С. (февраль 2020 г.). «Модель инфекции Drosophila melanogaster» . npj Микрогравитация . 6 (1): 4. дои : 10.1038/s41526-019-0091-2 . ПМК 7000411 . ПМИД 32047838 .
- ^ Перейти обратно: а б Досталова А., Роммелер С., Пуидевен М., Леметр Б. (сентябрь 2017 г.). «Тиоэфирсодержащие белки регулируют путь Toll и играют роль в защите дрозофилы от микробных патогенов и паразитоидных ос» . БМК Биология . 15 (1): 79. дои : 10.1186/s12915-017-0408-0 . ПМЦ 5584532 . ПМИД 28874153 .
- ^ Шринивасан Н., Гордон О., Аренс С., Франц А., Деддуш С., Чакраварти П. и др. (ноябрь 2016 г.). «Дрозофила меланогастер» . электронная жизнь . 5 . doi : 10.7554/eLife.19662 . ПМК 5138034 . ПМИД 27871362 .
- ^ Гото А., Яно Т., Терашима Дж., Ивашита С., Осима Ю., Курата С. (май 2010 г.). «Совместная регуляция индукции нового антибактериального листерицина с помощью белка распознавания пептидогликана LE и пути JAK-STAT» . Журнал биологической химии . 285 (21): 15731–8. дои : 10.1074/jbc.M109.082115 . ПМЦ 2871439 . ПМИД 20348097 .
- ^ Ван Л., Кунатидис И., Лигоксигакис П. (январь 2014 г.). «Дрозофила как модель для изучения роли клеток крови в воспалении, врожденном иммунитете и раке» . Границы клеточной и инфекционной микробиологии . 3 : 113. дои : 10.3389/fcimb.2013.00113 . ПМЦ 3885817 . ПМИД 24409421 .
- ^ Нейен С., Бретчер А.Дж., Бинггели О., Леметр Б. (июнь 2014 г.). «Методы изучения иммунитета дрозофилы» (PDF) . Методы . 68 (1): 116–28. дои : 10.1016/j.ymeth.2014.02.023 . ПМИД 24631888 .
- ^ Хасимото Ю., Табути Ю., Сакураи К., Куцуна М., Курокава К., Авасаки Т. и др. (декабрь 2009 г.). «Идентификация липотейхоевой кислоты как лиганда дрейпера при фагоцитозе Staphylococcus aureus гемоцитами дрозофилы» . Журнал иммунологии . 183 (11): 7451–60. doi : 10.4049/jimmunol.0901032 . ПМИД 19890048 .
- ^ Хольц А., Боссингер Б., Штрассер Т., Яннинг В., Клэппер Р. (октябрь 2003 г.). «Два происхождения гемоцитов у дрозофилы» . Разработка . 130 (20): 4955–62. дои : 10.1242/dev.00702 . ПМИД 12930778 .
- ^ Санчес Бош П., Махиджани К., Хербосо Л., Голд К.С., Багинский Р., Вудкок К.Дж. и др. (декабрь 2019 г.). «Взрослые дрозофилы лишены кроветворения, но полагаются на резервуар клеток крови в респираторном эпителии для передачи сигналов инфекции в окружающие ткани» . Развивающая клетка . 51 (6): 787–803.e5. дои : 10.1016/j.devcel.2019.10.017 . ПМЦ 7263735 . ПМИД 31735669 .
- ^ Parvy JP, Yu Y, Dostalova A, Kondo S, Kurjan A, Bulet P, et al. (July 2019). "Drosophila" . eLife . 8 : e45061. doi : 10.7554/eLife.45061 . PMC 6667213 . PMID 31358113 .
- ^ Стертевант А.Х. (1929). «Бордовый мутантный тип Drosophila simulans: исследование элиминации хромосом и клеточного происхождения». Журнал научной зоологии . 135 : 323–356.
- ^ Ниссани М. (май 1975 г.). «Новый поведенческий биоанализ для анализа полового влечения и феромонов у насекомых» . Журнал экспериментальной зоологии . 192 (2): 271–5. Бибкод : 1975JEZ...192..271N . дои : 10.1002/jez.1401920217 . ПМИД 805823 .
- ^ Хан Ф.А. (2011). Основы биотехнологии . ЦРК Пресс. п. 213. ИСБН 978-1-4398-2009-4 .
- ^ «Нобелевская премия по физиологии и медицине 2017 года присуждена совместно Джеффри К. Холлу, Майклу Росбашу и Майклу У. Янгу за открытие молекулярных механизмов, контролирующих циркадный ритм» . Нобелевская премия.org. 2 октября 2017 г. Проверено 5 октября 2017 г.
- ^ Ленерт Б.П., Бейкер А.Е., Годри К., Чианг А.С., Уилсон Р.И. (январь 2013 г.). «Особые роли каналов TRP в слуховой трансдукции и усилении у дрозофилы» . Нейрон . 77 (1): 115–28. дои : 10.1016/j.neuron.2012.11.030 . ПМЦ 3811118 . ПМИД 23312520 .
- ^ Чжан В., Ян З., Ян Л.И., Ян Ю.Н. (август 2013 г.). «Звуковой ответ, опосредованный каналами TRP NOMPC, NANCHUNG и INACTIVE в хордотональных органах личинок дрозофилы» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (33): 13612–7. Бибкод : 2013PNAS..11013612Z . дои : 10.1073/pnas.1312477110 . ПМЦ 3746866 . ПМИД 23898199 .
- ^ "Гомосексуализм включается и выключается у плодовых мушек"
- ^ Дасгупта С., Шихан Т.С., Стивенс К.Ф., Навлаха С. (декабрь 2018 г.). «Нейронная структура данных для обнаружения новизны» . Труды Национальной академии наук Соединенных Штатов Америки . 115 (51): 13093–13098. Бибкод : 2018PNAS..11513093D . дои : 10.1073/pnas.1814448115 . ПМК 6304992 . ПМИД 30509984 .
- ^ Звартс Л., Верстевен М., Каллаертс П. (1 января 2012 г.). «Генетика и нейробиология агрессии у дрозофилы» . Летать . 6 (1): 35–48. дои : 10.4161/fly.19249 . ПМЦ 3365836 . ПМИД 22513455 .
- ^ Дэвис С.М., Томас А.Л., Лю Л., Кэмпбелл И.М., Дирик Х.А. (январь 2018 г.). «Дрозофила использует экран для повреждения крыльев» . Генетика . 208 (1): 273–282. doi : 10.1534/genetics.117.300292 . ПМК 5753862 . ПМИД 29109180 .
- ^ Перейти обратно: а б с Верстевен М., Ванден Брук Л., Гертен Б., Цвартс Л., Декрекер Л., Билен М. и др. (февраль 2017 г.). «Агрессия дрозофилы» . Труды Национальной академии наук Соединенных Штатов Америки . 114 (8): 1958–1963. дои : 10.1073/pnas.1605946114 . ПМЦ 5338383 . ПМИД 28115690 .
- ^ Перейти обратно: а б Сенгупта С., Смит Д.П. (2014). «Как дрозофила обнаруживает летучие феромоны: передача сигналов, схемы и поведение». В Муцинья-Каретта C (ред.). Нейробиология химической связи . Границы в неврологии. CRC Press/Тейлор и Фрэнсис. ISBN 978-1-4665-5341-5 . ПМИД 24830032 . Проверено 30 мая 2019 г.
- ^ Латурни М., Биллетер Дж. К. (август 2016 г.). «Самки Drosophila melanogaster восстанавливают свою привлекательность после спаривания, удаляя мужские антиафродизиакальные феромоны» . Природные коммуникации . 7 (1): 12322. Бибкод : 2016NatCo...712322L . дои : 10.1038/ncomms12322 . ПМЦ 4976142 . ПМИД 27484362 .
- ^ Ван Л., Хан Х., Мерен Дж., Хирой М., Биллетер Дж.К., Миямото Т. и др. (июнь 2011 г.). «Иерархическая хемосенсорная регуляция социальных взаимодействий самцов и самцов у дрозофилы» . Природная неврология . 14 (6): 757–62. дои : 10.1038/nn.2800 . ПМК 3102769 . ПМИД 21516101 .
- ^ Перейти обратно: а б с Лим Р.С., Эййольфсдоттир Э, Шин Э, Перона П., Андерсон DJ (27 августа 2014 г.). «Как еда контролирует агрессию у дрозофилы» . ПЛОС ОДИН . 9 (8): e105626. Бибкод : 2014PLoSO...9j5626L . дои : 10.1371/journal.pone.0105626 . ПМК 4146546 . ПМИД 25162609 .
- ^ Эрион Р., ДиАнджело-младший, Крокер А., Сегал А. (сентябрь 2012 г.). «Взаимодействие между сном и обменом веществ у дрозофилы с измененной передачей сигналов октопамина» . Журнал биологической химии . 287 (39): 32406–14. дои : 10.1074/jbc.M112.360875 . ПМЦ 3463357 . ПМИД 22829591 .
- ^ Перейти обратно: а б с Кайзер М.С., Мэйнваринг Б., Юэ З., Сегал А. (июль 2015 г.). Гриффит LC (ред.). «Депривация сна подавляет агрессию у дрозофилы» . электронная жизнь . 4 : e07643. doi : 10.7554/eLife.07643 . ПМЦ 4515473 . ПМИД 26216041 .
- ^ Харди Р.К., Рагху П. (сентябрь 2001 г.). «Визуальная трансдукция у дрозофилы». Природа . 413 (6852): 186–93. Бибкод : 2001Natur.413..186H . дои : 10.1038/35093002 . ПМИД 11557987 . S2CID 4415605 .
- ^ Перейти обратно: а б с д Шарки Ч.Р., Бланко Дж., Лейбовиц М.М., Пинто-Бенито Д., Уордилл Т.Дж. (октябрь 2020 г.). «Спектральная чувствительность фоторецепторов дрозофилы» . Научные отчеты . 10 (1): 18242. Бибкод : 2020NatSR..1018242S . дои : 10.1038/s41598-020-74742-1 . ПМЦ 7588446 . ПМИД 33106518 . S2CID 215551298 .
 Материал был скопирован и адаптирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
Материал был скопирован и адаптирован из этого источника, который доступен по международной лицензии Creative Commons Attribution 4.0 .
- ^ Феуда Р., Гулти М., Задра Н., Гаспаретти Т., Розато Э., Пизани Д. и др. (август 2021 г.). «Филогеномика генов опсинов у двукрылых выявляет события, специфичные для линии, и контрастирующую эволюционную динамику у Anopheles и дрозофилы» . Геномная биология и эволюция . 13 (8): evab170. дои : 10.1093/gbe/evab170 . ПМЦ 8369074 . ПМИД 34270718 .
- ^ Харрис В.А., Старк В.С., Уокер Дж.А. (апрель 1976 г.). «Генетическое вскрытие фоторецепторной системы сложного глаза Drosophila melanogaster» . Журнал физиологии . 256 (2): 415–439. doi : 10.1113/jphysicalol.1976.sp011331 . ПМЦ 1309314 . ПМИД 16992509 . S2CID 45888026 .
- ^ Перейти обратно: а б Острой С.Е., Уилсон М., Пак В.Л. (август 1974 г.). «Родопсин дрозофилы: фотохимия, экстракция и различия в мутанте фототрансдукции norp AP12». Связь с биохимическими и биофизическими исследованиями . 59 (3): 960–966. дои : 10.1016/s0006-291x(74)80073-2 . ПМИД 4213042 .
- ^ Острой ГП (ноябрь 1978 г.). «Характеристики родопсина дрозофилы у мутантов трансдукции зрения дикого типа и norpA» . Журнал общей физиологии . 72 (5): 717–732. дои : 10.1085/jgp.72.5.717 . ПМК 2228556 . ПМИД 105082 . S2CID 5802525 .
- ^ Перейти обратно: а б с д и ж г Сальседо Э., Хубер А., Хенрих С., Чедвелл Л.В., Чоу В.Х., Полсен Р., Бритт С.Г. (декабрь 1999 г.). «Поглощающие синий и зеленый зрительные пигменты дрозофилы: эктопическая экспрессия и физиологическая характеристика родопсинов Rh5 и Rh6, специфичных для фоторецепторных клеток R8» . Журнал неврологии . 19 (24): 10716–10726. doi : 10.1523/jneurosci.19-24-10716.1999 . ПМК 6784940 . ПМИД 10594055 . S2CID 17575850 .
- ^ Киршфельд К., Франческини Н., Минке Б. (сентябрь 1977 г.). «Доказательства наличия сенсибилизирующего пигмента в фоторецепторах мух». Природа . 269 (5627): 386–390. Бибкод : 1977Natur.269..386K . дои : 10.1038/269386a0 . ПМИД 909585 . S2CID 28890008 .
- ^ Минке Б., Киршфельд К. (май 1979 г.). «Вклад сенсибилизирующего пигмента в спектры фоточувствительности родопсина и метародопсина мух» . Журнал общей физиологии . 73 (5): 517–540. дои : 10.1085/jgp.73.5.517 . ПМК 2215190 . ПМИД 458418 . S2CID 12451748 .
- ^ Перейти обратно: а б Киршфельд К., Фейлер Р., Франческини Н. (1978). «Фотостабильный пигмент в рабдомере фоторецепторов № 7 мух». Журнал сравнительной физиологии А. 125 (3): 275–284. дои : 10.1007/BF00656606 . S2CID 40233531 .
- ^ Киршфельд К., Франческини Н. (июнь 1977 г.). «Фотостабильные пигменты в мембране фоторецепторов и их возможная роль». Биофизика структуры и механизма . 3 (2): 191–194. дои : 10.1007/BF00535818 . ПМИД 890056 . S2CID 5846094 .
- ^ Цукер К.С., Монтелл К., Джонс К., Лаверти Т., Рубин Г.М. (май 1987 г.). «Ген родопсина, экспрессируемый в фоторецепторной клетке R7 глаза дрозофилы: гомологии с другими молекулами, передающими сигнал» . Журнал неврологии . 7 (5): 1550–1557. doi : 10.1523/jneurosci.07-05-01550.1987 . ПМК 6568820 . ПМИД 2437266 . S2CID 1490332 .
- ^ Перейти обратно: а б с Чоу В.Х., Холл К.Дж., Уилсон Д.Б., Уайдман К.Л., Таунсон С.М., Чедвелл Л.В., Бритт С.Г. (декабрь 1996 г.). «Идентификация нового опсина дрозофилы выявила специфическое паттернирование фоторецепторных клеток R7 и R8» . Нейрон . 17 (6): 1101–1115. дои : 10.1016/s0896-6273(00)80243-3 . ПМИД 8982159 . S2CID 18294965 .
- ^ Перейти обратно: а б с д Фейлер Р., Бьорнсон Р., Киршфельд К., Мисмер Д., Рубин Г.М., Смит Д.П. и др. (октябрь 1992 г.). «Эктопическая экспрессия ультрафиолетовых родопсинов в синих фоторецепторных клетках дрозофилы: зрительная физиология и фотохимия трансгенных животных» . Журнал неврологии . 12 (10): 3862–3868. doi : 10.1523/jneurosci.12-10-03862.1992 . ПМК 6575971 . ПМИД 1403087 .
- ^ Монтелл С., Джонс К., Цукер С., Рубин Дж. (май 1987 г.). «Второй ген опсина, экспрессируемый в чувствительных к ультрафиолету фоторецепторных клетках R7 Drosophila melanogaster» . Журнал неврологии . 7 (5): 1558–1566. doi : 10.1523/JNEUROSCI.07-05-01558.1987 . ПМК 6568825 . ПМИД 2952772 . S2CID 17003459 .
- ^ Хубер А., Шульц С., Бентроп Дж., Гроелл С., Вольфрум Ю., Полсен Р. (апрель 1997 г.). «Молекулярное клонирование родопсина Rh6 дрозофилы: зрительный пигмент подмножества фоторецепторных клеток R8». Письма ФЭБС . 406 (1–2): 6–10. дои : 10.1016/s0014-5793(97)00210-x . ПМИД 9109375 . S2CID 18368117 .
- ^ Поллок Дж. А., Бензер С. (июнь 1988 г.). «Локализация транскрипта четырех генов опсина в трех зрительных органах дрозофилы; RH2 специфичен для глазка». Природа . 333 (6175): 779–782. Бибкод : 1988Natur.333..779P . дои : 10.1038/333779a0 . ПМИД 2968518 . S2CID 4303934 .
- ^ Перейти обратно: а б Фейлер Р., Харрис В.А., Киршфельд К., Верхан С., Цукер К.С. (июнь 1988 г.). «Направленная неправильная экспрессия гена опсина дрозофилы приводит к изменению зрительной функции». Природа . 333 (6175): 737–741. Бибкод : 1988Natur.333..737F . дои : 10.1038/333737a0 . ПМИД 2455230 . S2CID 4248264 .
- ^ Сакаи К., Цуцуи К., Ямасита Т., Ивабе Н., Такахаши К., Вада А., Шичида Ю. (август 2017 г.). «Родопсин Rh7 дрозофилы melanogaster представляет собой датчик ультрафиолетового и видимого света с чрезвычайно широким спектром поглощения» . Научные отчеты . 7 (1): 7349. Бибкод : 2017НатСР...7.7349С . дои : 10.1038/s41598-017-07461-9 . ПМЦ 5544684 . ПМИД 28779161 . S2CID 3276084 .
- ^ Ни Дж.Д., Байк Л.С., Холмс Т.К., Монтелл С. (май 2017 г.). «Родопсин в мозге участвует в циркадном фотоувлечении у дрозофилы» . Природа . 545 (7654): 340–344. Бибкод : 2017Natur.545..340N . дои : 10.1038/nature22325 . ПМЦ 5476302 . ПМИД 28489826 . S2CID 4468254 .
- ^ Фогт К. (1 февраля 1984 г.). «Хромофор зрительного пигмента некоторых отрядов насекомых» . Журнал естественных исследований C. 39 (1–2): 196–197. дои : 10.1515/znc-1984-1-236 . S2CID 88980658 .
- ^ Фогт К., Киршфельд К. (апрель 1984 г.). «Химическая идентичность хромофоров зрительного пигмента мух». Naturwissenschaften . 71 (4): 211–213. Бибкод : 1984NW.....71..211В . дои : 10.1007/BF00490436 . S2CID 24205801 .
- ^ Гюманн М., Портер М.Л., Бок М.Дж. (август 2022 г.). «Глюопсины: опсины без лизина, связывающего сетчатку» . Клетки . 11 (15): 2441. doi : 10.3390/cells11152441 . ПМЦ 9368030 . ПМИД 35954284 .
- ^ Катана Р., Гуан С., Занини Д., Ларсен М.Е., Хиральдо Д., Гертен Б.Р. и др. (сентябрь 2019 г.). «Независимая от хромофора роль опсин-апопротеинов в механорецепторах дрозофилы» . Современная биология . 29 (17): 2961–2969.е4. Бибкод : 2019CBio...29E2961K . дои : 10.1016/j.cub.2019.07.036 . ПМИД 31447373 . S2CID 201420079 .
- ^ Перейти обратно: а б Люнг, Нью-Йорк, Тхакур Д.П., Гурав А.С., Ким Ш., Ди Пицио А., Нив М.Ю., Монтелл С. (апрель 2020 г.). «Функции опсинов во вкусе дрозофилы» . Современная биология . 30 (8): 1367–1379.е6. Бибкод : 2020CBio...30E1367L . дои : 10.1016/j.cub.2020.01.068 . ПМЦ 7252503 . ПМИД 32243853 .
- ^ Кумбаласири Т., Роллаг М.Д., Изольди М.К., Каструччи А.М., Провенсио I (март 2007 г.). «Меланопсин запускает высвобождение внутренних запасов кальция в ответ на свет». Фотохимия и фотобиология . 83 (2): 273–279. дои : 10.1562/2006-07-11-RA-964 . ПМИД 16961436 . S2CID 23060331 .
- ^ Перейти обратно: а б Рагху П., Колли Н.Дж., Вебель Р., Джеймс Т., Хасан Г., Дэнин М. и др. (май 2000 г.). «Нормальная фототрансдукция в фоторецепторах дрозофилы, лишенных гена рецептора InsP (3)». Молекулярная и клеточная нейронауки . 15 (5): 429–45. дои : 10.1006/mcne.2000.0846 . ПМИД 10833300 . S2CID 23861204 .
- ^ Харди Р.К., Юусола М. (октябрь 2015 г.). «Фототрансдукция у дрозофилы» . Современное мнение в нейробиологии . 34 : 37–45. дои : 10.1016/j.conb.2015.01.008 . ПМИД 25638280 . S2CID 140206989 .
- ^ Ван Т., Сюй Х., Обервинклер Дж., Гу Ю., Харди Р.К., Монтелл С. (февраль 2005 г.). «Функции световой активации, адаптации и выживания клеток обменника Na+/Ca2+ CalX» . Нейрон . 45 (3): 367–78. дои : 10.1016/j.neuron.2004.12.046 . ПМИД 15694324 .
- ^ Рейн К., Цёклер М., Мадер М.Т., Грюбель К., Гейзенберг М. (февраль 2002 г.). «Стандартный мозг дрозофилы» . Современная биология . 12 (3): 227–31. Бибкод : 2002CBio...12..227R . дои : 10.1016/S0960-9822(02)00656-5 . ПМИД 11839276 . S2CID 15785406 .
- ^ Докинз Р., Докинз М. (1976). «Иерархическая организация и облегчение позы: правила ухода за мухами». Поведение животных . 24 (4): 739–755. дои : 10.1016/S0003-3472(76)80003-6 . S2CID 53186674 .
- ^ Перейти обратно: а б с Дэвис WJ (1979). «Поведенческие иерархии». Тенденции в нейронауках . 2 (2): 5–7. дои : 10.1016/0166-2236(79)90003-1 . S2CID 53180462 .
- ^ Перейти обратно: а б Сидс А.М., Равбар П., Чунг П., Хэмпель С., Мидгли Ф.М., Менш Б.Д., Симпсон Дж.Х. (август 2014 г.). «Иерархия подавления среди конкурирующих двигательных программ стимулирует последовательный уход у дрозофилы» . электронная жизнь . 3 : e02951. doi : 10.7554/eLife.02951 . ПМЦ 4136539 . ПМИД 25139955 .
- ^ Матис А., Мамиданна П., Кюри К.М., Абе Т., Мурти В.Н., Матис М.В., Бетге М. (сентябрь 2018 г.). «DeepLabCut: безмаркерная оценка позы определенных пользователем частей тела с помощью глубокого обучения». Природная неврология . 21 (9): 1281–1289. дои : 10.1038/s41593-018-0209-y . ПМИД 30127430 . S2CID 4748395 .
- ^ Штраус Р., Гейзенберг М. (август 1990 г.). «Координация ног при прямолинейной ходьбе и поворотах у Drosophila melanogaster». Журнал сравнительной физиологии А. 167 (3): 403–12. дои : 10.1007/BF00192575 . ПМИД 2121965 . S2CID 12965869 .
- ^ ДеАнджелис Б.Д., Заватоне-Вет Дж.А., Кларк Д.А. (июнь 2019 г.). «Дрозофила» . электронная жизнь . 8 . doi : 10.7554/eLife.46409 . ПМК 6598772 . ПМИД 31250807 .
- ^ Возница А., Бокемюль Т., Дюбберт М., Шольц Х., Бюшгес А. (февраль 2013 г.). «Координация между ногами при контроле скорости ходьбы у дрозофилы» . Журнал экспериментальной биологии . 216 (Часть 3): 480–91. дои : 10.1242/jeb.078139 . ПМИД 23038731 .
- ^ Мендес К.С., Бартос И., Акай Т., Марка С., Манн Р.С. (январь 2013 г.). «Количественная оценка параметров походки свободно идущего дикого типа и сенсорной депривации Drosophila melanogaster» . электронная жизнь . 2 : е00231. doi : 10.7554/eLife.00231 . ПМЦ 3545443 . ПМИД 23326642 .
- ^ Щецинский Н.С., Бокемюль Т., Чокли А.С., Бюшгес А. (ноябрь 2018 г.). «Дрозофила» . Журнал экспериментальной биологии . 221 (Часть 22): jeb189142. дои : 10.1242/jeb.189142 . ПМИД 30274987 .
- ^ Хупер С.Л. (май 2012 г.). «Размер тела и нейронный контроль движения» . Современная биология . 22 (9): Р318-22. Бибкод : 2012CBio...22.R318H . дои : 10.1016/j.cub.2012.02.048 . ПМИД 22575473 .
- ^ Перейти обратно: а б с Фрай С.Н., Саяман Р., Дикинсон М.Х. (апрель 2003 г.). «Аэродинамика маневров свободного полета дрозофилы» (PDF) . Наука . 300 (5618): 495–8. Бибкод : 2003Sci...300..495F . дои : 10.1126/science.1081944 . ПМИД 12702878 . S2CID 40952385 . Архивировано из оригинала (PDF) 24 сентября 2015 г.
- ^ Хессельберг Т., Леманн Ф.О. (декабрь 2007 г.). «Поведение при повороте зависит от фрикционного демпфирования у плодовой мухи дрозофилы» . Журнал экспериментальной биологии . 210 (Часть 24): 4319–34. дои : 10.1242/jeb.010389 . ПМИД 18055621 .
- ^ Чианг А.С., Линь С.И., Чуан С.К., Чанг Х.М., Се С.Х., Йе С.В. и др. (январь 2011 г.). «Трехмерная реконструкция проводящих сетей всего мозга у дрозофилы с разрешением одной клетки» . Современная биология . 21 (1): 1–11. Бибкод : 2011CBio...21....1C . дои : 10.1016/j.cub.2010.11.056 . ПМИД 21129968 . S2CID 17155338 .
- ^ «FlyCircuit — база данных нейронов головного мозга дрозофилы» . Проверено 30 августа 2013 г.
- ^ Майнерцхаген И.А., О'Нил С.Д. (март 1991 г.). «Синаптическая организация столбчатых элементов в пластинке дикого типа Drosophila melanogaster». Журнал сравнительной неврологии . 305 (2): 232–63. дои : 10.1002/cne.903050206 . ПМИД 1902848 . S2CID 35301798 .
- ^ Ривера-Альба М., Виталадевуни С.Н., Мищенко Ю., Мищенко Ю., Лу З., Такемура С.Ю. и др. (декабрь 2011 г.). «Экономия проводки и исключение объема определяют расположение нейронов в мозгу дрозофилы» . Современная биология . 21 (23): 2000–5. Бибкод : 2011CBio...21.2000R . дои : 10.1016/j.cub.2011.10.022 . ПМЦ 3244492 . ПМИД 22119527 .
- ^ Такемура С.Ю., Бхариоке А., Лу З., Нерн А., Виталадевуни С., Ривлин П.К. и др. (август 2013 г.). «Схема визуального обнаружения движения, предложенная коннектомикой дрозофилы» . Природа . 500 (7461): 175–81. Бибкод : 2013Natur.500..175T . дои : 10.1038/nature12450 . ПМЦ 3799980 . ПМИД 23925240 .
- ^ Такемура С.Ю., Асо Ю., Хиге Т., Вонг А., Лу З., Сюй К.С. и др. (июль 2017 г.). «Мозг дрозофилы» . электронная жизнь . 6 : е26975. дои : 10.7554/eLife.26975 . ПМК 5550281 . ПМИД 28718765 .
- ^ «Весь мозг плодовой мухи, полученный с помощью электронной микроскопии» . Журнал Ученый . Проверено 15 июля 2018 г.
- ^ Чжэн З., Лауритцен Дж.С., Перлман Э., Робинсон К.Г., Николс М., Милки Д. и др. (июль 2018 г.). «Полный объем электронной микроскопии мозга взрослой Drosophila melanogaster» . Клетка . 174 (3): 730–743.e22. bioRxiv 10.1101/140905 . дои : 10.1016/j.cell.2018.06.019 . ПМК 6063995 . ПМИД 30033368 .
- ^ Сюй С.С., Янушевски М., Лу З., Такемура С.Ю., Хейворт К., Хуан Г., Шиномия К., Майтин-Шепард Дж., Акерман Д., Берг С., Блейкли Т. и др. (2020). «Коннектом центрального мозга взрослой дрозофилы ». биоRxiv . Лаборатория Колд-Спринг-Харбор: 21.01.2020.911859. дои : 10.1101/2020.01.21.911859 . S2CID 213140797 .
- ^ «Инструменты анализа для коннектомики» . ХХМИ.
- ^ Фелпс, Джаспер С.; Хильдебранд, Дэвид Грант Колберн; Грэм, Бретт Дж.; Куан, Аарон Т.; Томас, Логан А.; Нгуен, Три М.; Буманн, Джулия; Азеведо, Энтони В.; Сустар, Энн; Агравал, Света; Лю, Мингуань; Шэнни, Брендан Л.; Функе, Ян; Тутилл, Джон К.; Ли, Вэй-Чунг Аллен (2 февраля 2021 г.). «Реконструкция цепей управления моторикой взрослой дрозофилы с помощью автоматизированной просвечивающей электронной микроскопии» . Клетка . 184 (3): 759–774.e18. дои : 10.1016/j.cell.2020.12.013 . ПМЦ 8312698 . ПМИД 33400916 .
- ^ Шеффер Л.К., Сюй К.С., Янушевски М., Лу З., Такемура С.Ю., Хейворт К.Дж., Хуанг Г., Шиномия К., Мейтлин-Шепард Дж., Берг С., Клементс Дж. и др. (2020). «Коннектом и анализ центрального мозга взрослой дрозофилы » . биоRxiv . 9 . Колд-Спринг-Харбор. дои : 10.1101/2020.04.07.030213 . ПМЦ 7546738 . ПМИД 32880371 . S2CID 215790785 .
- ^ Попович, Сергей; Макрина, Томас; Кемниц, Нико; Кастро, Мануэль; Нехоран, Барак; Цзя, Чжэнь; Бэ, Дж. Александр; Митчелл, Эрик; Му, Шан; Траутман, Эрик Т.; Заальфельд, Стефан; Ли, Кай; Сын, Себастьян (27 марта 2022 г.). «Петамасштабный конвейер для точного выравнивания изображений, полученных при серийной секционной электронной микроскопии». bioRxiv 10.1101/2022.03.25.485816 .
- ^ Виндинг, Майкл; Педиго, Бенджамин Д.; Барнс, Кристофер Л.; Патсолич, Хизер Г.; Парк, Янгсер; Казимирс, Том; Фушики, Акира; Андраде, Ингрид В.; Хандельвал, Авинаш; Вальдес-Алеман, Хавьер; Ли, Фэн; Рэндел, Надин; Барсотти, Элизабет; Коррейя, Ана; Феттер, Ричард Д. (10 марта 2023 г.). «Коннектом мозга насекомого» . Наука . 379 (6636): eadd9330. дои : 10.1126/science.add9330 . ПМК 7614541 . ПМИД 36893230 .
- ^ «Невредные виды» . Здоровье растений Австралии . Проверено 19 сентября 2017 г.
- ^ МакИви С. (5 февраля 2014 г.). «Фруктовые мушки: случай ошибочной идентификации» . Австралийский музей . Проверено 19 сентября 2017 г.
Дальнейшее чтение
[ редактировать ]- Колер Р.Э. (1994). Повелители мух: генетика дрозофилы и экспериментальная жизнь . Чикаго: Издательство Чикагского университета. ISBN 978-0-226-45063-6 .
- Гилберт С.Ф. (2000). Биология развития (6-е изд.). Сандерленд (Массачусетс): Sinauer Associates; 2000. ISBN 978-0-87893-243-6 .
- Перримон Н., Бонини Н.М., Диллон П. (март 2016 г.). «Плодовые мушки на передовой: поступательное воздействие дрозофилы» . Модели и механизмы заболеваний . 9 (3): 229–31. дои : 10.1242/dmm.024810 . ПМЦ 4833334 . ПМИД 26935101 .
- Хендерсон М. (8 апреля 2010 г.). «Ссора из-за плодовой мушки Drosophila melanogaster назвала учёных клопов» . Таймс . Австралиец . Проверено 19 сентября 2017 г.
Внешние ссылки
[ редактировать ]- «Быстрое и простое знакомство с Drosophila melanogaster » . Виртуальная библиотека дрозофилы .
- «Ресурсный центр геномики дрозофилы» - собирает, хранит и распространяет дрозофилы . клоны ДНК и клеточные линии
- «Блумингтонский центр запасов дрозофил» - собирает, хранит и распространяет штаммы Drosophila melanogaster для исследований.
- «FlyBase — база данных генов и геномов дрозофилы» .
- «Программа просмотра карт NCBI – Drosophila melanogaster » .
- «Виртуальная библиотека дрозофилы» .
- Беркли «Проект генома дрозофилы » .
- «ФлайМов» . – видеоресурсы по дрозофилы развитию
- « Номенклатура дрозофил — наименование генов» . Архивировано из оригинала 8 октября 2011 года.
- Посмотреть геном Fruitfly на Ensembl
- Просмотрите сборку генома dm6 в браузере генома UCSC .
- Manchester Fly Facility - для публики. Архивировано 13 мая 2015 г. в Wayback Machine . Манчестерского университета
- Веб-сайт droso4schools со школьными ресурсами о дрозофиле.
- Часть 1 обучающего видеоролика «Маленькая муха: БОЛЬШОЕ воздействие», объясняющая историю и значение модельного организма дрозофилы .
- Часть 2 образовательных видеороликов «Маленькая муха: БОЛЬШОЕ воздействие», объясняющих, как проводятся исследования дрозофилы .
- «Внутри летающей лаборатории» — трансляция WGBH и PBS в сериале « Любопытно» , январь 2008 г.
- «Как муха обнаруживает яд». Архивировано 13 января 2013 г. на archive.today. В статьеWhyFiles.org описывается, как плодовая мушка пробует на вкус химическое вещество, убивающее личинок, в пище.


![Спектральная чувствительность опсинов Drosophila melanogaster у белоглазых мух. Чувствительность Rh3–R6 моделируется с использованием матриц опсина и оценок чувствительности Salcedo et al. (1999).[145] Опсин Rh1 (перерисованный из Salcedo et al. [145]) имеет характерную форму, поскольку он связан с пигментом, сенсибилизирующим УФ-излучение.](http://upload.wikimedia.org/wikipedia/commons/thumb/f/fc/Spectral_sensitivities_of_Drosophila_melanogaster_opsins_in_white_eyed_flies.png/750px-Spectral_sensitivities_of_Drosophila_melanogaster_opsins_in_white_eyed_flies.png)