Глатирамера ацетат
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Копаксон, [ 1 ] Глатопа, [ 2 ] Брабио |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а603016 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Подкожная инъекция |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук |
|
| НЕКОТОРЫЙ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.248.824 |
| Химические и физические данные | |
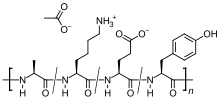
| Формула | С 25 Ч 45 Н 5 О 13 |
| Молярная масса | 623.657 g·mol −1 |
| | |
Глатирамера ацетат (также известный как сополимер 1 , Cop-1 под торговой маркой Copaxone ), продаваемый, среди прочего, , представляет собой препарат -иммуномодулятор, используемый для лечения рассеянного склероза . [ 1 ] [ 2 ] Глатирамера ацетат одобрен в США для снижения частоты рецидивов, но не для замедления прогрессирования инвалидности. Наблюдательные исследования , а не рандомизированные контролируемые исследования, предполагают, что это может замедлять прогрессирование инвалидности. Хотя для окончательного диагноза рассеянного склероза требуется наличие в анамнезе двух или более эпизодов симптомов и признаков, глатирамера ацетат одобрен для лечения первого эпизода, предшествующего диагнозу. Он также используется для лечения рецидивирующего ремиттирующего рассеянного склероза. Его вводят путем подкожной инъекции . [ 1 ] [ 2 ]
Это смесь пептидов произвольного размера, состоящих из четырех аминокислот , содержащихся в основном белке миелина , а именно глутаминовой кислоты , лизина , аланина и тирозина . Основной белок миелина — это антиген в миелиновых оболочках нейронов, который стимулирует аутоиммунную реакцию у людей с рассеянным склерозом, поэтому пептид может работать как приманка для атакующих иммунных клеток.
Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [ 6 ]
История
[ редактировать ]Глатирамера ацетат был первоначально обнаружен в Институте науки Вейцмана . За этим последовали три основных клинических исследования, чтобы продемонстрировать безопасность и эффективность: первое исследование было проведено в одном центре, двойное слепое, плацебо-контролируемое исследование и включало 50 пациентов. [ 7 ] Второе исследование представляло собой двухлетнее многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование, в котором участвовал 251 пациент. [ 8 ] Третье исследование представляло собой двойное слепое исследование МРТ , в котором приняли участие 239 пациентов. [ 9 ]
Медицинское использование
[ редактировать ]Глатирамера ацетат показан для лечения рецидивирующих форм рассеянного склероза (РС), включая клинически изолированный синдром, ремиттирующее заболевание и активное вторично-прогрессирующее заболевание у взрослых. [ 1 ]
обзор 2010 года Кокрейновский пришел к выводу, что глатирамера ацетат обладает частичной эффективностью в отношении «клинических результатов, связанных с рецидивами», но не влияет на прогрессирование заболевания. [ 10 ] В результате он одобрен FDA для снижения частоты рецидивов, но не для замедления прогрессирования инвалидности. [ 1 ] [ 2 ]
В ходе 15-летнего наблюдения за первоначальным исследованием сравнивались пациенты, продолжавшие прием глатирамера, с пациентами, выбывшими из исследования. У пациентов, принимавших глатирамер, наблюдалась меньшая частота рецидивов, а также снижение прогрессирования инвалидности и перехода к вторично-прогрессирующему рассеянному склерозу по сравнению с пациентами, которые не продолжали прием глатирамера. Однако эти две группы не обязательно были сопоставимы, поскольку это уже не было рандомизированным исследованием. Никаких долгосрочных проблем с безопасностью не было. [ 11 ]
Побочные эффекты
[ редактировать ]
Побочные эффекты могут включать шишку в месте инъекции ( реакция в месте инъекции ) примерно у 30% пользователей, а также боль, лихорадку, озноб (гриппоподобные симптомы) примерно у 10% пользователей. [ 12 ] Симптомы побочных эффектов обычно носят легкий характер. Реакция, которая включает приливы крови к лицу, одышку, беспокойство и учащенное сердцебиение, наблюдалась вскоре после инъекции у 5% пациентов (обычно после непреднамеренной инъекции непосредственно в вену). Эти побочные эффекты исчезают в течение тридцати минут. , может возникнуть видимая вмятина в месте повторной инъекции Со временем из-за местного разрушения жировой ткани, известного как липоатрофия .
Сообщалось о более серьезных побочных эффектах для глатирамера ацетата, согласно инструкции FDA, к ним относятся серьезные побочные эффекты со стороны сердечно-сосудистой, пищеварительной (включая печень), кроветворной, лимфатической, скелетно-мышечной, нервной, дыхательной и мочеполовой систем, а также особые чувства (в частности, глаза). Также сообщалось о нарушениях обмена веществ и питания; однако связь между глатирамера ацетатом и этими побочными эффектами не установлена. [ 1 ] [ 2 ]
Это также может вызвать лимфоцитарный инфильтрат Джесснера . [ 13 ]
Механизм действия
[ редактировать ]Глатирамера ацетат представляет собой случайный полимер (средняя молекулярная масса 6,4 кДа ), состоящий из четырех аминокислот, обнаруженных в основном белке миелина . Механизм действия глатирамера ацетата полностью не выяснен. Считается, что он действует путем модификации иммунных процессов, которые, как полагают, ответственны за патогенез рассеянного склероза. Введение глатирамера ацетата смещает популяцию Т-клеток от провоспалительных Т-клеток Th1 к регуляторным Т-клеткам Th2, которые подавляют воспалительную реакцию. [ 14 ] Это осуществляется путем ингибирования секреции провоспалительных цитокинов (IL-1, IL-12, TNF, INFγ) Т-клетками Th1, тем самым побуждая Т-клетки Th2 преодолевать гематоэнцефалический барьер и вырабатывать противовоспалительные цитокины. IL-4, IL-5, IL-13, IL-10, TGF-β). [ 15 ] Учитывая его сходство с основным белком миелина, глатирамера ацетат может действовать как приманка, отвлекая аутоиммунный ответ на миелин. Эта гипотеза подтверждается результатами исследований, проведенных с целью изучения патогенеза экспериментального аутоиммунного энцефаломиелита (ЭАЭ), состояния, вызванного у нескольких видов животных в результате иммунизации против материала, полученного из центральной нервной системы, содержащего миелин и часто используемого в качестве экспериментальной модели на животных. МС. специфичные для глатирамера ацетата регуляторные Т-клетки (Treg), ингибирующие воспалительную реакцию на основной белок миелина. Исследования на животных и в системах in vitro показывают, что при его введении на периферии индуцируются и активируются [ 1 ] [ 2 ]
Однако целостность гематоэнцефалического барьера не оказывает существенного влияния на глатирамера ацетат, по крайней мере, на ранних стадиях лечения. В клинических исследованиях было показано, что глатирамера ацетат снижает количество и тяжесть обострений рассеянного склероза. [ 16 ]
Общество и культура
[ редактировать ]Маркетинг
[ редактировать ]Глатирамера ацетат одобрен для продажи во многих странах мира, включая США , Израиль , Канаду и 24 Европейского Союза . страны [ 17 ] [ 18 ] Одобрение в США было получено в 1997 году. [ 19 ] Глатирамера ацетат был одобрен для продажи в Великобритании в августе 2000 года и запущен в продажу в декабре. [ 20 ] Это первое одобрение на крупном европейском рынке привело к одобрению во всем Европейском Союзе в рамках процедуры взаимного признания . Иран продолжает внутреннее производство глатирамера ацетата. [ 21 ] [ 22 ]
Статус патента
[ редактировать ]Дочерняя компания Novartis, компания Sandoz, с 2015 года продает Глатопу, генерическую версию оригинальной лекарственной формы Тева в дозе 20 мг, требующую ежедневных инъекций. [ 23 ]
Teva разработала препарат длительного действия в дозе 40 мг, продаваемый с 2015 года, что позволило сократить количество инъекций до трех в неделю. [ 24 ] В октябре 2017 года FDA одобрило генерическую версию, которая производится в Индии компанией Natco Pharma , а импортируется и продается голландской фирмой Mylan . [ 25 ] [ 26 ] В феврале 2018 года компания Sandoz получила одобрение FDA на свою непатентованную версию. [ 27 ] Параллельно с процессами разработки и утверждения конкуренты дженериков оспаривали новые патенты Teva, любой из которых, если бы он был поддержан, помешал бы сбыту дженериков длительного действия. [ 28 ]
Хотя срок действия патента на химическое лекарственное средство истек в 2015 году, [ 29 ] Teva получила новые патенты США на фармацевтические препараты длительного действия. [ 30 ] Судебные разбирательства со стороны отраслевых конкурентов в 2016–2017 годах привели к тому, что новые патенты были признаны недействительными. [ 31 ] [ 32 ] В октябре 2018 года Апелляционный суд Федерального округа США оставил в силе признание патента недействительным из-за очевидности . [ 33 ] [ 34 ] Этот случай отражает более масштабные разногласия по поводу вечнозелености непатентованных лекарств.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж г час «Копаксон-глатирамера ацетат для инъекций, раствор» . ДейлиМед . 23 июля 2020 г. Проверено 11 ноября 2020 г.
- ^ Jump up to: а б с д и ж г «Глатопа-глатирамера ацетат для инъекций, раствор» . ДейлиМед . 31 июля 2020 г. Проверено 11 ноября 2020 г.
- ^ «Неврологическая терапия» . Здоровье Канады . 9 мая 2018 года . Проверено 13 апреля 2024 г.
- ^ «Брабио, 20 мг/мл, раствор для инъекций, предварительно заполненный шприц – краткая характеристика продукта (SmPC)» . (эмс) . Проверено 11 ноября 2020 г.
- ^ «Копаксон 20 мг/мл раствор для инъекций в предварительно заполненном шприце. Краткое описание характеристик продукта (SmPC)» . (эмс) . 29 сентября 2020 г. Проверено 11 ноября 2020 г.
- ^ Всемирная организация здравоохранения (2023 г.). Выбор и использование основных лекарств до 2023 г.: веб-приложение A: Типовой список основных лекарств Всемирной организации здравоохранения: 23-й список (2023 г.) . Женева: Всемирная организация здравоохранения. hdl : 10665/371090 . ВОЗ/MHP/HPS/EML/2023.02.
- ^ Борнштейн М.Б., Миллер А., Слэгл С., Вайцман М., Кристал Х., Дрекслер Э., Кейлсон М., Мерриам А., Вассертайл-Смоллер С., Спада В. (август 1987 г.). «Пилотное испытание Cop 1 при обострении-ремиттирующем рассеянном склерозе». Медицинский журнал Новой Англии . 317 (7): 408–14. дои : 10.1056/NEJM198708133170703 . ПМИД 3302705 .
- ^ Джонсон К.П., Брукс Б.Р., Коэн Дж.А., Форд CC, Гольдштейн Дж., Лисак Р.П., Майерс Л.В., Панич Х.С., Роуз Дж.В., Шиффер Р.Б. (июль 1995 г.). «Сополимер 1 снижает частоту рецидивов и улучшает инвалидность при рецидивирующем ремиттирующем рассеянном склерозе: результаты многоцентрового двойного слепого плацебо-контролируемого исследования III фазы. Группа по изучению рассеянного склероза сополимера 1». Неврология . 45 (7): 1268–76. дои : 10.1212/WNL.45.7.1268 . ПМИД 7617181 . S2CID 28895177 .
- ^ Коми Дж., Филиппи М., Волински Дж.С. (март 2001 г.). «Европейско-канадское многоцентровое двойное слепое рандомизированное плацебо-контролируемое исследование воздействия глатирамера ацетата на магнитно-резонансную томографию - измерение активности и тяжести заболевания у пациентов с рецидивирующим рассеянным склерозом. Европейская/канадская группа по изучению глатирамера ацетата». Анналы неврологии . 49 (3): 290–7. дои : 10.1002/ана.64 . ПМИД 11261502 . S2CID 35614752 .
- ^ Ла Мантия Л., Мунари Л.М., Ловати Р. (май 2010 г.). «Глатирамера ацетат при рассеянном склерозе». Кокрановская база данных систематических обзоров . 5 (5): CD004678. дои : 10.1002/14651858.CD004678.pub2 . ПМИД 20464733 .
- ^ Форд С., Гудман А.Д., Джонсон К., Качук Н., Линдси Дж.В., Лисак Р. и др. (март 2010 г.). «Непрерывная долгосрочная иммуномодулирующая терапия при рецидивирующем рассеянном склерозе: результаты 15-летнего анализа проспективного открытого исследования глатирамера ацетата в США» . Рассеянный склероз . 16 (3): 342–50. дои : 10.1177/1352458509358088 . ПМЦ 2850588 . ПМИД 20106943 .
- ^ «Копаксон» . МедиГард.
- ^ Крафчик БР (2011). «Схемы реакции» . В Шахнер Л.А., Хансен Р.К. (ред.). Детская дерматология . Elsevier Науки о здоровье. п. 1022. ИСБН 978-0-7234-3665-2 .
- ^ Арнон Р., Села М. (1999). «Химический состав препарата Копаксон» (PDF) . хим. Израиль . 1 : 12–17. Архивировано из оригинала (PDF) 7 сентября 2003 г.
- ^ https://go.drugbank.com/drugs/DB05259 ; Глатирамер Механизм действия
- ^ «Копаксон» . Все о рассеянном склерозе .
- ^ Маккидж К. (май 2015 г.). «Глатирамера ацетат 40 мг/мл при ремиттирующем рассеянном склерозе: обзор». Препараты ЦНС . 29 (5): 425–32. дои : 10.1007/s40263-015-0245-z . ПМИД 25906331 . S2CID 30186027 .
- ^ Коми Дж., Амато М.П., Бертолотто А., Чентонце Д., Де Стефано Н., Фарина С. и др. (2016). «Наследие глатирамера ацетата и его применение при рассеянном склерозе» . Рассеянный склероз и демиелинизирующие заболевания . 1 (1). дои : 10.1186/s40893-016-0010-2 .
- ^ «Копаксон» . ЦентрВотч .
- ^ «Копаксон Teva одобрен в Великобритании» . Фармацевтическое письмо .
- ^ «Глатирамера ацетат» . Научно-инжиниринговая компания «Тофиг Дару». Архивировано из оригинала 21 октября 2018 г. Проверено 1 февраля 2017 г.
- ^ Исаев С, Джафаров Т (1 мая 2012 г.). «Иран будет производить лекарство от рассеянного склероза» . Информационное агентство «Тренд» .
- ^ «Сандоз объявляет о запуске Glatopa в США» . Новартис. 2015. Архивировано из оригинала 03 февраля 2018 г. Проверено 21 февраля 2017 г.
- ^ Сильва П. (9 октября 2015 г.). «Новый режим приема копаксона Тева 3 раза в неделю» . Новости рассеянного склероза сегодня .
- ^ Эрман М., Гровер Д. (3 октября 2017 г.). «Mylan растет, Teva падает после того, как FDA одобрило копию Copaxone» . Рейтер . Проверено 4 октября 2017 г.
- ^ «Маркетинговый партнер NATCO, компания Mylan, получает окончательное одобрение на дженерик глатирамера ацетата в версиях с концентрацией 20 мг/мл и 40 мг/мл» . НАТКО Фарма (Индия) . 3 октября 2017 года. Архивировано из оригинала 10 января 2019 года . Проверено 4 октября 2017 г. >
- ^ «Сандоз объявляет об одобрении FDA США и запуске препарата Глатопа в дозе 40 мг/мл» . Новартис Интернэшнл АГ . 13 февраля 2018 года . Проверено 10 мая 2018 г.
- ^ «Продукт Copaxone от Teva продолжает расти, несмотря на патентные риски» . БиоФармаДайв .
- ^ Гельфанд К. «Копаксон» . ФиерсФарма .
- ^ Декер С. (1 сентября 2016 г.). «Teva теряет решение о действительности патента на копаксон 302» . Блумберг Маркетс .
- ^ Декер С., Фланаган С., Бенмелех Ю. (30 января 2017 г.). «Teva проигрывает решение о признании недействительными патентов на препарат копаксон» . Блумберг Маркетс .
- ^ «Teva теряет патентное решение» . Портфель. Филадельфийский исследователь . Новости Блумберга. 2 сентября 2017. с. А12 . Получено 23 июня 2018 г. - через Newspapers.com (Extra Publisher).
- ^ «Апелляционный суд США оставил в силе решение об аннулировании патентов Teva Copaxone» . Рейтер . 12 октября 2018 г. . Проверено 12 октября 2018 г.
- ^ «В отношении: Консолидированные случаи копаксона» (PDF) . Апелляционный суд Федерального округа США . 12 октября 2018 г. . Проверено 12 октября 2018 г.